香根草组织培养基中的植物生长调节剂优化研究
单芹丽,屈云慧,汪国鲜,吴丽芳,方洪兵,杨春梅*
(1.云南省农业科学院 花卉研究所/国家观赏园艺工程技术研究中心,云南 昆明 650205;2.玉溪云星生物科技有限公司,云南 玉溪 652604)
0 引言
香根草(Vetiveria zizanioides)是禾本科岩兰属多年生草本植物,原产于印度尼西亚、印度、斯里兰卡和缅甸等热带和亚热带地区[1]。20世纪50年代开始进入中国[2],在江苏、广东、浙江、山东、四川、福建和广西等地均有种植和应用[1]。香根草地上部分密集丛生,质硬,适应能力强,能适应各种土壤环境,对生长条件要求不高,其在强酸、强碱、重金属和干旱、渍水、贫瘠、重金属和污染、贫瘠等环境条件下都能够生长[3],因此,香根草在华东、华南和西南等16个省(市、区)广泛种植,用于治理水土流失[4]。此外,香根草根叶片里芳香油含量丰富,可作为调味剂、香精和化妆品制作的主要原料,该芳香成分还具有驱虫、杀菌等功效,可用于防治病、虫、鼠害。同时,香根草还是工业造纸、饲料开发、食用菌培育和工艺编制的原料[2-6]。近年来,香根草在固土护坡[7]、环境修复治理[8-12]、土壤改良[13]等方面发挥着越来越大的经济效益和生态效益。
随着对香根草进一步的开发与利用,人们对香根草种苗的需求也越来越大。国内繁殖香根草的方法主要有分蘖繁殖法、留母株繁殖法、扦插繁殖法、插条繁殖法、切顶繁殖法和纵剖繁殖法等[14]。采用组织培养技术进行香根草繁殖能在短期内培育大量性状一致的种苗。培养基是植物组织培养的物质基础,而培养基中的关键物质植物生长调节剂对植株的生长发育具有明显的调节作用[15-17]。
前人对植物生长调节剂在香根草组织培养中的应用研究虽然取得了一些进展,但各研究对植物生长调节剂的种类和浓度选用上存在较大差异[18-22],导致植物生长调节剂在规模化应用于香根草种苗生产时,缺乏科学的理论依据和具有实践价值的指导性参考。因此,有必要深入研究植物生长调节剂对组培苗生长的影响,并对香根草组织培养基中的植物生长调节剂的种类和浓度进行优化。鉴于此,本试验在香根草各组织培养阶段,在培养基中添加不同种类和不同浓度配比的植物生长调节剂,研究植物生长调节剂在香根草组培生长中的影响情况,明确植物生长调节剂对香根草各培养阶段组培苗生长的作用大小(即主次关系),同时筛选出适宜各培养阶段的植物生长调节剂配方,以期为合理使用植物生长调节剂,高效生产香根草种苗提供理论依据。
1 材料与方法
1.1 试验材料
供试材料采自云南昆明地区处于分蘖期的香根草植株。
1.2 试验设计
在香根草各培养阶段配制含不同植物生长调节剂种类和浓度的培养基,植物生长调节剂配比采用正交表L9(34)设计,即设置4个因素,每个因素设置3个水平[23-24]。本试验中因素是指各培养阶段的4种植物生长调节剂种类(4列),若植物生长调节剂只有3种,则把正交表L9(34)的第4列作为空列;水平是指各培养阶段每种植物生长调节剂的3种浓度(3行),正交试验因素水平如表1所示。
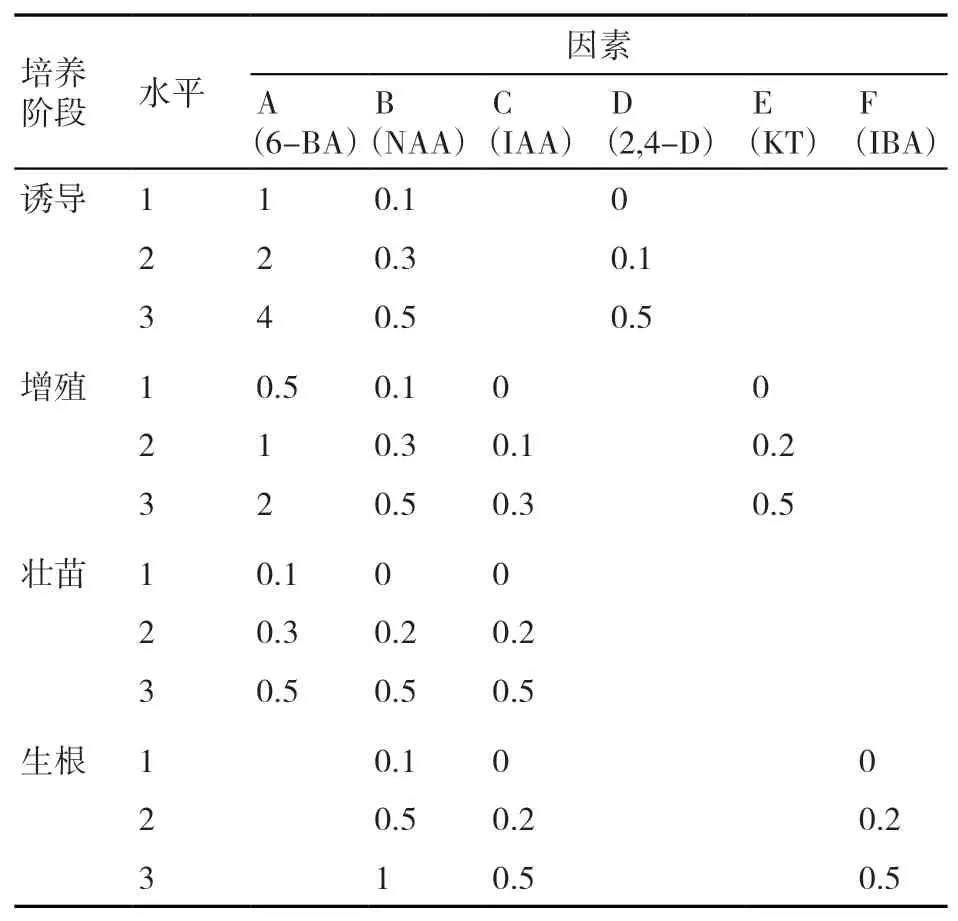
表1 正交试验L9(34)因素水平表 mg/L
根据正交设计表L9(34),每个培养阶段各因素设置水平见表2所示,共设置9个处理。即在诱导培养、增殖培养、壮苗培养和生根培养各阶段分别添加9种不同配比的植物生长调节剂于MS基本培养基中,配制成不同的诱导培养基、增殖培养基、壮苗培养基和生根培养基备用,4个阶段共计36种培养基。所有培养基附加食用白糖30 g/L,琼脂7 g/L,并调节pH值为5.5~5.8。
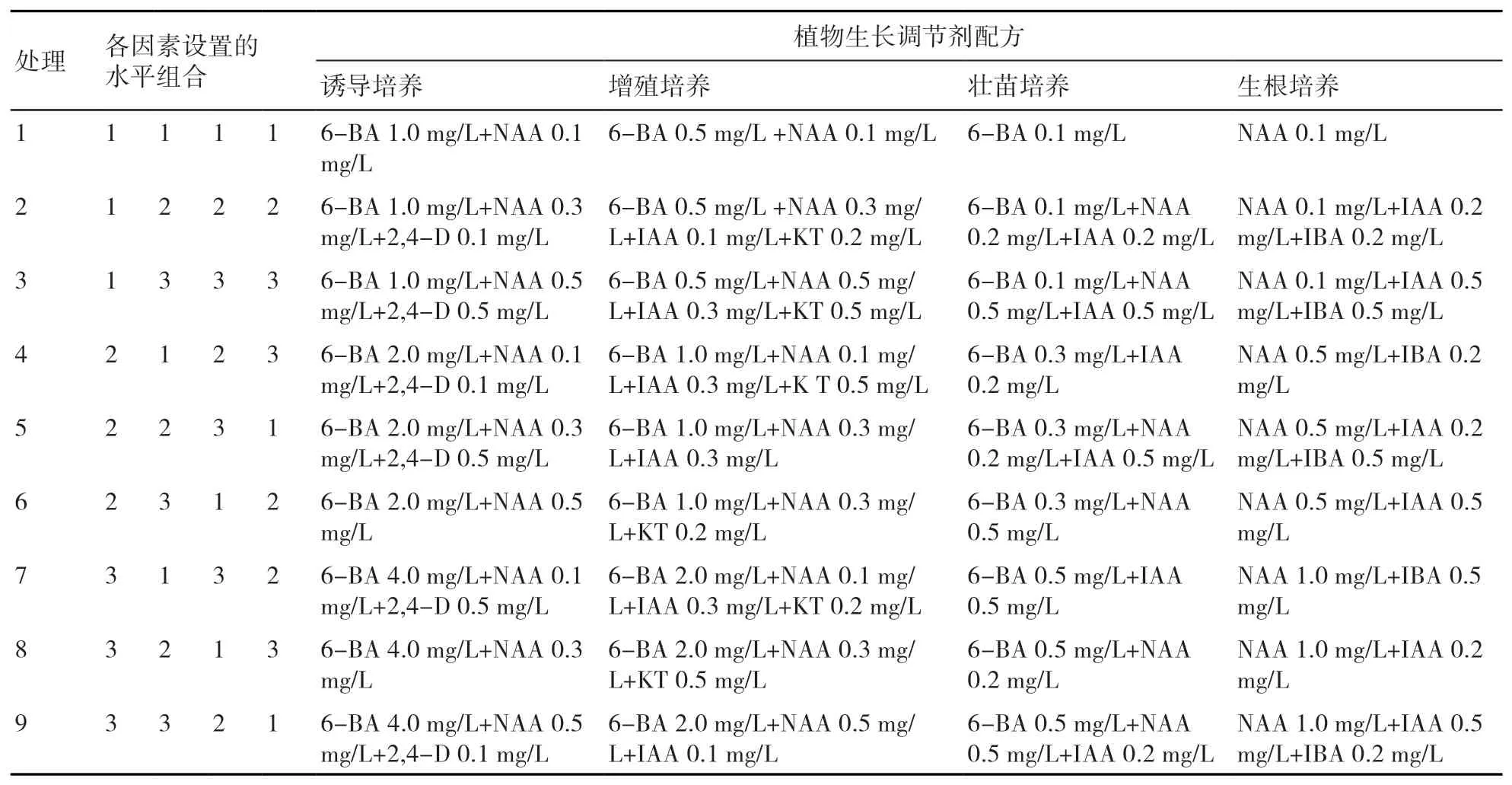
表2 正交试验L9(34)设计表
1.3 外植体的选择和消毒
将香根草整株拔起,剪取基部分蘖节,用洗衣粉水清洗后,再用自来水冲洗干净,在超净工作台上用含75%酒精的棉球迅速擦拭材料一遍后,再用刀片切取茎秆上部第1至第3个带节茎段,每个茎段大小约3 cm,放入0.1%氯化汞溶液中消毒15 min,然后放入含2%次氯酸钠和2滴吐温-20的混合溶液中消毒15 min,消毒过程中不时振荡材料,之后用无菌水冲洗3次,每次约2 min,即可获得无菌材料。
1.4 试验方法与数据处理
用镊子把消毒后的茎段接种在添加9种植物生长调节剂配比的诱导培养基中,每种培养基接种10瓶,每瓶6个茎段。接种20 d后,每个处理随机选取无污染和死亡的3瓶苗(3次重复),记录其茎段不定芽的诱导率。将诱导出的芽在MS培养基中过渡培养30 d后,选取苗高1.5 cm以下,生长状况相对一致的丛生芽,转接到添加不同植物生长调节剂配比的增殖培养基和壮苗培养基中,每瓶6个丛生芽,每个处理接种5瓶;将苗高超过1.5 cm的丛生芽切成单株,转接到添加不同植物生长调节剂配比的生根培养基中,每瓶15株。置于温度为(23±2)℃、光照强度为40~50 μmol/(m2·s)的培养室中,光照时间为10 h/d。培养20 d后,每个处理随机抽取无污染的3瓶苗(3次重复),观察并记录试验结果。主要记录的指标包括:诱导培养阶段的不定芽的诱导率、增殖培养阶段的繁殖系数、壮苗培养阶段观察有效苗生长情况以及生根培养阶段的生根率,各指标的计算方法为:
诱导培养阶段不定芽的诱导率(%)=(诱导出不定芽的茎段数/接种时的茎段数)×100%;
增殖培养阶段的繁殖系数=调查时的0.5 cm以上植株数量/繁殖接种时0.5 cm以上的植株数量;
壮苗培养阶段的有效苗率(%)=调查时的1.5 cm以上植株数量/壮苗接种时的0.5 cm以上植株数量×100%;
生根培养阶段的生根率(%)=生根株数/调查株数×100%。
试验数据采用Excel工作表和DPS软件进行统计分析,并利用Duncan’ s新复极差法对各处理的差异显著性进行检验。
2 结果与分析
2.1 各处理不同培养阶段指标测量值
培养20 d后,不同培养阶段各处理的测量指标值见表3。由表3可知,各培养阶段处理间的差异显著,各植物生长调节剂对香根草组织培养的影响存在互作效应。各处理诱导阶段诱导率介于22.3%~77.7%,以处理9的诱导率最高;各处理增殖阶段繁殖系数介于1.6~4.6,以处理6的繁殖系数最高;各处理壮苗阶段有效苗率介于0~80.0%,处理9不利于有效苗的形成,而处理4则对有效苗形成最有利;各处理生根阶段生根率介于37.7%~100%,其中处理4的香根草全部长出根系。综上,除增殖阶段繁殖系数外,各阶段指标值均以处理4的最高。
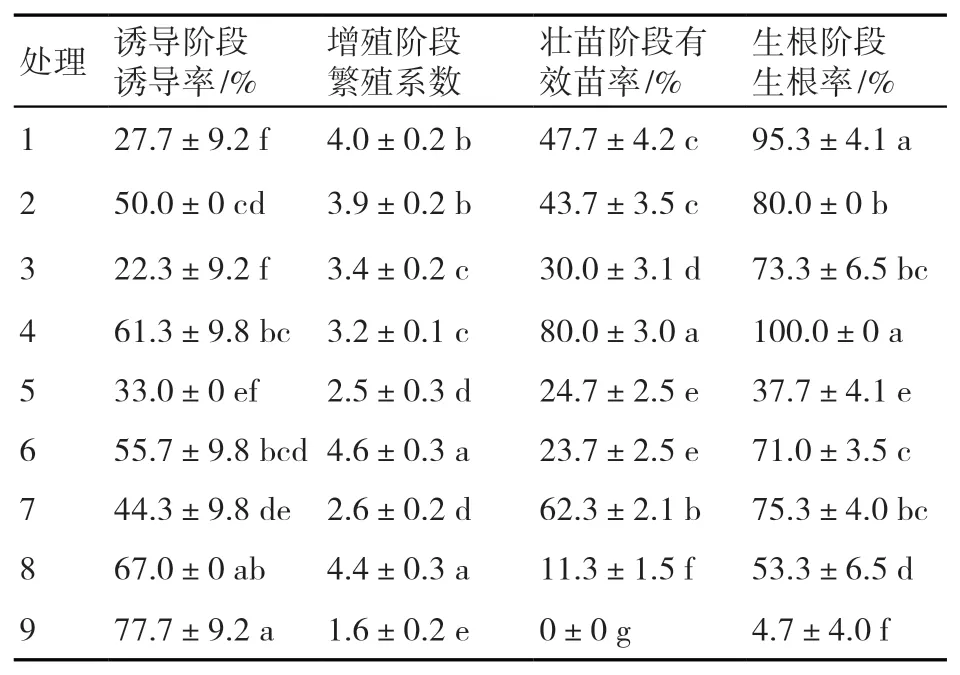
表3 各处理在不同培养阶段的指标测量值
2.2 植物生长调节剂对香根草诱导培养阶段不定芽诱导率的影响
由每种因素水平的均值(Ki)大小可总结出每个培养阶段各植物生长调节剂的最佳水平组合,并由因素内水平极差(R)的大小可以反映出每个培养阶段各种植物种质调节剂对香根草生长的影响大小[25-26]。
由表4可知,因素内水平极差大小反映了3种因素对香根草诱导培养阶段不定芽诱导率的影响程度,即参试的3种植物生长调节剂对香根草不定芽诱导的影响的主次关系是2,4-D>6-BA>NAA。由各因素水平的均值大小可得到植物生长调节剂的最优水平组合为A3B3D2,对照表1的正交试验L9(34)因素水平,即得到香根草诱导培养阶段植物生长调节剂最优配方为6-BA 4.0 mg/L+NAA 0.5 mg/L+2,4-D 0.1 mg/L,最优配方不定芽的诱导率最高,即处理9的诱导率最高,这与表3的试验结果吻合,且与表2中诱导培养阶段处理9的植物生长调节剂配方一致。研究表明,在试验水平内6-BA和NAA浓度越高对香根草不定芽的诱导越好,2,4-D在浓度介于0~0.5 mg/L时对不定芽诱导影响较大,以浓度0.1 mg/L时促进效果最好。
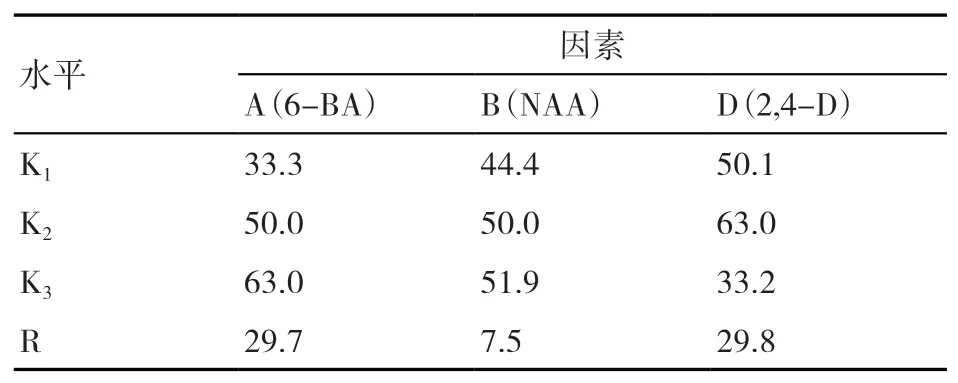
表4 植物生长调节剂对香根草诱导培养阶段不定芽诱导率的影响 %
2.3 植物生长调节剂对增殖培养阶段繁殖系数的影响
由表5可知,因素内水平极差大小可以反映出4种植物生长调节剂对香根草增殖培养的影响程度,其对香根草丛生芽繁殖系数影响的主次关系为IAA>KT>6-BA>NAA。IAA对香根草的繁殖影响最大,但为负效应,因此,在增殖阶段不宜添加IAA。由因素水平的均值大小可看出,在0~0.5 mg/L KT范围内,添加0.2或0.5 mg/L KT时香根草增殖培养阶段繁殖系数均为3.7,即此2种浓度KT的增殖效果一样。因此,筛选出有利于香根草丛生芽快速繁殖的植物生长调节剂最优组合为A1B2C1E2,对照表1的正交试验L9(34)因素水平,即得出植物增殖培养生长调节剂的最佳配方为6-BA 0.5 mg/L+NAA 0.3 mg/L+KT 0.2 mg/L。
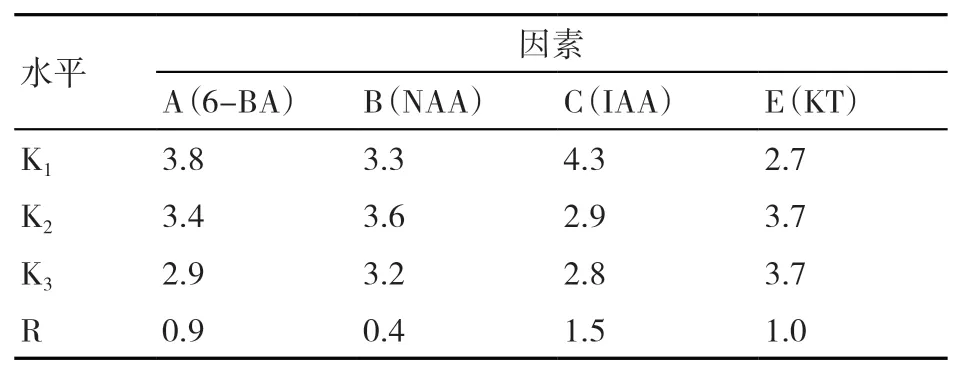
表5 植物生长调节剂对香根草增殖培养阶段繁殖系数的影响
2.4 植物生长调节剂对壮苗阶段有效苗率的影响
由表6可知,因素内水平极差大小可以反映出3种植物生长调节剂对壮苗阶段有效苗率影响的主次关系是NAA>6-BA>IAA。有利于香根草壮苗生长的植物生长调节剂最优组合为A2B1C2,对照表1的正交试验L9(34)因素水平,即得香根草壮苗培养阶段植物生长调节剂的最佳配方为6-BA 0.3 mg/L+IAA 0.2 mg/L,即处理4的有效苗率最高,该结果与表3的试验结果相吻合。NAA虽然对香根草苗高的影响最大,但为负效应,因此,壮苗培养阶段不宜添加NAA。
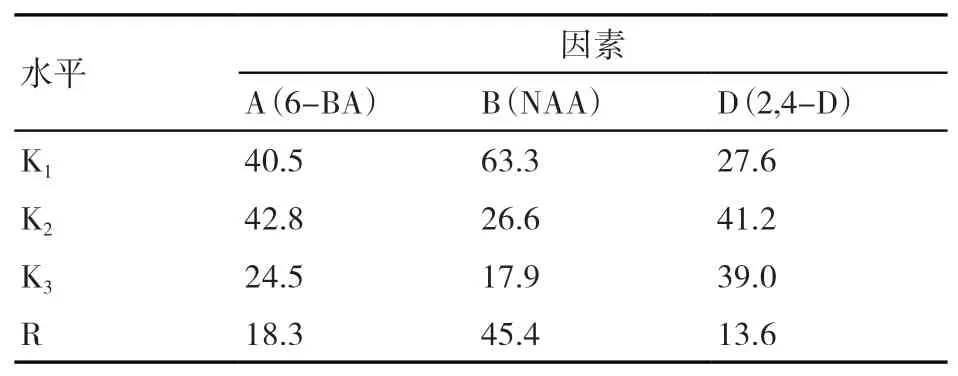
表6 植物生长调节剂对香根草壮苗阶段有效苗率的影响 %
2.5 植物生长调节剂对生根阶段生根率的影响
由表7可知,因素内水平极差大小可以反映出3种植物生长调节剂对香根草生根阶段生根率影响的主次关系为IAA>NAA>IBA。同样,由各因素水平(Ki)的均值大小分析出有利于香根草生根的最优植物生长调节剂组合为B1C1F1,对照表1的正交试验L9(34)因素水平,可知NAA浓度 0.1 mg/L为植物生长调节剂最优配方。NAA和IAA浓度在试验水平内,浓度越高越不利于香根草生根,IAA虽然对香根草生根影响最大,但为负效应,因此生根阶段不宜添加IAA。
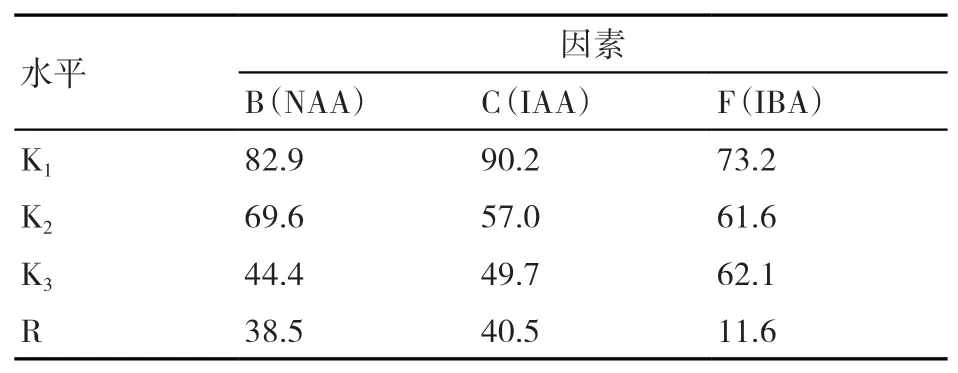
表7 植物生长调节剂对香根草生根阶段生根率的影响 %
3 讨论与结论
植物生长调节剂在香根草组培生长中的应用研究已有相关报道,但由于试验设计选取的植物生长调节剂种类和浓度不同,导致香根草各培养阶段的最适植物生长调节剂配方存在较大差异。王栋等[18]认为各阶段选取的生长调节剂最优培养配方:诱导阶段为6-BA 3.0 mg/L+NAA 0.2 mg/L,增殖阶段为2,4-D 0.5 mg/L+6-BA 2.0 mg/L,生根阶段为IBA 0.2 mg/L+NAA 0.2 mg/L+0.5 mg/L;杨冰冰等[19]认为各阶段选取的生长调节剂最优培养配方:诱导阶段为2,4-D 2.0 mg/L+6-BA 1.0 mg/L,增殖阶段为6-BA 1.0 mg/L,生根阶段为IBA 0.1 mg/L+PP333 0.1 mg/L。殷丽青等[20]认为各阶段选取的生长调节剂最优培养配方:诱导阶段为BA 4.0 mg/L+NAA 0.2 mg/L,增殖阶段为BA 2.0 mg/L+NAA 0.2 mg/L,生根阶段为IBA 0.2 mg/L+NAA 0.2 mg/L。韩露等[21]认为各阶段选取的生长调节剂最优培养配方:诱导阶段为6-BA 0.5 mg/L+2,4-D 2.0 mg/L,增殖阶段为6-BA 3.5 mg/L+IAA 0.2 mg/L,生根阶段为6-BA 3.0 mg/L+IAA 0.5 mg/L。姚振等[22]认为各阶段的选取生长调节剂最优培养配方:诱导阶段为2,4-D 0.5 mg/L,增殖阶段为6-BA 2.0 mg/L+IAA 1.0 mg/L,生根阶段为IAA 0.2 mg/L。综上,前人的研究结果对香根草种苗生产中植物生长剂种类的选择上有一定的指导作用。基于此,本研究应用正交设计方法,在前人研究的基础上用有限的试验处理优化了香根草各组培生长阶段植物生长调节剂的最佳配方,并明确了香根草各培养阶段植物生长调节剂对组培苗生长的作用大小。
本试验结果表明,植物生长调节剂2,4-D对香根草的不定芽诱导影响较大、IAA对增殖和生根影响较大、NAA对壮苗影响较大。在香根草种苗生产前期要控制好2,4-D的使用量,在生产后期生根阶段最好不使用IAA,并控制好NAA的使用量,IBA对香根草生根虽然影响不大,但使用后反而不利于生根。NAA不利于种苗增高,当苗较矮时,不宜使用NAA,建议配合使用适宜浓度的6-BA和IAA进行增高壮苗,当苗高超过1.5 cm后,可单独使用浓度为0.1 mg/L的NAA诱导根系的发生。在本研究中,诱导和壮苗阶段的直观分析结果和试验结果一致,但在增殖和生根阶段出现直观分析结果和试验结果不一致的情况,说明即使在植物生长调节剂浓度梯度范围内,通过有限的试验处理也较难获得合理的植物生长调节剂浓度配比。本研究采用的正交设计方法具有试验均衡分散、数据计算简单、水平整齐可比等优点,通过使用正交试验法减少了测试用例,采用有限的试验处理就能有效地比较试验结果并找出最优的试验条件。
本研究在预试验中发现,在诱导培养阶段可同时诱导愈伤组织和不定芽,继代转接时,丛生状比单株接种方式好,苗的繁殖力及长势强,在生根培养时丛生芽和单株的生根率无明显差别。本试验的目标是力求研究结果服务于香根草种苗生产者,为市场快速提供优质种苗,因此,试验设计方法和试验统计方法需具有较强实用性和可操作性。为此,本试验设计方案中生根培养转接单株材料,繁殖与壮苗培养均转接块状丛生芽材料。在培养过程中,发现有的处理会产生原球茎和畸形芽,因此,诱导培养阶段数据统计时,只统计不定芽的诱导率,而不是愈伤组织的诱导率。增殖和壮苗培养阶段数据统计时,接种前均只记录了苗高0.5 cm 以上的植株数量,接种后的增殖培养阶段只记录了苗高0.5 cm 以上的植株数量,壮苗培养阶段只记录了苗高1.5 cm 以上的植株数量。本试验是在前人研究及预试验基础上,采用正交设计探究香根草各培养阶段植物各种生长调节剂对组培苗生长影响的主次关系,并根据有限的试验处理结果进一步分析出各培养阶段适宜的植物生长调节剂配方。因此,本试验结果对香根草优质种苗标准化、规模化生产具有一定的指导作用和应用价值。

