碘化锂对甲醇羰基合成醋酸铱/钌催化体系的影响
顾明兰 石荣广 周志宏
上海华谊能源化工有限公司 (上海 200241)
醋酸作为重要的有机化工原料,主要用于生产醋酸乙烯、醋酸酯类和作为聚酯工业精对苯二甲酸(PTA)生产的溶剂等,每年的消耗量非常大。2022年,我国醋酸产能已达到约1 000 万t/a。甲醇羰基化生产醋酸是当今世界比较先进的方法。20 世纪60年代后期,孟山都公司(Monsanto)成功开发了铑基催化剂体系,其工艺因反应条件相对温和、醋酸选择性高等优点迅速实现了工业化。但铑基催化剂存在副反应(水煤气反应、乙酰基碘化物先生成乙醛再生成丙酸及有机碘等)多的缺点。20 世纪90 年代,英国石油公司(BP)成功开发了铱体系的Cativa 工艺技术,与铑体系相比,具有选择性高、副反应少、产品质量高等优点。
塞拉尼斯Ao Plus 工艺为使用铑体系催化剂[1],加入碘化锂(起到促进剂和稳定剂的作用)。加入碘盐后,[Rh(CO)2I2]-与HI 反应生成各种稳定可溶的四碘或五碘羰基铑配合物,铑催化剂在过量碘存在下的稳定性得到提高。另外,碘盐可使反应体系产生大量乙酸根和碘负离子,并与[Rh(CO)2I2]-形成亲核能力更强、活性更高的五配位中间体[Rh(CO)2I2(L)](L=I-或AcO-),提高反应决速步骤的速率。同时,碘化锂的加入可以促进醋酸甲酯向甲基碘转化,从而促进MeI 和[Rh(CO)2I2]-之间的氧化加成反应。
铱/钌体系在使用中存在催化剂沉淀问题。本课题研究了碘化锂对该体系活性和稳定性的影响。
1 铱体系的反应机理分析
对于使用铱催化剂体系催化甲醇羰基化合成醋酸,Forster 等提出的机制涉及阴离子和中性的催化循环,如图1 所示。
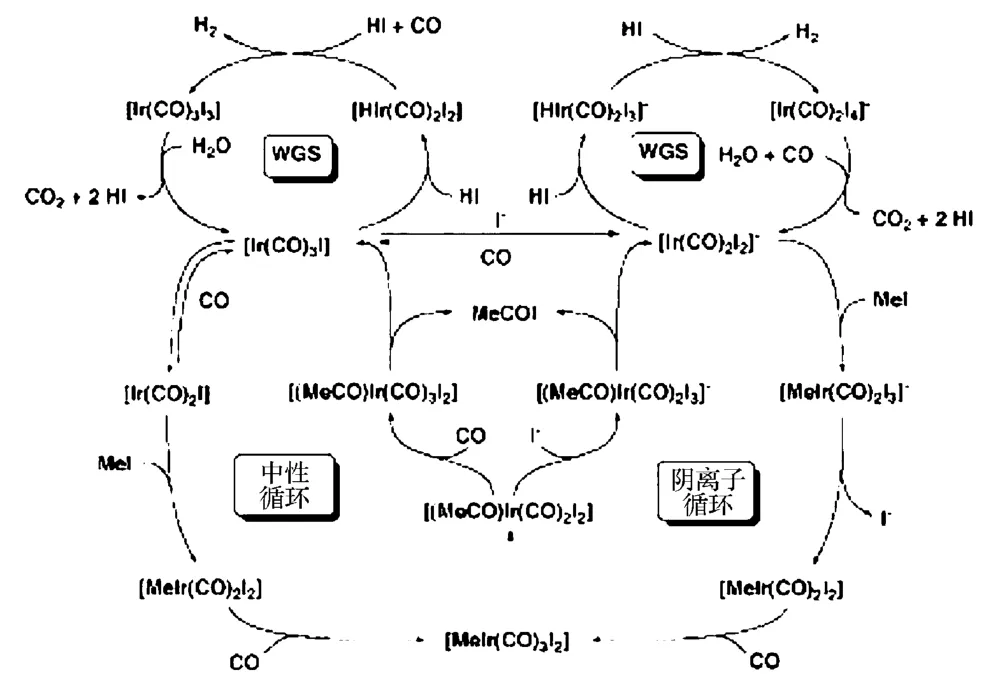
图1 铱催化甲醇羰基化制醋酸机理
Forster 提出存在两个不同但相关联的循环,其中一个循环涉及中性Ir 配合物,另一个循环主要涉及阴离子物种,两个循环中还存在水煤气变换反应。在低水和低碘的情况下,中性循环以[Ir(CO)3I]为活性态,而决速步骤为MeI 氧化加成生成[Ir(CO)2I]。在较高的水和碘化物浓度下,阴离子循环占主导,催化剂的活性态为顺式异构体[MeIr(CO)2I3]-,决速步骤为CO 的插入和碘离子的消除。在铑体系中,只存在阴离子循环,且MeI 氧化加成生成[Rh(CO)2I2]-是决速步骤。[2]
2 LiI 对铱/钌体系反应活性的影响
2.1 试剂与仪器
氧化铱[w(Ir)≥85.7%]、氧化钌[w(Ru)≥75.5%],陕西开达化工有限责任公司;甲基碘(w≥98.0%)、醋酸甲酯(w≥98.0%),国药集团化学试剂有限公司;醋酸(w≥99.5%),上海华谊能源化工有限公司;碘化锂(w≥99.5%),上海阿拉丁生化科技股份有限公司。
锆材釜(250 mL);Optima 8000 电感耦合等离子体发射光谱仪,珀金埃尔默仪器有限公司;Agilent 8890 气相色谱仪,安捷伦科技(中国)有限公司。
2.2 实验步骤
实验具体步骤如下:
(1)用1 MPa 氮气对反应釜充压查漏、消漏。
(2)将配好的物料倒入反应釜中,关闭反应釜。再次使用1 MPa氮气对反应釜进行查漏。消除漏点后,使用1 MPa CO 置换1~2 次。
(3)使用CO 充压到约0.5 MPa。开动搅拌,转速设为600 r/min。设定反应温度,打开加热开关进行加热,使用反应釜配套的控温系统对温度进行调控。
(4)当反应器压力开始下降时,反应开始计时。待压力降到低于2.8 MPa,用CO 钢瓶气充压到2.8 MPa,并维持在该压力下反应。配套的CO 积算仪将显示CO 的瞬时消耗量。
(5)待CO 瞬时流量小于100 mL/min 时,视为反应结束。关闭加热器,将反应釜移出加热炉膛,用冰水进行急冷,以终止反应。
(6)待温度降到室温后,关闭搅拌,用氮气置换两次后,打开反应釜,倒出反应液称重,取样分析。
工艺流程如图2 所示。

图2 实验工艺流程简图
3 结果与讨论
3.1 碘化锂对铱/钌催化剂活性的影响
铱/钌体系催化剂催化甲醇羰基化生产醋酸,反应液中醋酸甲酯和水的量对反应速率影响较大[3]。研究了反应液中添加一定量碘化锂的情况下,不同醋酸甲酯和水含量对反应速率的影响。
催化剂的量为w(Ir)=0.12%,w(Ru)=0.30%;温度为195 ℃,压力为2.8 MPa。催化剂活性评价结果见图3—图5。

图3 20%醋酸甲酯条件下水含量对催化剂活性的影响
由图3 可见:醋酸甲酯质量分数为20%时,水的质量分数为2%~3.5%时,添加碘化锂的反应速率大于不添加的,对反应活性起促进作用;当水的质量分数大于3.5%时,添加碘化锂的反应速率小于不添加的,对反应活性起抑制作用。根据Forster 研究机理可以推测:在该条件下,当水的质量分数约为3.5%时,催化循环从中性循环向阴离子循环过渡。
由图4 可见:醋酸甲酯质量分数为15%时,水的质量分数为2%~3%,添加碘化锂的反应速率大于不添加的,对反应活性起促进作用;当水质量分数大于3%时,添加碘化锂的反应速率小于不添加的,对反应活性起抑制作用。根据Forster 研究机理可以推测:在该条件下,当水的质量分数约为3%时,催化循环从中性循环向阴离子循环过渡。

图4 15%醋酸甲酯条件下水含量对催化剂活性的影响
由图5 可见:醋酸甲酯质量分数为10%时,水的质量分数为在2%~2.3%时,添加碘化锂的反应速率大于不添加的,对反应活性起促进作用;当水质量分数大于2.3%时,添加碘化锂的反应速率小于不添加的,对反应活性起抑制作用。根据Forster 研究机理可以推测:在该条件下,当水的质量分数为2.3%时,催化循环从中性循环向阴离子循环过渡。
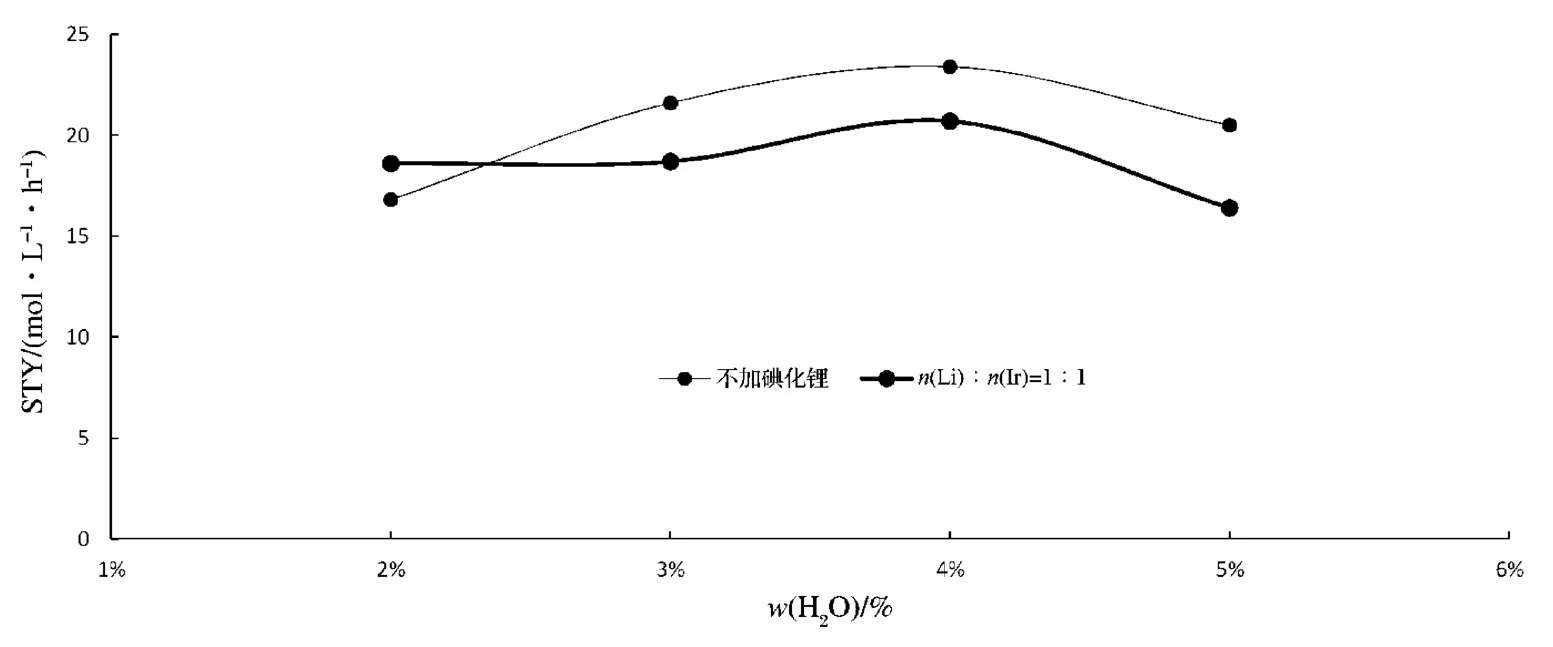
图5 10%醋酸甲酯条件下水含量对催化剂活性的影响
由以上几组实验结果可见:醋酸甲酯含量越高,催化循环由中性循环向阴离子循环过渡转折点的水含量越高。这主要是因为反应中存在如下平衡反应:
当醋酸甲酯浓度较高时,会消耗一部分碘化氢,所以需要增加水浓度,来增加碘化氢的浓度,从而保证在两个循环转折点处,碘离子浓度接近。
对低质量分数醋酸甲酯条件下水对催化剂活性的影响进行研究,结果如表6 所示。
由表6 可见:当醋酸甲酯质量分数小于8%时,添加碘化锂对反应均有抑制作用。
对不同碘化锂的量对反应的影响进行研究,结果如表7 如所示。
由表7 可见:LiI 的量减少时,即n(Li)∶n(Ir)由1∶1 变化到1∶2 时,对反应起抑制作用,与醋酸甲酯和水的量无关。
由以上研究工作可得:碘化锂对催化剂反应活性的影响与反应处于催化循环(中性循环和阴离子循环)有关,而反应处于哪个循环与醋酸甲酯和水的浓度有关。反应处于中性循环时,碘化锂与Ir 的物质的量比为1∶1 时,对反应有促进作用;反应处于阴离子循环时,碘化锂与Ir 的物质的量比为1∶1时,对反应有抑制作用。碘化锂与Ir 的物质的量比减小至1∶2,对两个循环的反应均有抑制作用。中性循环过程的反应速率一般小于阴离子循环过程的反应速率,醋酸甲酯浓度越高,催化剂活性越高。
3.2 LiI 对铱/钌催化剂稳定性的影响
在醋酸生产过程中,易发生催化剂沉淀的区域为缺少CO 的闪蒸区域。实验模拟了闪蒸区域的条件,研究了铱/钌稳定性情况:n(Li)∶n(Ir)=1∶1,温度为(135±0.5)℃,0.2 MPa 氮气保压3 h 后,观察溶液中出现沉淀的情况。实验结果如表5 所示。

表5 碘化锂对催化剂稳定性的影响

表6 5%~8%醋酸甲酯条件下对催化剂活性的影响
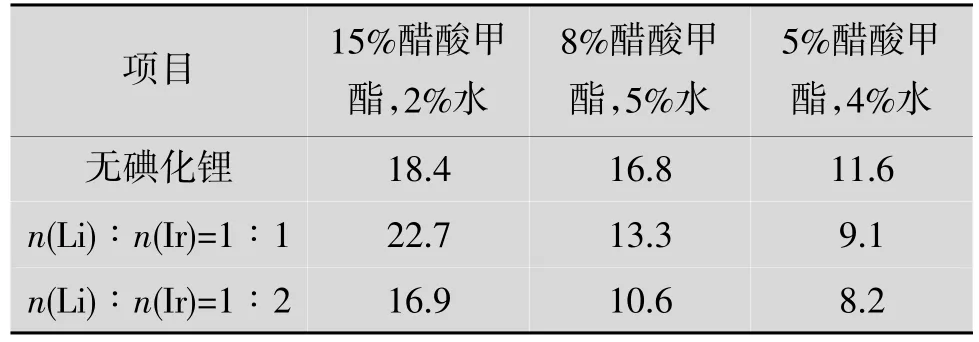
表7 不同碘化锂的量对反应的影响 mol/L/h
由表5 可知,添加一定量的碘化锂后:当水的质量分数为3%时,出现少量催化剂沉淀,但比不添加碘化锂时的沉淀量大大减少;当水的质量分数为5%时,没有出现催化剂沉淀。不添加碘化锂时,出现较多催化剂沉淀。由此可见,添加适量的碘化锂可以起到稳定催化剂的作用,从而减少催化剂的消耗。
4 结语
甲醇低压羰基化合成醋酸是目前世界工业生产中主要采用的工艺。铱/钌体系因催化剂活性高、选择性高、副反应少、产品品质高,已经在国内外得到工业化应用。因生产工艺需要,反应液中水的质量分数一般控制在3%以上,所以催化过程主要为阴离子循环。在生产过程中,适当提高醋酸甲酯的含量,同时加入与铱等比例的碘化锂,在确保不影响催化剂活性的前提下,可以提高催化剂的稳定性,从而降低催化剂的运行成本。铱作为贵金属之一,储备量稀少,随着其应用领域的拓宽,特别是被用作电解水制氢过程中的阳极催化剂,其价格可能会有一定幅度的提高。因此,进一步研究降低铱消耗的方法,具有较高的经济价值。

