山银花茎叶与花化学成分和抗炎活性比较研究
蔡 荣,徐春芳,李 珊,夏伯候,李亚梅,刘 武,谢菁琛,张智敏*,林丽美*
1.湖南中医药大学药学院,湖南 长沙 410208;2.湘产大宗药材品质评价湖南省重点实验室,湖南 长沙 410208;3.溆浦森鑫特色农业开发有限公司,湖南 怀化 419315
山银花是忍冬科植物灰毡毛忍冬Lonicera macranthoides Hand.-Mazz.、红腺忍冬Lonicera hypoglauca Miq.、华南忍冬Lonicera confusa DC.、黄褐毛忍冬Lonicera fulvoto-mentosa Hsu et S.C.Cheng的干燥花蕾或带初开的花,具有清热解毒、疏散风热的功效,用于痈肿疔疮、喉痹、丹毒、热毒血痢、风热感冒、温病发热[1]。 药理研究发现,山银花具有许多药用特性,诸如抗病毒、抗氧化、抗菌和抗炎作用[2-4]。
忍冬是山银花最早的药用名称,宋代及宋代以前多用忍冬的茎叶入药,到了明代,逐渐发展至茎、叶、花并用,明代以后,强调用花。 现代研究发现,山银花富含酚酸、三萜等多种活性成分[5],山银花酚酸化合物主要包括绿原酸、咖啡酸、异绿原酸等[6];山银花中三萜成分主要为灰毡毛忍冬皂苷甲、灰毡毛忍冬皂苷乙、川续断皂苷乙等[7]。 酚酸和三萜是山银花抗炎活性的有效成分[8-10]。 目前研究多集中于花,茎叶的研究相对较少。 金银花的药用部位是花和茎枝。 过去,金银花叶并不常用于医疗,但最近其引起了越来越多学者的关注[11-12]。 前人比较了金银花不同组织的化学成分和抗炎作用,指出金银花的叶和茎具有类似于花蕾的化学成分[13]和抗炎特性[14],可能成为花蕾的替代或补充来源。在治疗肿胀和疥疮方面,金银花的花、茎和叶具有相同功效[15]。
山银花生长过程中,除花蕾外,叶资源丰富,多数情况下弃之不用,如若可以将茎叶进行综合开发利用,则可实现茎叶的资源化。 因此,本研究首先表征山银花茎叶与花中酚酸和三萜类成分的异同,然后利用巨噬细胞体外模型评价其抗炎作用,最后采用小鼠耳郭肿胀和足趾肿胀体内抗炎模型研究其对小鼠耳郭、足趾肿胀度的影响,并测定足肿胀组织炎症因子,为后续对山银花茎叶的利用奠定基础。
1 仪器与材料
1.1 药材与试剂
山银花茎叶与花于2021 年6 月采集自湖南省怀化市溆浦县,经湖南中医药大学中药鉴定教研室龚力民副教授鉴定为灰毡毛忍冬Lonicera macranthoides Hand.-Mazz.的干燥茎叶与花蕾。
乙腈(色谱纯,批号:JA109230,默克股份两合公司);磷酸(色谱纯,批号:20100717,天津市光复精细化工研究所);地塞米松(纯度≥98%,批号:C12587834)、角叉菜胶(试剂级,批号:C12600607)、巴豆油(纯度≥95%,批号:C12229973)均购自上海麦克林生化科技有限公司;绿原酸标准品(纯度≥98%,批号:DSTDL002102)、咖啡酸标准品(纯度≥98%,批号:DST200918-013)均购自成都乐美天医药科技有限公司;异绿原酸A 标准品(纯度≥98%,批号:RFS-Y06802109007)、异绿原酸B 标准品(纯度≥98%,批号:RFS-Y06911812012)、异绿原酸C 标准品(纯度≥98%,批号:RFS-Y07011805016)、新绿原酸标准品(纯度≥98%,批号:RFS-X01401903029)、隐绿原酸标准品(纯度≥98%,批号:RFS-Y06701903029)、灰毡毛忍冬皂苷乙标准品(纯度≥98%,批号:RFSH01411804026)、灰毡毛忍冬皂苷甲标准品(纯度≥98%,批号:RFS-H07411804027)、川续断皂苷乙标准品(纯度≥98%,批号:RFS-C00511804026)均购于成都瑞芬思生物科技有限公司。
DMEM 培养基(批号:WH0021D111)、胎牛血清(批号:SA210518)均购于武汉普诺赛生命科技有限公司;脂多糖(lipopolysaccharides, LPS)(批号:127M4029V,美国Sigma 公司);CCK-8(批号:22005145,北京兰杰柯科技有限公司);一氧化氮(nitric oxide,NO)试剂盒(批号:022421210906,上海碧云天生物技术有限公司);肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)试剂盒(批号:M08014507)、白细胞介素-6(interleukin-6,IL-6)试剂盒(批号:M16014508)、白细胞介素-1β(interleukin-1β,IL-1β)试剂盒(批号:M17014509)均购于武汉华美生物工程有限公司;前列腺素E2(prostaglandin E2, PGE2)试剂盒(批号:A8KL9RWGU4,武汉伊莱瑞特生物科技股份有限公司)。
1.2 仪器
Waters e2695 型高效液相色谱仪(美国Waters公司);1510 型酶标仪[赛默飞世尔(上海)仪器有限公司];RE-2000A 型旋转蒸发器(巩义市中天仪器科技有限公司);P20-Y 型超纯水仪(湖南科尔顿水务集团有限公司);KQ-500DE 型数控超声波清洗器(昆山市超声仪器有限公司);microfuge 20R 型高速冷冻离心机(美国Beckman Coulter 公司);Synergy-HTX 型多功能酶标仪(美国伯腾仪器有限公司);ZWY-100H 型恒温培养振荡器(上海智诚分析仪器制造有限公司);WT C6002 型电子天平(杭州万特衡器有限公司)。
1.3 细胞株
小鼠巨噬细胞系(RAW264.7,目录号:TCM13)购自中国科学院上海细胞库。
1.4 动物
180 只SPF 级雄性KM 小鼠,体质量18~22 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2019-0004,合格证号:430727221100100456。所有实验动物均饲养于湖南中医药大学动物实验中心SPF 级动物房中。 适应性喂养1 周,自由摄食,环境温度24~26 ℃,相对湿度50%~60%,实验全程按照动物伦理学标准进行(伦理批准号:LLBH-202112010001)
2 方法
2.1 提取物的制备
分别将山银花干燥茎叶、花蕾加20 倍量蒸馏水煎煮3 次,第1 次煎煮1.5 h,第2 次和第3 次各煎煮1 h,趁热过滤,合并滤液,减压浓缩至质量浓度为0.1 g·mL-1,备用。
取D101 大孔树脂,用乙醇浸泡24 h,湿法装柱,用乙醇洗至流出液加适量蒸馏水后无白色混浊,再用蒸馏水洗至流出液无醇味。将预处理好的D101大孔树脂湿法装柱,分别加入上述山银花茎叶或花的水提液,上样流速为1 mL·min-1,静置25 min 后,用4 倍柱体积蒸馏水洗涤至无色,弃去。用10 倍柱体积的85%乙醇进行洗脱,洗脱剂流速为1 mL·min-1。收集洗脱液,浓缩干燥,即得。
2.2 总酚酸和总三萜含量的测定
2.2.1 总酚酸含量测定方法 以没食子酸为对照品,采用福林酚法进行测定。精密称取没食子酸标准品4.1 mg 于10 mL 容量瓶中,用甲醇溶解并定容至刻度,摇匀,得没食子酸标准储备液质量浓度为0.41 mg·mL-1。 分别吸取没食子酸标准储备液0、125、250、375、500、625、750、875、1 000 μL 置于1 mL 容量瓶中,加甲醇至刻度,摇匀,制成没食子酸系列标准溶液。分别精密移取0.5 mL 没食子酸系列标准溶液于10 mL 容量瓶中,加入福林酚溶液1.5 mL,振摇10 s,黑暗条件下放置10 min,再加入8%碳酸钠溶液2 mL, 用蒸馏水定容至10 mL, 振摇10 s,密塞,置50 ℃中水浴加热10 min,取200 μL 溶液置96 孔板中,于760 nm 处检测吸光度。绘制没食子酸标准溶液吸光度与其质量浓度的标准曲线,拟合得线性回归方程为Y=3.027 8X+0.009 9,R2=0.994 6。
精密称取各设定条件下提取的山银花茎叶与花提取物适量(相当0.2 g 生药量),加入10 mL 甲醇,充分溶解后,0.22 μm 微孔滤膜滤过,得样品溶液。精密移取样品溶液0.2 mL,置于10 mL 具塞试管中,按“2.2.1”项下方法制备待测溶液,根据没食子酸标准曲线求算出总酚酸浓度,并计算各处理的总酚酸含量和总酚酸得率。
2.2.2 总三萜含量测定方法 以熊果酸为对照品,采用香草醛-冰醋酸-高氯酸法进行测定。 精密称取熊果酸标准品4.6 mg 于10 mL 容量瓶中,用甲醇溶解并定容至刻度,摇匀,得熊果酸标准储备液质量浓度为0.46 mg·mL-1。 分别吸取熊果酸标准储备液0、125、250、375、500、625、750、875、1 000 μL 置 于1 mL 容量瓶中,加甲醇至刻度,摇匀,制成熊果酸系列标准溶液。 分别精密移取0.2 mL 熊果酸系列标准溶液于10 mL 具塞试管中,各试管加入新制的5%香草醛-冰醋酸溶液0.2 mL,振摇10 s,再向各试管中加入高氯酸1.8 mL,振摇10 s,密塞,置65 ℃水浴加热25 min 后,室温冷却5 min,再向各试管加入冰醋酸2.5 mL,振摇10 s,取200 μL 溶液置96孔板中,于547 nm 处检测吸光度。 绘制熊果酸标准溶液吸光度与其质量浓度的标准曲线,拟合得线性回归方程为Y=1.089 4X+0.149,R2=0.990 3。
精密称取各设定条件下提取的山银花茎叶与花提取物适量(相当0.2 g 生药量),加入10 mL 甲醇,充分溶解后,0.22 μm 微孔滤膜滤过,得样品溶液。精密移取样品溶液0.2 mL,置于10 mL 具塞试管中,按“2.2.2”项下方法制备待测溶液,根据熊果酸标准曲线求算出总三萜浓度和总三萜得率。
2.3 HPLC 法测定山银花茎叶与花中6 种酚酸和3种三萜的含量
2.3.1 色谱条件 Agilent ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相为0.4%磷酸溶液(A)和乙腈(B),梯度洗脱程序:0~5 min,8%~10%B;5~25 min,10%~12% B;25~37 min,12%~17%B;37~57 min,17%~20% B;57~70 min,20%~30%B;70~80 min,30%~35% B,流速1.0 mL·min-1,检测波长210 nm,柱温25 ℃,进样体积10 μL。 所得的色谱图见图1。
2.3.2 对照品溶液的制备 精密称定绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、新绿原酸、隐绿原酸、灰毡毛忍冬皂苷乙、灰毡毛忍冬皂苷甲、川续断皂苷乙、咖啡酸标准品适量,分别用85%乙醇配制成对照品储备液,绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、新绿原酸、隐绿原酸、灰毡毛忍冬皂苷乙、灰毡毛忍冬皂苷甲、川续断皂苷乙、咖啡酸浓度分别为0.537、0.644、0.538、0.508、0.513、0.564、0.538、0.520、0.461、0.551 mg·mL-1。取5 支10 mL 容量瓶,分别精密吸取各对照品储备液适量,用85%乙醇配制成5 个混合对照品溶液,其中绿原酸浓度为0.026 85、0.042 96、0.053 70、0.107 40、0.161 10 mg·mL-1,异绿原酸A 浓度为0.006 44、0.019 32、0.064 40、0.051 52、0.128 80 mg·mL-1,异绿原酸B 浓度为0.005 38、0.010 76、0.026 90、0.043 04、0.053 80 mg·mL-1,异绿 原 酸C 浓 度 为0.005 08、0.015 24、0.025 40、0.076 20、0.050 80 mg·mL-1,新绿原酸浓度为0.005 13、0.041 04、0.025 65、0.051 30、0.010 26 mg·mL-1,隐 绿 原 酸 浓 度 为0.005 64、0.056 40、0.028 20、0.112 80、0.016 92 mg·mL-1,灰毡毛忍冬皂苷乙浓度为0.107 60、0.161 40、0.053 80、0.026 90、0.043 04 mg·mL-1,灰毡毛忍冬皂苷甲浓度为0.041 60、0.052 00、0.026 00、0.005 20、0.010 40 mg·mL-1,川续断皂苷乙浓度为0.069 15、0.036 88、0.046 10、0.004 61、0.013 83 mg·mL-1,咖啡酸浓度为0.044 08、0.011 02、0.027 55、0.002 75、0.005 51 mg·mL-1。
2.3.3 供试品溶液的制备 精密称取山银花茎叶与花提取物,加85%乙醇充分溶解并定容后,过0.22 μm微孔滤膜,取续滤液,进行HPLC 分析。
2.3.4 方法学考察
(1)精密度、稳定性、重复性考察 分别取混合对照品溶液和山银花茎叶供试品溶液,按“2.3.1”项下条件进行精密度、稳定性、重复性考察,结果显示,每种成分的RSD 值均小于3%,符合要求。
(2)线性关系考察 取绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、新绿原酸、隐绿原酸、灰毡毛忍冬皂苷乙、灰毡毛忍冬皂苷甲、川续断皂苷乙的对照品储备液制备的各混标溶液,按相应色谱条件分析,进样量为10 μL,记录峰面积。 以溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)进行标准曲线回归,标准曲线方程和线性范围如表1 所示,各成分在各自范围内线性关系良好。

表1 各成分线性关系
(3)加样回收率考察 已知含量的供试品溶液共6 份,精密量取,加入含一定量的绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、新绿原酸、隐绿原酸、灰毡毛忍冬皂苷乙、灰毡毛忍冬皂苷甲、川续断皂苷乙的对照品溶液,混匀。 按“2.3.1”项下条件,计算各组平均回收率及RSD 值,结果见表2,10 个对照品的回收率为99.30%~105.22%,RSD 值均小于3%(1.04%~2.80%),说明该方法回收率好。
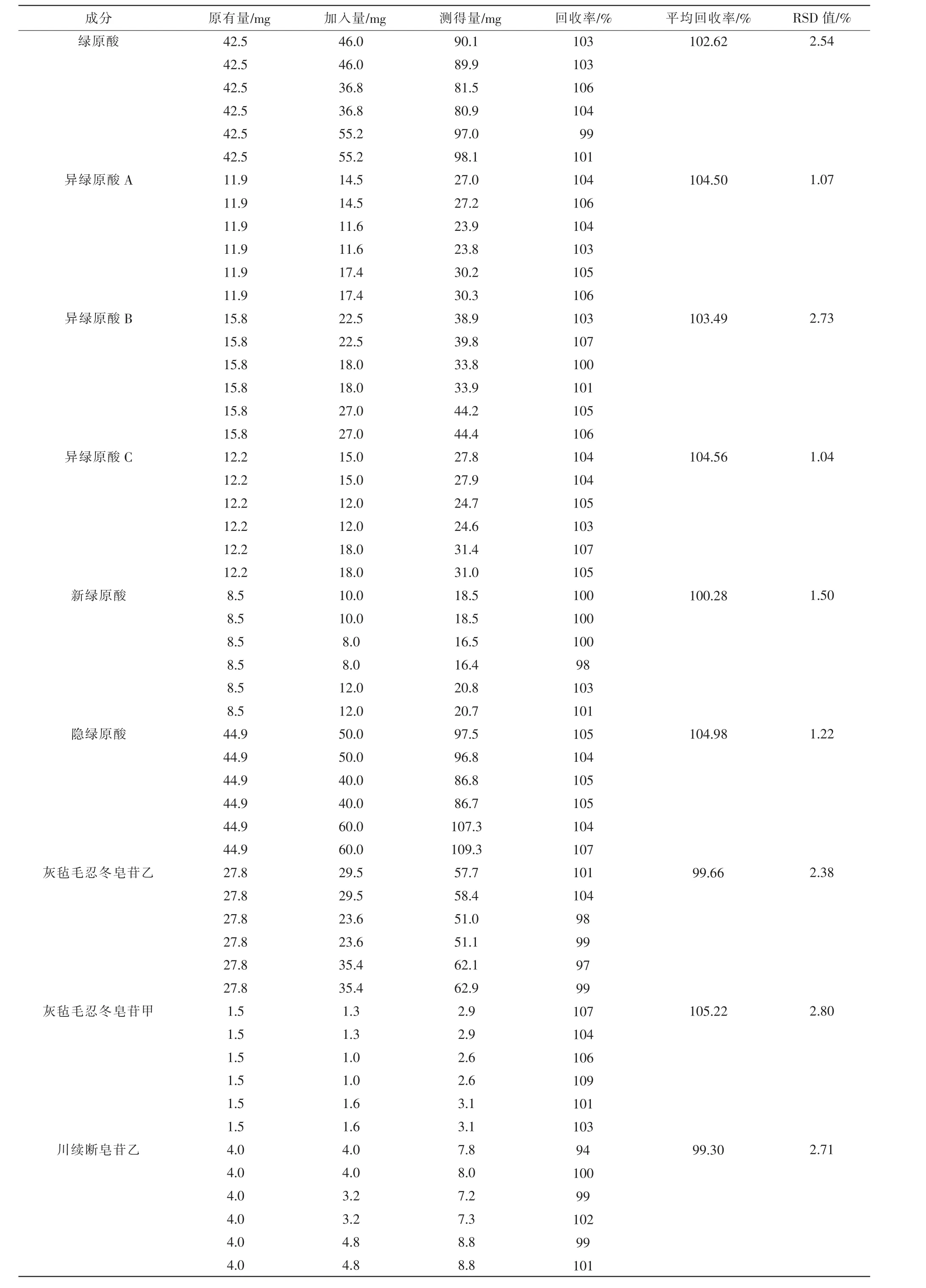
表2 各成分加样回收率试验结果(n=6)
2.4 体外抗炎活性研究
2.4.1 供试品配制 地塞米松用DMEM 培养基(无血清)配制成32 μg·mL-1的供试品药液;山银花茎叶提取物用DMEM 培养基(无血清)配制成25、50、100、200 μg·mL-1的储备液,山银花提取物用DMEM培养基(无血清)配制成29.5、59、118、236 μg·mL-1的储备液;经0.22 μm 微孔膜过滤后使用。
2.4.2 细胞分组及细胞存活率检测 取生长状态良好的RAW264.7 细胞,用含10%胎牛血清的培养液配成单细胞悬液,离心弃上清液,用完全培养基重悬细胞并计数,调整细胞悬液至5×104/mL,按每孔100 μL接种至96 孔板中,37 ℃、5%CO2培养箱中培养过夜。 接种12 h 后,在洁净工作台中用无血清DMEM培养基将山银花茎叶与花提取物稀释成62.5、125、250、500、1 000、2 000 μg·mL-1的供试品药液,弃去孔板中的培养基,每孔加入100 μL 对应浓度供试品药液,并设空白对照组(无血清DMEM 培养基+细胞),每组6 个复孔,于37 ℃、5%CO2培养箱中继续培养24 h 后,按每孔10 μL 加入CCK-8 试剂溶液,继续置于培养箱中培养2 h,随后用酶标仪检测450 nm处的吸光度。
2.4.3 细胞上清液中NO 释放量的检测 根据细胞存活率检测结果,在对细胞无毒性作用的安全浓度范围内设置各药物的浓度。实验共设置空白对照组、模型组(LPS 1 μg·mL-1)、地塞米松组(32 μg·mL-1)、山银花茎叶组(25、50、100、200 μg·mL-1)、山银花组(29.5、59、118、236 μg·mL-1)。
取对数生长期的RAW264.7 细胞进行消化,调整细胞悬液的密度为1×105/mL,按每孔1 mL 接种至12 孔板,于37 ℃、5%CO2培养箱中培养24 h,待细胞长至80%密度时,以含各药物的无血清培养基替换原培养基,空白对照组和模型组给予等量的无血清培养基,预处理2 h 后加入浓度为1 μg·mL-1的LPS,空白对照组给予等量的无血清培养基。继续培养24 h,随后收集各孔细胞上清,按照试剂盒说明采用Griess 法测定NO 含量。
2.5 体内抗炎活性研究
2.5.1 动物分组及耳郭肿胀度和肿胀抑制率检测 KM小鼠90 只,雄性,适应性喂养1 周,按体质量随机分为9 组,每组10 只,分别为空白对照组、模型组、地塞米松组(5 mg·kg-1)、山银花茎叶组(1.25、2.5、5 g·kg-1)和山银花组(1.25、2.5、5 g·kg-1)。 灌胃给药,给药体积为0.01 mL·g-1,每天1 次,连续给药7 d。空白对照组、模型组给予等体积蒸馏水。
末次给药30 min 后,于小鼠右耳正反两面均匀涂布巴豆油混合物(巴豆油∶无水乙醚∶无水乙醇∶蒸馏水=2∶73∶20∶5,临用前配制)40 μL/只,左耳不做任何处理,4 h 后,处死小鼠,剪下双耳,用8 mm 直径打孔器在小鼠耳朵相同的位置打下圆耳片,称重。计算肿胀度(两耳差值)和肿胀抑制率。 肿胀抑制率=(模型组平均肿胀度-实验组平均肿胀度)/模型组平均肿胀度×100%。
2.5.2 足趾肿胀度和肿胀抑制率检测 分组与给药同“2.5.1”。 末次给药后30 min,在小鼠左侧足趾皮下注射1%角叉菜胶30 μL,右侧足趾不做任何处理,4 h 后处死小鼠,沿踝关节剪下左右两足,称重,计算肿胀度(两足差值)和肿胀抑制率。 取小鼠左后足组织,匀浆后用ELISA 试剂盒检测TNF-α、IL-6、IL-1β、PGE2 含量。
2.6 统计学分析
采用SPSS 26 软件对数据进行统计分析。 实验数据均以“±s”表示,数据符合正态分布者用独立样本Student's t-test 检验,数据不符合正态分布用Mann-Whitney U test 进行统计分析。 组间比较时方差齐者采用Tukey 检验,方差不齐者用Dunnett-t 检验。 均以P<0.05 为差异有统计学意义。
3 结果
3.1 山银花茎叶与花中主要成分的含量
经计算得到山银花茎叶提取物中总酚酸、总三萜含量分别为26.68%、13.48%,山银花提取物中总酚酸、总三萜含量分别为16.14%、18.65%。山银花茎叶中总酚酸含量高于山银花(P<0.01),而山银花中总三萜含量高于茎叶(P<0.01)。 山银花茎叶与花提取物中主要成分含量存在差异,山银花茎叶中隐绿原酸含量高于山银花(P<0.05),灰毡毛忍冬皂苷乙(P<0.01)、灰毡毛忍冬皂苷甲(P<0.05)含量低于山银花。 详见图2。

图2 山银花茎叶与花中主要成分的含量测定结果(n=3)
3.2 体外抗炎活性分析评价
3.2.1 山银花茎叶与花对RAW264.7 细胞活性的影响 与空白对照组相比,山银花茎叶提取物浓度大于500 μg·mL-1时表现出对RAW264.7 细胞的显著毒性(P<0.05),山银花提取物浓度大于1 000 μg·mL-1时表现出对RAW264.7 细胞的显著毒性(P<0.05)。山银花茎叶提取物在250 μg·mL-1时RAW264.7 细胞的存活率仅为79.86%,故后续实验山银花茎叶提取物质量浓度调整为25、50、100、200 μg·mL-1,对应的山银花提取物质量浓度为29.5、59、118、236 μg·mL-1。详见图3。
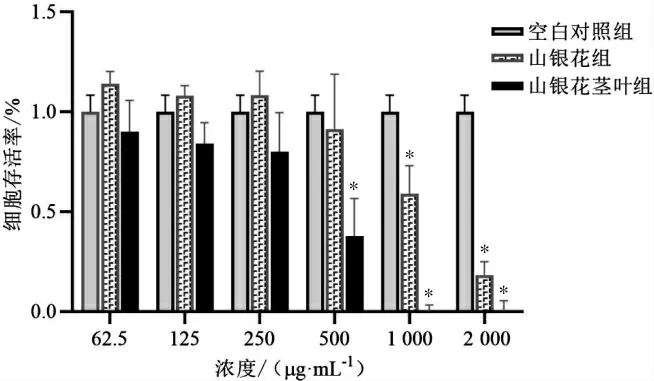
图3 山银花茎叶与花提取物对RAW264.7 细胞存活率的影响(±s,n=3)
3.2.2 山银花茎叶与花提取物对LPS 诱导RAW264.7细胞NO 释放量的影响 采用LPS 诱导RAW264.7细胞,与空白对照组比较,模型组NO 释放量显著升高(P<0.01)。与模型组比较,山银花茎叶组(50、100、200 μg·mL-1)、山银花组(59、118、236 μg·mL-1)均对LPS 诱导的NO 分泌有明显抑制作用(P<0.05,P<0.01)。 详见图4。

图4 山银花茎叶与花对细胞中NO 的影响(±s,n=3)
3.3 体内抗炎活性研究
3.3.1 山银花茎叶与花对巴豆油混合物致小鼠耳郭肿胀的影响 与空白对照组比较,模型组小鼠耳郭肿胀度明显升高(P<0.01);与模型组比较,地塞米松组、山银花茎叶组(1.25、2.5、5 g·kg-1)和山银花组(1.25、2.5、5 g·kg-1)小鼠耳郭肿胀度降低(P<0.01),耳肿胀抑制率升高(P<0.01);相同浓度下的山银花茎叶与花提取物对巴豆油致小鼠耳郭肿胀的影响差异无统计学意义(P<0.05)。 详见表3。
表3 山银花茎叶及花中提取物对巴豆油致小鼠耳郭肿胀度的影响(±s,n=10)
注:与空白对照组比较,##P<0.01;与模型组比较,**P<0.01。
组别空白对照组模型组山银花茎叶组剂量/(g·kg-1)——5耳肿胀抑制率/%100 0##山银花组地塞米松组2.5 1.25 5 2.5 1.25 0.005耳郭肿胀度/mg 0 21.0±4.0##9.0±3.0**10.4±4.6**14.2±4.2**9.6±2.6**10.9±3.1**14.5±3.5**3.8±2.8**57.14**50.48**32.38**54.29**48.10**30.95**81.90**
3.3.2 山银花茎叶与花提取物对角叉菜胶致小鼠足趾肿胀度的影响 与空白对照组比较,模型组小鼠足趾肿胀度明显升高(P<0.01);与模型组比较,地塞米松组、山银花茎叶组(1.25、2.5、5 g·kg-1)和山银花组(2.5、5 g·kg-1)小鼠足趾肿胀度降低(P<0.01),山银花茎叶组(2.5、5 g·kg-1)和山银花组(2.5、5 g·kg-1)足肿胀抑制率升高(P<0.01)。 此外,与山银花组(2.5、5 g·kg-1)比较,山银花茎叶组(2.5、5 g·kg-1)小鼠足趾肿胀度降低(P<0.01),足肿胀抑制率升高(P<0.05,P<0.01)。 详见表4。
表4 山银花茎叶及花中提取物对角叉菜胶致小鼠足趾肿胀度的影响(±s,n=10)
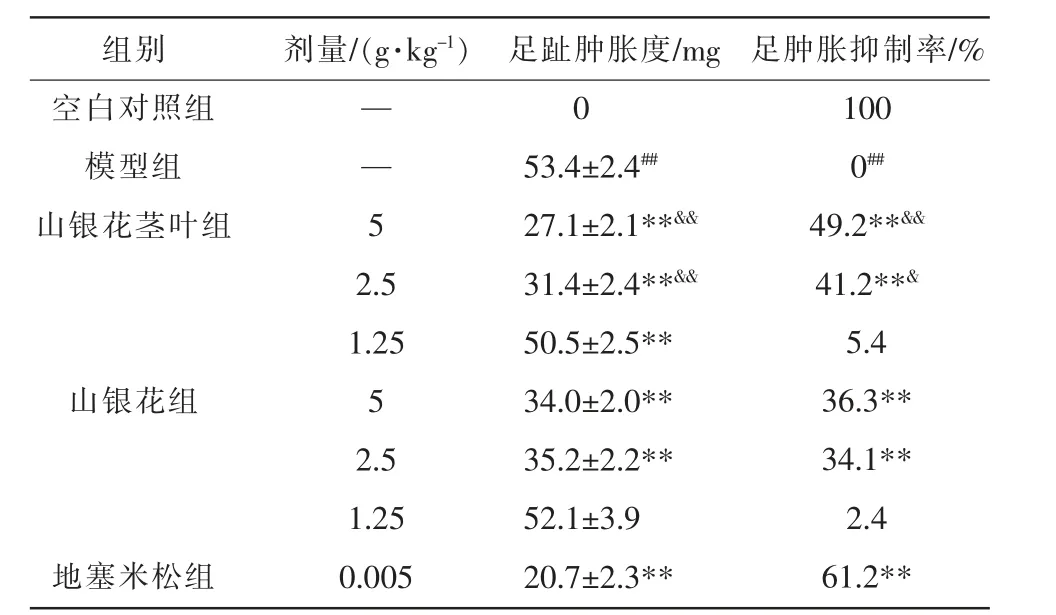
表4 山银花茎叶及花中提取物对角叉菜胶致小鼠足趾肿胀度的影响(±s,n=10)
注:与空白对照组比较,##P<0.01;与模型组比较,**P<0.01;与山银花组比较,&P<0.05,&&P<0.01。
组别空白对照组模型组山银花茎叶组剂量/(g·kg-1)——5足肿胀抑制率/%100 0##山银花组地塞米松组2.5 1.25 5 2.5 1.25 0.005足趾肿胀度/mg 0 53.4±2.4##27.1±2.1**&&31.4±2.4**&&50.5±2.5**34.0±2.0**35.2±2.2**52.1±3.9 20.7±2.3**49.2**&&41.2**&5.4 36.3**34.1**2.4 61.2**
3.3.3 山银花茎叶与花提取物对小鼠足肿胀组织中炎症细胞因子的影响 与空白对照组相比,模型组小鼠足肿胀组织中TNF-α、IL-6、IL-1β 和PGE2 含量均显著升高(P<0.01)。与模型组比较,地塞米松组及山银花茎叶组(2.5、5 g·kg-1)和山银花组(2.5、5 g·kg-1)小鼠足肿胀组织中IL-6、PGE2、IL-1β、TNF-α 含量均减少(P<0.05,P<0.01)。 详见图5。
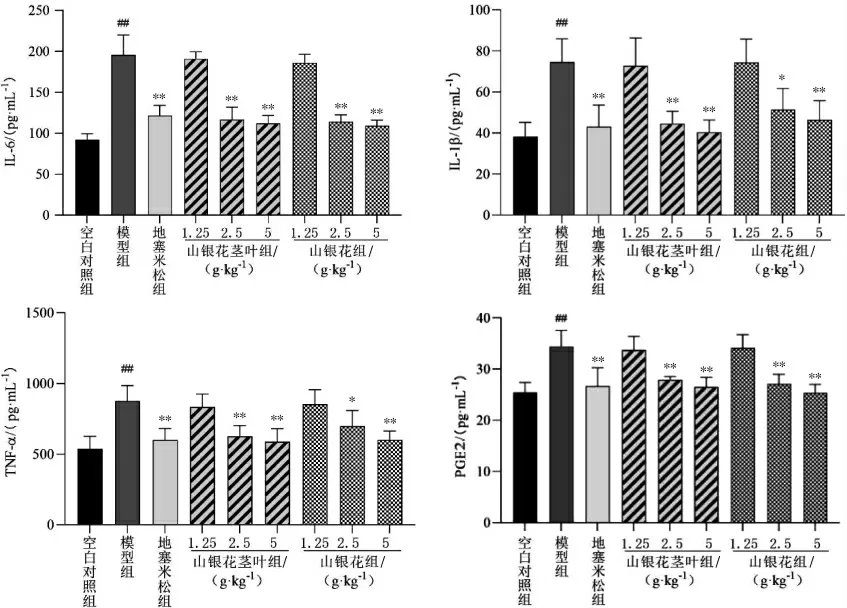
图5 小鼠足组织中炎症因子的含量比较(±s,n=6)
4 讨论
山银花已在中医药中使用数千年。迄今为止,已从山银花中分离和鉴定出200 多种化合物,主要成分为有机酸、三萜和黄酮等。 山银花的干燥花蕾或带初开的花是山银花的入药部位[1]。 不同的植物部分,包括花、花蕾、叶和整个植物,因含有不同的成分而具有不同的活性。 本研究通过HPLC 检测并比较了山银花茎叶与花中主要酚酸和三萜类成分的差异。
本研究结果表明,山银花中总三萜含量高于茎叶,而总酚酸含量低于茎叶。 山银花茎叶和花中酚酸和三萜成分种类相似,其中酚酸类成分以绿原酸和隐绿原酸为主,三萜类成分以灰毡毛忍冬皂苷乙为主,但各成分含量存在差异,如山银花茎叶中隐绿原酸含量高于花,而3 种三萜成分的含量均低于花。除了绿原酸,灰毡毛忍冬皂苷乙和川续断皂苷乙也是2020 版《中华人民共和国药典》[1]中规定的山银花质量控制的指标成分。 在本研究中,山银花中灰毡毛忍冬皂苷乙和灰毡毛忍冬皂苷甲含量均显著高于茎叶,这与已有文献报道结果一致[16]。
炎症是免疫系统对有害刺激(如病原体、受损细胞、有毒化合物或辐射)的反应,通过去除有害刺激并启动愈合过程[17]。因此,炎症是一种对健康至关重要的防御机制[18]。炎症可以在局部引起红肿、热、痛,激活巨噬细胞在炎症部位分泌多种促炎细胞因子,如TNF-α、IL-1β 和IL-6,以及促炎介质NO 和PGE2[19]。本实验采用巴豆油致小鼠耳郭肿胀模型和角叉菜胶致小鼠足趾肿胀模型,考察山银花茎叶和花提取物对小鼠的耳郭肿胀和足趾肿胀的影响及肿胀足组织中IL-1β、IL-6、TNF-α、PGE2 含量变化,结果显示,巴豆油致小鼠耳郭肿胀度增加,角叉菜胶致小鼠足趾肿胀度增加,而山银花茎叶和花均可降低小鼠耳郭肿胀度和足趾肿胀度,升高耳肿胀抑制率和足肿胀抑制率,足肿胀组织中IL-1β、IL-6、TNF-α、PGE2含量也明显降低,其机制可能与抑制IL-1β、IL-6、TNF-α、PGE2 的合成与释放有关。 山银花茎叶组的小鼠足趾肿胀度低于山银花组,但山银花茎叶和山银花对各细胞因子的调控作用差异无统计学意义,提示山银花茎叶和花的抗炎作用还可能与其他机制有关。炎症部位损伤程度与炎症因子水平非正相关情况,也存在于赪桐根[20]、蒙药阿给水[21]等的抗炎作用机制研究中。
本研究初步阐明了山银花茎叶与花中的酚酸和三萜类成分及其含量的差异。 体内外抗炎实验结果表明,山银花茎叶与花的提取物均具有显著的抗炎活性,且二者抗炎活性相当,证实了山银花茎叶与药用部位花的等效一致性。 本研究结果可为山银花茎叶用于治疗相关炎症性疾病以及进一步的研究利用提供科学参考。

