基于U-Det模型对肺内小结节CT图像良恶性鉴别的价值分析
张靖
中国中医科学院西苑医院 器材供应科,北京 100091
引言
肺实质中细胞的不规则和不可控生长是肺结节形成的主要原因之一,在早期检测和分析肺组织中的这些结节可大大提高患者的生存机会,并有助于治疗。CT 因在肺结节筛查中的高性能而被广泛用作体格检查的工具。根据肺部CT 筛查报告,实性结节评分4 分以上(结节大小超过8 mm)则怀疑为恶性,建议进行额外的诊断[1]。除了结节大小外,放射科医生还会根据毛刺、分叶和胸膜反应等放射学特征进行倾向诊断[2]。然而,由于这些病灶的错误分类,过度诊断和高假阳性率仍然存在,这与这些特征在CT 图像上的外观和扫描参数在层厚和对比度增强方面的相似性有关。在精准医疗理念及数字技术、深度学习网络快速发展下,以医学与数字技术紧密联系,应用网络模型诊断、预测各种疾病具有一定可行性[3]。基于U-Net 肺结节分割方法在肺结节分割中具有一定价值,但在肺内小结节分割方面的卷积神经网络架构仍不成熟[4-5]。为应对有效特征提取和适应肺结节异质性的挑战,本研究旨在提出一种改进的U-Net结构,即具有加权双向特征网络(U-Det),将其用于多种形式肺结节的分割中,以期提高恶性肺内小结节的确诊率。
1 资料与方法
1.1 一般资料
选取2021 年6 月至2022 年1 月于我院就诊并经病理检查的150 例肺内小结节患者作为研究对象,留取恶性样本(n=104)及非恶性样本(n=46)。纳入标准:① 肺结节良恶性经病理学证实[6];② CT 检查前未接受相关治疗;③ 患者及其家属签署知情同意书。排除标准:① 厚度超过3 mm 的薄层CT 图像;② 使用造影剂拍摄的CT 图像;③ 既往存在肺部手术史。
1.2 方法
1.2.1 CT图像采集
病理确诊前,研究对象均行胸部CT 平扫(仪器:GE Optima 型64 排CT 扫描仪),扫描范围:肺尖处至双肺后肋膈角。参数设置:管电压:120 kV;管电流:200 mA;螺距:0.560 ∶1;图像矩阵:512×512;视野:360 mm;层厚/层间隔均为10 mm。采用高分辨率算法重建,重建层厚为1.25 mm。结果由两名胸部放射科医师独立审查影像归档和通信系统上的所有CT 图像包括病变大小、毛刺和分叶等特征并达成共识后确定。留取恶样本及非恶性样本,扩增至各800 张。按照比例7 ∶3随机分为训练集样本(n=1120)和验证集样本(n=480),同时选取1400 张LUNA16 数据集图片作为测试集样本。
1.2.2 数据预处理
采用统计参数图软件SPM12 将原始CT 图像数据集行三维重建,利用CT 数据中的序列,将多个DICOM转换为单个NIFI 格式文件,以保留肺的空间特征。采用宽×高×深(W×H×D)表示数据尺寸行切片层数整理,首先找到切片中第一层肺组织的切片位置,将此层位置作为Start 层,后根据标签定位至End 层(最后出现肺组织的CT 图像位置),以上述两层所在位置为基础,将切片层数扩展至S 层(数据最完整地包裹肺,根据数据量情况得知S 层为20)。该步骤存在以下几种情况:① 以Start 和End 作为中心,向S 层扩展;② Start 层以上层数较End 层往下少时,以Start 为基础,往End 层方向扩展至S 层,反之往Start 方向扩展至S 层;③ 若数据层数无法达到S 层,则将该部分数据去除。
1.2.3 肺图像的分割过程
对CT 图像进行下采样操作以保留肺图像的空间位置和形状特征,降低图像的尺寸大小,以最大限度保留目标器官的图像位置信息。设置抽取因子(R=4),在横截平面上对CT 图像进行下采样处理后得到CT 图像数据为XR。经过预处理后,整理原始数据X 的尺寸(512×512×20)。基于下采样原理,在横截面下采样后设置数据维度为(W/R)×(H/R)×20,使肺图像维度降为128×128×20。采样后的CT 图像XR作为粗分割阶段的U-Det 网络训练输入,下采样后CT 图像作为输入,根据上述步骤构建U-Det 网络模型。以YR(Y为肺轮廓标签集,抽取因子R=4)作为模型标签,获取感兴趣的候选区域(根据粗分割模型输出)。保持U-Det网络结构基本不变,适当改进维度大小对粗分割的结果进行上采样操作,将上述采样操作获得的特征作为细分割输入,确保分割阶段能将肺组织所有图像包裹。
1.2.4 模型体系结构
U-Det 模型基于U-Net 的编码器、解码器主干,以及在Efficient-Det 中实现的功能丰富器Bi-FPN,特征网络的输出分别与解码器结构相结合,用于肺结节分割。本研究提出的模型利用U-Network 的骨干网与Bi-FPN相结合的方式完成肺结节的分割任务,在U-Det 模型编码部分,每一层分辨率包含3×3 的卷积核(2 个)和损失函数(1 个),为确保网络模型快速收敛,行归一化处理(标准差和均值),实现整体数据更新处理。另外,基于全卷积网络的U-Net 编码器获取CT 图像(CT 扫描的1 个切片),并输出5 个相应深度处特征,这些特征是Bi-FPN 的相应输入以特征网络的输出分别与解码器架构相结合,获得低层细粒度特征与高层语义特征的组合。具体U-Det 模型结构如图1 所示。
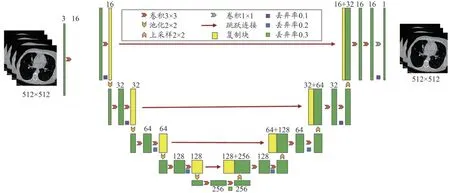
图1 基于U-Net的主干网络使用ResNet50的卷积神经网络进行下采样
1.2.5 U-Det模型的构建
以512×512 图像作为输入,输出512×512 掩码。收缩路径由两个3×3 卷积重复应用组成,每个卷积后有1 个非线性Mish 激活函数和1 个2×2 最大步长的池化操作,用于输入图像特征的下采样。将5 个深度处的特征输入Bi-FPN 中,输出的特征向量输入扩展段中。展开路径中的每一步均对特征图进行上采样,然后进行2×2 卷积,将每个深度上的特征通道数量减半。首先在骨干网的最后一层,得到512×512×64 特征图经过两次3×3 卷积;其次是Mish 激活函数和最后一个1×1卷积块;最后是sigmoid 激活函数,从而得到形状为512×512的输入CT图像的掩码对应的logits。将在U-Det卷积神经网络模型中输入预处理图片并进行训练,最后将验证集输入模型中以进行验证。
1.2.6 训练方法
在模型的训练阶段,训练过程中模型优化算法采用Adam 法,初始学习率:1×10-5,权重衰减:0.0001,动量:0.9。同时,利用两个样本的批次大小来训练模型。在后处理阶段,批大小batch_size 为8。数据预处理后得到肺结节图片。
1.3 统计学分析
采用Python 3.6.5(Win64)软件处理数据,计数资料采用n(%)表示,采用χ2检验;连续变量以±s表示,采用t检验,以P<0.05 为差异有统计学意义。采用Keras 人工神经网络库建立卷积神经网络模型,以U-Net作为基线卷积,从预训练基线卷积层中提取特征。
2 结果
2.1 两组临床资料比较
两组结节位置、直径比较,差异均无统计学意义(P>0.05),见表1。
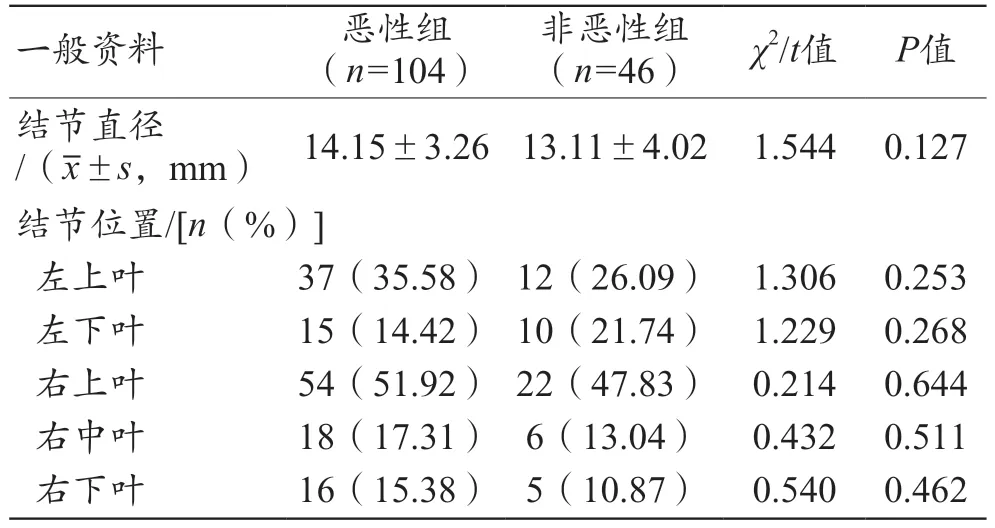
表1 两组临床资料比较
2.2 U-Det模型构建结果
U-Det 模型中训练样本的平均损失率为0.126%±0.046%,验证样本的平均损失率为0.135%±0.053%,见图2。U-Det 模型中训练样本的平均准确度为88.42%±4.21%,验证样本的平均准确度为89.01%±4.09%,见图3。
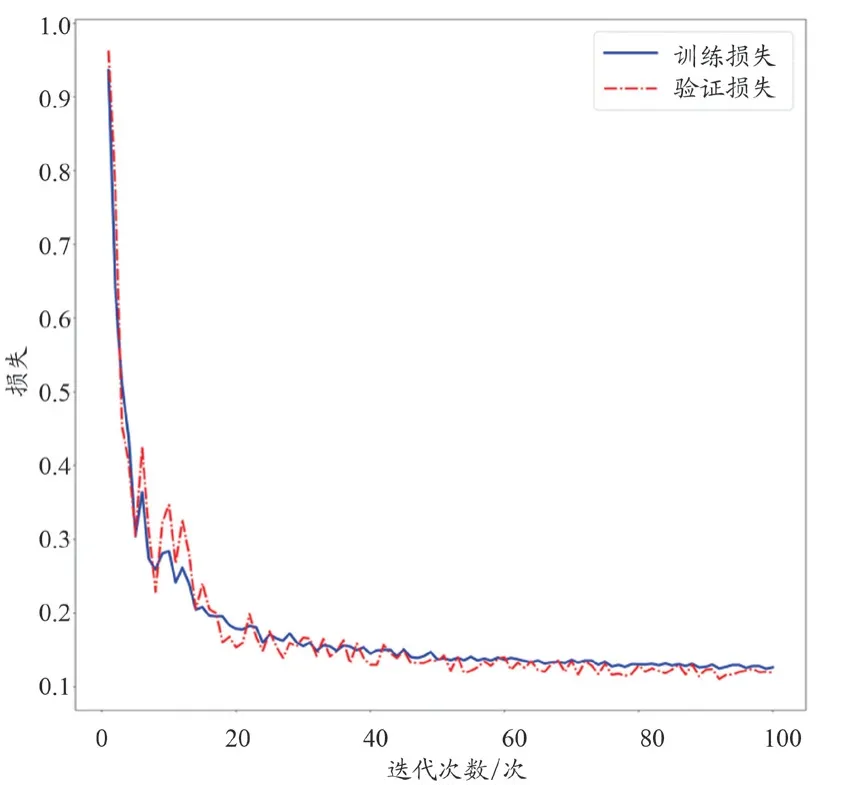
图2 U-Det模型构中训练组及验证组损失情况
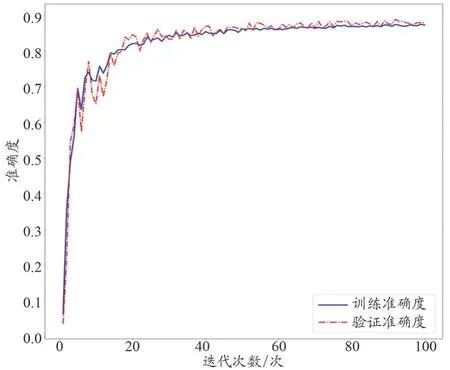
图3 U-Det模型构中训练组及验证组准确度
2.3 U-Det模型对肺内小结节的良恶性识别
如图4 所示,U-Det 模型能有效预测结节良恶性,辅助临床医生对疾病进行诊断。
图4 U-Det模型对肺内小结节的良恶性识别
2.4 U-Det、U-Net和ResNet50模型的混淆矩阵
U-Det 模型诊断准确度、敏感度、特异性、阳性预测值、阴性预测值最高;除特异性外,U-Net 模型的各项指标均高于ResNet50 模型,见表2。
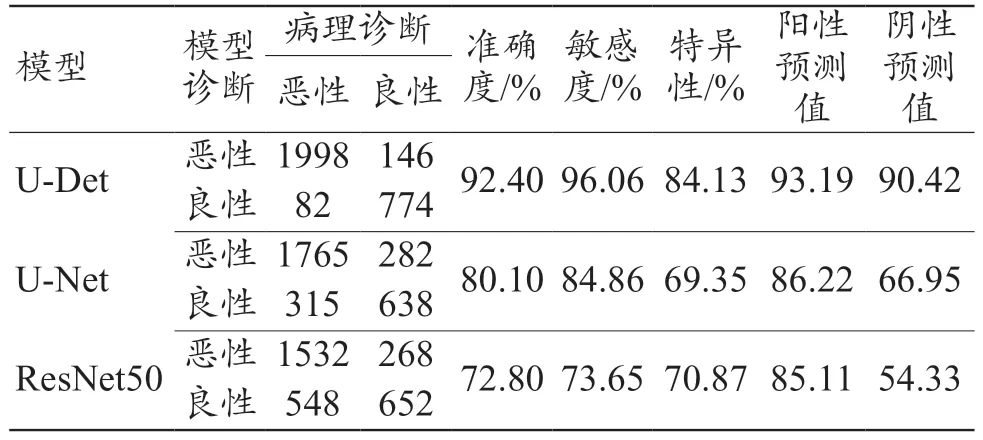
表2 U-Det、U-Net和ResNet50模型的混淆矩阵
2.5 U-Det、U-Net和ResNet50模型的预测价值比较
受试者工作特征(Receiver Operator Characteristic,ROC)曲线显示,U-Det、U-Net 和ResNet50 模型预测准确度递减,其中U-Det 模型预测AUC 最高为0.924(95%CI:0.900~0.943),U-Net 模型次之为0.801(95%CI:0.768~0.832),ResNet50 模型最低为0.728(95%CI:0.692~0.763),两两对比差异具有统计学意义(U-Detvs.U-Net,Z=4.966,P<0.001;ResNet50vs.U-Net,Z=2.195,P=0.028;ResNet50vs.U-Det,Z=4.966,P<0.001),见图5。
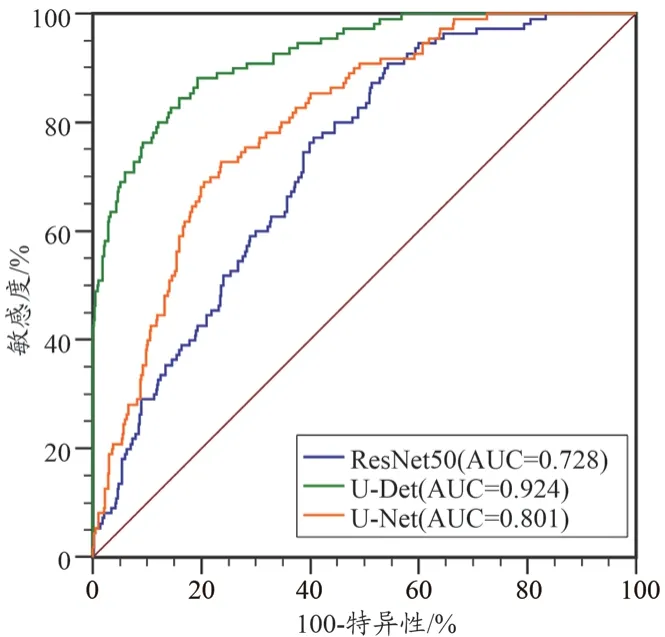
图5 U-Det、U-Net和ResNet50模型对肺内小结节预测价值ROC曲线
2.6 LUNA16测试集下U-Det、U-Net和ResNet50模型的混淆矩阵
LUNA16 测试集下U-Det 模型的诊断准确度、敏感度、特异性、阳性预测值、阴性预测值最高,U-Net 次之,ResNet50 最低,见表3。
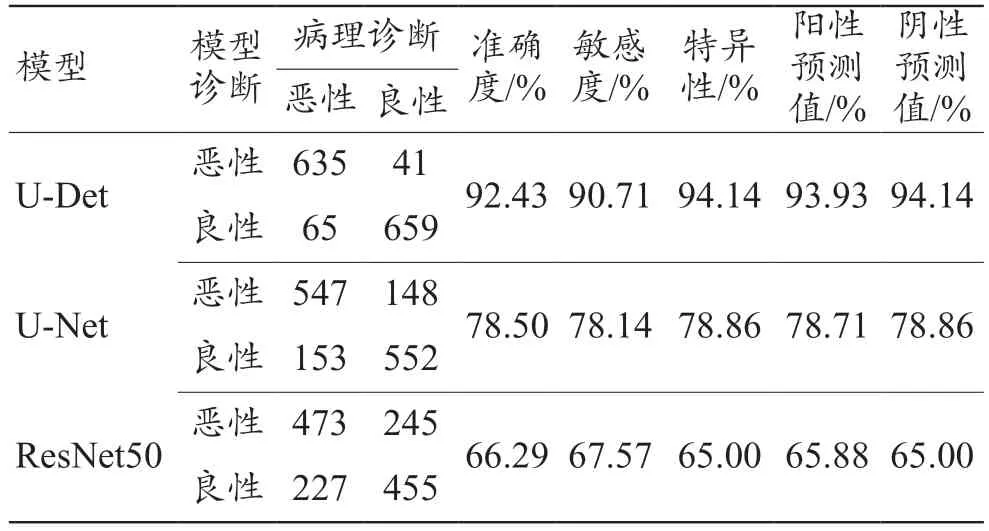
表3 LUNA16测试集下U-Det、U-Net和ResNet50模型的混淆矩阵
3 讨论
肺癌的早期诊断和分析需要在CT 图像中精确有效地分割肺结节,这对随后的分析结果有重大影响,为确保诊断准确度,放射科医生必须检查包含150~500 个切片的CT 扫描,这无疑会增加工作难度[7-8]。此外,CT图像中结节的匿名形状、视觉特征和周围环境给肺部结节的稳健分割带来了挑战。临床通过用简单阈值和基于形态学的方法对肺结节进行分割,但由于肺结节的大小和类型有很大差异、从粘连型结节(胸膜旁和血管旁)到毛玻璃样阴影结节导致稳健分割非常困难[9-10]。因此,急需一个稳健的分割网络来适应大规模结节问题。
在计算机视觉领域,卷积神经网络已成为主流架构[11-12],在乳腺癌[13]、头颈癌[14]、肝癌[15]等癌症中能为临床医生制定一个准确的诊断提供参考意见的形态学评估期间组织病理学图像,以减少人为错误诊断。Peng等[16]对结节予以多视图卷积神经网络进行分割,可分别从3 个视点(矢状面、轴面和冠状面)对结节特征进行分析;Baldwin 等[17]认为采用增强金字塔池化卷积网络可有效提高肺结节分割性能,该网络架构能同时融合低级细粒度和高级功能的特征;另一方面,完全卷积网络是分割CT 图像的不同方法,U-Net 作为完全卷积神经网络的一种架构,在生物医学成像领域中,该模型在分割任务上取得了较好的成果。Tang 等[18]提出的2D U-Net 架构和3D U-Net 方法是更适合生物医学成像的分割方法。然而,截至目前,用于肺结节分割任务的卷积神经网络架构仍不成熟。因此,开发处理以前体系结构缺点的高级体系结构至关重要。由于部分肺结节图像具有目标区域小、边缘模糊等情况,其训练时均采用原始U-Net 模型,将会出现特征利用率低、梯度消失等问题,最终对模型分割准确度造成一定程度的影响[19-20]。基于此,本研究尝试在U-Net 模型的基础上,针对原始U-Net模型的不足,提出了一种改进的肺结节分割法即U-Det模型。该算法可有效增强网络算法对特征的传递与利用,缓解不平衡问题,并对肺结节等小目标区域的分割具有较大的改善作用。
本研究对肺内小结节患者CT 图像建立U-Det 模型并对U-Det辅助诊断平台进行深度训练及临床数据验证,结果显示,随着迭代次数增加,U-Det 模型训练和验证损失随之减小、准确度逐渐增加并趋于稳定,U-Det 模型能准确预测肺内小结节良恶性;且采用LUNA16 图片作为测试集进行测试后发现,U-Det 模型诊断价值最高。但由于肺结节种类相对较多、肺结节的判断标准相对复杂,本研究所收集的数据集尚不能充分体现肺结节的多样性,后期需增加样本量进行进一步研究。随着技术的进步,在肺结节检测中计算机辅助诊断系统或将发挥重要作用,未来还将开发基于U-Det 组件的3D 无监督胶囊网络,用于肺癌的全自动恶性分类。
4 结论
本文提出了一种使用U-Det 分割肺部结节的高效改进U-Net 结构的模型,是一种端到端的深度学习方法。该模型通过骨干U-Net 架构提取和解码特征地图,Bi-FPN 通过合并多尺度特征融合充当特征丰富器。通过对所提方法结果的评估和可视化,能成功地分割结节病例,提高肺结节分割的精度,并为医生诊断提供辅助资料。

