环丙沙星生物条形码检测技术的研究
栗慧,于苗,孙丰梅,魏玉文,魏东*
(1. 河北北方学院 河北省农产品食品质量安全分析检测重点实验室,河北 张家口 075000;2. 河北北方学院 农林科技学院,河北 张家口 075000;3. 河北北方学院 张家口市特色农产品质量安全重点实验室,河北 张家口 075000;4. 张家口市动物卫生监督所,河北 张家口 075000)
环丙沙星(ciprofloxacin,CPFX)属于氟喹诺酮类药物,物理形态为结晶粉末,颜色呈现为白色或微黄色,化学分子式为C17H18FN3O3[1]。其药物作用为破坏细菌DNA 的双螺旋链,干扰其DNA 转录、复制及重组等过程。医学上一般应用于由敏感病原体引起的呼吸道感染、胃肠道感染、肺部感染、泌尿道感染和局部感染等疾病[2-5]。由于其抗菌活性比其他氟喹诺酮类药物强,尤其是对革兰氏阴性菌和支原体,是氧氟沙星和培氟沙星的4 倍,所以在动物养殖过程中被广泛应用,但其存在一定的不良反应发生率、二重感染率以及细菌耐药性等问题,特别是耐药性问题,对环丙沙星产生耐药性后,可能也会引发对其他喹诺酮类药物的交叉耐药性,甚至对氨基糖苷类药物也产生耐药性[6-8]。目前,对我国食品中兽药的最大残留限量采用GB 31650—2019《食品安全国家标准食品中兽药最大残留限量》,标准中规定了环丙沙星在牛、羊、猪的肌肉中允许残留的最大限量为400 μg/kg,在家禽肌肉中允许残留的最大限量为300 μg/kg,鱼(皮+肉)中允许残留的最大限量为300 μg/kg[9]。近年来,动物源性食品中的环丙沙星残留问题引起了消费者的广泛关注。目前,对动物源性食品中CPFX 残留的检测方法包括微生物法[10]与仪器方法[11-12]等,其中最常用的方法是高效液相色谱法和高效液相串联质谱法,这些方法结果可靠,可满足一般检测。但这些方法样品前处理较为繁琐,需要操作人员有较高的专业性知识,且仪器价格较为昂贵[13-15]。因此,迫切需要建立一种灵敏性高、操作简单易学、结果可靠的检测手段。
生物条形码检测技术是近年兴起的一种快速检测新技术,其原理是指通过化学、静电耦合等方式首先将相同序列的DNA 条形码耦连在纳米金颗粒表面,其次将检测抗原耦连在磁性微球表面,以形成“纳米金探针-目标物-磁性探针”的三明治结构,检测其条形DNA 码含量,以此实现高灵敏度检测残留药物的方法。该技术具有操作步骤相对简便、准确度高、特异性强、不需要大型仪器辅助等优点,被广泛应用于医学检验与检疫、食品卫生检测、环境监测等各个领域[16-20]。目前,生物条形码检测技术与其他多种技术相结合,包括生物芯片印染技术、酶标纳米金探针技术、生物传感器技术、聚合酶链式反应(polymerase chain reaction,PCR)技术以及微孔板银染技术等。通过与上述技术相结合,更加提高了生物条形码技术的灵敏性和准确度。
本研究采用生物条形码技术与微孔板银染技术相结合的方法,首先将DNA 链与环丙沙星多克隆抗体标记于纳米金颗粒表面制备纳米金探针,其次将环丙沙星单克隆抗体标记于磁性微珠表面制备磁性探针;然后制备三明治结构,获取DNA 链,建立一种使用酶标仪快速检测CPFX 残留的方法。为CPFX 药物残留的定量定性检测研究开拓思路,对保障我国动物源性食品质量安全具有重大的意义。
1 材料与方法
1.1 材料与试剂
环丙沙星标准品:中国兽医药品监察所;纳米金:上海金标生物科技有限公司;卵清蛋白(ovalbumin,OVA)、牛血清白蛋白(bovine serum albumin,BSA):美国Sigma 公司;环丙沙星单克隆抗体:MedChemExpress 试剂公司;羧基化的磁珠:海狸生物有限公司;银染增强液(A 液、B 液)、杂交缓冲液:瑞士罗氏公司;DNA 链:生工生物工程(上海)股份有限公司;环丙沙星多克隆抗体:河北北方学院河北省农产品食品质量安全分析检测重点实验室自制。
1.2 仪器与设备
电子天平(LE225D):北京赛多利斯仪器系列有限公司;恒温磁力搅拌器(JB-2 型):上海雷磁新经仪器有限公司;离心机(TGL-16A):金坛市仪都仪器有限公司;紫外-可见分光光度计(Lambda365):铂金埃尔默仪器有限公司;透射电子显微镜(7650):日本日立公司。
1.3 寡核苷酸链的设计与合成
试验用DNA 链如表1 所示。
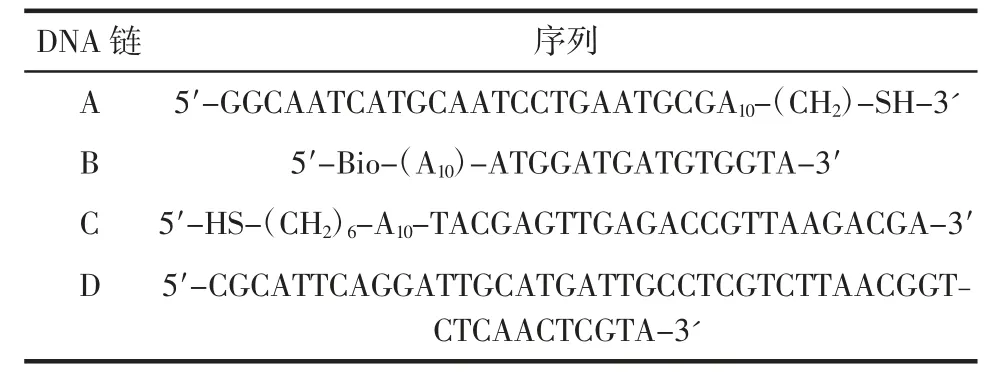
表1 试验用DNA 链Table 1 DNA chain for test
1.4 试验方法
1.4.1 纳米金探针的制备
首先取1mL 纳米金溶液,通过加入浓度为0.25mol/L K2CO3将其pH 值调节为9.0;然后将1.2 μg/mL 的环丙沙星多克隆抗体加入到上述纳米金溶液中,在室温条件下,充分振荡孵育1 h;而后加入稳定剂(5%BSA),以防止胶体金颗粒和抗体发生聚集和沉淀。
将寡核苷酸A 链(0.5 OD/mL)加入上述已制备完成的混合液中,室温静置48 h,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)调节pH 值至7.0,然后离心15 min,转速为10 000 r/min;最后加入寡核苷酸D 链(0.5 OD/mL),室温杂交8 h,离心20 min,转速为10 000 r/min 即得到纳米金复合探针,4 ℃保存备用。
1.4.2 纳米金探针的鉴定
1.4.2.1 可见光光谱法鉴定纳米金探针
使用紫外-可见分光光度计,波长选择在400~700 nm 之间,对纳米金探针溶液进行扫描,得到纳米金探针的可见光吸收光谱,观察其波形是否为光滑曲线,是否有最大吸收峰,以此确定纳米金探针是否制备成功。
1.4.2.2 透射电镜法鉴定纳米金探针
在鉴定前对纳米金探针溶液进行15 min 超声处理,目的是分离样品,防止样品发生团聚。先将少量纳米金探针溶液滴于承载样品的铜网上,然后用滤纸吸收多余试剂,在室温条件下干燥30 min,放置于透射电镜下观察其形状及分布情况,进一步鉴定纳米金探针是否制备成功。
1.4.3 磁性探针的制备
1.4.3.1 磁性颗粒的活化
取5 mL 磁珠放入含有45 mL PBS 的离心管中充分振荡混匀,然后放置于磁力架上磁性分离,弃去上清溶液;为保证完全去除保护磁珠的活化液,用PBS缓冲液冲洗磁珠4 次;加入5%戊二醛溶液30 mL,放入振荡器中振荡3 h,振荡完成后重复上述步骤1 次;最后将磁珠混匀于20 mL 的含吐温-20 的磷酸盐缓冲液中,于4 ℃保存。
1.4.3.2 磁性颗粒与CPFX 单克隆抗体结合
完成1.4.3.1 步骤后,将10 μL 浓度为2 μg/mL 的CPFX 单抗加入到磁珠溶液中,振荡反应24 h,放置于磁力架上磁性分离,弃去上清液;加入40 mL PBS 缓冲溶液和20 mL 甘氨酸溶液先后与分离后的磁珠混匀,振荡反应30 min,重复进行磁性分离,弃去上清液,用PBS 缓冲溶液重复清洗3 次,完成清洗后加入45 mL PBST 溶液置于4 ℃条件下保存。
1.4.4 磁性探针的鉴定
磁性探针的鉴定选用透射电镜法,先将少量磁性探针溶液滴于承载样品的铜网上,然后用滤纸吸收多余试剂,在室温条件下干燥30 min,放置于透射电子显微镜下观察其形状与分散情况,以此鉴定磁性探针是否制备成功。
1.4.5 检测探针的制备
将寡核苷酸C 链用TE 缓冲液溶解,再按照1∶300的体积比与三(2-羧乙基)膦溶液混合,二者充分混匀12 h。然后将上述溶液加入到制备好的纳米金溶液中混合均匀,室温放置20 h。在此过程中,分6 次加入4 mL NaCl 溶液(0.2 mol/L),老化40 h。在4 ℃条件下以10 000 r/min 的转速离心30 min,弃去上清液,最后加入1 mL 的磷酸盐缓冲液(浓度为10 mmol/L)混匀,所得到检测探针4 ℃保存。
1.4.6 检测探针的鉴定
1.4.6.1 可见光光谱法鉴定检测探针
参照1.4.2.1 的方法对检测探针溶液进行扫描鉴定,得到检测探针的可见光吸收光谱,观察吸收光谱是否为光滑曲线,并且有最大吸收峰值,以此鉴定其是否制备成功。
1.4.6.2 透射电镜法鉴定检测探针
在鉴定前对检测探针溶液进行10 min 超声处理,参照1.4.2.2 的方法对检测探针溶液进行观察,鉴定其是否制备成功。
1.4.7 竞争免疫体系的建立
在室温条件下,将待检样品(CPFX 标准品)0.01 mmol/L 加入到磁性探针溶液中,振荡反应1 h,使其充分杂交融合。振荡完成后,置于磁力架上磁性分离,用PBS 溶液清洗3~4 次,去除未结合上的待检样品。分离完成后加入纳米金复合探针溶液,使其三者形成一个夹心结构,振荡反应45 min;同样进行磁性分离和PBS 缓冲溶液清洗步骤4~5 次,除去未结合成功的探针。在上述制备完成的溶液中加入无菌水,在60 ℃的条件下,充分振荡反应1 h,置于磁力架上分离,收集上清液,此时该上清液中含有生物条形码。
1.4.8 基于生物素-亲合素系统酶标板杂交体系的建立
取25 μL 1.4.7 中制备完成的溶液,向其中加入2 μL生物素探针溶液和25 μL 罗氏杂交缓冲液,于室温条件下混合均匀,充分反应15 min;再向其中加入5 μL检测探针溶液继续反应15 min;反应完成后将上述所得溶液加入到已预先包被好链霉亲和素的酶标板中,25 ℃条件下,孵育1 h;孵育完成后用含吐温-20 的磷酸盐缓冲液进行洗板工作,共3 次;将50 μL 银染增强A 液和B 液迅速混匀后加入酶标板内,置于避光环境下反应一段时间,放入超纯水中终止银染反应,完成终止反应后用酶标仪记录各孔在630 nm 处的吸光度。
1.4.9 优化微孔板内的杂交体系
1.4.9.1 优化包被浓度
建立微孔板内的杂交体系中关键步骤为链霉亲和素的包被浓度,依次选择0、0.05、0.1、0.15、0.2 mg/kg 5 个浓度值,按照1.4.8 中的步骤,测定各孔在630 nm处的吸光度,从中选出链霉亲和素的最佳包被浓度。
1.4.9.2 优化检测探针浓度
检测探针浓度的优化有利于提高检测技术的灵敏度,依次选择0、30、60、90、120 nmol/L 5 个浓度值,按照1.4.8 中的步骤,测定各孔在630 nm 处的吸光度,从中选出检测探针的最佳浓度。
1.4.9.3 优化生物素探针浓度
若生物素探针浓度过高可能会抑制检测技术的灵敏度,浓度过低而会使杂交体系反应不充分。因此依次选择0、25、50、75、100、125、150 nmol/L 7 个浓度值,按照1.4.8 中的步骤,测定各孔在630 nm 处的吸光度,从中选出生物素探针的最佳浓度。
1.4.9.4 优化银染时间
若银染反应时间过长则会导致阴离子产生聚集现象,反应时间过短则会导致反应不充分。因此依次选择0、2、4、6、8 min 5 个不同的银染时间,按照1.4.8中的步骤,测定各孔在630 nm 处的吸光度,从中选出最佳的银染时间。
1.5 数据处理
采用Origin 2019 软件进行试验数据处理与绘图,WPS 2020 软件进行统计与计算。
2 结果与分析
2.1 纳米金探针的鉴定结果
2.1.1 纳米金探针的可见光光谱鉴定结果纳米金探针可见光谱如图1 所示。
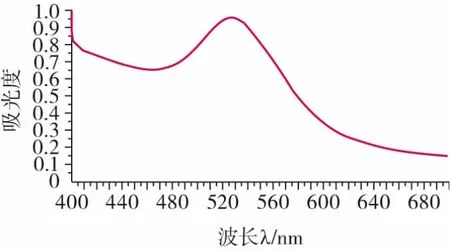
图1 纳米金探针可见光谱图Fig.1 Visible spectrum of nano-gold probe
以波长为横坐标,吸光值A 为纵坐标,测试试验所得纳米金探针溶液,得到一条光滑曲线,具有明显的吸收峰,最大吸收峰λ 位于528 nm 附近,其对应的吸光度为0.952 9。根据杜鹏飞[18]对纳米金探针的研究,初步证明纳米金探针制备成功。
2.1.2 纳米金探针的透射电镜鉴定结果
纳米金探针的透射电镜鉴定结果如图2 所示。

图2 纳米金探针透射电镜图Fig.2 Transmission electron microscope of nano-gold probe
由图2 可知,多克隆抗体与DNA 链标记在粒径为15 nm 的纳米金颗粒上,纳米金探针分散比较均匀,并且纳米金颗粒周围有明显的灰黑色晕环,表明纳米金颗粒、多克隆抗体及DNA 链标记较为成功。
2.2 磁性探针的鉴定结果
磁性探针的透射电镜鉴定结果如图3 所示。

图3 磁性探针透射电镜图Fig.3 Transmission electron microscope of magnetic probe
如图3 所示,将CPFX 单克隆抗体与粒径大小为2.8 μm 的磁性颗粒修饰完成后,其磁性探针在颗粒外围形成一圈清楚的光晕,这表明外围有一层低电子密度的物质包围在磁性颗粒表面;从图中可以看出修饰后的磁性颗粒分散较均匀,表明磁性探针制备成功。
2.3 检测探针的鉴定结果
2.3.1 检测探针的可见光光谱法鉴定结果
检测探针的可见光光谱法鉴定结果如图4 所示。
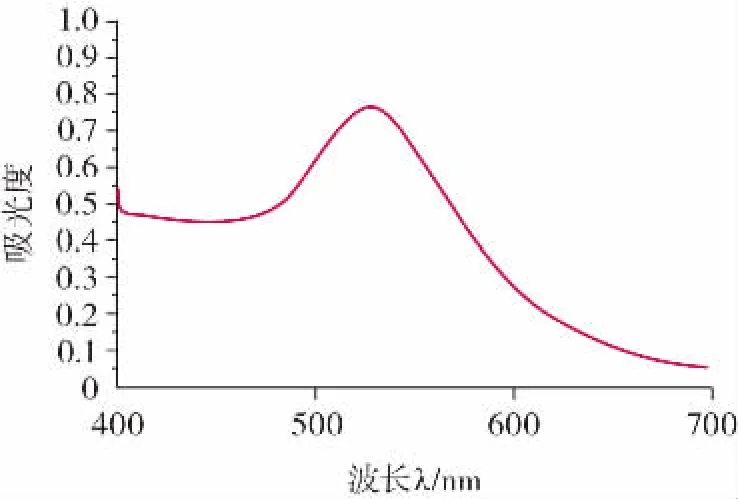
图4 检测探针可见光谱图Fig.4 Visible spectrum of detection probe
在波长400~700 nm 下,对检测探针溶液进行检测,以波长为横坐标,吸光度A 为纵坐标,得光滑曲线(图4),具有明显吸收峰,最大吸收峰λ 位于524 nm附近,其对应的吸光度为0.762 2,初步证明纳米金探针制备成功。
2.3.2 检测探针的透射电镜鉴定结果
检测探针的透射电镜鉴定结果如图5 所示。

图5 检测探针透射电镜图Fig.5 Transmission electron microscope of detection probe
由图5 可以看出检测探针分布均匀、颗粒大小一致且颗粒与颗粒之间没有出现重叠在一起的现象,与杜鹏飞[18]的研究成果较为匹配,证明检测探针制备成功。
2.4 测定CPFX 的标准曲线
CPFX 标准曲线如图6 所示。
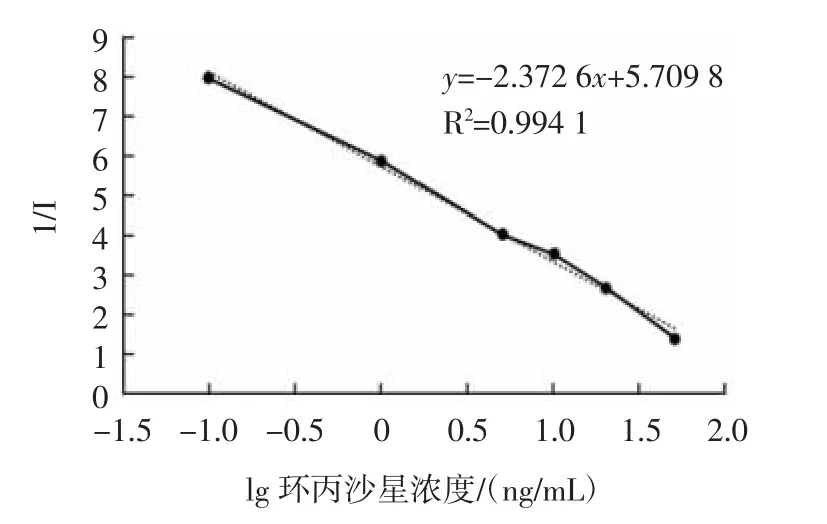
图6 环丙沙星的标准曲线Fig.6 Standard curve of ciprofloxacin
标准曲线的横坐标选用环丙沙星浓度的对数值,纵坐标选用抑制率的倒数,由图6 可知,环丙沙星浓度的对数值与抑制率的倒数呈良好的线性关系,其回归方程为y=-2.372 6x+5.709 8,R2=0.994 1,根据所得方程计算,取抑制率I 为1.5 时为最低检出限,则环丙沙星浓度为2.13 ng/mL。结果显示,应用微孔板银染的生物条形码检测方法具有超高的灵敏度与准确性。
2.5 优化微孔板内的杂交体系
2.5.1 包被浓度优化结果
链霉亲和素包被浓度优化结果如图7 所示。
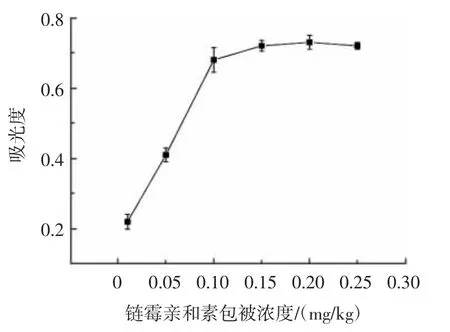
图7 链霉亲和素包被浓度的优化Fig.7 Optimization of streptavidin coating concentration
包被链霉亲和素作为建立杂交体系的基础,其浓度的选择至关重要。由图7 所知,包被浓度达到0.10 mg/kg后,吸光度值变化趋近于平缓,为保证杂交体系的建立,链霉亲和素的最佳包被浓度为0.15 mg/kg。
2.5.2 检测探针浓度优化结果
检测探针浓度的优化结果如图8 所示。
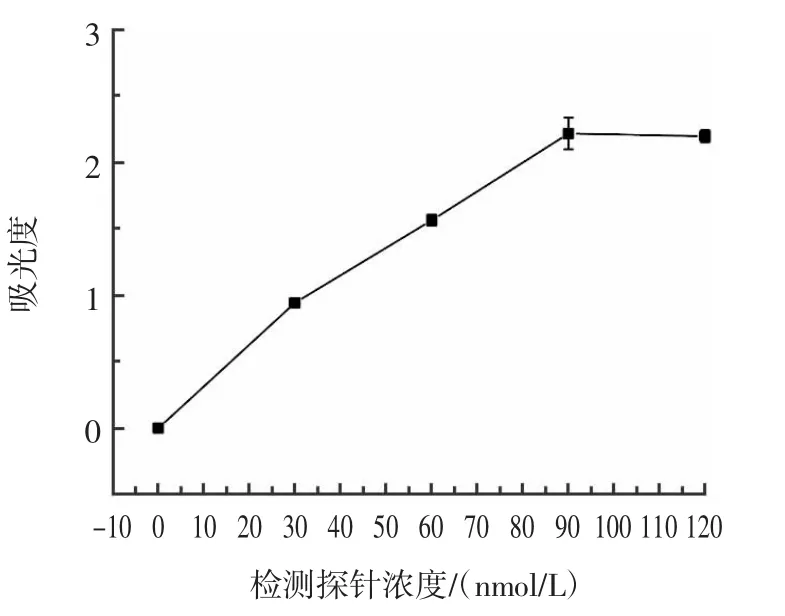
图8 检测探针浓度的优化Fig.8 Optimization of detection probe concentration
由图8 可知,当检测探针浓度达到90 nmol/L 后,吸光度值后续变化幅度变小,为优化药品用量,检测探针的浓度确定为90 nmol/L。
2.5.3 生物素探针浓度优化结果
生物素探针浓度优化结果如图9 所示。
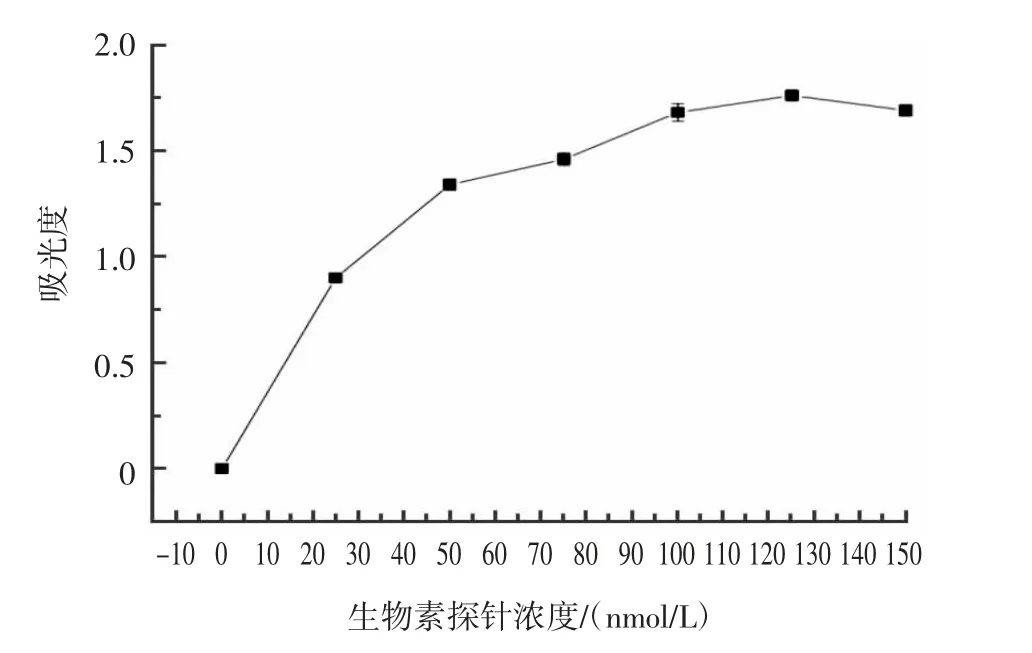
图9 生物素探针浓度的优化Fig.9 Optimization of biotin probe concentration
生物素探针作为构成三明治结构的一部分,其浓度的确定尤为重要。由图9 可知,当生物素探针浓度达到125 nmol/L 后,吸光度值变化缓慢,为优化生物素探针浓度,因此生物素探针最适浓度确定为125 nmol/L。
2.5.4 银染时间优化结果
银染时间优化结果如图10 所示。
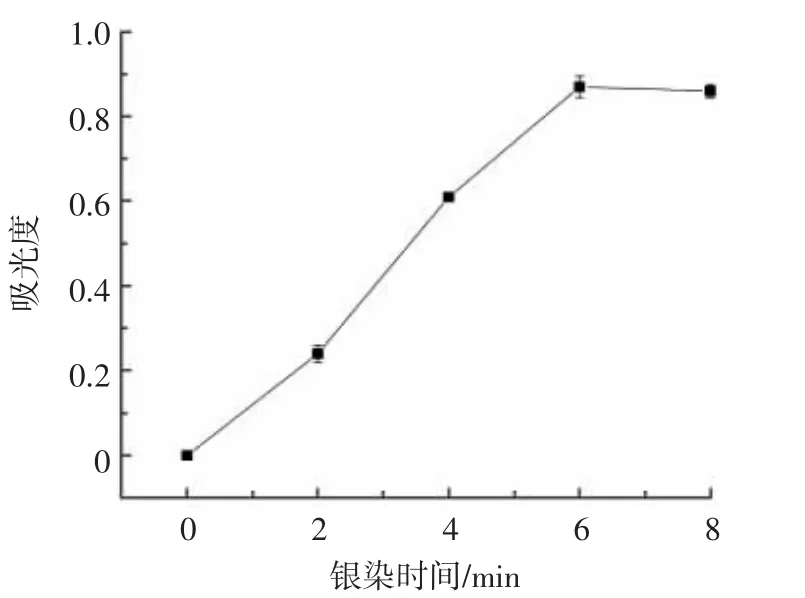
图10 银染时间的优化Fig.10 Optimization of silver dyeing time
银染反应作为测定步骤前的最后一步,反应时间的优化也是关键因素。由图10 可知,当银染时间达到6 min 后,吸光度值变化缓慢,因此最佳银染时间确定为6 min。
2.6 常见方法结果对比
环丙沙星残留的检测方法众多,每种方法各有优缺点。通过将本试验方法与其他检测方法进行对比,结果见表2。

表2 常见方法结果比对Table 2 Comparison of common methods and results
由表2 可知,本研究方法的检出限较低,并且提高了检测的准确度,适合广泛应用于检测过程中。
3 结论
生物条形码检测技术灵敏度高于酶联免疫吸附法检测的灵敏度,并且结合微孔板银染技术,能够对环丙沙星进行微量检测,该技术具有操作相对简便、灵敏度高、特异性强、并且无需大型仪器辅助等优点。
本研究所建立的基于微孔板银染的生物条形码检测技术能够实现对环丙沙星残留量快速、准确的检测,首先通过可见光光谱法、透射电镜法鉴定3 种探针制备成功,其次建立竞争免疫体系和基于生物素-亲合素系统酶标板杂交体系,通过测定其吸光度值确定检出限为2.13 ng/mL,应用该方法测得的检出限要低于酶联免疫吸附法测得的检出限。由表2 可知,该方法的建立为未来检测小分子物质残留量提供了新思路,也为制备环丙沙星生物条形码检测试剂盒奠定了基础。

