猕猴桃DCL、RDR和AGO基因家族的鉴定与分析
方远鹏,李云洲,赵志博,2,樊 荣,2,龙友华,2
(1.贵州大学 农学院,贵阳 550025;2.贵州大学 猕猴桃工程中心,贵阳 550025)
中国是猕猴桃(ActinidiaLindl.)的主产区及原产地,猕猴桃种质资源丰富,但其产量严重受各种生物病害与非生物病害影响[1-2]。自2003年首例猕猴桃病毒病报道后,迄今共鉴定出3组(即特异性及非特异性猕猴桃病毒、致病性病毒)15种猕猴桃病毒及多种可能的猕猴桃病毒[3-5]。共计23种猕猴桃病毒,根据其症状分为4类:第1类为导致叶片黄萎病、花叶病、环斑病和斑点症状的病毒。第2类病毒导致叶片乃至整株变黄和环斑。第3类仅导致轻微症状或没有症状的病毒。第4类病毒导致叶片坏死和环斑。另外,猕猴桃黄化病毒1(AcYV1) 和猕猴桃黄化病毒2(AcYV2) 侵染猕猴桃导致症状尚不明确[6]。其中,猕猴桃的多种病毒带毒率逐渐上升;例如,中国陕西省猕猴桃中柑橘叶斑驳病毒(Citrusleafmottlevirus)、猕猴桃病毒A(ActinidiavirusA)和猕猴桃病毒B(ActinidiavirusB)均有广泛地分布和较高的带毒率,并且存在较大的分子变异[7-8]。
同时,由于樱桃卷叶病毒(Cherryleafrollvirus)、天竺葵带状斑点病毒(Pelargoniumzonatespotvirus)等具备侵染范围大及交叉感染可能性高等原因。特别是近年来随着病毒病,如柑橘叶斑驳病毒在猕猴桃上不断的发现,防治猕猴桃病毒病成为保障猕猴桃安全生产的重要任务,但是因病毒危害症状与生理病害类似,且大多数病毒通过昆虫传毒[7],预防与控制难度大,因此,从猕猴桃自身免疫方面提高植株对病毒的抗性显得尤为重要[9]。RNA干扰(RNA interference,RNAi)是植物抗病毒的重要机制[10]。参与RNAi机制的蛋白主要包含3类:DCL蛋白(Dicer-like,DCL)、RNA依赖型RNA聚合酶(RNA-dependent RNA Polymerase,RDR)和 AGO(Argonaute,AGO)。首先,DCL负责将病毒衍生的双链RNA(double strand RNA,dsRNA)剪切加工成‘初级siRNA’;其后,RDR将‘初级siRNA’重新反转录重新合成dsRNA,新合成的dsRNA再次被DCL剪切加工形成更多的‘次级si RNA’;最后,AGO与siRNA形成RNA沉默复合体(RIGC),RISC通过碱基互补配对的方式剪切降解与siRNA匹配的病毒序列[10-11]。
拟南芥(Arabidopsisthaliana)DCL2与DCL4都可以作为病毒siRNA形成的关键因子,参与植物抗病毒防御[12]。拟南芥DCL3、AGO1和AGO7、RDR6也具备调控RNAi清除病毒的重要作用[13]。AGO、RDR、DCL蛋白促进甲基化的发生从而提升对多种RNA和DNA病毒(如黄瓜花叶病毒、萝卜皱缩病毒(Turnipcrincklevirus,TCV))的抗病毒防御[12-16]。拟南芥AGO2异常会导致马铃薯X病毒(PotatovirusX,PVX)易感表型的出现[14]。 AGO2和 AGO3介导脱落酸(ABA)诱导产生竹花叶病毒(Bamboomosaicvirus,BaMV)的抗病毒防御能力增强[15]。水稻(Oryzasativa)RDR6可以对水稻条斑病毒(Ricestreakvirus,RSV)感染过程产生应答反应,从而抑制RSV的危害[16]。马铃薯纺锤纤块茎类病毒(Potatospindletuberviroid,TSTV)可受寄主DCL2和DCL3的协同作用,以减轻病情[17]。番茄(Solanumlycopersicum)RDR2、RDR3a、RDR3b、RDR6、DCL2(2a、2c、2d)、DCL3、AGO1a、AGO4b的表达均受番茄黄化曲叶病毒(Tomatoyellowleafcurlvirus,TYLCV)的诱导[18]。辣椒(Capsicumannuum)AGO2、AGO10b、DCL2和DCL4受黄瓜花叶病毒(Cucumbermosaicvirus,CMV)、马铃薯病毒Y(PotatovirusY,PVY)和烟草花叶病毒(Tobaccomosaicvirus,TMV)诱导表达上调[19]。
准确鉴定猕猴桃基因组中RNAi相关蛋白家族成员是研究和利用猕猴桃抗病毒相关基因的重要前提,正确判断不同植物基因家族的变迁过程,将有助于深入理解和设计猕猴桃抗病毒育种。猕猴桃基因组国际合作组织最早在2013年完成猕猴桃(Actinidiachinensis)基因组的全基因组测序[20]。本研究通过对红阳猕猴桃(A.chinensis)RNAi途径主要蛋白家族进行鉴定并分析其基本特性,旨在为猕猴桃抗病毒研究提供理论依据。
1 材料与方法
1.1 RNAi相关蛋白家族基因的鉴定
拟南芥和番茄序列信息取至拟南芥数据库(https://www.arabidopsis.org)和茄科数据库(https://solgenomics.net/projects/varitome/)。采用拟南芥和番茄的所有DCL、RDR、AGO蛋白序列对猕猴桃基因组数据库[20]进行blastp检索,并经SMART(http://smart.embl-heidelberg.de/)[21]网站进行结构域的确认,手工合并去重。
1.2 保守性及染色体定位分析
基因结构图、保守基序和染色体定位图使用GSDS2.0(http://gsds.cbi.pku.edu.cn/)、MEME (RDR和AGO蛋白一起进行基序的搜索,参数设置为基序数量30,显著性限制为0.05;DCL蛋白单独进行基序的搜索,参数设置为基序数量5,显著性限制为0.05)和TBtools[22]软件 1.0版本进行预测或绘制。
1.3 基因基础信息的预测
使用EXPASy的Prot-Paramtool在线程序(http://web.expasy.org/cgi-bin/protparam/protparam)[23]预测蛋白等电点和分子质量;蛋白亚细胞定位利用Softberry(http://www.softberry.com/)预测。采用SignalP-5.0 (http://www.cbs.dtu.dk/services/SignalP/)及TMHMM 2.0网站(http://www.cbs.dtu.dk/services/TMHMM/)进行信号肽和跨膜结构的检查。蛋白的二级使用NPS@(https://npsa-prabi.ibcp.fr/cgi-bin/)。
1.4 系统进化树构建
采用MEGA 7.0分别对猕猴桃DCL、RDR、AGO蛋白家族和猕猴桃、拟南芥、番茄AGO、DCL、RDR蛋白序列分别进行建树分析。对齐算法采用Clustal W方法,建树时采用bootstrap= 1 000,建树方法采用Neighbor-Joining法。
2 结果与分析
2.1 基因家族的鉴定
明确基因家族的成员的分布特点有助于对其演化、功能进行初步推测。为此,笔者观察到,这些猕猴桃RNAi相关蛋白编码基因的分布情况呈现出以下特征。在第6、13和18号染色体上各分布有1个DCL基因;在第13、26和27号染色体上各分布有1个RDR基因;AGO基因在第3、9、12、13、16、17、29号染色体上各分布有1个,在第23号染色体上分布有2个,在第19号染色体上分布有4个。部分基因未定位在染色体上,包括AcAGO1e、AcAGO4a、AcAGO4d、AcRDR1c、AcAGO2c、AcAGO5a、AcDCL1a、AcRDR1a、AcRDR6a。其中AcAGO1d、AcAGO2a、AcAGO2b、AcAGO2d基因在较短区域内成簇存在。
此外,大部分的基因定位区域均为基因密度较高的区域内,只有少部分处于低基因密度的区域,例如AcAGO7、AcAGO1d、AcAGO2a、AcAGO2b、AcAGO2d等基因。同时笔者检查这些猕猴桃RNAi相关蛋白的氨基酸长度均大于550 aa,最短和最长的蛋白分子为AcAGO6和AcDCL4的575 aa和2 308 aa(表1、图1-A)。

红色、黄色、蓝色分别为AGO、DCL、RDR基因;A.猕猴桃AGO、DCL、RDR基因的染色体定位;B.猕猴桃AGO、DCL、RDR蛋白的进化树;C. 猕猴桃AGO、DCL、RDR蛋白基序;D. 猕猴桃AGO、DCL、RDR蛋白基因结构
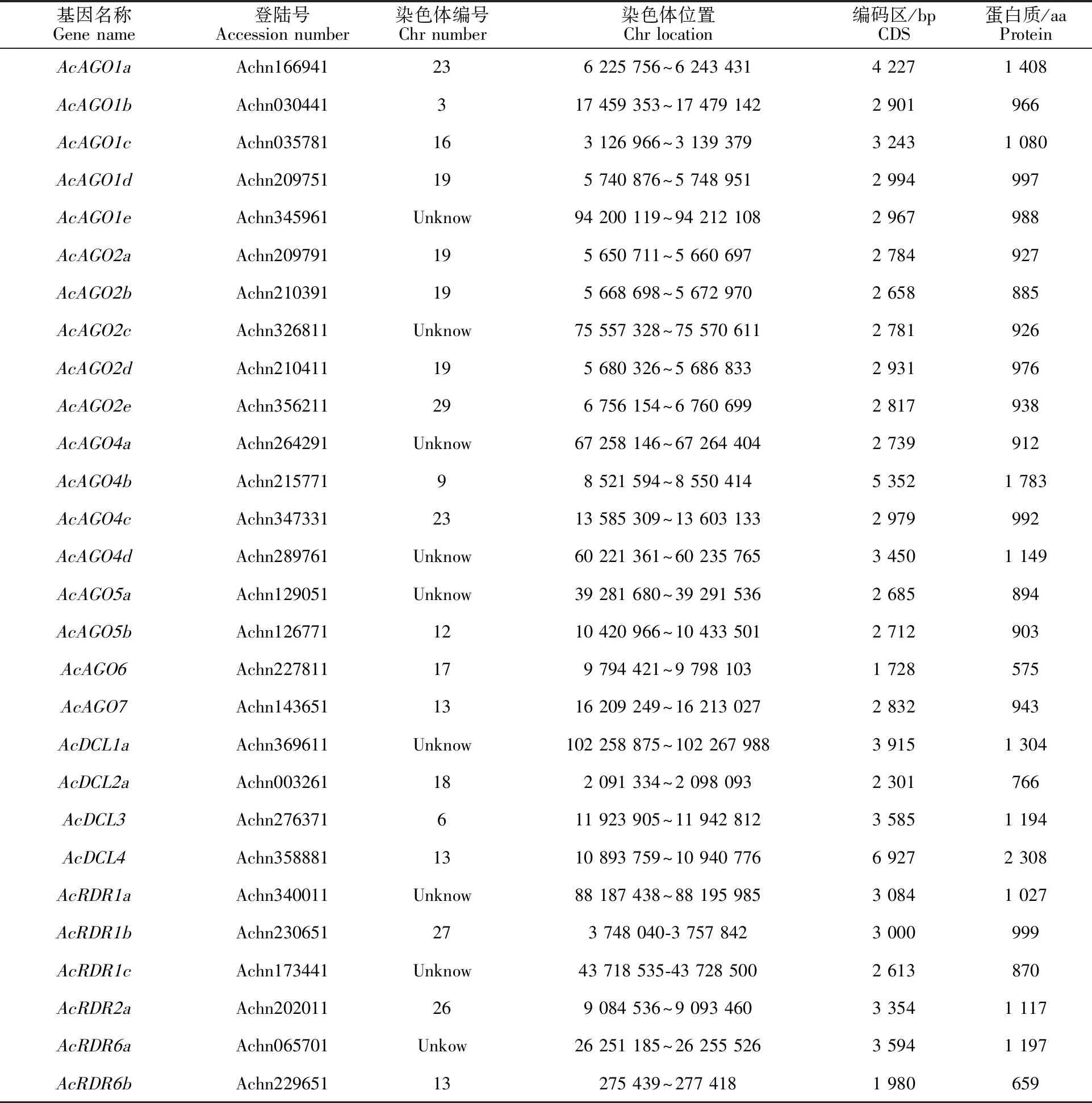
表1 猕猴桃DCL、AGO 和RDR基因的鉴定
2.2 基因结构及保守基序分析
如图1-A所示,本研究鉴定的AcDCL、AcRDR和AcAGO基因家族分布于猕猴桃不同的染色体上,但是AcAGO1e、AcAGO2c、AcAGO4a、AcAGO4d、AcAGO5a,AcDCL1a和AcRDR1a、AcRDR1c、AcRDR6a在染色体上的分布还不清楚。在保守基序方面,AcDCL间的保守性相对较差,但仍具备DCL3、4、5个保守基序,独特的是,除AcDCL2a以外均具备DCL-1基序;除AcDCL3以外均具备DCL-2基序。而在AcRDR蛋白中,均具备Motif 6、Motif17、Motif19、Motif26,这些保守基序存在于RdRP结构域中。在AcAGO蛋白中,具备丰富的保守基序,Motif1、Motif3、Motif7、Motif9、Motif11、Motif12、Motif14、Motif17、Motif18、Motif19、Motif22、Motif24为均具备的基序,其次还具备丰富的其他基序(图1-B、1-C)。在基因结构方面,猕猴桃AcRDR基因内含子数小于5,AcDCL基因均内含子数大于5,AcAGO基因大部分为内含子数大于5,而AcAGO2/7基因的内含子数小于5(图1-D)。
2.3 基于蛋白保守结构域的鉴定与进化树的构建
DCL蛋白家族可以分为明显的4类,即DCL1、DCL2、DCL3、DCL4。其中猕猴桃AcDCL蛋白与番茄DCL(SlDCL)亲缘关系最近,其次是拟南芥DCL(AtDCL);猕猴桃AcDCL与拟南芥AtDCL间均具备唯一的直系同源蛋白,但是通过图2可以确认DCL家族蛋白存在多个保守结构域(图2-A)。

橙色星形、红色三角、蓝色圆圈分别为番茄、拟南芥、猕猴桃基因;Sl.番茄,At.拟南芥,Ac.猕猴桃;拟南芥、番茄、猕猴桃DCL(A)、RDR(B)、AGO(C)蛋白的进化树与结构域分布
RDR蛋白家族表现出明显的4类,即RDR1、RDR2、RDR3/4/5、RDR6。猕猴桃AcRDR、番茄RDR(SlRDR)、拟南芥(AtRDR)间的亲缘关系与其对应的DCL亲缘关系保持一致,首先是番茄SlRDR,其次是拟南芥AtRDR。猕猴桃AcRDR具备3个RDR1蛋白、1个RDR2、2个RDR6蛋白,但是并不具备RDR3/4/5。RDR家族表现出只有RdRP保守结构域,且该结构域长度可变,但 AcRDR1c除基础的RdRP保守域外还具备一段短的RRM_1保守结构(图2-B)。
AGO蛋白家族可以分为4类,即AGO1/10、AGO2/3/7、AGO4/6/8/9/15、AGO5,但是区别并不明显。亲缘距离表现出番茄SlAGO和猕猴桃AcAGO亲缘关系最近,其次是拟南芥AtAGO。猕猴桃AcAGO蛋白包括AcAGO1、AcAGO2、AcAGO4、AcAGO5、AcAGO6、AcAGO7的同源蛋白分别为5、5、4、2、1、1个,而并未发现AcAGO3、AcAGO10、AcAGO15等的同源蛋白。所有AGO家族蛋白包含有丰富的保守结构域,包括基本保守结构域Piwi和PAZ,还包括ArgoL1、ArgoL2、ArgoMid、ArgoN和Gly-rich_Ago1等9个保守域(图2-C)。
2.4 DCL、RDR和AGO家族蛋白的理化性质 分析
2.4.1 DCL家族蛋白的理化性质分析 DCL家族蛋白亚细胞定位预测均在核内,AcDCL4是具有信号肽的跨膜蛋白,其他AcDCL蛋白均不具备跨膜结构。其蛋白理化性质体现出酸碱性氨基酸的数量相似,等电点为5.88~7.58,脂溶系数较大在88~95,除AcDCL2a、AcDCL3外均较稳定,均具亲水性,值为-0.25~0(表2)。

表2 猕猴桃DCL蛋白基础理化性质和跨膜结构
2.4.2 RDR家族蛋白的理化性质分析 RDR家族蛋白亚细胞定位均为细胞外(分泌),均不具备跨膜结构。其蛋白理化性质表现为酸碱性氨基酸的数量相似,等电点为5.89~8.62,脂溶系数较DCL家族成员小,处于78~90,除AcRDR1a、AcRDR1b外均较稳定,均具亲水性较强处于 -0.35~-0.20(表3)。

表3 猕猴桃RDR蛋白基础理化性质和跨膜结构
2.4.3 AGO家族蛋白的理化性质分析 AGO家族蛋白亚细胞定位广泛分布于核内、细胞质和细胞外(分泌),均不具备跨膜结构。其蛋白理化性质表现为碱性氨基酸数量一般大于酸性氨基酸数量,等电点为6.46~9.50,脂溶系数较DCL家族成员小,处于74.88~89.96,除AcRDR1a、AcRDR1b外均不稳定,亲水性均较强处于 -0.483~ -0.193(表4)。

表4 猕猴桃AGO蛋白基础理化性质和跨膜结构
2.5 蛋白二级结构分析
猕猴桃RNAi相关蛋白二级结构分析显示,不同蛋白类型的二级结构存在较大差异。在DCL中,4种DCL蛋白二级结构的分布差异巨大,但大体保持着38%α-螺旋、15%β-折叠、47%无规则卷曲的结构组成,其中AcDCL4相对特殊,无规则卷曲区域更大,二级结构由28%α-螺旋、20%β-折叠、52%无规则卷曲组成。在RDR中,6个RDR蛋白的二级结构也存在差异,α-螺旋区域占比为25%~34%、β-折叠区域占比为15%~21%。在AGO中,相同蛋白类的AGO蛋白二级结构分布较相似,另外AGO蛋白大体上具备α-螺旋、β-折叠、无规则卷曲区域占比分别为25%~30%、17%~23%、50%~58%(图3)。

红色、蓝色分别为β-折叠、α-螺旋区域
3 讨论与结论
在植物与病毒互作不断发展的过程中,植物逐渐形成一系列抗病毒机制,其中RNAi是最重要的抗病毒机制。RNAi机制参与调控植物多种生物及非生物胁迫、生长繁殖、细胞周期、遗传稳定等过程[24]。RNAi相关蛋白家族不同成员的功能存在差异。拟南芥中研究发现,DCL家族的DCL2和DCL4是RNAi抗病毒过程中的核心蛋白,而DCL1、DCL3与miRNA和siRNA的形成至关重要[12,25]。RDR2和RDR6是RNAi的信号放大最为相关[26-27]。不同植物的AGO成员的抗病毒活性不同,具备抗病毒活性的AGO蛋白主要分布于AGO1、 AGO2、AGO3、 AGO4、AGO5、AGO7、AGO10、AGO18[17,28-29]。而猕猴桃是我国重要的经济果树,随着猕猴桃病毒不断报道,鉴定和研究猕猴桃抗病毒相关基因DCL、RDR和AGO基因家族显得尤为重要,本研究鉴定了红阳猕猴桃基因组上29个RNAi相关蛋白同源基因家族AcDCL、AcRDR和AcAGO,通过同源序列分析其中具潜在抗病毒活性的同源基因有23个,分别是4个DCL基因(DCL1a、DCL2a、DCL3、DCL4)、3个RDR基因(RDR2、RDR6a、RDDR6b)、16个AGO基因(AGO1a-e、AGO2a-e、AGO4a-d、AGO7)。
在黄瓜(Cucumissativus)、水稻、番茄、拟南芥、棉花(Gossypiumhirsutum、G.raimondii、G.arboreum)、茄属(Solanumtuberosum、S.commersonii、S.lycopersicum、S.pennellii)、欧洲油菜(Brassicanapus)等物种中,DCL基因均分为DCL1、DCL2、DCL3、DCL44类,同一类数量一般在1~3个[17-18,30-32]。猕猴桃DCL基因同样具备以上特征,存在4类DCL基因,各类分别有1个与拟南芥保持一致。DCL蛋白酶通过氨基末端的解旋酶的PAZ结构域与ds RNA结合,DCL酶其一般具备DEAD盒、RNA解旋酶结构域、DUF283、ds RBD、RNaseⅢ和PAZ六种结构域,其中具有内切酶作用的催化域有两个[12],但不同的物种蛋白存在结构域丢失的可能。本研究中,猕猴桃结构域大多不具备完整的6个结构域,但均具备PAZ、Ribonuclease_3和Ribonucleas_3_3结构域,表明这4个DCL蛋白均具备与ds RNA结合和具备内切酶活性。
RDR酶主要存在一个RdRP结构域,可放大抗病毒信号从而促进抗病毒作用[15,20]。在拟南芥中发现6个RDR基因,随后黄瓜、水稻、茄属、欧洲油菜等物种中显示RDR基因主要保留RDR1、RDR2、RDR3、RDR6四类,而RDR4/5大多缺失。而猕猴桃RDR基因包含RDR1、RDR2、RDR6三类共6个,这同大部分物种相似,呈现与番茄相似的同源性[17-18,30,32],但其丢失AtRDR3/4/5的同源基因。
AGO与siRNA结合形成RNA沉默复合体(RISC)靶向降解病毒序列[20]。AGO基因家族是一个典型的多拷贝家族,直系同源和旁系同源关系复杂。AGO基因主要包括AGO1、AGO2、AGO2、AGO3、AGO4、AGO5、AGO6、AGO7、AGO8、AGO9、AGO10、AGO15,在不同的物种内AGO基因的保留和扩张也有所差异。猕猴桃具备AGO基因18个,较大部分物种更多,但与玉米、水稻相似[33-34]。同时其在AGO1、AGO2、AGO4上大量形成同源蛋白,但缺乏AGO3、AGO10、AGO15等的同源蛋白,这种情况在多种物种中也有出现,但丢失的同源蛋白不同[17-18,34]。 同时猕猴桃AGO基因在AGO1、AGO2、AGO4中大量拷贝,而 AGO1、AGO2蛋白是植物已知的核心抗病毒组分[35],在某些物种中AGO4、AGO7也被发现抗病毒活性,这些基因的大量扩张可能是猕猴桃在受病毒大量危害后产生的独特进化[28,35]。
自从2013年红阳猕猴桃基因组测序宣告完成[18],对猕猴桃病害防控研究走向分子生物学时代。为辨明猕猴桃基因组中丰富的抗病毒相关基因资源,本研究鉴定了红阳猕猴桃RNAi途径相关基因家族(DCL、RDR、AGO)并通过生物信息学进行分析。这些基础研究对于后续抗病品种选育以及转基因获得高抗品种、抗病种质资源的筛选、病毒的预测与综合防控有着重大意义,同时为基因编辑技术改良猕猴桃品种特性提供重要参考。关于猕猴桃RNAi相关蛋白的逆境表达特征、组分功能协调、进化途经等均有待进一步研究。

