StvacINV1负调控马铃薯的耐旱性
巩慧玲 林红霞 任小丽 李 彤 王晨霞 白江平
负调控马铃薯的耐旱性
巩慧玲1,*林红霞1任小丽1李 彤1王晨霞1白江平2,3
1兰州理工大学生命科学与工程学院, 甘肃兰州 730050;2甘肃省干旱生境作物学重点实验室 / 甘肃省作物遗传改良与种质创新重点实验室, 甘肃兰州 730070;3甘肃农业大学农学院, 甘肃兰州 730070
植物液泡酸性转化酶不可逆的催化蔗糖转化为葡萄糖和果糖, 在植物的生长和发育及其逆境适应中扮演重要的角色。马铃薯液泡转化酶基因参与调控薯块的糖化, 但其是否参与对干旱胁迫的调控尚不清楚。本研究以马铃薯品种‘Atlantic’和‘Russet Burbank’的RNA干扰表达的转基因株系及其野生型为材料, 采用停止浇水进行自然干旱处理, 研究对马铃薯植株耐旱性的调控机制。结果表明干旱胁迫引起马铃薯叶片的表达量及其液泡酸性转化酶活性显著降低; 与野生型相比, 干旱胁迫下干扰效率高的转基因株系植株不易失水萎蔫、离体叶片的失水率低, MDA含量低且叶片的相对水分含量高, 由此表明干扰效率高的转基因株系的耐旱性高于野生型, 即负调控马铃薯的耐旱性; 进一步的分析表明, 干旱胁迫下干扰效率高的转基因株系的气孔开度和气孔导度显著低于野生型, 水分利用率显著高于野生型, 因此推测可能通过介导气孔的关闭来调节马铃薯植株的耐旱性; 干旱胁迫下干扰株系的蔗糖含量显著高于野生型, 且外源高浓度蔗糖处理可诱导气孔的关闭,因此推测可能通过其底物蔗糖参与调控气孔的关闭;外源ABA诱导的气孔关闭过程中,干扰株系比野生型更敏感。综上所述, 干旱胁迫下通过介导气孔的关闭负调控马铃薯植株的耐旱性,可能通过其所催化的底物蔗糖参与调控气孔的关闭,也参与ABA介导的气孔关闭。本研究为选育既耐糖化(块茎)又耐干旱的马铃薯品种提供理论依据。
马铃薯; 液泡酸性转化酶; 耐旱性; 气孔关闭
植物转化酶(invertase, INV, EC 3.2.1.26)是蔗糖代谢的关键酶, 可以水解二糖中的β-呋喃果糖苷键即不可逆的催化蔗糖分解为葡萄糖和果糖。根据转化酶的最适pH、溶解性和亚细胞定位等差异, 将转化酶分为酸性转化酶和中性/碱性转化酶2类, 其中酸性转化酶可分为液泡酸性转化酶(vacuolar invertase, VIN)和细胞壁酸性转化酶(cell wall invertase, CWIN), 而中性/碱性转化酶一般存在于细胞质、线粒体或质体中[1]。不同转化酶基因的表达具有组织器官和发育时期的特异性, 还受低氧、糖、激素、生物和非生物胁迫等多种信号的转录水平的表达调控[2], 此外, 酸性转化酶活性还受内源蛋白抑制因子(proteinaceous inhibitor, INH)的翻译后水平的调控[3]。植物液泡酸性转化酶在催化蔗糖代谢的同时也参与了生长发育的调控, 例如影响拟南芥植株的碳代谢[4]和根的延长[5], 参与棉花纤维的延长和种子发育的调控以及棉花的花器官建成以及雌蕊和雄蕊的育性[5-6], 参与番茄果实成熟[7]。此外, 研究发现,玉米受干旱胁迫时, 子房中的液泡酸性转化酶基因的表达水平下降[8]; 与此相反, 玉米叶片在中等程度的水分胁迫下会出现早期VIN活性增强的现象,并且伴随有的表达上调和己糖的积累[9]。大多数马铃薯栽培品种的块茎在低温贮藏下VIN基因的表达量及其酶活性均显著增加[10]。
马铃薯(L.)是仅次于水稻、小麦和玉米的世界第四大粮食作物, 属典型的温带气候作物, 其对水分的亏缺十分敏感, 水分短缺严重影响马铃薯的产量和品质[11-13]。马铃薯加工产品中油炸食品是最主要的部分, 大约占马铃薯加工产业的70%以上[14]。马铃薯炸片炸条等油炸食品的色泽与块茎还原糖(葡萄糖和果糖)含量密切相关, 高温油炸过程中, 还原糖与游离氨基酸发生非酶促褐变反应, 即“美拉德反应”, 造成高糖组织的褐化, 并伴随产生潜在致癌物质丙烯酰胺[15-17]。因此, 控制马铃薯块茎的还原糖含量是保证马铃薯炸片炸条的品质的重要途径。马铃薯块茎还原糖的异常积累一般受生长条件、贮藏条件和遗传因素等的影响[18]。马铃薯块茎在低温贮藏期间, 大多数栽培品种会发生还原糖积累即低温糖化[10,15-17]; 马铃薯块茎膨大期的短期水分亏缺导致薯块的茎端还原糖含量增加即块茎末端糖化[19], 中度干旱和高温共同胁迫导致块茎末端糖化[20]; 块茎在长期贮藏期间也会发生还原糖及其他可溶性糖的积累即衰老糖化[21]; 以上这些低温糖化、末端糖化和衰老糖化均会引起块茎油炸产品的褐化和品质降低。研究发现, 通过RNA干扰技术下调马铃薯VIN基因的表达而降低液泡酸性转化酶活性, 转基因马铃薯块茎表现为耐受低温糖化[15,22], 同时, 块茎末端糖化程度降低[23]且衰老糖化现象也被延迟[24]。由此表明,是调控马铃薯块茎糖化现象的关键基因。此外, 将马铃薯的酸性转化酶抑制蛋白基因或烟草酸性转化酶的抑制蛋白基因在马铃薯中超表达, 转基因马铃薯块茎酸性转化酶的活性降低, 低温糖化现象受到显著抑制, 炸片褐化现象显著低于野生型[16,25-26]; 而将烟草酸性转化酶的抑制蛋白基因在拟南芥液泡中超表达, 导致液泡酸性转化酶活性降低, 同时发现转基因拟南芥植株的叶片气孔开度降低, 耐旱性增强[27]。同时, Yang等[28]也发现, 甘薯转化酶的抑制蛋白基因被超表达后, 转基因甘薯植株耐旱性显著提高, 而被下调表达后, 转基因甘薯耐旱性降低。由此表明, 植物酸性转化酶活性可能与植株的耐旱性相关。因此, 我们推测除了参与调控马铃薯块茎的低温糖化、末端糖化和衰老糖化外, 可能也参与调控马铃薯植株的耐旱性。马铃薯品种‘Atlantic’的块茎呈卵圆形, 生产中被用于加工薯片, 而品种‘Russet Burbank’的块茎呈长圆型, 生产上被用于加工薯条。为了探究在马铃薯植株的耐旱性中的功能, 本研究以下调表达的转基因马铃薯品种‘Atlantic’和‘Russet Burbank’为材料, 首先对其进行耐旱性评价, 然后探讨调控马铃薯耐旱性的机制, 从而为培育既耐糖化又耐干旱的马铃薯品种的选育提供理论依据。
1 材料与方法
1.1 供试材料与培养
试验材料: 马铃薯四倍体栽培品种‘Atlantic’及其RNA干扰株系、和, 以及栽培品种‘Russet Burbank’及其RNA干扰株系、和, 均由美国密歇根州立大学Jiming Jiang教授实验室提供。
培养条件: 马铃薯组培苗在MS培养基中进行继代增殖培养, 培养条件为光周期16 h d–1、光照强度50mmol m–2s–1、温度23℃±2℃; 待组培苗生长4周后, 移栽至装有蛭石的花盆中, 置于温室中培养, 2~4 d浇一次水, 10 d浇一次Hoagland营养液, 生长50 d后供试验使用。
1.2 材料处理
1.2.1 干旱胁迫处理 马铃薯组培苗移栽至温室生长50 d后, 停止浇水开始干旱胁迫处理, 对照组正常浇水, 观察植株表型变化并照相记录, ‘Atlantic’干旱胁迫7 d后, ‘Russet Burbank’干旱胁迫10 d, 在光照开始4 h后取倒3~5叶片, 直接测定生理生化指标, 或液氮中速冻后保存在–80℃冰箱中备用。
1.2.2 外源蔗糖处理 将生长3周的马铃薯试管苗转至黑暗条件下进行暗饥饿处理(旨在除去保卫细胞中存在的储藏状态的糖类) 40 h, 剪取暗处理后的叶片, 在光照条件下于MES-KCl缓冲液漂浮处理2 h使气孔充分打开, 然后将叶片转移至0.1、1、10、100 mmol L–1的蔗糖溶液中, 经过2 h的孵化后测定气孔开度[29]。
1.2.3 外源ABA处理 剪取马铃薯移栽苗的倒3~5叶片, 置于盛有MES-KCl缓冲液的培养皿中, 25℃光照2 h使气孔充分打开, 然后将叶片转移至10 μmol L–1ABA中, 分别在0.5、1和2 h后撕下叶片下表皮并制片, 测量气孔开度[29]。
1.3 测定指标与方法
1.3.1 离体叶片脱水率的测定 剪取温室中生长50 d的马铃薯移栽苗叶片, 立即称重并记录, 之后放置于温度为25℃、湿度为60%~70%的植物培养室中使其失水, 每隔1 h称重一次, 共统计5 h, 重复3次。以叶片离体时的重量为初始值, 计算叶片失水率[30]。
1.3.2 叶片相对含水量 参考田伟丽等[31]的方法, 叶片相对含水量(%)=(Wf– Wd)/(Wt– Wd)´100, 式中, Wf: 叶片鲜重(g); Wd: 叶片干重(g); Wt: 叶片饱水重(g)。
1.3.3 丙二醛含量的测定 参考李合生[32]的方法即硫代巴比妥酸试剂测定丙二醛含量。
1.3.4 气孔开度的测定 取经干旱、蔗糖和ABA处理的马铃薯叶片, 用透明胶带轻轻撕下叶片下表皮并制片, 在光学显微镜下用ImageJ图像处理软件测量气孔的内纵径和内横径。测量时, 在10×30倍下, 随机选取7~8个视野, 每个视野随机选3~4个气孔, 重复3次。气孔开度以气孔的内纵横径之比表示, 即横径/纵径[29]。
1.3.5 气孔导度和水分利用率的测定 待马铃薯盆栽苗生长50 d, 选择从顶叶往下数的第3~5片叶, 测定气孔导度和水分利用率。使用便携式光合仪在CO2浓度为400 μL L–1和光合有效辐射(PAR)为1000 μmol m–2s–1的光照下测定, 测定时间为09:00—11:00, 每个处理测定8片叶[31]。
1.3.6 蔗糖含量的测定 参考肖世远[33]的方法即间苯二酚试剂测定蔗糖的含量。
1.3.7 液泡酸性转化酶活性的测定 称取0.5 g叶片组织, 在2 mL抽提缓冲液(30 mmol L–1MOPS, 250 mmol L–1Sorbitol, 10 mmol L–1MgCl2, 10 mmol L–1KCl, 1 mmol L–1PMSF)中研磨成匀浆(4℃下操作), 在4℃、6000´离心10 min。吸取全部上清液, 然后取50 μL上清加入到600 μL反应缓冲液(30 mmol L–1NaAc (pH 4.7), 30 mmol L–1蔗糖)中37℃下反应1 h, 再加入1000 μL DNS溶液, 沸水浴反应5 min。冷却后在波长540 nm处测定吸光值[25]。
1.3.8 基因表达量的测定 采用TRIzol试剂盒(TaKaRa公司)进行RNA提取, 反转录为cDNA, 稀释后用TB GreenPremix ExII (TliRNAaseH Plus)(TaKaRa公司)试剂盒在荧光定量PCR仪(Bio-Rad, 美国)上进行qPCR。qPCR体系20 μL, 包含TB Green PreMix ExII 10 μL、上下游引物各0.8 μL、cDNA 4 μL、dd H2O 4.4 μL。反应程序: 95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 40个循环。以作为内参基因, 基因表达量用2–ΔΔCt计算[23]。qPCR引物序列见表1, 由生工生物工程(上海)股份有限公司合成。

表1 试验所用的引物序列
1.4 数据处理与统计分析
利用Microsoft Excel 2016软件进行数据处理和作图; 采用SPSS19.0统计软件对数据进行单因素方差分析, 运用Duncan’s检验法对显著性差异(<0.05)进行多重比较, 所有数据用平均值±标准误(mean±SE)表示。
2 结果与分析
2.1 马铃薯StvacINV1干扰株系的鉴定
对本研究中所使用的马铃薯干扰株系的表达水平和VIN活性进行检测, 如图1所示, 正常生长条件下, 品种‘Atlantic’的3个干扰株系、和的mRNA表达量分别较WT下调13.6%%、45.7%和52.6%, 而其VIN活性较野生型(WT)分别下调9.2%、22.4%和23.1%, 3个干扰株系的表达量和VIN活性均与野生型差异显著; 品种‘Russet Burbank’的3个干扰株系、和的mRNA表达量分别较WT下调5.2%%、34.2%和61.0%, 而其VIN活性较WT分别下调10.5%、34.4%和42.3% (图1)。说明马铃薯品种‘Atlantic’的、株系和品种‘Russet Burbank’、株系是干扰率较高的株系, 而品种‘Atlantic’的株系和品种‘Russet Burbank’株系的是干扰率较低的株系; 马铃薯下调表达降低了VIN的活性, 2个品种的各干扰株系的VIN的活性与其野生型均差异显著。
2.2 干旱胁迫抑制马铃薯StvacINV1的表达水平和VIN活性
干旱胁迫后, 品种‘Atlantic’ WT和干扰株系的mRNA表达量和酶活性均明显下降, 其中WT和干扰株系、、的mRNA表达量比胁迫前分别降低73.2%、76.2%、79.5%和52.6%; 各干扰株系的mRNA和VIN活性显著低于野生型, 其中、、株系的mRNA表达量比野生型低23.1%、58.4%和69.3%, 而VIN活性比野生型低10.5%、34.4%、43.3%。对于品种‘Russet Burbank’, 干旱胁迫导致WT和各干扰株系的mRNA表达量和VIN活性均显著下降, 且干扰株系的mRNA和VIN活性显著低于野生型, 这与品种‘Atlantic’对干旱胁迫的响应相似, 即干旱胁迫引起mRNA表达量及其VIN活性下降, 且干旱胁迫下2个品种的干扰株系的mRNA和VIN活性均显著低于其野生型(图1)。

图1 野生型和StvacINV1干扰株系干旱处理前后StvacINV1表达量(A)和液泡酸性转化酶活性(B)
*:< 0.05.
2.3 StvacINV1下调表达增强了马铃薯植株的耐旱性
为了解下调表达后对马铃薯耐旱能力的影响, 马铃薯2个品种‘Atlantic’和‘Russet Burbank’的野生型及其干扰株系在干旱胁迫前后的生理生化指标如植株形态、离体叶片失水率、相对含水量和MDA含量被测定和分析。正常浇水条件下, 马铃薯品种‘Atlantic’和‘Russet Burbank’的野生型及其各干扰株系的生长状态无明显差异。对于品种‘Atlantic’, 停止浇水进行自然干旱处理7 d后, 叶片开始失绿变黄, 野生型叶片的失绿变黄现象最为明显; 经干旱处理9 d后, 野生型和株系植株均出现明显的倒伏、叶片失水萎蔫和卷曲, 而和株系叶片仅表现极轻微的萎蔫现象。对于品种‘Russet Burbank’, 在干旱处理10 d时, 叶片开始失绿变黄, 野生型和株系的叶片失绿变黄现象最明显, 在干旱处理14 d时, 野生型、和株系的植株叶片失水萎蔫和卷曲现象较明显, 而株系仅表现轻微的萎蔫(图2-A)。干旱胁迫后, ‘Atlantic’的3个干扰株系的相对水分含量显著高于野生型, 且干扰率较高的2个株系和的丙二醛含量显著低于野生型; ‘Russet Burbank’的干扰率较高的2个株系和的相对水分含量显著高于其野生型, 且其丙二醛含量也显著低于野生型(图2-B, C)。品种‘Atlantic’和‘Russet Burbank’各干扰株系离体叶片的失水率均低于其野生型, 即各干扰株系的离体叶片失水速率减缓。综上, 通过比较2个马铃薯品种的野生型及其干扰株系在干旱胁迫前后的植株形态、离体叶片失水率、相对含水量和MDA含量, 均发现干旱胁迫后干扰率较高的干扰株系, 受干旱胁迫的伤害程度较低, 即耐旱性高于其野生型(图2-D, E)。表明参与对马铃薯耐旱性的负调控。
2.4 StvacINV1下调表达降低干旱胁迫下气孔开度, 提高水分利用率
气孔调节是控制植物水分系统的一种主要机制, 当植物突然遭受干旱时, 最重要的快速响应是气孔关闭[34]。为了探讨下调表达后马铃薯植株耐旱性提高的原因, 气孔开度、气孔导度和水分利用率等气孔相关的参数被检测。干旱胁迫引起2个品种‘Atlantic’和‘Russet Burbank’的野生型及其各干扰株系的叶片气孔开度和气孔导度降低, 且干扰率较高的株系、、和的叶片气孔开度和气孔导度均显著低于其相应的野生型(图3-A, B)。干旱胁迫后, ‘Atlantic’和‘Russet Burbank’两品种的野生型及其各干扰株系的水分利用率显著上升, 且干扰率较高的株系、和的叶片水分利用率均显著高于其野生型(图3-C)。综上, 在干旱胁迫下,干扰率较高的转基因株系, 气孔开度和气孔导度显著低于其野生型, 且水分利用率显著高于其野生型。说明可能介导气孔的运动, 影响水分利用率, 从而调控植株的耐旱性。
2.5 StvacINV1的下调表达增加干旱胁迫下蔗糖含量, 高浓度蔗糖诱导气孔关闭
为了探讨马铃薯干扰株系在干旱胁迫后气孔开度显著低于野生型的原因, 测定了所催化的底物即蔗糖的含量, 并用外源蔗糖处理检测其对气孔开度的影响。干旱处理后品种‘Atlantic’和‘Russet Burbank’的野生型及其各干扰株系的蔗糖含量明显上升, 且干扰株系的蔗糖含量均显著高于其相应的野生型(图4)。不同浓度的外源蔗糖处理对马铃薯叶片气孔开度的影响不同, 低浓度的蔗糖处理(0.1 mmol L–1, 1 mmol L–1)并不影响气孔开度, 而高浓度蔗糖处理(10 mmol L–1, 100 mmol L–1)显著降低了气孔开度, 且100 mmol L–1蔗糖处理下的气孔开度小于10 mmol L–1蔗糖处理(图5)。因此, 我们推测, 干旱胁迫下StvacINV1下调表达引起其所催化的底物蔗糖含量增加, 而高浓度蔗糖引起气孔关闭。
2.6 StvacINV1参与ABA介导的气孔关闭
为了探讨是否参与ABA诱导的气孔关闭, 用外源10 μmol L–1ABA处理品种‘Atlantic’野生型和干扰株系、的离体叶片, 检测气孔开度的变化。由图6可知, 随着ABA处理时间的延长, 气孔开度逐渐降低, 且干扰株系和的气孔开度显著小于野生型, 即干扰株系对ABA处理更敏感。说明参与ABA介导的气孔关闭。
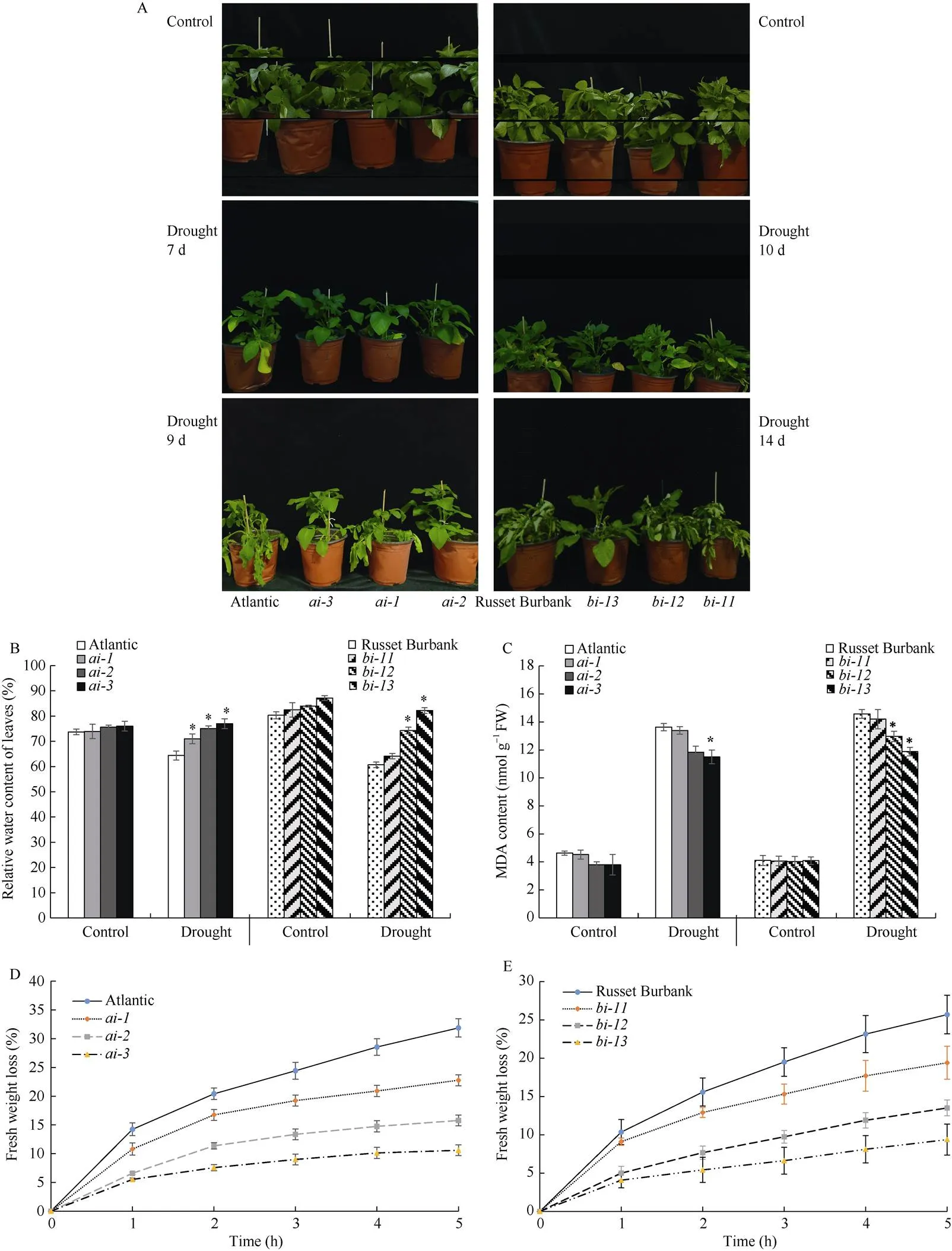
图2 野生型和StvacINV1干扰株系干旱处理前后的植株形态(A)、叶片相对水分含量(B)、丙二醛含量(C)和失水率(D和E)
*:<0.05.
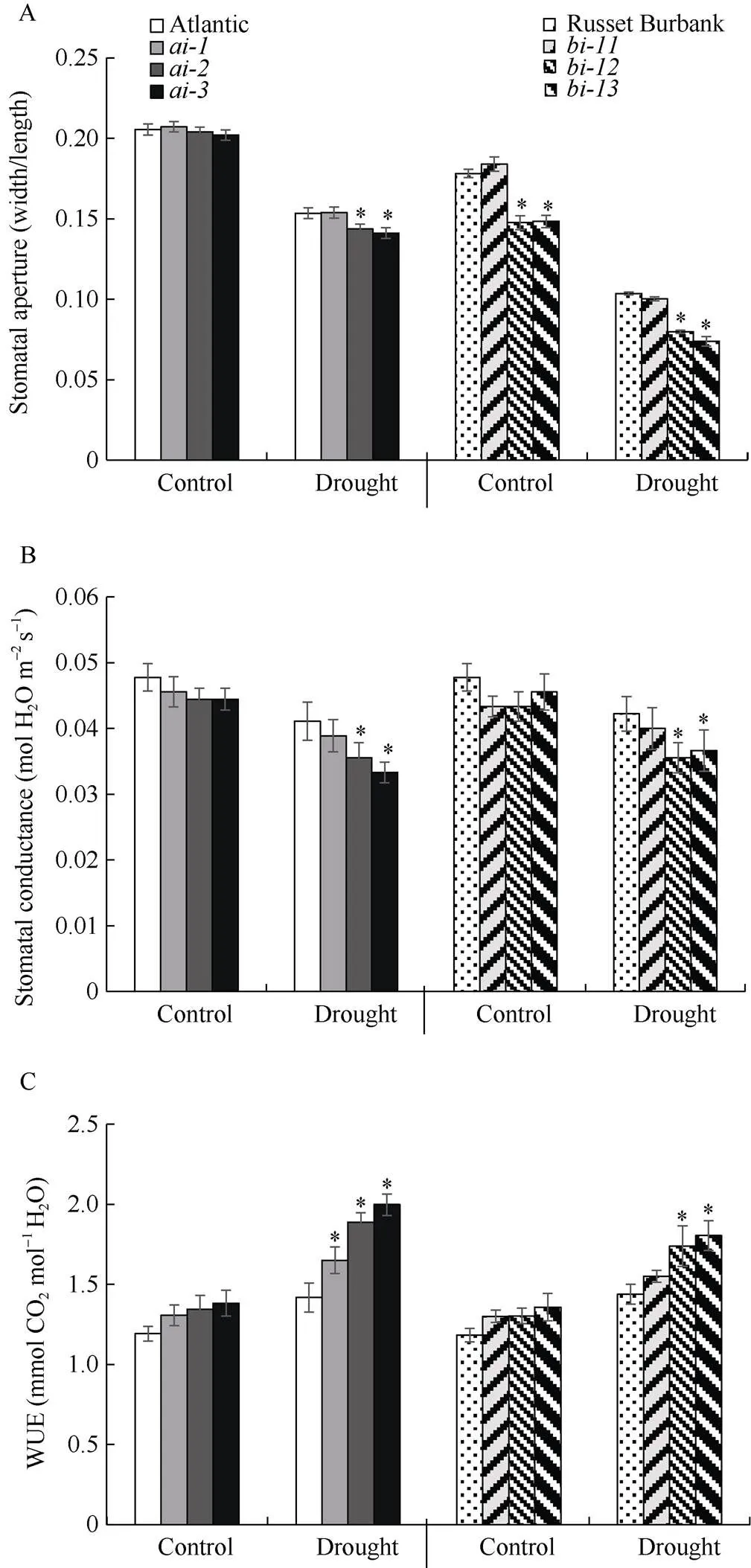
图3 野生型和StvacINV1干扰株系干旱处理前后的气孔开度(A)、气孔导度(B)和水分利用率(C)
*:< 0.05.
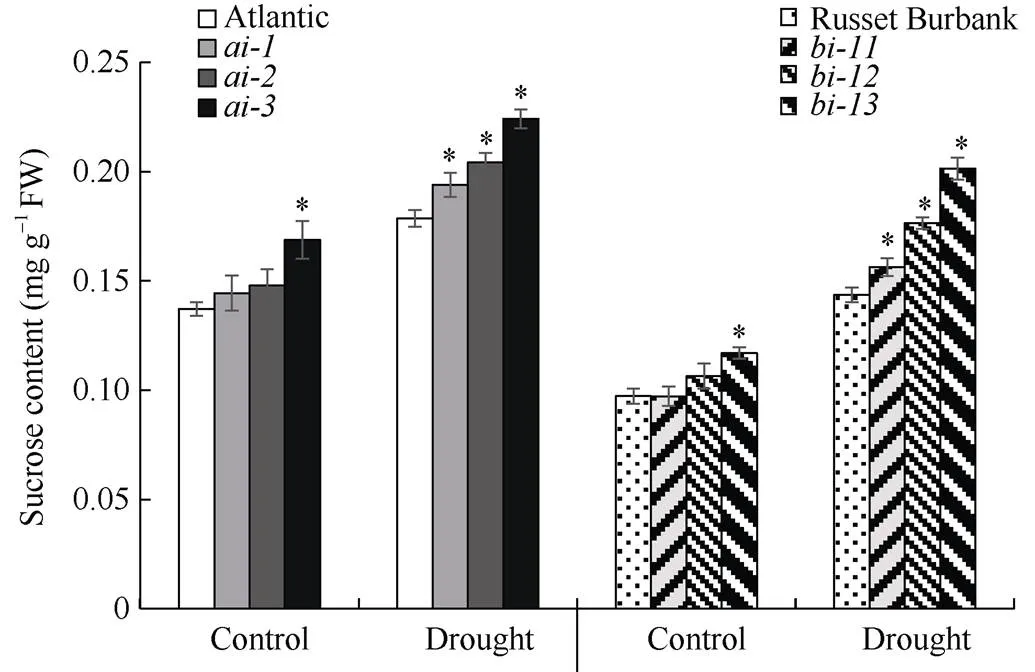
图4 野生型和StvacINV1干扰株系干旱处理前后的蔗糖含量
*:< 0.05.
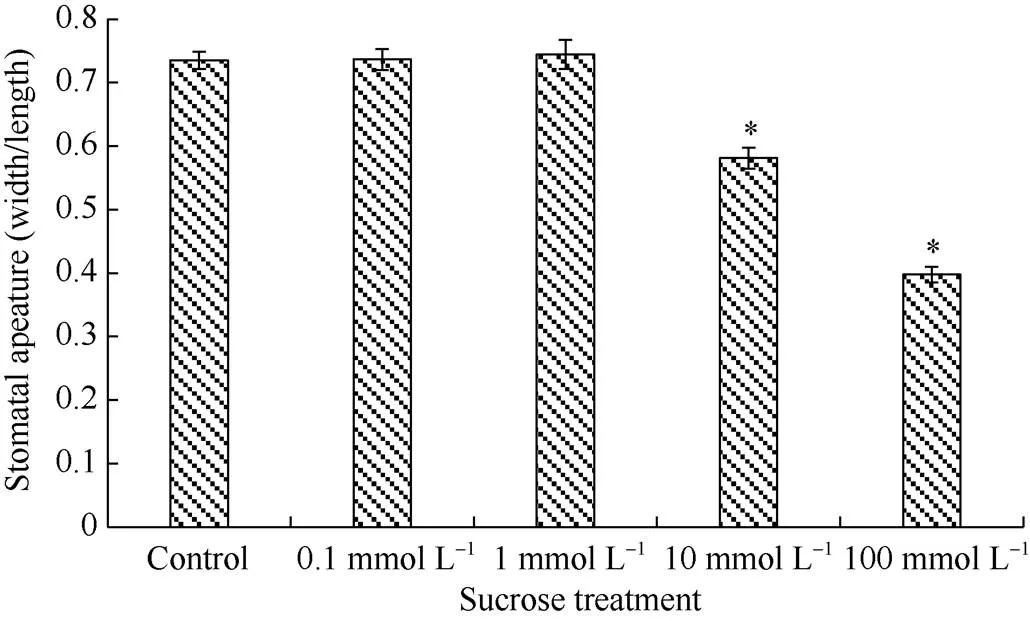
图5 蔗糖处理对马铃薯气孔开度的影响
*:< 0.05.
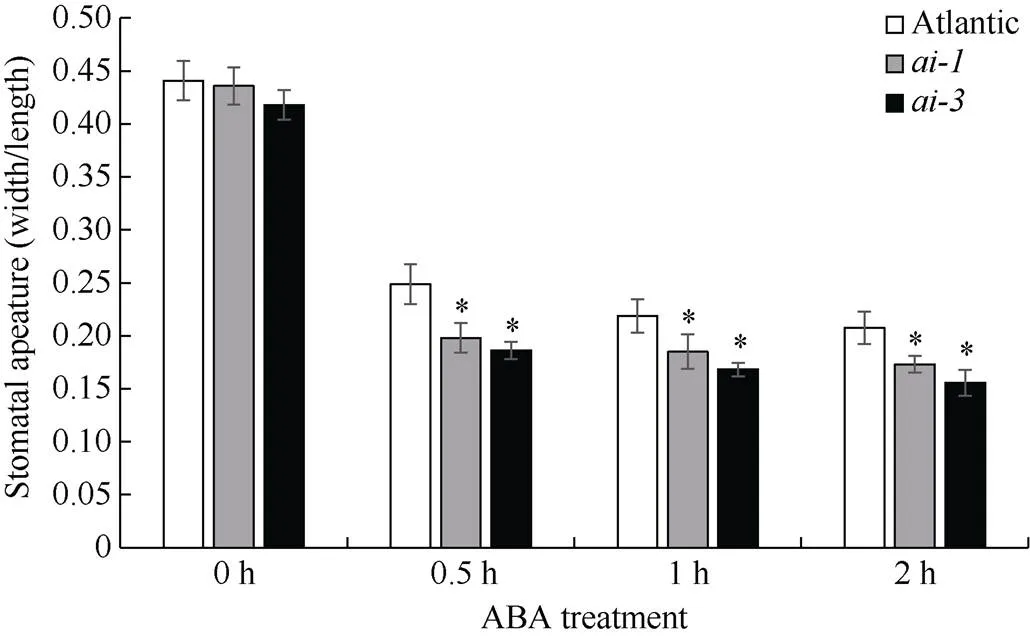
图6 ABA处理对马铃薯气孔开度的影响
*:< 0.05.
3 讨论
植物液泡酸性转化酶在植物的生长和发育及其逆境适应中发挥着重要的作用。马铃薯液泡转化酶基因下调表达的转基因株系, 在正常生长条件下其植株表型和块茎产量与野生型相比均没有显著的差异, 但其块茎的品质性状却产生了显著的改善, 如块茎低温糖化、衰老糖化和末端糖化现象均显著降低或减缓[15,22-24]。本研究表明,下调表达的马铃薯转基因株系的耐旱性显著高于野生型, 即负调控马铃薯的耐旱性。因此,可作为选育既耐糖化又耐干旱的马铃薯品种的标记基因。
3.1 干旱胁迫抑制StvacINV1的表达
植物液泡酸性转化酶基因响应干旱、缺氧和低温等非生物胁迫, 也具有组织、器官特异性。Ahiakpa等[34]发现, 番茄在干旱胁迫下, 不同器官中液泡酸性转化酶基因SlvacVIN9的表达量差异显著, 根和叶片的受干旱胁迫的诱导表达, 而花和茎的表达受干旱胁迫的抑制, 而Albacete等[35]却发现, 干旱胁迫下番茄叶片液泡酸性转化酶活性下降。在马铃薯中, 液泡酸性转化酶基因在花、叶和块茎等不同组织中的表达量差异显著, 且在高温、盐和干旱胁迫下的表达量显著高于其他转化酶基因[36]。本研究中, 干旱胁迫引起马铃薯2个品种‘Atlantic’和‘Russet Burbank’的野生型及其各干扰株系叶片的mRNA表达量不同程度的下降, 其液泡酸性转化酶的活性也随之降低。液泡酸性转化酶除了受转录水平的调控外, 也受酸性转化酶抑制蛋白等翻译后水平的调控, 研究发现, 甘薯、番茄的酸性转化酶抑制蛋白基因的表达受干旱胁迫的诱导表达[28,35]。本研究发现, 干旱胁迫下, 马铃薯2个品种‘Atlantic’和‘Russet Burbank’的野生型及其干扰株系的mRNA表达量下调的幅度与液泡酸性转化酶活性降低的幅度差异很大(图1), 由此暗示, 马铃薯酸性转化酶抑制蛋白基因的表达也响应干旱胁迫, 从而调控液泡转化酶活性。
3.2 StvacINV1负调控马铃薯的耐旱性
在拟南芥和甘薯等植物中发现, 液泡酸性转化酶的活性与植物的耐旱性之间有一定关联。在拟南芥中, 将烟草酸性转化酶的抑制蛋白基因连接上基因(ABA敏感及保卫细胞特异启动子)超表达后, 液泡酸性转化酶的活性降低, 同时也发现转基因植株的耐旱性增强[27]; 此外, 在甘薯中, 超表达酸性转化酶抑制蛋白基因后, 转基因植株的耐旱性也显著提高[28]。本研究也发现与此相同的结果, 通过RNA干扰技术下调马铃薯2个品种‘Atlantic’和‘Russet Burbank’的的表达量, 液泡酸性转化酶的活性随之降低(图1), 转基因马铃薯植株的耐旱性高于野生型(图2), 由此表明, 液泡酸性转化酶基因负调控马铃薯的耐旱性。但是, 将红叶藜的细胞壁转化酶基因在番茄中超表达后, 转基因番茄的耐旱性增加, 即正调控植物的耐旱性[35]。马铃薯液泡酸性转化酶基因与红叶藜细胞壁酸性转化酶基因分别正调控和负调控植物的耐旱性, 因而, 液泡酸性转化酶基因与细胞壁酸性转化酶基因在耐旱性中的功能差异值得进一步探讨。
3.3 StvacINV1调控马铃薯耐旱性的机制
气孔调节是控制植物水分系统的一种主要机制,当植物突然遭受干旱时, 最重要的快速响应是气孔关闭[37]。Ni[38]研究发现, 拟南芥中液泡酸性转化酶的活性与气孔开度相关; Antunes等[39]发现, 将酵母酸性转化酶基因在马铃薯气孔中被特异性表达后, 转基因马铃薯的气孔导度增加, 水分利用率降低, 本研究通过下调马铃薯酸性转化酶基因的表达, 转基因马铃薯的气孔导度和水分利用率也发生变化”。在本研究中, 马铃薯品种‘Russet Burbank’的干扰率较高的2个株系、, 在正常生长条件下, 其液泡酸性转化酶较低, 气孔开度也较小, 均显著低于野生型(图3); 在干旱胁迫下, 品种‘Atlantic’和‘Russet Burbank’的干扰率较高的株系, 相较于野生型, 其液泡酸性转化酶较低, 且其气孔开度和气孔导度也较小, 而水分利用效率高(图3)。因此, 我们推测, 由于下调表达(即VIN活性降低)而引起干旱胁迫下气孔开度降低, 从而提高了马铃薯干扰株系的耐旱性。
近期的研究表明, 蔗糖在气孔运动的调节中具有双重作用, 一方面, 在光合速率较高时, 叶肉细胞产生的蔗糖被转运到保卫细胞周围, 可诱导气孔的关闭; 另一方面, 在光诱导的气孔张开过程中, 蔗糖在保卫细胞内分解来维持糖酵解和谷氨酰胺的合成[40-42]。研究表明, 外源高浓度蔗糖处理, 可诱导烟草、拟南芥气孔关闭[42-43]。在本研究中也发现, 高浓度蔗糖可诱导马铃薯的气孔关闭(图5); 同时, 本研究发现, 马铃薯干扰率较高的株系在干旱胁迫下的蔗糖含量显著高于野生性(图4), 其气孔开度也显著低于野生型(图3), 且耐旱性高于野生型(图2)。因此, 我们推测,下调表达, 导致干旱胁迫下其催化的底物蔗糖积累量增加, 从而诱导气孔关闭, 随之调控马铃薯的耐旱性。
较多研究表明, 植物酸性转化酶与ABA信号存在有一定关联性Trouverie等[9]研究表明, 玉米液泡酸性转化酶基因及其酶活受外源ABA的诱导; 在拟南芥中, ABA通过降低转化酶内源蛋白抑制子的表达而增强酸性转化酶的活性[44]; 在番茄中, 酸性转化酶活性影响ABA诱导的叶片衰老现象[45]; 马铃薯液泡转化酶基因也受ABA的诱导表达[36]。本研究发现, 在ABA介导的气孔关闭中,下调表达的转基因株系比野生型更敏感(图6), 即可能参与ABA介导的气孔关闭, 但其具体的信号转导机制, 需进一步探讨。
4 结论
马铃薯液泡转化酶基因的表达受干旱胁迫的抑制,下调表达的转基因株系的耐旱性高于野生型。调节马铃薯植株耐旱性的可能机制是: 干旱胁迫下通过介导气孔的关闭负调控马铃薯植株的耐旱性,可能通过其所催化的底物蔗糖参与调控气孔的关闭,此外,也参与ABA介导的气孔关闭。
[1] Tauzin A S, Giardina T. Sucrose and invertases, a part of the plant defense response to the biotic stresses., 2014, 5: 293.
[2] 赵杰堂. 蔗糖转化酶在高等植物生长发育及胁迫响应中的功能研究进展. 热带亚热带植物学报, 2016, 24: 352–358.Zhao J T. Advances in research on invertase in plant development and response to abiotic and biotic stresses., 2016, 24: 352–358 (in Chinese with English abstract).
[3] Hothorn M, Wolf S, Aloy P, Greiner S, Scheffzek K. Structural insights into the target specificity of plant invertase and pectin methylesterase inhibitory proteins., 2004, 16: 3437–3447.
[4] Nägele T, Henkel S, Hörmiller I, Sauter T, Sawodny O, Ederer M, Heyer A G. Mathematical modeling of the central carbohydrate metabolism inreveals a substantial regulatory influence of vacuolar invertase on whole plant carbon metabolism., 2010, 153: 260–272.
[5] Wang L, Li X R, Lian H, Ni D A, He Y K, Chen X Y, Ruan Y L. Evidence that high activity of vacuolar invertase is required for cotton fiber androot elongation through osmotic dependent and independent pathways, respectively., 2010, 154: 744–756.
[6] Wang L, Ruan Y L. Critical roles of vacuolar invertase in floral organ development and male and female fertilities are revealed through characterization of Gh-RNAi cotton plants., 2016, 171: 405–423.
[7] Qin G, Zhu Z, Wang W, Cai J, Chen Y, Li L, Tian S. A tomato vacuolar invertase inhibitor mediates sucrose metabolism and influences fruit ripening., 2016, 172: 1596–1611.
[8] McLaughlin J E, Boyer J S. Sugar-responsive gene expression, invertase activity, and senescence in aborting maize ovaries at low water potentials., 2004, 94: 675–689.
[9] Trouverie J, Chateau-Joubert S, Thévenot C, Jacquemot M P, Prioul J L. Regulation of vacuolar invertase by abscisic acid or glucose in leaves and roots from maize plantlets., 2004, 219: 894–905.
[10] Liu X, Zhang C, Ou Y B, Lin Y, Song B, Xie C H, Liu J, Li X Q. Systematic analysis of potato acid invertase genes reveals that a cold-responsive member, StvacINV1, regulates cold-induced sweetening of tubers., 2011, 286: 109–118.
[11] Yuan B Z, Nishiyama S, Kang Y H. Effects of different irrigation regimes on the growth and yield of drip-irrigated potato., 2003, 63: 153–167.
[12] 李鹏程, 毕真真, 孙超, 秦天元, 梁文君, 王一好, 许德蓉, 刘玉汇, 张俊莲, 白江平. DNA甲基化参与调控马铃薯响应干旱胁迫的关键基因挖掘. 作物学报, 2021, 47: 599–612.Li P C, Bi Z Z, Sun C, Qin T Y, Liang W J, Wang Y H, Xu D R, Liu Y H, Zhang J L, Bai J P. Key genes mining of DNA methylation involved in regulating drought stress response in potato., 2021, 47: 599–612 (in Chinese with English abstract).
[13] Gervais T, Creelman A, Li X, Bizimungu B, Koeyer D D, Dahal K. Potato response to drought stress physiological and growth basis:, 2021,12: 698060.
[14] 王郁, 程鑫, 叶夕苗, 程李香, 李高峰, 文国宏, 王玉萍, 张峰. 不同品系马铃薯块茎末端糖化差异分析. 中国粮油学报, 2020, 35(7): 22–27. Wang Y, Cheng X, Ye X M, Cheng L X, Li G F, Wen G H, Wang Y P, Zhang F. Analysis of sugar-end differences of potato tubersin different lines., 2020, 35(7): 22–27 (in Chinese with English abstract).
[15] Bhaskar P B, Wu L, Busse J S, Whitty B R, Hamernik A J, Jansky S H, Buel C R, Bethke P C, Jiang, J. Suppression of the vacuolar invertase gene prevents cold-Induced sweetening in potato., 2010, 154: 939–948.
[16] Liu X, Lin Y, Liu J, Song B, Ou Y, Zhang H, Li M, Xie C. StInvInh2 as an inhibitor of StvacINV1 regulates the cold-induced sweetening of potato tubers by specifically capping vacuolar invertase activity., 2013, 11: 640–647.
[17] Lin Y, Liu T, Liu J, Liu X, Ou Y, Zhang H, Li M, Sonnewald U, Song B, Xie C. Subtle regulation of potato acid invertase activity by a protein complex of invertase, invertase inhibitor, and SUCROSE NONFERMENTING1-RELATED protein KINASE., 2015, 168: 1807–1819.
[18] Kyriacou M C, Siomos A S, Ioannides I M, Gerasopoulos D. The chip-processing potential of four potato (L.) cultivars in response to long-term cold storage and reconditioning., 2009, 89: 758–764.
[19] Eldredge E P, Holmes Z A, Mosley A R, Shock C C, Stieber T D. Effects of transitory water stress on potato tuber stem-end reducing sugar and fry color., 1996, 73: 517–530.
[20] Wang Y, Bussan A J, Bethke P C. Stem-end defect in chipping potatoes (L.) as influenced by mild environmental stresses., 2012, 89: 392–399.
[21] Burton W G. Senescence in stored potato tubers., 1977, 85: 433–436.
[22] Wu L, Bhaskar P B, Busse J S, Zhang R, Bethke P C, Jiang J. Developing cold-chipping potato varieties by silencing the vacuolar invertase gene., 2011, 51: 981–990.
[23] Zhu X, Richael C, Chamberlain P, Busse J S, Bussan A J, Jiang J, Bethke P C. Vacuolar invertase gene silencing in potato (L.) improves processing quality by decreasing the frequency of sugar-end defects., 2014, 9: 93381.
[24] Wiberley-Bradford A E, Bethke P C. Suppression of the vacuolar invertase gene delays senescent sweetening in chipping potatoes., 2018, 98: 354–360.
[25] Greiner S, Rausch T, Sonnewald U, Herbers K. Ectopic expression of a tobacco invertase inhibitor homolog prevents cold-induced sweetening of potato tubers., 1999, 17: 708–711.
[26] McKenzie M J, Chen R K Y, Harris J C, Ashworth M J, Brummell D A. Post-translational regulation of acid invertase activity by vacuolar invertase inhibitor affects resistance to cold-induced sweetening of potato tubers., 2013, 36: 176–185.
[27] Chen S F, Liang K, Yin D M, Ni D A, Zhang Z G, Ruan Y L. Ectopic expression of a tobacco vacuolar invertase inhibitor in guard cells confers drought tolerance in., 2016, 31: 1381–1385.
[28] Yang D, Xie Y, Sun H, Bian X, Ke Q, Kim H S, Ji C Y, Jin R, Wang W, Zhang C, Ma J, Li Z, Ma D, Kwak S S. IbINH positively regulates drought stress tolerance in sweetpotato., 2020, 146: 403–410.
[29] Shang Y, Dai C, Lee M M, Kwak J M, Nam K H. BRI1-associated receptor kinase 1 regulates guard cell ABA signaling mediated by open stomata 1 in., 2016, 9: 447–460.
[30] 杜培兵, 杨文静. 马铃薯抗旱品种筛选及鉴定试验. 中国蔬菜, 2018, (9): 29–34. Du P B, Yang W J. Screening and identification test of drought resistant potato varieties., 2018, (9): 29–34 (in Chinese with English abstract).
[31] 田伟丽, 王亚路, 梅旭荣, 李玉中, 郭家选. 水分胁迫对设施马铃薯叶片脱落酸和水分利用效率的影响研究. 作物杂志, 2015, (1): 103–108. Tian W L, Wang Y L, Mei X R, Li Y Z, Guo J X. Effect of water stress on ABA content in leaf and water efficiency of facilities potato., 2015, (1): 103–108 (in Chinese with English abstract).
[32] 李合生. 植物生理生化实验原理与技术. 北京: 高等教育出版社, 2000. pp 260–261. Li H S. Principles and Techniques of Plant Physiological and Biochemical Experiments. Beijing: Higher Education Press, 2000. pp 260–261 (in Chinese).
[33] 肖世远. 间苯二酚光度法测定蔗糖的适宜条件. 四川师范学院学报(自然科学版), 1998, 19: 293–295. Xiao S Y. The suitable conditions of measuring cane sugar by using resorcinol-photometric method.(Nat Sci Edn), 1998, 19: 293–295 (in Chinese with English abstract).
[34] Ahiakpa J K, Magdy M, Karikari B, Munir S, Mumtaz M A, Tamim S A, Mahmood S, Liu G, Chen W, Wang Y, Zhang Y. Genome-wide identification and expression profiling of tomato invertase genes indicate their response to stress and phytohormones., 2022, 41: 1481–1498.
[35] Albacete A, Cantero-Navarro E, Großkinsky D K, Arias C L, Balibrea M E, Bru R, Fragner L, Ghanem M E, González MDLC, Hernández J A, Martínez-Andújar C, van der Graaff E, Weckwerth W, Zellnig G, Pérez-Alfocea F, Roitsch T. Ectopic overexpression of the cell wall invertase gene CIN1 leads to dehydration avoidance in tomato., 2015, 66: 863–878.
[36] Abbas A, Shah A N, Shah A A, Nadeem M A, Alsaleh A, Javed T, Alotaibi S S, Abdelsalam N R. Genome-wide analysis of invertase gene family, and expression profiling under abiotic stress conditions in potato., 2022, 11: 539.
[37] Egilla J N, Davies F T, Boutton T W. Drought stress influences leaf water content, photosynthesis, and water-use efficiency ofat three potassium concentrations., 2005, 43: 135–140.
[38] Ni D A. Role of vacuolar invertase in regulatingstomatal opening., 2012, 34: 2449–2452.
[39] Antunes W C, Provart N J, Williams T C R, Loureiro M E. Changes in stomatal function and water use efficiency in potato plants with altered sucrolytic activity., 2012, 35: 747–759.
[40] Medeiros D B, Souza L P, Antunes W C, Araújo W L, Daloso D M, Fernie1 A R. Sucrose breakdown within guard cells provides substrates for glycolysis and glutamine biosynthes is during light-induced stomatal opening., 2018, 94: 583–594.
[41] Lima V F, Medeiros D B, Dos Anjos L, Gago J, Fernie A R, Daloso D M. Toward multifaceted roles of sucrose in the regulation of stomatal movement., 2018, 13: 1494468.
[42] Daloso D M, Dos Anjos L, Fernie A R. Roles of sucrose in guard cell regulation., 2016, 211: 809–818.
[43] Kelly G, Moshelion M, David-Schwartz R, Halperin O, Wallach R, Attia Z, Belausov E, Granot D. Hexokinase mediates stomatal closure., 2013, 75: 977–988.
[44] Koh E J, Lee S J, Hong S W, Lee H S, Lee H. The ABA effect on the accumulation of an invertase inhibitor transcript that is driven by the CAMV35S promoter in., 2008, 26: 236–242
[45] Jin Y, Ni D A, Ruan Y L. Posttranslational elevation of cell wall invertase activity by silencing its inhibitor in tomato delays leaf senescence and increases seed weight and fruit hexose level., 2009, 21: 2072–2089.
negatively regulates drought tolerance in potato
GONG Hui-Ling1,*, LIN Hong-Xia1, REN Xiao-Li1, LI Tong1, WANG Chen-Xia1, and BAI Jiang-Ping2,3
1School of Life Sciences and Engineering, Lanzhou University of Technology, Lanzhou 730050, Gansu, China;2Gansu Provincial Key Laboratory of Aridland Crop Science / Gansu Key Laboratory of Crop Improvement and Germplasm Enhancement, Lanzhou 730070, Gansu, China;3College of Agronomy, Gansu Agricultural University, Lanzhou 730070, Gansu, China
Plant vacuolar acid invertase catalyses irreversible hydrolysis of sucrose into glucose and fructose, which plays a vital role in plant growth, development, and abiotic stress adaption. The vacuolar acid invertase genein potato (L.) are involved in regulating cold-induced sweetening in tubers, however the physiological role ofduring adaptation to drought stress conditions is not yet fully understood. To investigate the mechanism ofregulating drought toleration under natural drought stress (water was withheld), this experiment was conducted with potato cultivars ‘Atlantic’, ‘Russet Burbank’, and their-RNAi transgenic lines. The results showed that drought stress strongly reduced mRNA abundance ofand vacuolar acid invertase activity in the leaves of the wild-type plants and-RNAi transgenic lines. Compared with the wild type, the transgenic lines with high interference efficiency of-RNAi were less prone to slower wilting, lower water loss, lower MDA content, and higher relative water content in leaves under drought stress, which indicated that the transgenic strains with high interference efficiency ofhad higher drought tolerance than wild type. StvaclNV1 regulated negatively drought tolerance of potao. Further analysis showed that under drought stress, stomatal aperture and stomatal conductance in highly interfered-RNAi transgenic lines were significantly lower than wild type, whereas water use efficiency was significantly higher, which demonstratedmight regulate the drought tolerance of potato plants by stomatal movement. Sucrose content in highly interfered-RNAi transgenic lines was significantly higher than wild type under drought stress, meanwhile the exogenous high concentration sucrose treatment can induce stomatal closure, which led us to speculate thatwas involved in regulating stomatal closure through its catalytic substrate sucrose. Compared with wild type,-RNAi transgenic lines were more sensitive during ABA-induced stomatal closure. In conclusion,negatively regulated the drought tolerance by stomatal closure in potato plants, andmay be involved in regulating stomatal closure through its catalytic substrate sucrose, andwas involved in ABA-induced stomatal closure. This study provides a theoretical basis for breeding potato varieties resistant to both sweetening (tubers) and drought stress.
potato; vacuolar acid invertase; drought tolerance; stomatal closure
10.3724/SP.J.1006.2023.34015
本研究由国家自然科学基金项目(31860397, 31360296), 旱区作物逆境生物学国家重点实验室开放课题项目(CSBAAKF2018006)和甘肃省自然科学基金重点项目(22JR5RA228)资助。
This study was supported by the National Natural Science Foundation of China (31860397, 31360296), the Open Project of the State Key Laboratory of Crop Stress Biology for Arid Areas (CSBAAKF2018006), and the Key Program of Natural Science Foundation of Gansu Province (22JR5RA228).
巩慧玲, E-mail: gonghl@lut.edu.cn
2023-01-18;
2023-04-17;
2023-05-05.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20230504.1757.008.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

