基于microRNA探讨补肾养精颗粒对高龄小鼠卵母细胞质量的影响
王 昭,付凌宇,武丽丽,刘鹏飞,于 潇,刘金星
(1. 山东中医药高等专科学校,山东 烟台 264199;2. 山东中医药大学附属医院,山东 济南 250014)
目前医学界虽然未对高龄妇女年龄作出明确界定,但是根据“高龄产妇”的概念,习惯上将35岁以上称之为高龄妇女。女性在30岁之后生育力逐渐开始下降,尤其是35岁后,生育力出现断崖式下降,这与女性年龄相关的卵子数量减少和质量降低造成的卵巢储备功能减退(decreased ovarian reserve,DOR)密切相关[1]。据统计,女性在35~40岁时,不孕症发生率约为30%,随着年龄的增长,不孕症的发生率越来越高,在40~45岁时可达69%[1]。随着医学技术的发展,辅助生殖技术给不孕不育患者带来了福音,但是高龄所导致的不孕依然是辅助生殖技术的难点[2]。实验和临床研究均证实补肾类中药可以提高生殖能力[3-4]。补肾养精颗粒是山东省名中医刘金星教授在三十余年临床经验的基础上结合“四二五合方”加减化裁而成,用于月经病、不孕症等疾病的治疗效果显著[5-6]。本研究从颗粒细胞miRNA角度出发,探讨了补肾养精颗粒对高龄小鼠卵巢储备功能的影响,旨在为其临床应用提供理论基础。
1 实验材料与方法
1.1动物 C57BL/6J小鼠,雌性6~8周龄10只、10月龄30只,雄性6~8周龄10只,体重18~20 g,均购自北京唯尚立拓科技有限公司,生产许可证号:SCXK(京)2016-00009。小鼠均饲养于山东中医药高等专科学校中心实验室,室温25 ℃左右,湿度45%~55%,自由饮水和摄食。本实验操作符合动物伦理要求,由山东中医药大学附属医院动物伦理委员会审核批准(2020-40)。
1.2药物 补肾养精颗粒由熟地12 g、当归12 g、白芍12 g、川芎9 g、菟丝子18 g、枸杞子15 g、盐车前子6 g、制五味子9 g、覆盆子9 g、川牛膝15 g、醋香附12 g、炒枳壳12 g、党参12 g、炙淫羊藿12 g、盐知母12 g、益母草15 g组成,颗粒剂购自江阴天江药业。
1.3试剂及仪器 RT-PCR试剂盒购自山东思科捷生物技术有限公司(miRNA提取试剂盒,货号:AC1501;反转录试剂盒,货号:AG0502;qPCR试剂盒,货号:AH0501),JC-1试剂盒(C2006)、活性氧(ROS)检测试剂盒(货号:S0033S)购自碧云天,孕马血清(PMSG,货号:P9970)、人绒毛膜促性腺激素(HCG,货号:YZ-1817)、透明质酸酶(货号:H8030)购自索莱宝,矿物油(货号:M8410)购自Sigma。体视显微镜(Olympus,SZX7),荧光倒置显微镜(Olympus-CKX53),超净台(苏州净化,SW-CJ-2G),CO2培养箱(Thermo Forma,I250),Roche Light Cycler 480 实时定量PCR仪(Roche公司)。
1.4实验方法 10只雌性6~8周龄小鼠作为青年组;将30只10月龄小鼠随机分为高龄组、补肾养精低剂量组、补肾养精高剂量组,每组10只;雄性小鼠不予以分组仅标记编号。按照人和小鼠等效剂量换算标准,补肾养精低、高剂量组分别给予补肾养精颗粒5.5 g/kg(0.11 g/d)、11 g/kg(0.22 g/d)灌胃,青年组和高龄组给予同等体积生理盐水灌胃,均连续干预45 d。
1.5精子制备方法 提前制作小鼠精子受精液获能滴和受精滴,平衡一夜。处理雌鼠前约1 h脱颈椎处死雄鼠,腹部75%酒精消毒。剖腹取出附睾尾,在提前准备好的获能滴中于附睾尾中间处剪开,使精子充分流出,放于37 ℃、5% CO2培养箱中获能1.5 h,为受精备用。
1.6检测指标及方法
1.6.1获卵数及卵母细胞成熟率 灌胃干预第43天,各组雌性小鼠均腹腔注射PMSG 10 IU,48 h后腹腔注射HCG 10 IU。注射14~15 h后脱颈椎处死小鼠,75%酒精消毒,背部剖开取下输卵管壶腹部。在体式显微镜下用1 mL注射器划破输卵管透明膨大壶腹部,收集卵丘-卵母复合物(COCs)。用透明质酸酶脱颗粒细胞,M2反复清洗后收集卵母细胞。以第一极体排出作为卵母细胞成熟的标志[7],分别记录获卵数及成熟卵母细胞的数量,计算卵母细胞成熟率。
1.6.2体外受精率与囊胚率 将卵母细胞用平衡过夜的受精液清洗后放入提前准备好的受精滴中。用上游法优化精液[4],取3 μL获能1.5 h的上游精子加入受精滴,放至37 ℃、5% CO2培养箱培养6 h。用受精液清洗后,移至平衡2 h的KSOM液滴中反复清洗,洗掉卵子周围的精子。培养至二细胞,观察二细胞率,即受精率[8]。将受精卵培养至4.5 d,计算囊胚率。
1.6.3卵母细胞线粒体膜电位 每组取12~15个M Ⅱ期卵母细胞于20 μL M2液滴中,加入14 μL JC-1染色工作液,放入37 ℃、5% CO2培养箱孵育1 h。孵育结束后,用M2清洗卵母细胞,注意避光。送至荧光倒置显微镜下观察拍照,检测JC-1单体时使用绿色荧光,将激发光设置为490 nm,发射光设置为530 nm;检测JC-1单体聚合物时使用红色荧光,将激发光设置为525 nm,发射光设置为590 nm。用Image J软件分析目标条带的光密度值,以红色荧光与绿色荧光比值衡量卵母细胞线粒体膜电位。
1.6.4卵母细胞线粒体ROS含量 每组取12~15个M Ⅱ期卵母细胞于20 μL M2液滴中,加入1∶1 000稀释的DCFH-DA 20 μL,放入37 ℃、5% CO2培养箱孵育0.5 h。孵育结束后,M2清洗卵母细胞,注意避光。迅速送至荧光倒置显微镜下拍照观察,使用绿色荧光,将激发光设置为488 nm,发射光设置为525 nm。用Image J软件分析目标条带的光密度值。
1.6.5颗粒细胞miR-23a和miR-27a mRNA表达量 灌胃干预第43天,腹腔注射PMSG10 IU,48 h后脱颈椎处死。75%酒精消毒,剖腹取卵巢,用PBS冲洗多遍后转移至高糖DMEM/F-12培养基中。在体式显微镜下用1 mL注射器针头刺破卵泡,以充分释放颗粒细胞。加入胰酶,反复吹打细胞悬液,分离成团的颗粒细胞,置于37 ℃、5% CO2培养箱中消化。完成消化后,加入完全培养基终止消化,静置10 min。200目细胞滤网过滤,轻取细胞悬液于离心管中,1 000 r/min离心10 min。弃上清,加入完全培养基,轻轻吹打,制成细胞悬液,计数后分装于细胞培养瓶中,置于37 ℃、5% CO2培养箱中培养,每2 d换液1次。待细胞长满至瓶底90%时,收集颗粒细胞,加入Trizol提取总RNA;按照试剂盒说明将RNA反转录成cDNA;实时荧光定量采取20 μL反应体系:10 μL 2×miRNA SYBR qPCR Master Mix,0.4 μL Specific Primer(10 μmol/L),0.4 μL mQ Primer R(10 μmol/L),1 μL cDNA,8.2 μL RNase Free H2O;反应程序:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,40个循环 ;95 ℃延伸5 s,65 ℃延伸1 min。采用2-△△CT法分析数据,引物由山东思科捷生物技术有限公司合成,引物序列见表1。
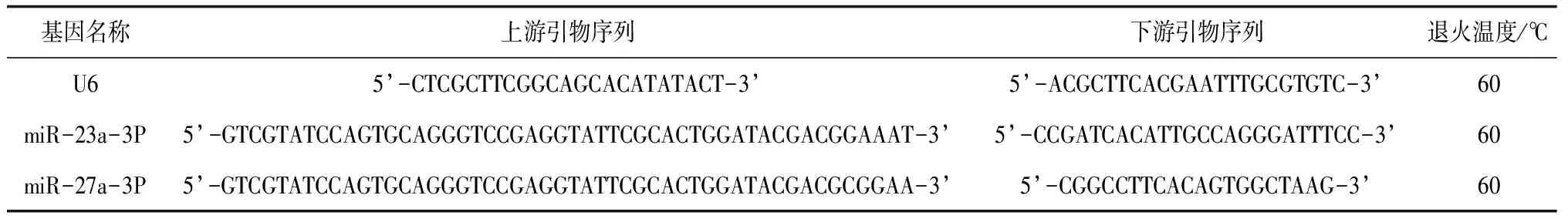
表1 引物序列
2 结 果
2.1各组小鼠获卵数、卵母细胞成熟率比较 高龄组、补肾养精低剂量组、补肾养精高剂量组获卵数、卵母细胞成熟率均明显低于青年组(P均<0.05);补肾养精高剂量组获卵数、卵母细胞成熟率均明显高于高龄组(P均<0.05);补肾养精高剂量组获卵数明显高于补肾养精低剂量组(P<0.05),补肾养精低剂量组与补肾养精高剂量组卵母细胞成熟率比较差异无统计学意义(P>0.05)。见表2。

表2 青年组和高龄各组小鼠获卵数、卵母细胞成熟率比较
2.2各组小鼠体外受精率和囊胚率比较 高龄组、补肾养精低剂量组、补肾养精高剂量组受精率、囊胚率均明显低于青年组(P均<0.05);补肾养精高剂量组受精率明显高于高龄组和补肾养精低剂量组(P均<0.05),高龄组、补肾养精低剂量组与补肾养精高剂量组囊胚率比较差异均无统计学意义(P均>0.05)。见表3。

表3 青年组和高龄各组小鼠体外受精率和囊胚率比较
2.3各组小鼠卵母细胞线粒体膜电位和ROS含量比较 与青年组比较,高龄组、补肾养精低剂量组、补肾养精高剂量组线粒体膜电位均明显降低(P均<0.05),线粒体ROS含量均明显增高(P均<0.05);与高龄组比较,补肾养精高剂量组线粒体膜电位明显增高(P<0.05),线粒体ROS含量明显降低(P<0.05);补肾养精低剂量组与补肾养精高剂量组线粒体膜电位和线粒体ROS含量比较差异均无统计学意义(P均>0.05)。见表4及图1、图2。

图1 青年组和高龄各组小鼠卵母细胞线粒体膜电位检测荧光染色情况(×100)

图2 青年组和高龄各组小鼠卵母细胞线粒体活性氧表达荧光染色情况(×100)
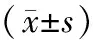
表4 青年组和高龄各组小鼠卵母细胞线粒体膜电位和ROS含量比较
2.4各组小鼠颗粒细胞miR-23a和miR-27a mRNA表达量比较 高龄组、补肾养精低剂量组、补肾养精高剂量组miR-23a mRNA表达量和高龄组、补肾养精低剂量组miR-27a mRNA表达量均明显高于青年组(P均<0.05);补肾养精低、高剂量组miR-23a和miR-27a mRNA表达量均明显低于高龄组(P均<0.05),且补肾养精高剂量组均明显低于补肾养精低剂量组(P均<0.05)。见表5。
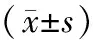
表5 青年组和高龄各组小鼠颗粒细胞miR-23a和miR-27a mRNA表达量比较
3 讨 论
miRNA是一种大小19~25个核苷酸的内源性非编码小RNA,广泛存在于真核细胞[9]。目前,在人类基因中发现一千余个miRNA,其中1/3参与了人类蛋白质的表达和调控,同时也参与了人类的多个生理、病理过程[10]。miR-23a和miR-27a同属于miR-23a~27a~24-2家族,该家族高度参与了细胞的增殖、分化和凋亡等。相关研究发现,卵巢早衰患者与健康女性的血浆中存在部分差异基因表达,卵巢早衰会上调miR-146a、miR-27a、miR-23a、miR-126表达[11], miR-146a、miR-27a、miR-23a可通过多途径促进细胞凋亡[12]。王英[13]研究报道,采用戊酸雌二醇片和补肾为主的中药治疗卵巢早衰患者可明显下调miR-23a和miR-27a表达。海派朱氏妇科传人朱南孙根据“肾主生殖”的理论,提出补肾活血治疗卵巢早衰的原则,临床研究证实补肾活血法可以通过降低miR-23a过度表达,减少卵泡颗粒细胞凋亡引发的卵泡闭锁,提高血清抗缪勒管激素(AMH)水平,改善卵巢早衰[14]。中山大学团队研究发现,加味八珍方可能通过降低miR-23a和miR-27a表达而改善卵巢早衰大鼠的卵巢功能[15]。杨延周等[16]对大鼠卵巢颗粒细胞体外培养研究发现,过表达的miR-23a-3p会诱导大鼠卵泡闭锁,促进颗粒细胞凋亡,而抑制miR-23a-3p表达对卵泡发育和颗粒细胞没有明显影响,提示颗粒细胞miR-23a-3p的异常表达可能是导致大鼠卵泡闭锁的主要原因,并进一步证实了miR-23a-3p是通过靶向调节缝隙连接蛋白43(Gja1)而实现的。孙婧[17]研究发现, miR-27a有促进颗粒细胞凋亡、抑制颗粒细胞增殖和雌激素分泌作用,推测其可能是通过调节下游的靶基因环磷腺苷效应元件结合蛋白Creb1而实现的。Yang等[11]发现,卵巢早衰患者血浆中miR-23a含量明显升高,其可能是通过靶向XIAP和Caspase信号通路级联诱导人类颗粒细胞凋亡的。Nie等[18]认为miR-23a和miR-27a通过靶向SMAD5促进人类颗粒细胞凋亡,或者说miR-23a和miR-27a直接靶向SMDA5后,通过Fas-FasL途径促进颗粒细胞凋亡。目前对于如何下调miR-23a和miR-27a改善卵巢早衰尚无具体定论,这也正是本课题研究的方向。
线粒体作为卵母细胞中数量最多的细胞器,不仅是卵母细胞发育过程中能量的主要提供者[19],而且也参与其他的细胞活动,如减数分裂纺锤体的形成,调节细胞内钙离子的浓度,参与细胞氧化还原反应,控制细胞的凋亡与老化[20]等,所以线粒体近年来也常常被作为卵母细胞质量评价的指标[21]。随着年龄的增加,M Ⅱ期卵母细胞中的线粒体膜电位逐渐降低是造成线粒体功能障碍,降低高龄女性生育力的重要原因[22]。线粒体通过氧化磷酸化为细胞供能,同时也会制造副产物ROS,ROS的过度积累会引发氧化应激反应使细胞膜受损,导致线粒体DNA突变、缺失,影响ATP的产生,造成卵母细胞发育障碍、损伤,降低卵母细胞发育潜能,在胚胎中表现为卵裂球溶解,出现细胞碎片[23]。
《素问·上古天真论》言:“女子……四七,筋骨坚,发长极,身体盛壮;五七,阳明脉衰,面始焦,发始堕……七七,任脉虚,太冲脉衰少,天癸竭,地道不通,故形坏而无子。”指出了女性在五七的年纪身体由“盛壮”逐渐走向“衰”,肾气开始出现减弱,气血暗耗。卵巢内的卵泡属于生殖之精,此时由于肾气的不足,导致可以募集的卵泡数量和质量降低,卵泡发育障碍,无法排出。刘金星教授认为,肾虚是高龄DOR不孕的根本,主张“补肾填精,益气养血”,拟定了补肾养精颗粒,方中四物汤补血养血,五子衍宗丸填补肾精,二者共奏补血填精之效,且精血同源,二者共用,效果相得益彰。配伍二仙汤中仙灵脾和知母,取其温补肾阳之意,与四物汤、五子衍宗丸共奏阴阳双补之效,且配伍应用温阳而不助热。酌加党参补中益气,与四物汤共奏气血双补之效。香附、枳壳理气行滞,防止久服行呆腻之弊,川牛膝引血下行,益母草活血化瘀,与香附、枳壳共行行气活血之效,使全方补而不滞。
本实验结果显示,高龄组小鼠获卵数、卵母细胞成熟率、体外受精率和囊胚率、卵母细胞线粒体膜电位均明显低于青年组,卵母细胞线粒体ROS含量和颗粒细胞miR-23a、miR-27a mRNA表达量均明显高于青年组;与高龄组比较,补肾养精高剂量组小鼠获卵数、卵母细胞成熟率、体外受精率、卵母细胞线粒体膜电位均明显增高,补肾养精高剂量组卵母细胞线粒体ROS含量和补肾养精低、高剂量组颗粒细胞miR-23a、miR-27a mRNA表达量均明显降低。结合既往研究,分析补肾养精颗粒可能是通过降低卵巢颗粒细胞miR-23a和miR-27a mRNA的表达,抑制颗粒细胞凋亡,促进颗粒细胞增殖,从而提高卵母细胞的质量,增加优质卵子获取数量,提高受精率。但目前对于miRNA的具体生物功能和调节机制仍知之甚少,有待确定其相应的靶基因和调节途径,在分子水平解开miRNA的神秘面纱。
利益冲突:所有作者均声明不存在利益冲突。

