肾炎防衰液通过FGF21/SIRT1信号通路防治糖尿病肾病的机制研究
孙 娜,陈振杰,吕 杰,和 莹,梁瑛楠,王 健,周静威
(北京中医药大学东直门医院,北京 100700)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见且严重的并发症之一,是世界上终末期肾病最常见的原因(占终末期肾病的30%~50%)[1]。我国DN发病率超过了慢性肾小球肾炎相关慢性肾脏病,成为慢性肾脏病的首位病因[2]。DN发病率高、治疗难度大、社会经济负担重,如何有效防治DN具有重大意义。然而目前DN治疗方案尚存在诸多不足,亟须结合中医理论探索更为安全、有效的延缓DN进展的治疗方法和药物。国医大师吕仁和教授提出“肾络微型癥瘕”的理论[3],王耀献教授将祖国传统医学中的络病理论及癥瘕理论和现代医学对肾脏生理、病理的认识相结合,进一步推进“肾络微型癥瘕”理论,提出“肾络癥瘕”理论,并将“聚散”概念引入肾络癥瘕理论中,在“肾络癥瘕”理论的基础上,将其细化为功能态、聚散消长态、癥瘕形成态三个阶段,以消癥散结为法拟定肾炎防衰液,前期研究证实该方可以通过减轻氧化应激反应而发挥肾脏保护作用[4]。本研究通过建立DN小鼠模型,进一步探讨肾炎防衰液对DN的干预作用及延缓DN进展的潜在机制,以期为肾炎防衰液防治DN提供客观依据。
1 实验材料与方法
1.1实验动物 5周龄无特定病原体(SPF)级雄性C57BL/6小鼠40只,体重(13±2)g,购自北京华阜康实验动物技术有限公司,生产许可证号:SCXK(京)2016-0006。所有小鼠饲养于北京中医药大学东直门医院SPF 级实验动物屏障环境,自由摄食、进水,饲养环境保持恒温[(22±2)℃]、恒湿[(50±10)%],12 h/12 h明暗交替,室内通风良好。本实验已取得北京中医药大学东直门医院动物管理委员会批准(伦理编号:21-34),所涉及的研究方案符合中国伦理委员会关于实验动物的指导原则。
1.2药物与饲料 肾炎防衰液(生黄芪30 g、当归15 g、鳖甲15 g、三七9 g、海藻30 g、生牡蛎30 g、熟大黄9 g)由北京中医药大学东直门医院药学部提供,用原药材总量的10倍体积的蒸馏水浸泡30 min后煎煮,最后过滤浓缩至生药含量1 g/mL,使用时按照比例稀释。厄贝沙坦[赛诺菲(杭州)制药有限公司,国药准字J20171089,规格:150 mg/粒]由北京中医药大学东直门医院药学部提供,将片剂研磨成粉,溶于蒸馏水中,配制成浓度为0.02 g/mL混悬液,低温封存备用。高脂饲料(60 kcal%脂肪,20 kcal%碳水化合物,20 kcal%蛋白质,总能量为5.24 kcal/g,美国Research Diets公司,货号:D12492),普通饲料(10 kcal%脂肪,20 kcal%碳水化合物,20 kcal%蛋白质, 总能量为3.85 kcal/g, 美国Research Diets公司,货号:D12450J)。
1.3主要试剂与仪器 小鼠成纤维细胞生长因子21(FGF21)ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号:E-EL-M0029c),小鼠血清肌酐(SCr)、尿素氮(BUN)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)测定试剂盒(南京建成生物工程研究所有限公司,货号分别为C013-2-1、C011-2-1、A111-1-1、A110-1-1、A113-1-1),小鼠尿微量白蛋白(mALB)ELISA试剂盒(上海酶联生物科技有限公司,货号:ml063626),小鼠尿肌酐 (Cr) 测定试剂盒(南京建成生物工程研究所有限公司,货号:C013-2-1),链脲佐菌素(STZ ,Sigma,货号:S0130-1G),0.1 mol/L柠檬酸钠缓冲液(北京索莱宝科技有限公司,货号:C1013),糖原PAS染色液(Solarbio,货号:G1281),改良Masson三色染色液(Solarbio,货号:G1346),沉默信息调节蛋白1(SIRT1)抗体(abcam,货号:ab110304),微管相关蛋白1轻链3(LC3) (abcam,货号:ab192890),Anti-SQSTM1/p62(abcam,货号:ab109012),兔二步法免疫组化检测试剂盒(中杉金桥,货号:PV-9001),DAB显色试剂盒(中杉金桥,货号:ZLI-9018),TritonX-100(Solarbio,货号:T8200),防荧光淬灭封片剂(含DAPI,货号:ZLI-9557),荧光二抗(Invitrogen,货号:A21206)。石蜡包埋机、石蜡切片机、冰冻切片机、DM300光学显微镜(德国Leica公司),4 ℃离心机、全自动酶标仪(美国Thermo Fisher Scientific公司),生物显微镜(蔡司Axio Scope.A1)。
1.4实验方法 40只小鼠适应性饲养1周后,随机分为正常组、模型组、肾炎防衰液组及厄贝沙坦组,每组10只。正常组给予普通饲料喂养;其余组小鼠参考文献[5]方法采用高脂饲料喂养, 喂养8周后禁食12 h以上,然后连续5 d腹腔注射STZ 40 mg/kg(STZ临用前溶解于0.1 mol/L、pH 4.5的0.1 mol/L柠檬酸盐缓冲液,现用现配,低温,避光,20 min内使用),正常组小鼠腹腔注射等体积上述缓冲液。72 h后连续3 d尾尖采血测随机血糖,高于16.7 mmol/L视为糖尿病造模成功。定期监测血糖并留取尿液测定尿白蛋白肌酐比(UACR)。造模成功后,按照人与动物的体表面积等效剂量换算法[6],小鼠给药剂量约为人临床用量的9.1倍,肾炎防衰液组给予肾炎防衰液20.93 g/(kg·d)灌胃,厄贝沙坦组给予厄贝沙坦22.75 mg/(kg·d)灌胃,正常组和模型组给予等量的生理盐水灌胃,均每日1次,连续12周。干预期间模型组、肾炎防衰液组、厄贝沙坦组继续高脂饲料喂养,正常组继续普通饲料喂养。
1.5样本采集 灌胃12周后,提尾反射法收集小鼠随机尿液样本,以4 ℃ 3 000 r/min离心10 min,收集上清夜分装,-80 ℃冰箱冻存备用;小鼠过夜禁食12 h以上,眼眶取血, 4 ℃ 3 000 r/min离心10 min,收集上层血清分装,-80 ℃冰箱冻存备用。完整剪下右侧肾脏,剥离包膜,称重。分离肾皮质,部分迅速放入冻存管投入液氮中,转移至-80 ℃冰箱保存;剩余部分移至4%多聚甲醛在4 ℃冰箱中固定24 h以上,拟石蜡包埋的组织全自动脱水机脱水后进行石蜡包埋,拟用于OCT包埋的组织经20%蔗糖、30%蔗糖梯度脱水,每个梯度浸泡24 h。
1.6检测指标及方法
1.6.1小鼠一般状态、体重及血糖 实验过程中观察各组小鼠精神状态、活动情况、毛色、饮水饮食情况、尿量等,灌胃过程中每4周测量1次小鼠体重及血糖。
1.6.2肾功能及肾重/体重比 严格按说明书检测血BUN、SCr和尿mALB、尿Cr水平,根据尿mALB、尿Cr水平计算UACR;根据各组小鼠肾重及体重计算肾重/体重比。
1.6.3血清脂代谢指标及FGF21水平 严格按说明书检测血清TC、TG、LDL-C、FGF21水平。
1.6.4肾脏组织病理形态 ①HE染色:60 ℃烤片1 h,二甲苯Ⅰ、Ⅱ和Ⅲ中分别脱蜡10 min,100%,100%,95%,90%,80%,70%梯度乙醇水化各3 min, PBS洗3次,5 min/次;苏木素核染5 min,自来水冲洗多余染液,1%盐酸乙醇分化10 s,自来水冲洗返蓝10 min;1%伊红染液染色10 min,自来水冲洗1 min; 70%,80%,90%,95%,100%,100%梯度乙醇上行脱水,各3 min;二甲苯Ⅰ、Ⅱ、Ⅲ中分别透明10 min,中性树胶封片,光镜下观察。②PAS染色:石蜡切片常规脱蜡、水化同HE染色操作,滴加1%过碘酸溶液反应8~10 min,流水冲洗3 min,蒸馏水浸洗2次,每次3 min; Schiff染液阴暗处浸染1 h,流水冲洗10 min;苏木素染核及梯度乙醇上行脱水、透明、封片同HE染色操作。③Masson染色:石蜡切片常规脱蜡、水化同HE染色操作,60 ℃煤染液浸染1 h,流水冲洗10 min;天青石蓝染液滴染2~3 min,水洗2次,每次15 s;苏木素染核3 min,自来水冲洗多余染液,盐酸乙醇分化至组织完全变红,水洗终止分化,流水冲洗10 min;丽春红染液滴染12 min,弱酸溶液冲洗2次,每次10~15 s;磷钼酸溶液处理15 min,镜下观察血管周围胶原亮红色褪至淡红色或无色为止;苯胺蓝染液滴染5 min,弱酸溶液洗涤并覆盖静置2 min;梯度乙醇上行脱水、透明、封片同HE染色操作。
1.6.5肾脏组织中SIRT1蛋白阳性表达情况 石蜡切片常规脱蜡、水化,PBS浸洗3次,每次5 min;水浴锅预热柠檬酸盐修复液(pH 6.0)至95 ℃以上,切片浸入修复液修复20 min,自然恢复至室温; PBS浸洗3次,每次5 min,滴加内源性过氧化物酶阻断剂50 μL,避光孵育20 min; PBS浸洗3次,每次5 min,擦干组织周围液体,组化笔围绕组织画圈,滴加100 μL山羊血清,湿盒中37 ℃封闭30 min;一抗孵育(rabbit anti-SIRT1抗体1∶200),湿盒4 ℃过夜;次日,室温放置1 h,PBS浸洗6次,每次5 min;滴加反应增强液100 μL,37 ℃孵育20 min,PBS浸洗3次,每次5 min;滴加二抗孵育组织,37 ℃孵育20 min,PBS浸洗3次,每次5 min;DAB显色,镜下观察并记录显色时间,保证各组别切片显色时间一致,水洗终止显色;苏木素核染5 s,自来水冲洗多余染液,盐酸乙醇分化15 s,流水冲洗10 min返蓝;梯度乙醇上行脱水、透明、封片。以平均光密度值(MOD)作为免疫组化阳性表达强度,对其进行半定量分析,计算每个视野下阳性结果的积分光密度和面积,即单位面积(Area)的累积光密度值(IOD),MOD=IOD/Area。
1.6.6肾脏组织中LC3、p62阳性表达情况 将组织冰冻切片平衡至室温后,置于PBS中泡洗5 min×2次,洗去OCT;将组织切片放入水浴锅中预热至92 ℃以上的抗原修复液中,完全没过组织,水浴20 min后取出,自然冷却至室温,PBS浸洗5 min×3次;滴加0.5%TritonX-100溶液室温透膜10 min,PBS清洗5 min×3次;擦干切片组织周围的液体后,用免疫组化笔标记样本的范围;在组织保持湿润状态下,滴加5%驴血清(PBS稀释),37 ℃孵育箱封闭1 h;倾弃封闭液,滴加驴血清稀释后的一抗(p62兔抗体1∶1 000, LC3兔抗体1∶1 000),4 ℃冰箱孵育过夜,次日,从4 ℃冰箱中取出切片,平衡至室温;PBS浸洗5 min×3次,滴加PBS稀释的荧光二抗(稀释浓度1∶1 000,注意种属来源,避光),37 ℃孵育箱避光孵育1 h;PBS浸洗5 min×3次,以含DAPI防淬灭封片剂,盖上盖玻片,避免产生气泡;荧光显微镜下观察、拍片,注意各组必须在同一条件下拍摄,每组随机拍摄15个视野,将每组采集的15张免疫荧光图片通过Image-Pro Plus 6.0进行分析,以图片的平均荧光强度(Mean)作为免疫荧光阳性表达强度,对其进行半定量分析,计算每个视野下阳性结果的累计荧光强度和总面积,即Area的累积光密度值(IntDen),Mean=IntDen/Area。
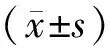
2 结 果
2.1各组小鼠一般状况比较 正常组小鼠状态良好,活动自如,反应敏捷,毛色光亮。模型组、肾炎防衰液组和厄贝沙坦组小鼠在整个实验期间血糖均维持在16.7 mmol/L以上,其中模型组小鼠精神欠佳,活动减少,反应迟缓,明显消瘦,毛色粗糙且缺少光泽,饮水、饮食、尿量较正常组明显增多;肾炎防衰液组及厄贝沙坦组小鼠精神状态、毛色光泽度及反应性较模型组改善。
2.2各组小鼠体重及血糖比较 各造模组小鼠灌胃前及灌胃4周、8周、12周血糖水平和灌胃前体重均明显高于正常组(P均<0.05);灌胃4周、8周、12周,肾炎防衰液组及厄贝沙坦组小鼠血糖水平和体重较模型组有下降趋势,但差异均无统计学意义(P均>0.05)。见表1。
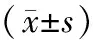
表1 正常组和糖尿病肾病各组小鼠各时间点血糖及体重比较
2.3各组小鼠肾功能及肾重/体重比比较 模型组小鼠UACR、肾重/体重比均明显高于正常组(P均<0.05);SCr、BUN水平升高,但与正常组比较差异均无统计学意义(P均>0.05)。肾炎防衰液组和厄贝沙坦组小鼠UACR及厄贝沙坦组小鼠SCr水平均明显低于模型组(P均<0.05);2组其余指标有降低趋势,但与模型组比较差异均无统计学意义(P均>0.05)。见表2。
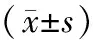
表2 正常组和糖尿病肾病各组小鼠肾功能及肾重/体重比比较
2.4各组小鼠血清脂代谢指标及FGF21水平比较模型组小鼠血清TC、TG、LDL-C、FGF21水平均明显高于正常组(P均<0.05),肾炎防衰液组小鼠血清TC、TG、LDL-C、FGF21水平均明显低于模型组(P均<0.05),厄贝沙坦组各指标与模型组比较差异均无统计学意义(P均>0.05)。见表3。
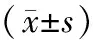
表3 正常组和糖尿病肾病各组小鼠血清脂代谢指标及FGF21水平比较
2.5各组小鼠肾脏病理形态比较 HE染色:正常组小鼠肾脏结构清晰完整,肾组织细胞排列整齐,肾小球体积正常,肾小管排列致密,轮廓正常;模型组小鼠肾组织细胞排列紊乱,肾小球体积增大,肾小管上皮细胞排列紊乱,广泛空泡样变性,小管上皮细胞萎缩、脱落;与模型组相比,肾炎防衰液组、厄贝沙坦组小鼠肾小球体积稍有恢复,肾小管损伤明显改善。PAS染色:正常组小鼠肾小球结构完整,无明显系膜基质增生;模型组小鼠肾小球体积增大,系膜区明显增宽,系膜基质弥漫性增生,肾小球硬化明显;与模型组相比,肾炎防衰液组、厄贝沙坦组小鼠肾小球体积减小,系膜基质增生明显减少,散发K-W结节形成。Masson染色:正常组小鼠肾间质未见明显胶原物质沉积;模型组小鼠肾间质蓝染面积明显增多,存在大量胶原物质沉积,纤维化改变明显;与模型组相比,肾炎防衰液组、厄贝沙坦组小鼠肾间质蓝染面积明显减少,纤维化程度有所缓解。见图1。
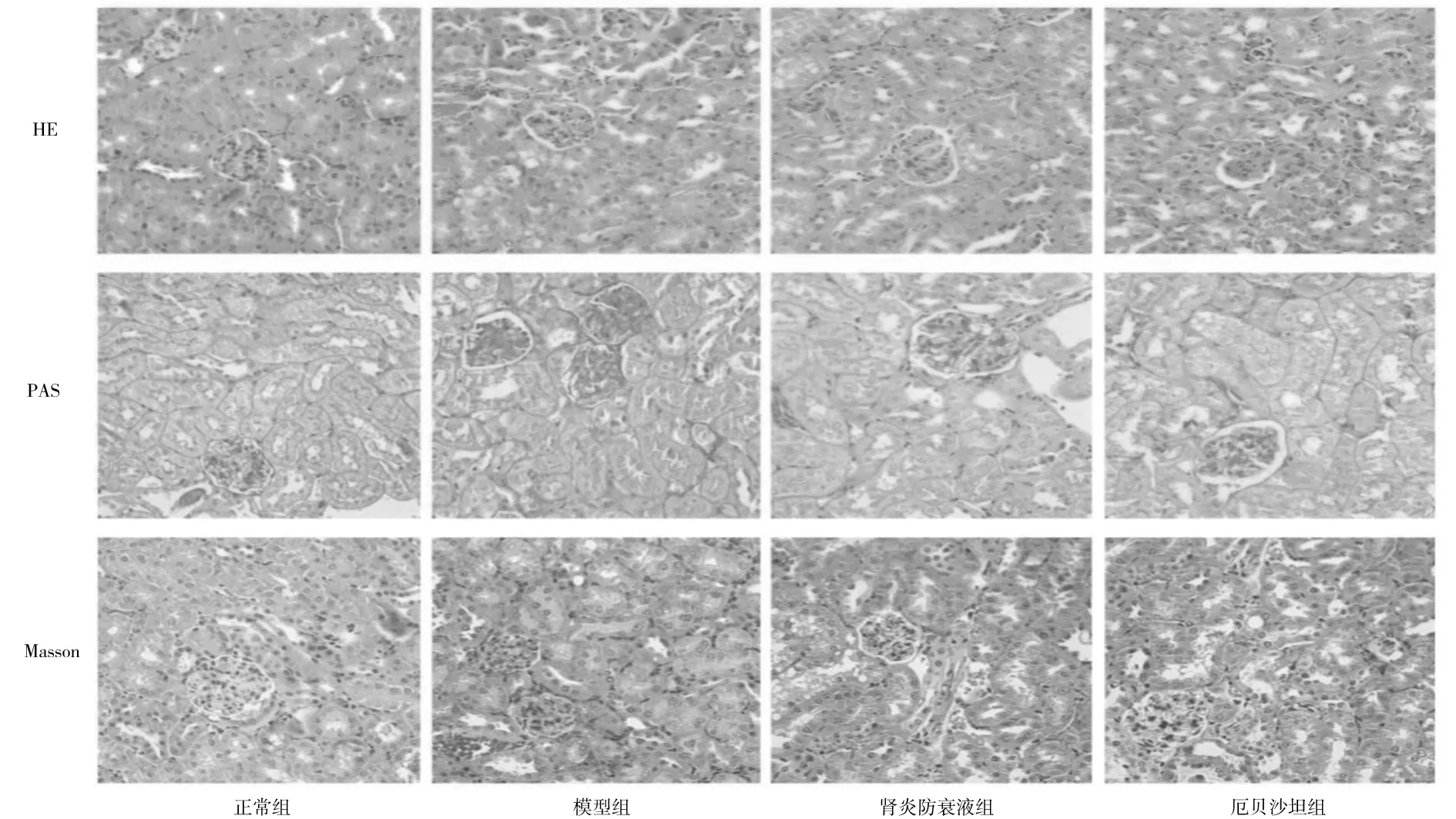
图1 正常组和糖尿病肾病各组小鼠肾脏组织病理形态比较(×400)
2.6各组小鼠肾组织中SIRT1蛋白表达情况比较免疫组化染色显示,SIRT1蛋白在肾小球、肾小管均有表达,肾小管表达更为明显。正常组、模型组、肾炎防衰液组及厄贝沙坦组SIRT1蛋白阳性表达平均光密度值分别为55.89±3.90,35.47±2.05,49.32±1.92,43.81±2.54,模型组明显低于正常组(P<0.05),肾炎防衰液组及厄贝沙坦组均明显高于模型组(P均<0.05)。见图2。
2.7各组小鼠肾组织中LC3及p62蛋白表达情况比较 免疫荧光染色显示,与正常组比较,模型组LC3蛋白表达减少(P<0.05),p62蛋白表达增加(P<0.05)。与模型组比较,肾炎防衰液组、厄贝沙坦组LC3蛋白表达增加(P均<0.05),p62蛋白表达减少(P均<0.05)。见图3、图4及表4。
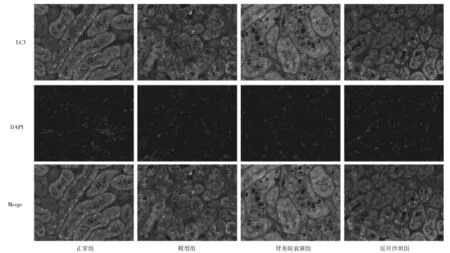
图3 正常组和糖尿病肾病各组小鼠肾脏组织中LC3蛋白表达情况(免疫荧光染色,×400)
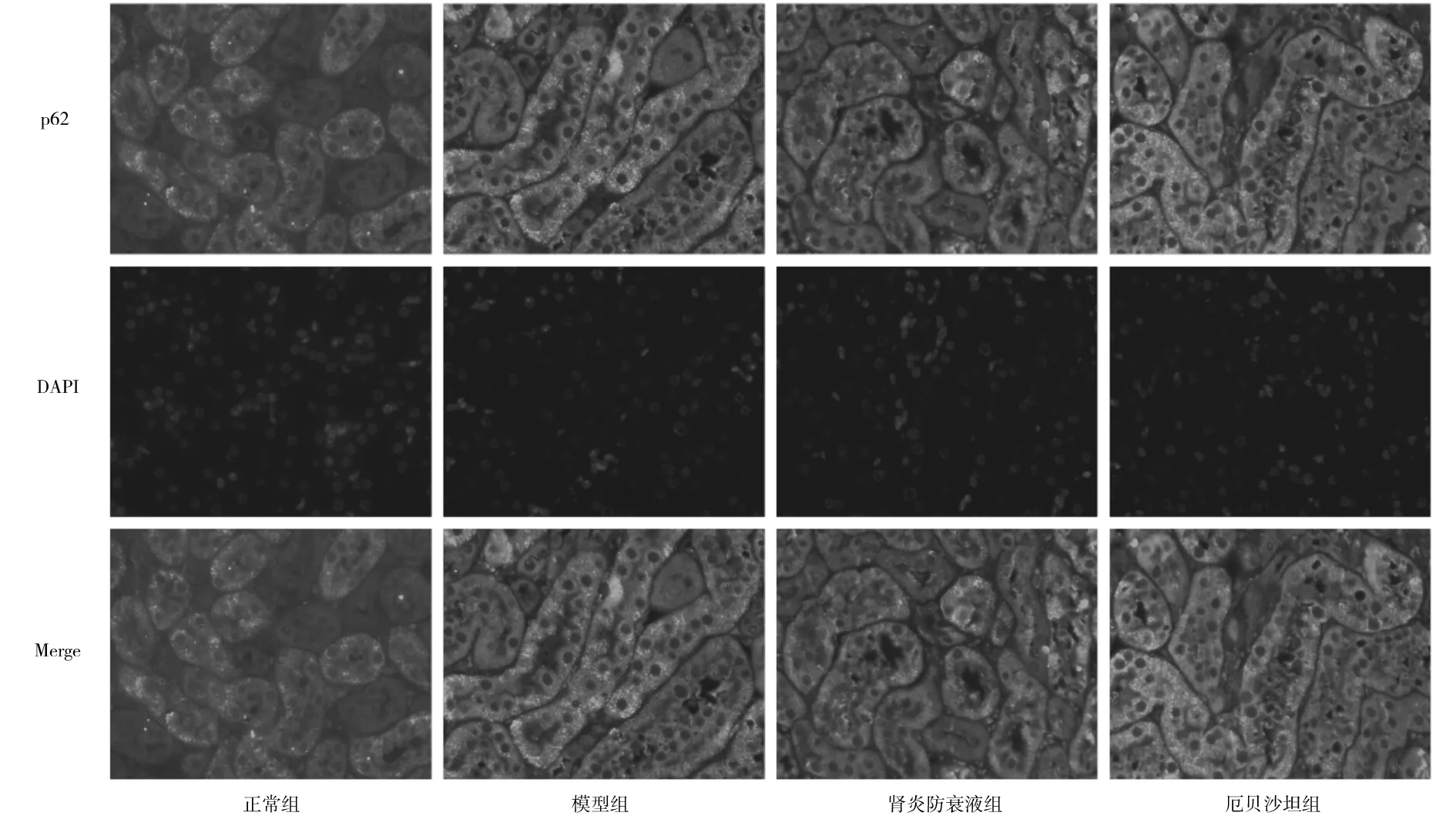
图4 正常组和糖尿病肾病各组小鼠肾脏组织中p62蛋白表达情况(免疫荧光染色,×400)
表4 正常组和糖尿病肾病各组小鼠肾脏组织中LC3、p62蛋白表达平均荧光强度比较
3 讨 论
DN是全球终末期肾脏疾病的主要原因,大约40%的2型糖尿病及30%的1型糖尿病患者可发展为DN[7-8]。国际糖尿病联合会(IDF) 2021年糖尿病地图集显示,在未来24年里,全球糖尿病患者将从5.37亿人增至7.83亿人,预计增长近50%[9]。在全球糖尿病患病率上升的同时,DN患者的数量预计也会增加[6]。DN发病机制复杂,代谢紊乱、肾脏血流动力学异常、肾素-血管紧张素-醛固酮系统激活、氧化应激、炎症等均参与了DN的发生、发展[10]。
肾纤维化是引起终末期肾衰竭的主要原因和病理基础之一,肾纤维化的主要特征为肾内细胞外基质(ECM)过度产生,并在肾小球及肾小管间质沉积,表现为肾小球硬化和(或)肾间质纤维化[11],肾纤维化的严重程度与肾功能的丧失和终末期肾脏疾病进展高度相关[12]。 王耀献教授指出,肾纤维化的病理过程与“肾络癥瘕聚散消长”有异曲同工之妙[13]。DN的发展可分为3期:早期临床表现为微量白蛋白尿,此时正气尚足,肾络癥瘕初现,癥瘕可被消散,为聚散功能态。中期病理已经出现典型的K-W结节,临床出现大量蛋白尿,此时正气亏虚,痰、瘀、毒等病理产物内生阻于肾络,癥瘕大量形成,难以逆转,为聚散消长态。晚期病势缠绵,正虚邪恋,痰、瘀、毒等病理产物形成速度渐渐大于消散速度,肾络癥瘕积聚形成;肾体受损,肾用失司,肾脏封藏失司固摄无力,精微外溢,临床表现为血尿、蛋白尿;肾脏气化失调,水液输布异常,痰、瘀等病理产物蓄积,从而出现水肿、SCr升高等表现,最终发展至尿毒症。“肾络癥瘕”的形成是DN的核心病机,故消癥散结为其主要治则。肾炎防衰液中的黄芪、当归、三七补气活血化瘀,鳖甲、海藻、牡蛎软坚化痰散结,熟大黄通腑泄浊,与“肾络癥瘕”里的虚、瘀、痰、浊等病机相契合。肾炎防衰液中多种药物的有效成分已被证实可以延缓DN进展,保护肾功能。如黄芪中的重要活性成分黄芪甲苷可以通过激活 PPARγ-Klotho-FoxO1通路抑制氧化应激,进而减轻足细胞损伤,保护肾功能[14]。大黄中的活性成分大黄素可以降低DN小鼠的尿白蛋白、SCr和BUN,减轻肾脏病理损伤[15]。三七的活性成分三七皂苷可通过抑制细胞凋亡和氧化应激,减轻DN小鼠肾损伤[16]。但肾炎防衰液缓解DN肾损伤的内在机制仍不清楚,故本实验进行了相关探讨。
本实验以高脂饲料喂养8周联合小剂量多次腹腔注射STZ法成功构建小鼠DN模型,血糖、血脂、UACR、肾重/体重比均明显增高,肾小球硬化、纤维化改变明显;肾炎防衰液干预后,血脂、UACR明显降低,血糖变化不明显,肾组织损伤减轻,表明肾炎防衰液可以减少蛋白尿,减轻肾脏损伤,但不是通过降糖环节来实现的。
自噬是细胞对各种应激刺激的反应,毒性蛋白质和受损的细胞器被自噬小体吞噬,并最终由溶酶体降解[17]。自噬对维持细胞稳态及正常功能具有重要作用,越来越多的研究表明自噬失调参与了DN的发生、发展[18],调控自噬可以减轻STZ诱导下DN模型的肾小球肥大,改善肾功能,延缓DN的进展[19];还可以抑制足细胞凋亡,保护足细胞[20]。细胞自噬受多种信号通路的影响,其中FGF21/SIRT1信号通路为调控自噬的关键通路。本实验结果显示,模型组小鼠血清SIRT1水平降低,肾脏组织中LC3蛋白表达减少、p62蛋白表达增加;肾炎防衰液干预可上调SIRT1、LC3表达,下调p62表达,提示肾炎防衰液可能通过调控自噬延缓DN的进展。
综上所述,肾炎防衰液能明显改善DN小鼠的肾功能,减轻肾脏组织损伤,其可能通过调控FGF21/SIRT1通路、促进自噬发挥肾保护作用,但确切机制及相关靶点仍需进一步探讨。
利益冲突:所有作者均声明不存在利益冲突。

