基于自噬理论探讨活血解毒降糖方对糖尿病动脉粥样硬化的影响
符显昭,蒋晓凤,陈佳俊,申亚亚
(右江民族医学院附属医院,广西 百色 533099)
目前糖尿病患病率呈上升趋势,且明显年轻化,给人类健康带来了严重的影响[1]。动脉粥样硬化是糖尿病的常见慢性并发症,其是心脑血管疾病的独立危险因素[2]。研究发现,细胞自噬、内质网应激和炎症介质等信号通路在调控动脉粥样硬化的发生发展中发挥重要作用[3]。细胞自噬是存在于真核生物进化过程中的一种高度保守的降解和回收利用生物大分子和受损细胞器的过程,其在动脉粥样硬化形成发展过程中同样扮演着重要的角色[4]。研究发现,适度的自噬对动脉粥样硬化具有保护作用,而过度的自噬会导致细胞死亡,降低斑块的稳定性,导致斑块破裂,发生急性临床事件[5]。因此,调控血管细胞自噬以拮抗动脉粥样硬化是目前靶向药物研究的热点。中医理论认为,糖尿病动脉粥样硬化病变是在气阴两虚并燥热内蕴病机基础上不断发展而来,气虚无力运血则血行缓慢而致瘀,燥热内蕴过久则炼津为痰,痰瘀互结日久可化毒,导致瘀血、痰浊、热毒滞留并沉积于脉络,形成斑块(即动脉粥样硬化斑块)[6]。前期实验研究发现,活血解毒降糖方能减轻糖尿病大鼠机体炎症反应,减少主动脉细胞凋亡,抑制内质网应激偶联炎症反应[7]。本研究观察了活血解毒降糖方对糖尿病大鼠主动脉细胞自噬相关蛋白表达的影响,旨在从内质网应激-细胞自噬角度探讨其作用机制,为糖尿病动脉粥样硬化的防治提供实验依据。
1 实验材料与方法
1.1实验动物 雄性SD大鼠100只,体重220~240 g,购于广西医科大学实验动物中心,合格证号:SCXK(桂)2020-003。大鼠饲养于右江民族医学院动物实验中心,普通饲料适应性喂养7 d,保持室温20~25 ℃,自然采光,相对湿度40%~50%。本实验已通过右江民族医学院实验动物伦理委员会审查(2019030701)。
1.2实验药物 活血解毒降糖方(由人参10 g、麦冬15 g、五味子10 g、山茱萸10 g、生地15 g、山药15 g、大黄5 g、鳖甲15 g、桃仁10 g、丹皮10 g、黄连8 g等13味中药组成),药材购自右江民族医学院附属医院,符合《中华人民共和国药典》药品质量控制标准。先将各味中药置于约4倍量超纯水中室温浸泡2 h,再用不锈钢提桶煎煮1.5 h,将浓缩药液转移至烘干箱中,90 ℃烘干36 h,制成浸膏,每1 g浸膏剂量相当于原生药10 g,保鲜膜将浸膏密封,放入-20 ℃冰箱冷冻保存,用时取出,室温解冻。格列喹酮(北京万辉双鹤药业有限责任公司,国药准字H10940258);贝那普利(北京诺华制药有限公司,国药准字H20030514)。
1.3主要仪器与试剂 ABI-7500型荧光定量PCR仪(美国罗氏公司);DM750型光学显微镜(日本奥林巴斯公司);ST5010型切片机(德国Thermo scientific公司);台式高速低温离心机(德国Eppendorf公司);ASP300型组织脱水机(德国徕卡公司);CLG-40L型全自动热蒸汽灭菌器(日本ALP公司);SIM-F140型制冰机(上海三洋生物科技有限公司);SW-CJ-1G型超净工作台(中国苏州医疗设备厂);4279血糖仪(武汉博士德生物工程有限公司);链脲佐菌素(STZ,货号:18883-66-4,上海源叶生物科技有限公司);糖化血红蛋白ELISA试剂盒(货号:SP12114,北京华越洋生物科技有限公司);Beclin1(货号:ab207612,Abcam公司)、微管相关蛋白1轻链3蛋白Ⅱ(LC3Ⅱ,货号:12741T,CST公司)。
1.4实验方法 取20只SD大鼠作为正常组,腹腔内注射生理盐水,普通饲料喂养。其余大鼠空腹8 h后单次腹腔注射50 mg/kg STZ,3 d后用血糖试纸检测空腹血糖(FPG),以2次FPG≥16.7 mmol/L 为糖尿病造模成功,随后高脂饲料(含普通饲料78.2%、胆固醇1.5%、蛋黄粉10%、胆盐0.3%、猪油10%,江苏省协同生物工程有限公司)喂养3个月。大鼠禁食8 h后,腹腔注射0.3%戊巴比妥钠10 mL/kg麻醉,无菌条件下做颈正中切口,分离左颈外动脉,结扎远心端,向心脏方向插入1.5F球囊,约进入8 cm后充盈球囊,感到阻力后缓慢回拉约5 cm,放空球囊,再进入5 cm,充盈、回拉,重复3次,退出球囊,结扎近心端,逐层缝合,术后肌注青霉素钠3 d,随后继续高脂饲料喂养1个月。将糖尿病动脉粥样硬化造模成功大鼠随机分为模型组、西药组、活血解毒降糖低剂量组、活血解毒降糖高剂量组各20只,活血解毒降糖低、高剂量组分别给予活血解毒降糖方1.0 g/(kg·d)和1.2 g/(kg·d)灌胃(室温下解冻后将浸膏置于EP管中,加入生理盐水,经涡旋震荡配制成2 mL混悬液),西药组给予含格列喹酮9.80 mg/kg和贝那普利3.30 mg/kg(按成人临床用药剂量的5.4倍计算)的蒸馏水稀释液灌胃,正常组和模型组给予等容积蒸馏水灌胃,均1次/d,连续灌胃2个月,灌胃期间各造模组大鼠继续高脂饲料喂养。
1.5取材 灌胃结束后,采用10%水合氯醛溶液3 mL/kg腹腔注射麻醉大鼠,颈静脉采血,室温下静置30 min,4 ℃下3 500 r/min离心分离血清,-80 ℃冰箱保存。大鼠因失血过多死亡后,在冰上迅速取出胸主动脉,用生理盐水将管腔内血液冲洗干净,一部分用4%多聚甲醛固定,用于HE染色进行主动脉病理观察;一部分用3%戊二醛溶液浸泡后置4 ℃冰箱保存,用于电镜观察细胞自噬及动脉超微结构;其余动脉放入液氮-80 ℃冷藏,用于内质网应激分子mRNA和自噬相关蛋白检测。
1.6检测指标及方法
1.6.1糖化血红蛋白及血清三酰甘油(TG )、低密度脂蛋白胆固醇(LDL-C)水平 采用ELISA法测定糖化血红蛋白水平,实验步骤严格按照说明书进行。采用全自动生化仪测定TG、LDL-C水平。
1.6.2主动脉组织病理形态 从冰箱中取出主动脉,经乙醇脱水,石蜡包埋,切4 μm薄片,60 ℃烘箱烘烤,二甲苯脱蜡,苏木素染色5 min,自来水冲洗5 min,盐酸乙醇分化30 s,自来水浸泡15 min,置伊红液2 min,自来水冲洗,再乙醇脱水,200倍显微镜下采集图像并进行半定量分析。0级(0分):血管内皮光滑,表面致密,细胞排列整齐,内膜完整;1级(1分):血管内皮结构较光滑,细胞排列比较整齐,内膜完整;2级(2分):细胞肿胀,内膜增厚,出现动脉粥样硬化斑块;3级(3分):细胞肿胀明显,排列不齐,内膜增厚,粥样硬化斑块较多;4 级(4分):血管内皮细胞脱落,细胞肿胀明显,排列紊乱,内膜明显增厚,有集中的动脉粥样硬化斑块。
1.6.3主动脉细胞自噬及超微结构 将主动脉从3%戊二醛固定液中取出,用1%锇酸溶液固定2 h,吸出固定液,用0.1 mol/L pH 7.0 PBS漂洗样品3次,每次15 min,梯度浓度(50%,70%,80%,90%,95%)乙醇溶液对样品进行脱水,纯丙酮处理20 min,用812环氧树脂包埋,制成超薄切片,用醋酸双氧铀和柠檬酸铅溶液双重染色15 min,透射电镜观察(加速电压60~80 kV),调节物镜聚焦旋钮至图片清晰,拍照。
1.6.4主动脉组织中内质网应激分子mRNA表达情况 采用RT-PCR法检测:从-80 ℃冰箱取出主动脉,加入Trizol液,在研钵中研磨,静置10 min,使得核蛋白与核酸完全分离,12 000 r/min离心10 min,取上清液,加入200 μL氯仿,12 000 r/min离心10 min,取上清液,加入异丙醇,静置15 min,4 ℃下12 000 r/min离心15 min,弃上清液,加1 mL 75%乙醇漂洗沉淀,4 ℃下12 000 r/min离心5 min,弃上清液,再加1 mL无水乙醇,沉淀,4 ℃下12 000 r/min离心5 min,弃上清,室温干燥后加入40 μL的DEPC水溶解RNA。利用超微分光光度计测定溶解后RNA浓度和纯度,当A260/A280在1.8~2.1时表明所提取RNA纯度较好。将RNA反转录为cDNA,然后将获得的cDNA进行扩增,步骤参数:设3个复孔点样,置于Realtime PCR仪上进行PCR反应,反应条件:96 ℃ 10 min变性;94 ℃ 15 s;60 ℃ 60 s;40次循环。记录达到所设定的阈值所经历的循环数,即CT值,利用溶解曲线检测引物的特异性,采用2-△△CT计算目的基因表达量。目的基因肌醇需求酶1(IRE-1)、肿瘤坏死因子相关受体因子2(TRAF2)、葡萄糖调节蛋白78(GRP78)和内参基因甘油醛-3-磷酸脱氢酶(GAPDH)引物由康为世纪生物科技有限公司设计合成,引物序列见表1。

表1 引物序列
1.6.5主动脉组织中Beclin1、LC3Ⅱ 蛋白表达情况 采用Western blot法检测:从-80 ℃冰箱取出主动脉,碎裂,加1 mL冷Lysis Buffer液匀浆,冰上裂解15 min,放入离心管中,12 000 r/min离心5 min,取上清置于新的离心管中,用BCA试剂盒检测其浓度。
用SDS-PAGE电泳和转膜后,将PVDF膜放入孵育盒,加入5%脱脂奶粉封闭液,摇床振荡2 h, TBST洗膜3次;将膜放入含一抗稀释液的孵育盒中,4 ℃摇床振荡孵育过夜;第2天取出,在室温中振荡30 min,吸弃一抗,用TBST洗3次;用5%脱脂奶粉封闭液稀释二抗,室温摇床振荡反应1 h;二抗反应结束后,回收二抗,用TBST洗膜3次。滴加混合液发光试剂,充分接触反应5 min,使用ECL成像仪拍照存储图片,采用Image J软件测定并分析灰度值。
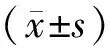
2 结 果
2.1各组大鼠糖化血红蛋白及血清TG、LDL-C水平比较 模型组大鼠糖化血红蛋白及血清TG、LDL-C水平均明显高于正常组(P均<0.05);各药物组大鼠糖化血红蛋白及血清TG、LDL-C水平均明显低于模型组(P均<0.05);活血解毒降糖高剂量组大鼠糖化血红蛋白及血清TG、LDL-C水平均明显低于西药组(P均<0.05),各指标与活血解毒降糖低剂量组比较差异均无统计学意义(P均>0.05)。见表2。
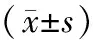
表2 正常组和糖尿病动脉粥样硬化各组大鼠糖化血红蛋白及血清TG、LDL-C水平比较
2.2各组大鼠主动脉组织病理形态比较 正常组血管内皮光滑,表面致密,细胞排列整齐,内膜完整,主动脉组织病理积分为(0.20±0.05)分;模型组内皮细胞脱落,排列紊乱,细胞肿胀明显,内膜明显增厚,有集中的动脉粥样硬化斑块,主动脉组织病理积分为(3.24±0.08)分,明显高于正常组(P<0.05);西药组、活血解毒降糖低剂量组、活血解毒降糖高剂量组动脉组织损伤较模型组减轻,主动脉组织病理积分分别为(2.35±0.08)分、(1.86±0.08)分、(1.58±0.07)分,各组主动脉组织病理积分均明显低于模型组(P均<0.05),且活血解毒降糖低剂量组、活血解毒降糖高剂量组均明显低于西药组(P均<0.05),活血解毒降糖低剂量组与活血解毒降糖高剂量组比较差异无统计学意义(P>0.05)。见图1。
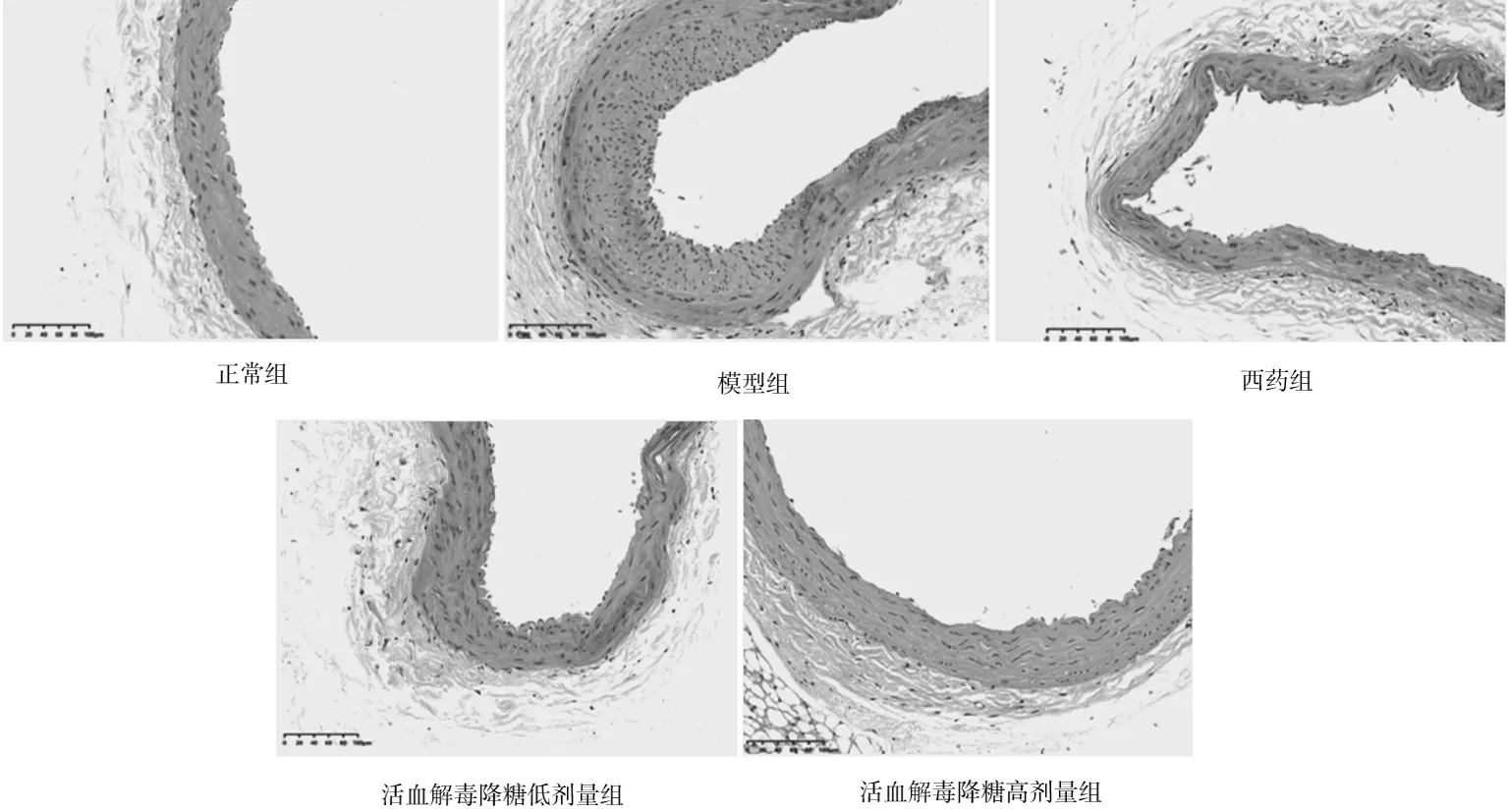
图1 正常组和糖尿病动脉粥样硬化各组大鼠主动脉组织病理学形态(HE染色,×200)
2.3各组大鼠主动脉细胞超微结构比较 正常组主动脉细胞自噬小体较少,细胞形态正常,光滑完整,细胞连接紧密,胞体内多见含量不等的内质网和线粒体等细胞器,平滑肌排列整齐;模型组主动脉细胞自噬小体明显增多,细胞外形不规则,突向腔面或脱落,细胞间连接扩大,内有多个空泡,细胞浆内充满肿胀的线粒体,呈空泡样改变,平滑肌细胞不规则;与模型组相比,西药组、活血解毒降糖低剂量组、活血解毒降糖高剂量组主动脉细胞自噬小体有所减少,超微结构损伤减轻。见图2。
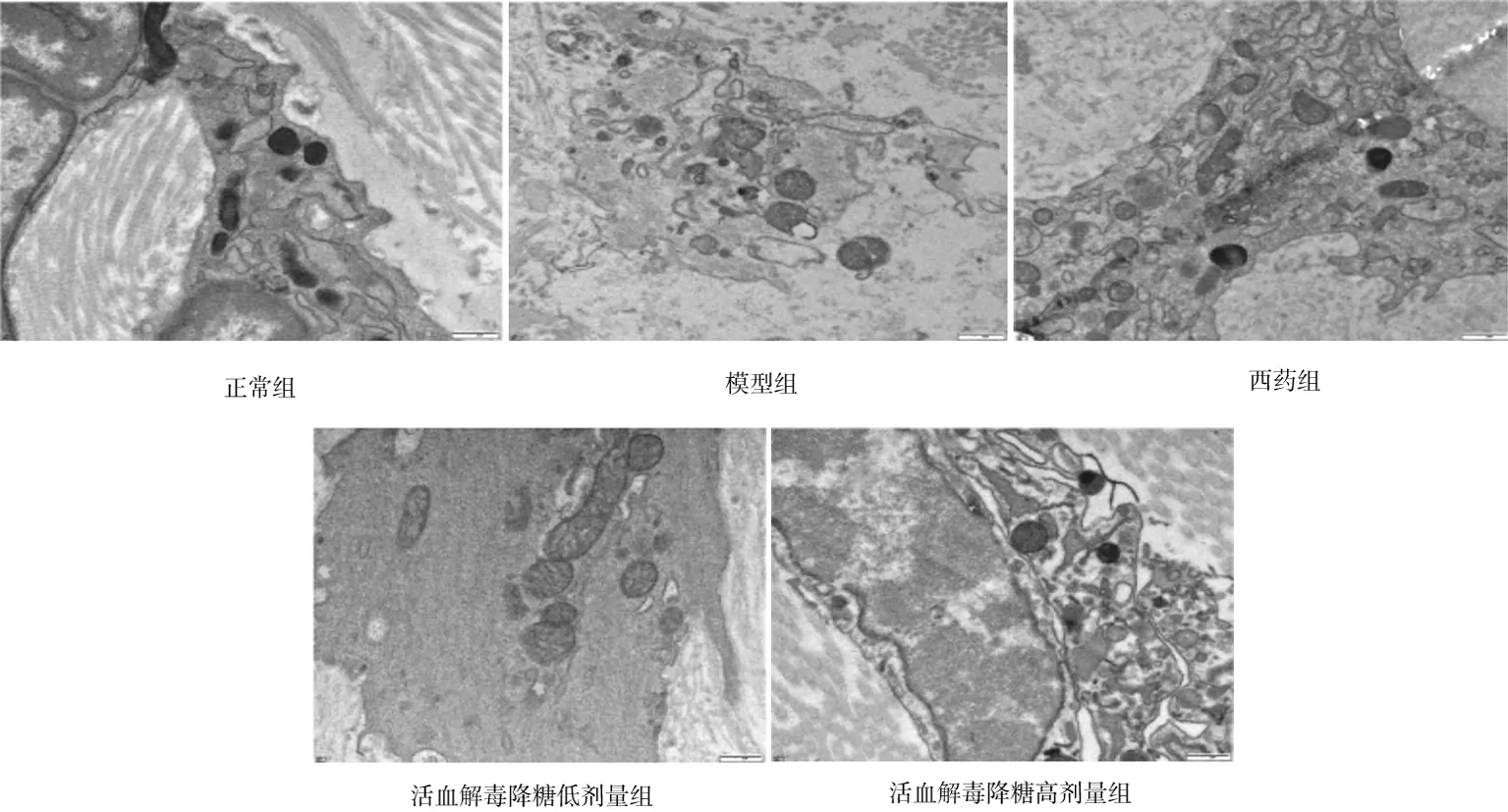
图2 正常组和糖尿病动脉粥样硬化各组大鼠主动脉细胞超微结构(×30 000,箭头所指为自噬小体)
2.4各组大鼠主动脉组织中IRE-1、TRAF2、GRP78 mRNA相对表达量比较 模型组大鼠IRE-1、TRAF2、GRP78 mRNA相对表达量均明显高于正常组(P均<0.05);各药物组大鼠IRE-1、TRAF2、GRP78 mRNA相对表达量均明显低于模型组(P均<0.05);活血解毒降糖高剂量组大鼠IRE-1、TRAF2、GRP78 mRNA相对表达量均明显低于西药组(P均<0.05),各指标与活血解毒降糖低剂量组比较差异均无统计学意义(P均>0.05)。见表3。
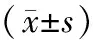
表3 正常组和糖尿病动脉粥样硬化各组大鼠主动脉组织中IRE-1、TRAF2、GRP78 mRNA相对表达量比较
2.5各组大鼠主动脉组织中Beclin1、LC3Ⅱ蛋白表达情况比较 模型组大鼠Beclin1、LC3Ⅱ蛋白相对表达量均明显高于正常组(P均<0.05);各药物组大鼠Beclin1、LC3Ⅱ蛋白相对表达量均明显低于模型组(P均<0.05);活血解毒降糖低、高剂量组大鼠LC3Ⅱ蛋白相对表达量均明显低于西药组(P均<0.05),活血解毒降糖低剂量组大鼠Beclin1、LC3Ⅱ蛋白相对表达量与活血解毒降糖高剂量组比较差异均无统计学意义(P均>0.05)。见图3及表4。
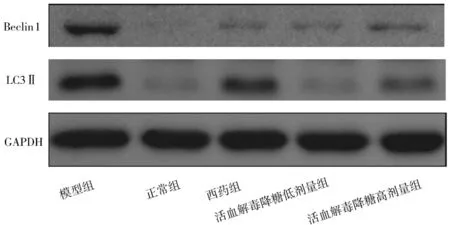
图3 正常组和糖尿病动脉粥样硬化各组大鼠主动脉组织中Beclin1、LC3Ⅱ蛋白表达电泳图
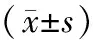
表4 正常组和糖尿病动脉粥样硬化各组大鼠主动脉组织中Beclin1、LC3Ⅱ蛋白相对表达量比较
3 讨 论
自噬是细胞利用溶酶体降解受损的细胞器及衰老的蛋白质过程,是维持细胞稳态的一条高度保守分解代谢途径[8]。内质网是细胞内负责蛋白质的翻译、折叠、修饰和转运,并维持细胞内环境稳态的细胞器,当未折叠或错误折叠蛋白在细胞内过度积累时,新的蛋白质合成将受到抑制,发生内质网应激[9]。内质网应激发生时,未折叠或错误折叠的蛋白超过内质网的处理能力,自噬就会被诱导激活,作为次级反应降解累积的蛋白质,从而减轻内质网的负荷,其中LC3Ⅱ和Beclin1是自噬相关基因表达的自噬蛋白[10-11]。正常情况下,内质网应激与自噬的适度激活形成了机体内适应性、保护性的交互作用,内质网应激激活未折叠蛋白反应,导致活化转录因子6(ATF6)、IRE-1、蛋白激酶样内质网应激酶(PERK)3个跨膜蛋白从GRP78中解离,解离后的这3个跨膜蛋白既可激活内质网应激下游的信号通路,也可激活自噬信号通路,因此PERK、IRE-1及ATF6信号通路介导的内质网应激和自噬之间发生交互效应,对细胞自噬发挥着重要的作用[12]。其中内质网应激激活IRE-1信号通路与自噬的激活密切相关,IRE-1激活后与TRAF2结合,形成IRE1α-TRAF2复合物,募集凋亡信号调控激酶l(ASK1),随后激活c-Jun 氨基末端激酶(JNK),进而磷酸化B细胞淋巴瘤/白血病-2基因(Bcl-2),促进Beclin1与Bcl-2的分离,诱发自噬反应[13]。
动脉粥样硬化主要表现为动脉内膜出现大量脂质沉积,平滑肌细胞向内膜迁移,血管壁内结缔组织增生,在内膜上有纤维斑块形成,大量脂质逐渐在斑块内沉积,伴随有泡沫细胞和结缔组织坏死,释放大量的胆固醇酯形成粥样物质,导致血管壁增厚、弹性降低、管腔狭窄,而粥样硬化斑块的破裂可导致急性心肌梗死、脑血管意外等临床事件的发生[14]。近年研究发现,适度自噬能降解细胞内受损的细胞器,减轻氧化应激、炎症反应和缺氧等因素诱导的内皮细胞凋亡和坏死,抑制动脉粥样硬化的形成和发展,但是过度自噬会导致动脉中巨噬细胞自噬性死亡增加,并分泌大量炎性因子,诱导白细胞向动脉壁渗透,同时过度自噬可导致血管平滑肌细胞和内皮细胞的死亡,使胶原纤维合成减少和斑块纤维帽变薄,降低动脉粥样硬化斑块的稳定性[15]。糖尿病是动脉粥样硬化的独立危险因素[4],糖尿病导致体内正常的糖代谢途径受损,代之以多元醇途径、蛋白激酶C(PKC)途径、己糖胺途径、晚期糖基化终末产物途径四条代谢旁路过度激活,增强了还原型辅酶Ⅱ(NADPH)的氧化活性,导致氧化应激增强,在细胞内产生过多的活性氧簇(ROS),而过量ROS会影响蛋白质的空间结构折叠,致使细胞内未折叠蛋白蓄积,诱发内质网应激[16]。另一方面,过量ROS可使低密度脂蛋白氧化,生成氧化型低密度脂蛋白(ox-LDL),由于巨噬细胞清道夫受体与ox-LDL有高度的亲和力,并且这一过程无负反馈机制,导致胆固醇酯不断聚积,进而形成泡沫细胞[17]。如果胆固醇、游离脂肪酸、晚期糖基化终末产物、同型半胱氨酸等在平滑肌细胞、单核巨噬细胞内长期过度堆积,导致未折叠蛋白反应被持续过度激活,细胞内环境长时间没有恢复稳态,内质网应激就加重自噬活性,导致细胞自噬性死亡[18-19]。
中医认为糖尿病并动脉粥样硬化病因病机演变是从发病之初阴虚燥热开始,久之气阴两虚,进而气虚失运,湿聚成痰,血停成瘀,导致瘀血与痰浊滞留脉络,而痰瘀内蕴过久可化毒,可变生各种危症(心脑血管事件)[6]。因此,气阴两虚、瘀毒内蕴成积为糖尿病动脉粥样硬化的基本病机,辨证论治应采用滋阴益气、活血化痰、解毒散结之法,正如清朝医家喻嘉言在《医门法律》所言“若知其在气则顺之,在血则行之,郁则开之,滞则逐之,火多实则或散或清之”,其中就提到了“清热散火”的治法。活血解毒降糖方中含生脉散成分(人参、麦冬、五味子)、左归丸成分(山药、地黄、山茱萸)和鳖甲煎丸成分(鳖甲、大黄、桃仁、丹皮),同时加入黄连、黄芪、丹参以增强清热燥湿解毒、益气扶正解毒和活血散瘀之功。临床研究发现,活血解毒降糖方可明显减轻糖尿病急性冠状动脉综合征患者胸闷、胸痛症状,减少心电图ST段下移导联数、T波低平导联数、T波倒置导联数,改善心脏重构,提高心功能[20-21]。
本研究结果显示,糖尿病动脉粥样硬化大鼠糖化血红蛋白和TG、LDL-C水平均明显升高,主动脉中IRE-1、TRAF2 、GRP78 mRNA和Beclin1、LC3Ⅱ蛋白表达显著上调,提示主动脉中的内质应激-自噬被激活;活血解毒降糖方干预后,糖化血红蛋白和TG、LDL-C水平降低,主动脉内膜增生明显减轻,主动脉细胞自噬小体减少,空泡样改变现象减轻,超微结构损伤少,主动脉中IRE-1、TRAF2 、GRP78 mRNA和Beclin1、LC3Ⅱ蛋白表达显著下调,提示活血解毒降糖方可改善糖尿病代谢紊乱,其可能通过抑制内质网应激-自噬的过度激活而发挥保护动脉作用。
利益冲突:所有作者均声明不存在利益冲突。

