饲养材料和保幼激素Ⅲ对门源蝠蛾幼虫生长发育的影响及通径分析
王 涛,李秀璋,陈建博,唐楚煜,梁 静,李玉玲
(青海大学畜牧兽医科学院,西宁 810016)
【研究意义】冬虫夏草是我国传统的名贵中药材,是冬虫夏草菌(Ophiocordycepssinensis)侵染蝙蝠蛾科幼虫致死后形成的幼虫尸体(菌核)与真菌子座的复合体[1]。其营养和药用价值受到消费者的普遍认可,天然冬虫夏草的需求量逐年增加,而自然条件下冬虫夏草的形成较为缓慢[2-3],供需失衡直接导致牧民对野生冬虫夏草资源的过度采挖,不仅造成部分地区出现涸泽而渔的现象,也对生态造成难以修复的破坏[4],促使冬虫夏草的人工繁育成为研究热点。其中选育发育速度快、繁殖能力强、中国被毛孢(Hirsutellasinensis)高侵染率和冬虫夏草高产出率的寄主昆虫是冬虫夏草人工抚育的关键。【前人研究进展】20世纪初,李全平等[5]采用单蛾系制种选择法,通过对100对蝙蝠蛾亲本进行交尾连续驯化4代后,得到繁殖能力强、高侵染率的昆虫品系,但在后续试验中发现子代雌雄比例失调、发育历期增加、雄性生殖力退化等现象。同期周宇爝等[6]采用类似的方法得到交配、产卵较为成功的小金蝠蛾(Hepialusxiaojinensi),但形成的冬虫夏草有效成分含量较低甚至缺失。因此,李明超[7]认为寄主昆虫的人工驯化应选择本土特有种,在当地进行多代连续饲养,逐渐完成从野生条件到实验室培育再到工厂规模化饲养的转变。青海省具有丰富的寄主昆虫资源如玉树蝠蛾(Hepialusyushuensis)、拉脊蝠蛾(Hepialuslagiensis)、门源蝠蛾(Hepialusmenyuanicus)等[8],但其中人工驯化成功的较少。门源蝠蛾是青海省特有的蝙蝠蛾品种也是冬虫夏草的优势寄主之一,早在19世纪末,王宏生等[9]尝试将野生蝙蝠蛾成虫捕捉到室内交尾产卵、孵化,并将卵的孵化率提升到90%以上。涂永勤等[10]提出温度16 ℃和70%的环境湿度最有利于幼虫的生长发育。张德利等[11]发现幼虫的取食量与幼虫的头宽、体长、体重呈线性极相关,且对胡萝卜、圆穗蓼和珠芽蓼表现出喜食性。因此,王栋[12]认为其是较适宜在青海省内人工驯化的幼虫之一,加之门源蝠蛾幼虫与冬虫夏草菌之间也表现出极高的专一性,有利于提高冬虫夏草菌的侵染率[13]。已有报道的饲养方法中,门源蝠蛾大多可以被饲养成功,但能完成继代饲养和人工驯化的几乎未见。此外,刘飞等[14]指出环境变化也会影响幼虫生长发育,逆境胁迫如干燥、高寒、高紫外会刺激JHIII的快速合成以调节幼虫的生长发育。JHIII是由昆虫咽侧体(Corpus alatum,CA)合成并分泌到血淋巴的倍半烯类活性物质,对幼虫生长发育的调控呈现两面性,低滴度时促进幼虫生长发育,高低度时抑制幼虫生长发育速率维持幼虫状态,是调控幼虫生长发育重要的激素之一,其滴度的高低是主导幼虫变态发育的关键[15-16]。而幼虫的营养状态直接决定虫体JHIII滴度的高低,幼虫进食富营养材料后通过激活Insulin/insulin-like growth factor(IIS)/Target of rapamycin complex 1(TORC1)信号通路调节JHIII滴度[17]。以上研究均表明饲养材料的不同和JHIII滴度变化会引起幼虫生长发育差异,但并未对这种差异的原因展开研究,如饲养材料的营养水平、营养物质种类差异等外在因子和昆虫体内JHIII直接影响幼虫生长发育的内在因子。【本研究切入点】饲养材料的差异可能是引起幼虫生长发育的外在因子,JHIII可能是调节幼虫生长发育的内在因子或直接因子。因此,本文设计了饲养材料和JHIII的双因素完全随机试验,探究饲养材料营养物质和JHIII对门源蝠蛾幼虫生长发育的影响,并用通径分析进一步明确饲养材料营养物质和JHIII对幼虫生长发育的直接和间接关系。【拟解决的关键问题】对门源蝠蛾幼虫生长发育的研究能为门源蝠蛾幼虫的合理、科学饲养提供科学方法,促进门源蝠蛾幼虫的大规模人工饲养,分担了消费者对冬虫夏草的需求压力,降低了野生冬虫夏草过度采挖所造成的生态破坏等。
1 材料与方法
1.1 试验材料
1.1.1 供试幼虫与饲养材料 3龄期是门源蝠蛾幼虫取食量较大、生长发育较快的时期[18],故试验幼虫为刚刚蜕皮的门源蝠蛾3龄幼虫,头宽0.82 mm,体长9.17 mm,体重15.65 mm,存活率为45.74%,JHIII含量22.67 μg/g,由青海大学青海省畜牧兽医科学院冬虫夏草研究室提供。
1.2 试验方法
1.2.1 试验设计 试验采用饲养材料×JHIII滴度双因素完全随机设计。选择青海大学畜牧兽医科学院草原所冬虫夏草研究室中常用的蝙蝠蛾幼虫饲养材料,结合陈一凯等[19]对蝙蝠蛾幼虫饲养发现的多种喜食性植物材料与青海省海北州门源回族自治县(H:3200 m,101°37′19″ E,37°22′34″ N)门源蝠蛾分布区内的优势种植被种类进行综合分析,选择4种饲养材料(J:蕨麻、H:胡萝卜、Z:珠芽蓼和D:大黄);JHIII滴度依据门源蝠蛾幼虫3龄、4龄、5龄幼虫体内的JHIII滴度设置3个水平(B1:13.32 μg/g、B2:16.56 μg/g和B3:22.76 μg/g);共设JB1、JB2、JB3、HB1、HB2、HB3、ZB1、ZB2、ZB3、DB1、DB2、DB312个处理,3次重复。将J、H、Z和D切割成约3 cm×3 cm的小块放入发酵椰糠粉中,饲养基质和饲养材料(2∶1)配置,虫口密度为200头/(kg·m2),温度16 ℃,基质湿度 60%[20],每组处理饲养50头,放置于50 cm×50 cm的长方形凹槽内(高度15 cm),发酵椰糠粉0.17 kg,饲养材料0.08 kg,室内堆叠饲养50 d。
1.2.2 幼虫生长发育指标测定 将幼虫放在指缝中,用游标卡尺轻轻卡住头壳和体长,记录头宽和体长。将幼虫放在万分之一天平上,待读数稳定后记录体重[21]。幼虫存活率=存活幼虫数量/总饲养幼虫数量。
1.2.3 饲养材料营养指标的选择及测定 营养指标的选择:建立在本研究室已有研究基础上并结合李文佳等[22]研究成果选择饲养材料的粗蛋白(Crude protein,CP)、粗纤维(Crude fiber,CF)、可溶性糖(Soluble sugar,SS)、粗灰分(Crude ash,Ash)、水分含量(H2O)、碳水水合物含量(Carbohydrate,CHO)作为主要测定营养成分。
测定方法:粗蛋白测定参照考马斯亮蓝法[23];粗纤维测定参照蒽酮-硫酸法[23];水含量测定参照干燥法[24];可溶性糖测定参照3,5-二硝基水杨酸比色法[25];粗灰分测定参照干灰化法[26];碳水化合物=100-(粗脂肪含量+粗蛋白含量+粗灰分含量+水分含量),式中,粗蛋白质、粗脂肪、碳水化合物的含量均为100 g鲜样中的含量[27]。
1.2.4 JHIII滴度测定 幼虫处理:随机取5头幼虫,清洗干净用滤纸吸去幼虫体表水分阴干后测量并记录头宽、体长和体重,切取咽侧体置于研钵中加入适量液氮研磨,研碎后置于15 mL离心管中后充分研磨,加入10 mL正己烷匀浆。超声波破碎仪间隔5 s破碎60 s,冷却后8000 r/min离心10 min,弃去下层幼虫残渣取上清液,用2 mL针管2 μm滤膜过滤送入样品瓶待检。
色谱条件:250.0 mm×4.6 mm RestekTC-C18柱,粒径5 μm或等效色谱柱;流动相为v(色谱甲醇)∶v(水)=68∶32,流速1 mL/min,紫外检测λ= 218 nm,进样量10 μL,以峰面积定量[28],计算1头幼虫JHIII滴度(图1)。
标准曲线建立:吸取JHIII标品10 μg加入1 mL色谱甲醇配置成10 μg/mL的JHIII标准溶液,吸取200 μL上标准溶液加入200 μL甲醇配置成5 μg/mL的标准溶液,依次配置出2.5、2.0、1.0、0.5、0.1、0.01 μg/mL的标准溶液,采用高效液相法测定并拟合曲线为Y= 30 826X+ 2831.67(R2=0.99,Y为峰面积,X为JHIII滴度),外标法定量,保留时间在2.37 min左右。
1.3 数据分析
采用Excel 2019进行原始数据的录入及图表制作,采用SPSS 23.0进行双因素方差分析,Duncan法对4种饲养材料的CP、CF、SS、Ash、H2O、 CHO含量和JHIII滴度、头宽、体长、体重、存活率进行多重比较(P<0.05),随后进行营养指标和生长发育、JHIII与生长发育的Person相关性分析,最后进行营养物质和JHIII对幼虫生长发育的多元回归和通径分析。

图1 JHIII标品(10 μg/mL)经RP-HPLC测定色谱图
2 结果与分析
2.1 饲养材料和JHIII及其互作对幼虫生长发育的影响
在同一饲养材料下,随着JHIII滴度升高,幼虫的头宽、体长和体重都呈降低趋势,幼虫存活率逐渐升高;同一JHIII滴度下,饲养材料也显著影响幼虫的生长发育。由表1可知,头宽生长表现为J>Z>D>H(P<0.05),体长表现为Z>J>D>H(P<0.05),体重表现为D>Z>J>H(P<0.05),存活率表现为Z>H>J>D(P<0.05);因此每一种饲养材料对幼虫生长发育的影响各有差异,这可能与饲养材料为幼虫提供的营养物质种类和含量有关。
方差分析发现,饲养材料和JHIII均对幼虫的头宽、体长、体重、存活率均有极显著影响(P<0.01),对头宽和体重具有极显著的互作效应影响(P<0.01),对体长和存活率具有显著互作效应(P<0.05),且JHIII对幼虫生长发育的影响较饲养材料更大(表2)。
2.2 饲养材料的营养物质分析
不同的饲养材料,Z具有最高的CF、SS、Ash和H2O,J具有最高的CP含量,D具有最高的CHO含量,H具有最高的H2O含量(表3),表明4种饲养材料的6种营养物质含量不同,而不同饲养材料饲养幼虫后其生长发育出现较大差异可能与饲养材料的营养物质含量差异有关。
2.3 营养物质和JHIII与幼虫生长发育的相关性分析
2.3.1 营养物质与幼虫生长发育的相关性分析 CP与头宽、体长、体重均呈极显著正相关,按相关关系大小依次为头宽>体重>体长>存活率(表4);CF与头宽、体长、体重呈显著正相关, 按相关关系大小依次为体长>头宽>体重=存活率;SS与头宽、体长、体重呈显著正相关,按相关关系大小依次为体重>头宽=存活率>体长;Ash与头宽、体长、体重呈显著正相关,按相关关系大小依次为头宽>存活率>体重>体长;H2O 仅与存活率呈显著正相关;CHO与头宽、体长、体重呈显著正相关,按相关关系大小依次为体重>存活率>头宽>体长。因此,CP、Ash对头宽的促进作用更大,CF对体长的促进作用更大,SS、CHO对体重的促进作用更大,H2O对存活率的促进作用更大。表明,不同营养物质对幼虫生长发育的作用强度和效果不同,进而引起幼虫生长发育差异。
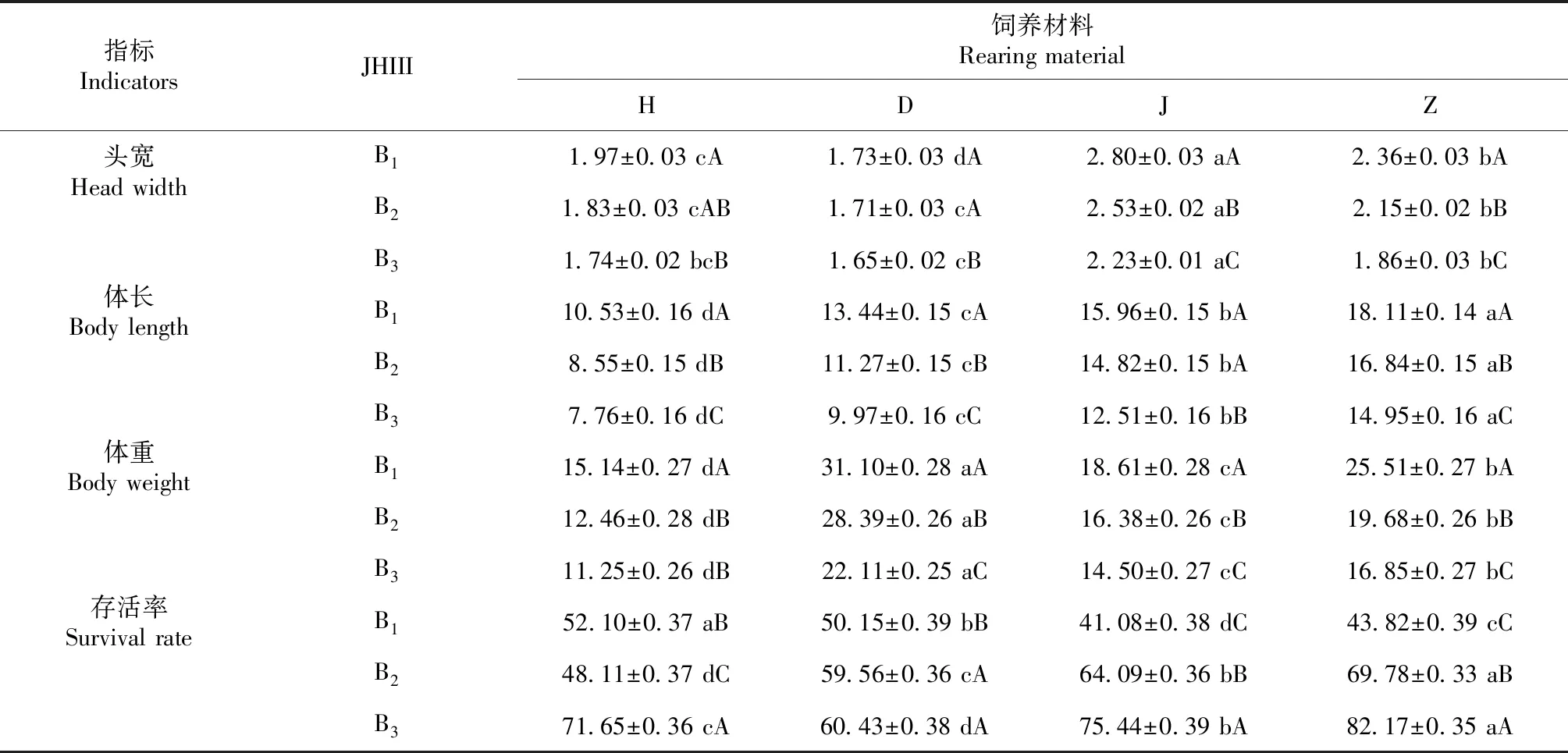
表1 不同处理对幼虫生长发育的影响

表2 不同处理对幼虫生长发育的方差分析(F值)

表3 饲养材料的6种营养物质差异

表4 营养物质与幼虫生长发育的相关性
2.3.2 JHIII与幼虫生长发育的相关性分析 JHIII与头宽、体长、体重均呈显著负相关,与存活率呈极显著正相关,按相关关系大小依次为存活率>头宽>体长>体重(表5)。因此,JHIII对幼虫存活率的促进作用最大,对头宽、体长、体重的抑制作用次之。
2.4 营养物质和JHIII对幼虫生长发育的多元线性回归和通径分析
2.4.1 头宽 通过回归分析得到幼虫头宽生长发育的最优方程为y=72.46-7.02JHIII+30.3CP+7.65CF+3.28SS+14.16Ash-7.39CHO(r2=0.56),促进头壳生长的因子依次为:CP>Ash>CF>SS,JHIII和CHO对头宽影响也较大但呈抑制作用(表6)。
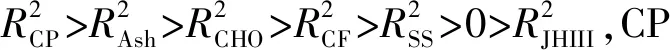

表5 JHIII与幼虫生长发育的相关性

表6 幼虫头宽的多元线性回归(已去除不显著变量H2O)

表7 头宽与影响因子的通径分析
2.4.2 体长 通过回归分析得到幼虫体长生长发育的最优方程为y=226.64-20.59JHIII+24.1CP+16.56CF+6.21SS+15.63Ash-7.04CHO(r2=0.75),其中,JHIII对体长的影响最大且呈抑制作用,促进体长生长的因子依次为:CP>CF>Ash>SS(表8)。

2.4.3 体重 通过回归分析得到幼虫体重生长发育的最优方程为y=368.87-12.28JHIII+10.62CP+9.93CF+14.96SS+7.57Ash+4.18H2O-7.94CHO(r2=0.86),其中,SS对体重促进作用最大,JHIII对体重的抑制作用最大(表10)。

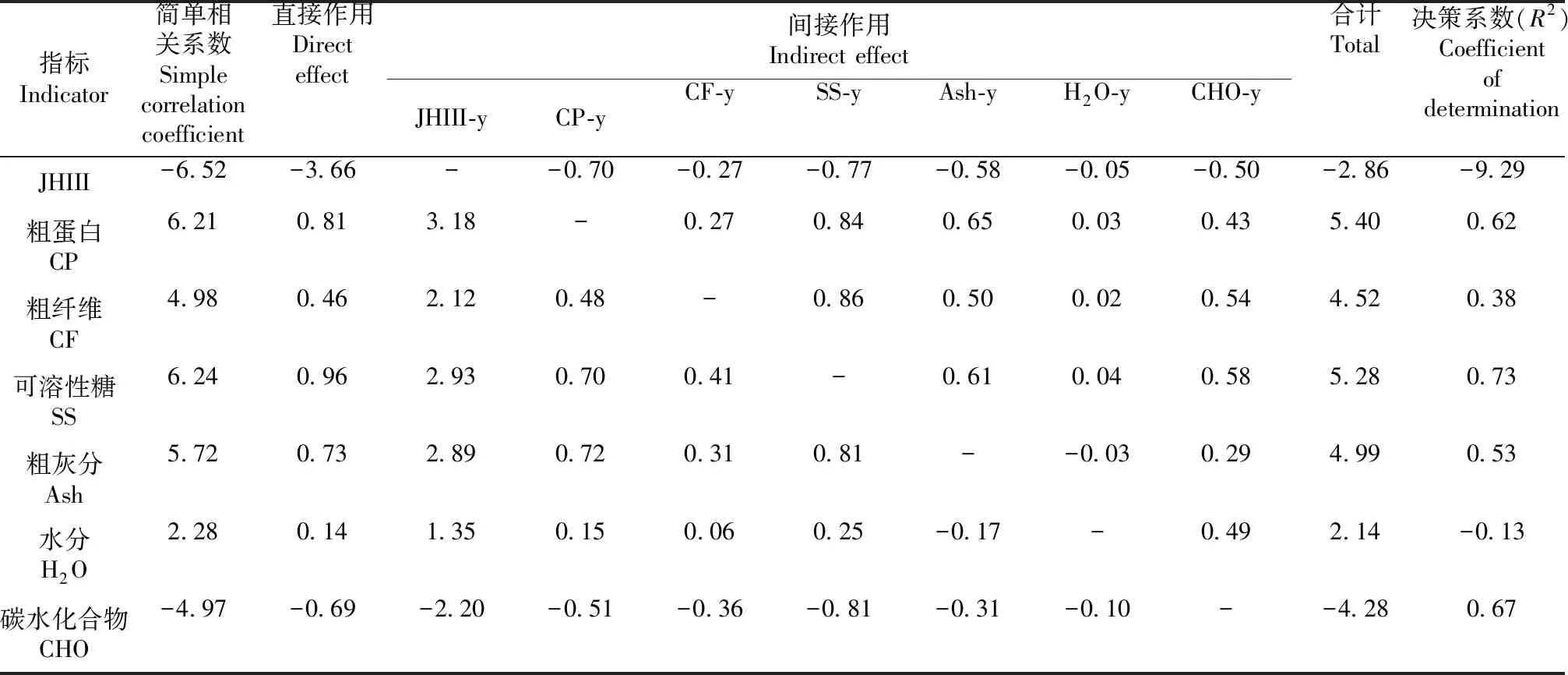
表11 体重与影响因子的通径分析
2.4.4 存活率 通过回归分析得到幼虫存活率生长发育的最优方程为y=650.24+84.46JHIII-8.32CP-7.17CF-18.61SS-13.07Ash+9.4H2O-11.25CHO(r2=0.91),其中,JHIII对存活率促进作用最大,Ash对存活率的抑制作用最大(表12)。

3 讨 论
昆虫与寄主植物的关系一直是学者们研究的热点问题,传统观点认为植物是昆虫进行生命活动所需营养的重要来源[29]。虽然有些幼虫属杂食性,也以土壤腐殖质为食,如:蝙蝠蛾属幼虫,但这种取食方式对幼虫的生长发育是不利的,幼虫长期取食腐殖质,导致幼虫体内氨基酸水平降低,抑制幼虫的生长发育[30]。因此,饲养材料的选择对门源蝠蛾人工驯化至关重要,适宜的饲养材料可以促进幼虫的生长发育,促进其存活。本研究发现蕨麻对头宽的促进作用最强,珠芽蓼对体长和存活率的促进作用最强,大黄对体重的促进作用最大。宫玉艳等[31]使用不同饲养材料饲养南美斑潜蝇(Liriomyzahuidobrenisis),发现甘蓝(Brassicaoleracea)组幼虫存活率低,发育历期长,西葫芦(Cucurbitapepo)和菜豆(Phaseolusvulgaris)组幼虫发育快,存活率高。在褐背小萤叶甲(Galerucellagrisecens)、虎凤蝶(Luehdorfiachinensis)、豆野螟(MarucatestulalisGeyer)、安婀珍蝶(Actinoteanteas)上都有类似的现象,使用不同的饲养材料后,幼虫或成虫均在产卵量、生长发育、化蛹出现较大差异甚至幼虫期致死等[32-35],遗憾的是学者虽然猜测幼虫的这种变化可能与饲养材料的营养物质有关,但并未对这种现象进行深入分析并给出合理的解释。陈一凯[19]提出对幼虫不同材料饲养后存活率的变化可能是饲养材料含水量较低,饲养基质的湿度也较低,二者互作加剧了幼虫死亡。同时本研究也发现胡萝卜饲养组幼虫存活率较高,分析其营养物质水平仅在水分含量上表现较优,这可能是其较高的水分含量改善了饲养基质的湿度,保持幼虫生长所需的环境湿度。这也为本文结论“饲养基质和饲养材料对幼虫存活率有较大影响且存在互作效应”提供了支持。此外,本文发现饲养材料通过其所富含的营养物质水平对幼虫生长发育产生不同影响。
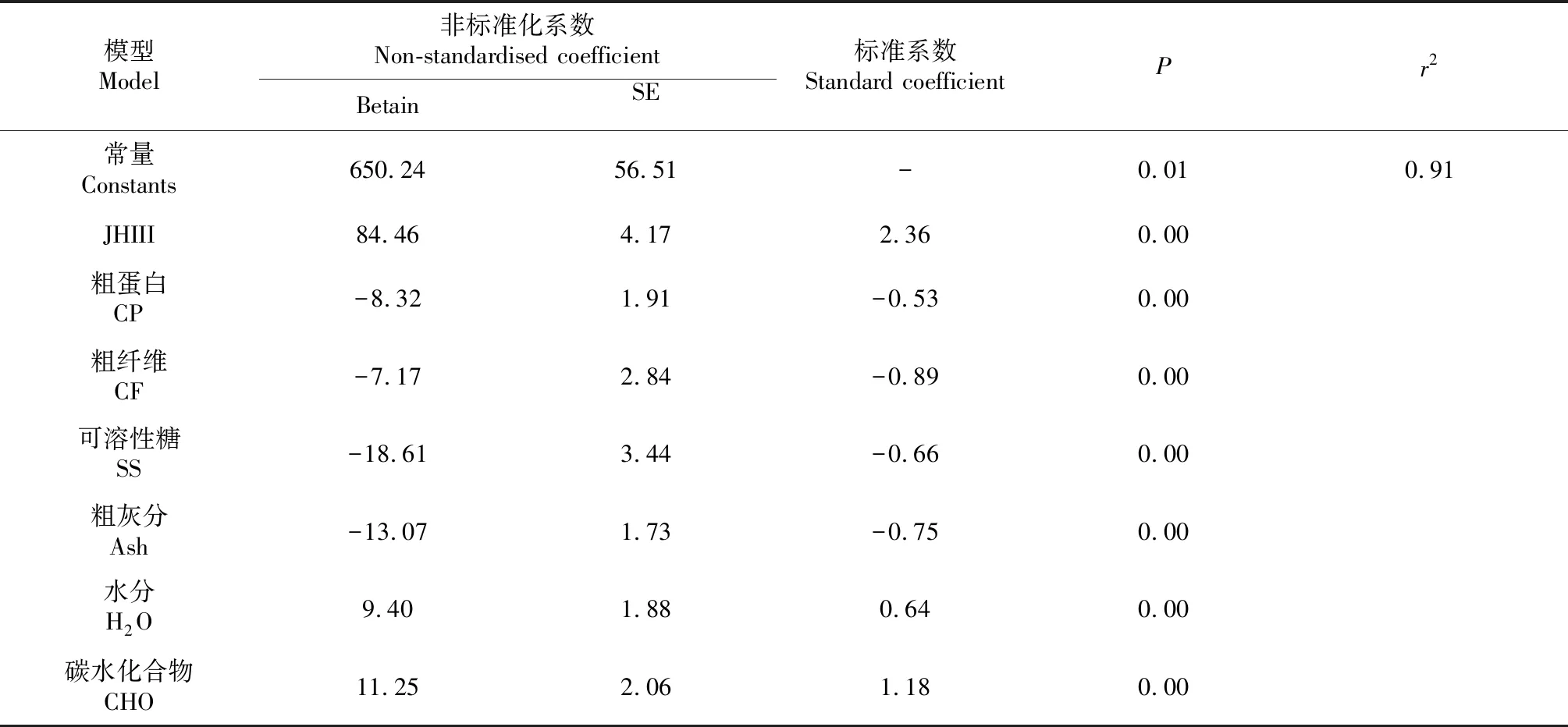
表12 幼虫存活率的多元线性回归

表13 存活率与影响因子的通径分析
昆虫的变态发育主要取决于幼虫的营养状态,而饲养材料的营养物质决定了幼虫营养状态[36-37]。幼虫进食富营养材料后促进体内氨基酸、糖原、脂肪等的合成,且多为必需氨基酸,幼虫生长发育加快,龄期跨越所需时间较短,但当幼虫持续采食富营养植物材料也会导致虫体营养物质过剩,幼虫生长发育过快出现蜕皮障碍现象[38]。近年来,关于营养物质影响幼虫生长发育报道较多,如:类黄酮含量高的寄主植物会提高美国白蛾(Hyphantriacunea)幼虫对食物的利用率、转化率和近似消化率,加快幼虫的生长进程[39]。可溶性糖高的饲养材料降低蝙蝠蛾幼虫的发育历期,但李文佳等[40]推论这可能与糖是昆虫的诱食剂有关,在一定范围内,适当的糖分含量可以增加昆虫的取食量,而刺激昆虫的取食反应需要一定量蔗糖与氨基酸的参与,这也与本试验结果“可溶性糖通过抑制JHIII滴度促进幼虫的体重发育”具有相似之处。基于本文研究,笔者发现门源蝠蛾幼虫也存在类似现象,即幼虫饲喂不同的饲养材料后生长发育不一致,试验结果表明饲养材料营养物质含量的差异先引起幼虫体内JHIII的变化进而引起幼虫生长发育的变化。对饲养材料的营养物质分析发现4种饲养材料所含的粗蛋白、粗纤维、可溶性糖、粗灰分、水分和碳水化合含量差异较大,结合通径分析发现营养物质的差异是导致幼虫生长发育不一致的外在原因,JHIII是引起幼虫生长发育变化的内在原因,且营养物质种类对JHIII的影响也不同。粗蛋白、可溶性糖抑制JHIII滴度,粗灰分促进JHIII滴度,这也解释了不同饲养材料对幼虫生长发育的影响不同,是由于其所富含的营养物质差异引起,也表明当幼虫长期处于富营养状态下,其自身会通过对JHIII滴度的调节维持正常的生长发育速率,但这种调节能力是否存在阈值仍需要继续探讨[41],且Meritxell等[42]在20世纪初就提出在鳞翅目幼虫生长发育和龄期转化间,幼虫对营养物质的重分配是昆虫生存策略的重要组成部分,侧面验证了本试验结果。基于此,本研究认为JHIII是调节幼虫营养信息和生长发育转导系统的一部分。
此外,JHIII还是幼虫体内的一种抗胁迫激素,高寒、缺氧、极低气温、食物竞争等多种胁迫因素促使幼虫大量合成JHIII[43]。如热应激导致雌性果蝇(Drosophilid)JHIII和多巴胺水平升高,紫外胁迫提高了棉铃虫(Helicoverpaarmigera)体内JHIII滴度[44-45],抵抗不良环境的同时也提高了虫体JHIII滴度、抑制了幼虫的生长发育。因此,在蝙蝠蛾幼虫的人工饲养过程中,应保证饲养环境的稳定以维持幼虫正常的生长发育。
4 结 论
JHIII是幼虫生长发育的直接影响因子,饲养材料的营养物质是间接因子并通过影响JHIII滴度的变化来影响幼虫的生长发育。饲养材料的营养物质通过影响虫体JHIII滴度导致幼虫生长发育不一致,其中CP、SS、Ash通过抑制JHIII滴度分别促进幼虫头宽和体长生长、促进体重发育、降低幼虫存活率。

