日本医蛭摄食前后不同组织中水蛭素基因(hirudin)的时空表达模式
石 萍,游华建,邓小书,陈仕江,鲁增辉
(1.重庆市中药研究院,重庆 400065;2.重庆中医药学院,重庆 402760;3.中国中医科学院中药资源中心重庆分中心,重庆 400065)
【研究意义】水蛭始载于《神农本草经》,作为活血化瘀类药材的代表,具有破血通经、逐淤消癥的功效[1]。现代药理及临床研究表明,水蛭药材在治疗动脉粥样硬化[2]、高脂血症[3]、抗血栓[4]、抗肿瘤[5]等方面具有较好的疗效。日本医蛭(HirudonipponiaWhitman),别名水蛭、稻田医蛭,隶属于环节动物门蛭纲医蛭科医蛭属[6],是《中国药典》(2020年版本)收载的唯一摄食动物血液的水蛭药材种类[1],其体内含有世界上最强的天然凝血酶抑制剂——水蛭素,因此具有极高的抗凝血酶活性和抗血小板聚集作用[7]。临床上,水蛭素多用于治疗弥漫性血管内凝血、不稳定性心绞痛、急性心肌梗死和连续性肾脏替代治疗[8]。研究发现,水蛭不同部位的抗凝活性存在较大差异,而且摄食行为对水蛭的抗凝活性也有一定影响,这一现象与水蛭素的时空分布必然有一定的联系,但相关文献资料还十分欠缺。为此,重庆市中药研究院药用动物课题组研究水蛭素hirudin基因的时空表达模式,对于阐明水蛭抗凝活性差异的机理、合理采收水蛭药材和药用部位的充分利用均有重要的理论和实践意义。【前人研究进展】近年来,由于生存环境的破坏、人为过度捕捞、自身繁殖率低下等因素的影响,野生水蛭资源数量锐减[9-11],已远远不能满足药企及人民群众的用药需求。天然水蛭素是由65~66个氨基酸残基组成的、无糖基化的小分子酸性单链多肽,来源非常有限[12-14]。有学者致力于通过基因工程途径获取水蛭素,以期摆脱自然资源的限制,进而实现水蛭药材的现代化利用[7,15-16]。另有学者研究不同品种、不同部位、不同采收加工方式对水蛭抗凝活性的影响,以期提高水蛭药材的抗凝活性。研究表明,不同种类水蛭的抗凝活性存在较大差异,其中日本医蛭、菲牛蛭等吸血蛭类的抗凝活性显著高于宽体金线蛭等非吸血蛭类[17-18]。水蛭不同部位的抗凝活性有显著差异,其头部的活性远远大于尾部[19]。不同采收及加工方法对金边蚂蟥的抗凝血酶活性有显著影响,超低温冷冻干燥方法加工后的抗凝活性高于晒干方法[20];超低温冻干的水蛭抗凝活性高于晒干和鲜品[21]。究其原因可能是水蛭素受高温影响会严重失活[22]。蚂蟥唾液腺在摄食后各阶段的抗凝活性均显著高于其他组织,摄食行为和食物均可诱导唾液腺和消化道分泌抗凝活性物质[23]。传统认为,水蛭素主要来源于水蛭头部的唾液腺,而躯体内含有的是伪水蛭素[24]。实践证明,水蛭除了头部具有较强的抗凝活性外,躯体也具有较强的抗凝活性。因此有必要研究除唾液腺以外的组织是否也能表达水蛭素基因,摄食行为是否影响唾液腺及其他组织中的水蛭素基因表达。【本研究切入点】目前,关于水蛭素基因表达模式的研究报道极其匮乏,尤其是在抗凝血活性极高的日本医蛭中水蛭素基因的时空表达相关研究尚未见报道,因此本研究基于前期唾液腺转录组筛选数据及克隆得到的日本医蛭水蛭素基因全长序列[25],对日本医蛭在不同摄食阶段、不同组织中的水蛭素基因(hirudin)时空表达规律进行了研究。【拟解决的关键问题】采用实时荧光定量PCR的方法对日本医蛭摄食前后不同阶段、各种组织中水蛭素基因的表达模式进行分析,为日本医蛭抗凝机制的研究提供基础资料,同时为水蛭药材的科学采收加工利用提供理论依据。
1 材料与方法
1.1 试验材料及仪器
本研究所用水蛭(同一居群、月龄一致)均来源于重庆市中药研究院水蛭养殖基地。经重庆市中药研究院陈仕江研究员鉴定为日本医蛭(H.nipponia)。
试验试剂有RNA提取试剂盒TRIzol Reagent(Invitrogen),RT-PCR(反转录)试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time) (TaKaRa) ,荧光定量PCR试剂Luna®Universal qPCR Master Mix (NEB)。
试验仪器有RNA浓度测定仪 Nanodrop分光光度计(Thermo),荧光定量PCR仪BIO-RAD CFX ConnectTM。
1.2 试验方法
1.2.1 试验设计及取样 将200尾健康无病、表面无伤痕、个体大小相近的日本医蛭,单独饲养在5 L的养殖网箱中。饥饿处理30 d后投喂新鲜健康猪血,观察日本医蛭的摄食情况,分别用摄食前(Before feeding,BF)、摄食中(During feeding,DF)、摄食后(After feeding,AF)表示,以摄食新鲜猪血为开始时间,此后24 h为第1天,以此类推第48、72、168、192 h代表摄食后第2、3、7、8天,分别用序号D1、D2、D3、D7、D8表示。以上每组取5~10条日本医蛭(重复3次)于冰上解剖,分别取唾液腺(SG)、嗉囊(C)、精/卵巢(G)、肠(I)、皮肤(S)样品。取样后样品迅速用液氮冻存,随后转入-20 ℃冰箱备用。
1.2.2 总RNA提取及cDNA合成 将不同摄食阶段(BF、DF、D1、D2、D3、D7、D8)各组织(SG、C、G、I、S)的共计35个样品,分别放置于研钵中加入液氮充分研磨,采用TRIzol试剂盒提取各样品的总RNA。用1.5%琼脂糖凝胶电泳及RNA浓度测定仪来检测RNA提取质量。总RNA经RT-PCR(反转录)试剂盒得到各样品的cDNA。
1.2.3 引物设计与合成 根据课题组前期克隆得到水蛭素基因hirudin的mRNA全长序列(GenBank登录号:MN116511)设计荧光定量PCR引物。选取内参基因α-tubulin(GenBank登录号:U67677.1)。引物设计采用软件Primer Premier 5进行,引物由生工生物工程(上海)有限公司合成,引物序列特征见表1。
1.2.4 水蛭素基因(hirudin)及内参基因α-tubulin的PCR扩增 以待测cDNA样品为模板,使用表1中的引物扩增内参基因α-tubulin和目的基因hirudin。PCR扩增体系为:cDNA(20 ng/μL)3 μL,TaKaRa LATaq(5 U/μL)0.5 μL,10×LATaqBuffer Ⅱ(Mg2+Plus)5 μL,2.5 mmol/L dNTP Mixture 8 μL,上下游引物各2 μL,双蒸水补至50 μL。PCR反应程序:94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。PCR产物用1.5%琼脂糖凝胶电泳检测。目的条带切胶回收纯化后送上海生工测序。
1.2.5 荧光定量PCR检测 所有cDNA样品分别用水蛭素基因hirudin及内参基因α-tubulin进行荧光定量PCR,每个样品3次重复。PCR反应体系:cDNA 1.5 μL,Luna®Universal qPCR Master Mix 10 μL,Primer F 0.5 μL,Primer R 0.5 μL,Nuclease-free water 7.5 μL。反应条件:95 ℃ 3 min;95 ℃ 10 s,55 ℃ 20 s,72 ℃ 20 s,40个循环。溶解曲线检测条件为65 ℃ 1 min,95 ℃ 1 min,然后以0.5 ℃/s的速度提高到95 ℃,连续检测荧光信号。采用2-△△Ct方法分析荧光定量结果。
1.3 数据处理
试验结果采用SPSS 18.0软件进行统计,用单因素方差分析(One-way ANOVA)方法分析,显著水平为P<0.05,数据以平均值±标准差表示。
2 结果与分析
2.1 水蛭素基因(hirudin)及内参基因α-tubulin的PCR扩增结果
所有cDNA样品及引物在荧光定量上机检测前均会进行预实验,以验证内参基因α-tubulin和目的基因hirudin引物的特异性及cDNA模板质量。结果显示,目的条带特异单一,内参基因111 bp(图1-A),目的基因138 bp(图1-B),大小符合预期。以上结果表明内参基因α-tubulin及目的基因hirudin引物的特异性良好,且cDNA模板质量满足后续试验要求。
2.2 水蛭素基因(hirudin)的时空表达结果
通过对水蛭素基因hirudin(图2-A、2-C)和内参基因α-tubulin(图2-B、2-D)的熔解曲线、扩增曲线进行分析,结果显示各基因的熔解曲线均有良好的特异性,表现为无非特异性荧光峰的单峰(图2-A、2-B);扩增曲线也显示引物扩增效率良好(图2-C、2-D)。
2.2.1 在不同组织中的表达 由图3可见,水蛭素基因(hirudin)在各组织(唾液腺、嗉囊、精/卵巢、肠和皮肤)中均有表达,其中在唾液腺中的表达量极高,与其他组织中的表达量呈显著性差异(P<0.05);水蛭素基因(hirudin)在嗉囊、肠、精/卵巢组织中也有较高的表达量,在皮肤中的表达量次之。
2.2.2 在不同摄食阶段的表达 摄食前后不同阶段唾液腺中hirudin表达量的检测结果(图3)发现,摄食后第2天(D2)的表达量最高,与其他阶段的表达量呈显著性差异(P<0.05);嗉囊中的表达量在摄食后第1天(D1)较高,摄食后第7天(D7)、第8天(D8)表达量呈显著性下降(P<0.05);肠中的表达量在摄食后第2天(D2)最高,后随着停食时间的延长,表达量呈显著下降趋势(P<0.05);皮肤组织中的表达量随着停食时间的延长呈先升后降趋势,最高峰出现在摄食后第2天(D2)(P<0.05);精/卵巢在摄食阶段(DF)的表达量最高,与其他阶段的表达量呈显著差异(P<0.05)。

表1 试验所用引物序列
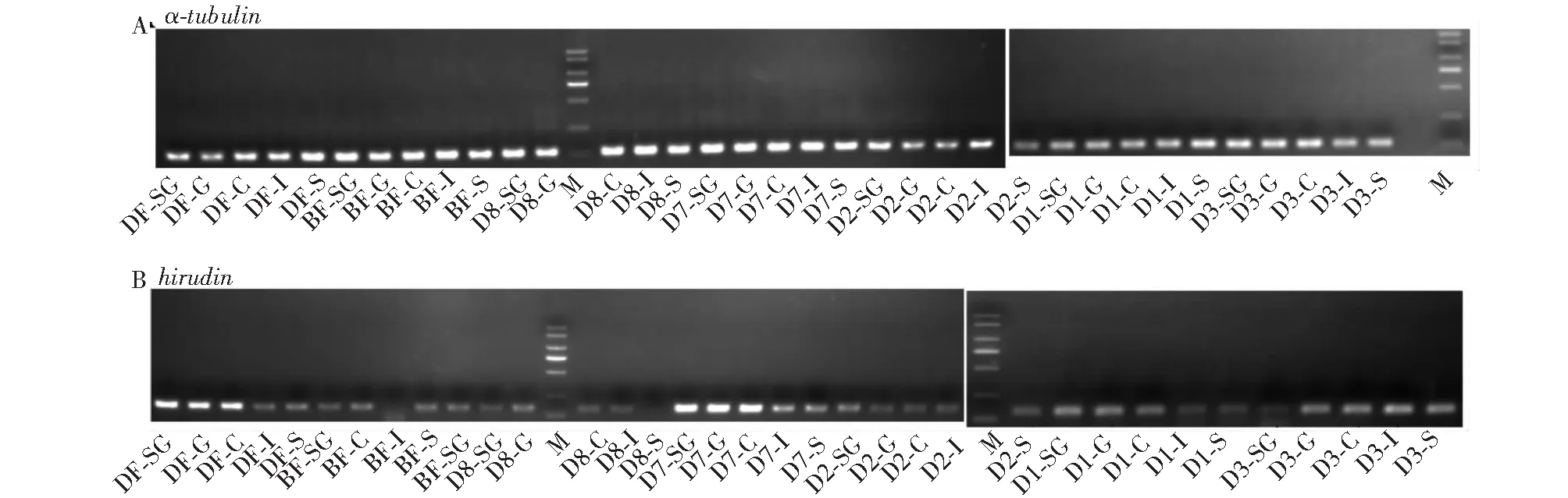
M.Marker DL 2000;以“摄食阶段-组织”命名各样品,如DF-SG、DF-G、DF-C、DF-I、DF-S分别为摄食中唾液腺、精卵巢、嗉囊、肠、皮肤组织样品;以此类推,“BF-”为摄食前各组织样品;“D1-, D2-, D3-, D7-, D8-”分别为摄食后第1、2、3、7和8天各组织样品。
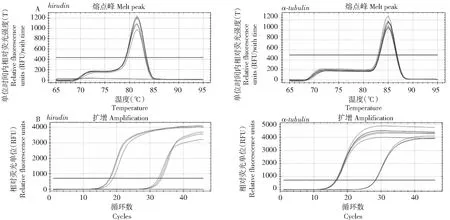
图2 水蛭素基因hirudin和内参基因α-tubulin的熔解曲线及扩增曲线
3 讨 论
水蛭是我国经典的活血化瘀类药材,传统研究认为水蛭素主要来源于水蛭头部的唾液腺,其他器官或组织如肠、嗉囊、性腺等不会分泌水蛭素;摄食行为及食物刺激会影响水蛭的抗凝活性。本研究中,目的基因扩增结果及荧光定量结果一致显示,除唾液腺以外,日本医蛭的肠、皮肤、嗉囊、精/卵巢中均有水蛭素基因(hirudin)表达,尤其唾液腺中水蛭素基因hirudin的表达量显著高于其他组织。证明日本医蛭除唾液腺这一主要分泌器官外,其他组织也极有可能分泌水蛭素,是水蛭药材高效抗凝活性的重要物质基础。

不同小写字母表示同一时间不同组织的表达差异显著,不同大写字母表示同一组织不同时间的表达差异显著(P<0.05)。
自然界中由于环境及季节等因素的影响,存在食物分布不均的现象,导致蛭类动物遭受饥饿胁迫[26-27],因此研究水蛭在饥饿胁迫下的行为、形态和生理反应过程及特点,从而揭示水蛭适应饥饿胁迫的机理机制,对水蛭养殖及水蛭药材药用价值的挖掘等均具有重要的现实意义。本研究中,日本医蛭唾液腺在摄食期间(DF)的水蛭素基因(hirudin)表达量高于饥饿条件下(摄食前,BF),摄食后第2天(D2)又显著升高,之后随着摄食时间的延长而呈下降趋势。究其原因,一方面是饥饿胁迫有可能激活日本医蛭体内的一系列免疫反应,唾液腺的水蛭素基因(hirudin)表达水平发生显著变化[28];另一方面,取食行为诱导唾液腺的腺体分泌[29],摄食期间和摄食后短期内,唾液腺通过合成大量的抗凝剂、舒张血管物质及麻醉剂等蛋白类活性物质,确保顺利取食及摄食血液的长期储存[30-31]。随着摄食行为的结束,唾液腺分泌水蛭素的作用日趋减弱,因此水蛭素基因表达总体呈下降趋势。当日本医蛭长期未摄食,处于饥饿胁迫的唾液腺中hirudin基因表达量下调,恢复喂食后,hirudin基因很快显著上调。
水蛭的消化道主要由口、食管、嗉囊、肠道和肛门组成[6]。水蛭在摄食血液后储存在嗉囊中,经过最佳的投喂时间(2~5 d)[32],通过肠道组织消化吸收后排出体外[6]。肠道中具有大量黏膜组织,向上突起形成褶皱状结缔组织,增加了血液与肠道的接触面积,同时肠道褶皱还能延长血液与肠道的接触时间,从而加快水蛭消化吸收速率[33]。该储存和消化过程与本研究水蛭素在嗉囊和肠道中的表达模式高度吻合,即日本医蛭嗉囊和肠中的水蛭素基因(hirudin)表达量分别在摄食后第1天(D1)和第2天(D2)达到最高值,之后在摄食后第7天(D7)、第8天(D8)呈显著下降趋势。证明摄食后的新鲜血液对嗉囊和消化道的刺激导致水蛭素大量分泌[23],随着摄食时间延长,消化道刺激减弱,水蛭素表达量呈减少趋势。
水生动物口咽部均含有丰富的粘液细胞,不仅可以粘着水中浮游生物,还可以减少吞咽食物的摩擦力对口腔咽部的损伤,具有一定抑菌作用[34]。水蛭的消化道组织细胞中存在大量的粘液细胞,可以将某些营养物质吸收到肌肉组织或排泄到身体外[35]。本研究在日本医蛭皮肤组织中检测到水蛭素基因(hirudin)的表达,推测水蛭在吸食血液后刺激消化道分泌水蛭素,可能通过粘液细胞吸收到皮肤组织中。
水蛭属于雌雄同体动物,一般在越冬结束后,精卵细胞同步成熟[36]。研究表明,养殖水体温度是影响水蛭性腺发育的主要因素[37]。抗凝活性等相关物质在水蛭性腺组织中的分泌表达研究极其匮乏。本研究发现,在日本医蛭的精/卵巢中检测到水蛭素基因(hirudin)表达,该基因在摄食中(DF)阶段表达量显著升高,其他阶段无显著性差异,类似报道仅有1例[38],具体原因不明,尚需要进一步研究和验证。
本研究结果显示,水蛭素基因(hirudin)表达具有组织特异性,在唾液腺中存在优势表达,同时在饥饿胁迫下也有表达量的差异变化,说明水蛭素基因(hirudin)参与了水蛭的生长发育进程及在饥饿胁迫下的积极响应。后续将进一步围绕水蛭素这一关键抗凝活性成分,在蛋白水平上探讨其含量与水蛭药材之间的关系。
4 结 论
基于荧光定量方法首次证明,日本医蛭除唾液腺以外的组织,如肠、嗉囊、精/卵巢、皮肤等也能大量表达水蛭素基因hirudin,且随着摄食时间推移,水蛭素基因呈现不同的时空表达模式。水蛭摄食期间,唾液腺通过合成大量的水蛭素,确保顺利取食及摄食血液的长期储存。摄食后的新鲜血液对存储和消化器官的刺激,使嗉囊和消化道大量分泌水蛭素,随着摄食后时间延长,消化道刺激减弱,水蛭素表达量日趋减少。
本研究可为深入研究日本医蛭的抗凝机制提供基础资料,同时为水蛭药材的科学采收加工、提取部位的科学选取提供参考,对水蛭药材资源的可持续利用、安全用药及推动水蛭药材的现代化开发利用等具有重要价值。

