盐穗木HcALDH7B4基因的原核表达增强耐盐抗旱性
毛晓菲,黄世平,银芳柳,曾幼玲
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830000)
0 引 言
【研究意义】干旱和高盐胁迫是抑制植物生长和作物产量的两个主要环境因素。当植物遭受盐旱胁迫时会导致细胞中活性氧(ROS)的过度累积[1],ROS会氧化膜磷脂以及游离氨基酸等物质而产生有毒物质,如醛类[2]。解决植物在逆境环境下的生存问题,有必要去除和解毒过量的醛类化合物[3]。【前人研究进展】乙醛脱氢酶基因(ALDH)超家族成员是一大类催化酶,在NAD(P)+的协助下,乙醛脱氢酶可以将有毒醛氧化形成相对应的羧酸,使植物不被醛类毒害而缓解逆境胁迫[4]。基于其蛋白序列,共鉴定出24个家族,其中ALDH10、ALDH12、ALDH19、ALDH21、ALDH22、ALDH23和ALDH24家族是植物所特有的[5]。ALDH7家族的酶被称为Δ1-piperideine-6-carboxylate脱氢酶(P6CDH, E.C.1.2.1.31),或α-氨基己二酸半醛脱氢酶(AASADH),是一个典型的跨物种高度保守的蛋白群[5],参与赖氨酸的分解代谢,并催化α-氨基己二酸半醛转化为无毒的α-氨基己二酸,从而缓解醛类对植物的毒害[6]。植物ALDH基因已经从多种植物中克隆,如拟南芥(Arabidopsisthaliana)[7]、水稻(OryzasativaL.)[8]、葡萄(VitisviniferaL.)[9]、玉米(ZeamaysL.)[10]等,且基因的过表达在不同程度上可提高转基因植物对盐旱胁迫和氧化胁迫的耐受性。【本研究切入点】盐穗木(Halostachyscaspica, Bieb.)是一种耐盐性极强的苋科矮灌木,自然生长在高盐碱半荒漠地区。课题组前期以pMD18-T Simple-HcALDH7B4为模板,通过PCR扩增、连接转化以及酶切,成功构建重组的原核表达载体pET28a-HcALDH7B4[11]。需继续基于已构建的pET-28a-HcALDH7B4重组载体,原核诱导表达,分析盐旱胁迫下重组大肠杆菌耐盐抗旱性。【拟解决的关键问题】研究HcALDH7B4基因在原核细胞里的耐盐抗旱性,分析盐旱胁迫下重组菌株的菌落大小和生长活力,为HcALDH7B4基因的功能提供依据。
1 材料与方法
1.1 材 料
将实验保存的盐穗木种子接种到培养基质(1∶1∶2蛭石∶珍珠岩∶土壤)中,培养条件:温度26℃,相对湿度20%~30%,黑暗/光照周期为8/16 h。生长2.5个月后给予盐旱胁迫处理。设盐穗木不同浓度的NaCl处理(200、400、600 mmol/L)并分别于0、6、12、24、48、72 h采样;于旱胁迫,设自然干旱处理并分别于15、30 d采样。
E.coliDH5α、Transetta (DE3)购自北京全式金生物技术有限公司;植物总RNA提取试剂盒购自北京天根生化科技有限公司;Transcriptase M-MLV(RNase H)、ITPG、蛋白Marker购自大连宝生物技术有限公司;SYBR®Select master Mix购自赛默飞世尔科技(中国)有限公司;引物由上海生工工程股份有限公司合成;其余常用试剂为国产分析纯试剂。
1.2 方 法
1.2.1 HcALDH7B4的生物信息学分析
ExPASy 软件用于在线预测盐穗木HcALDH7B4蛋白质的基本理化性质、亲疏水性和三级结构;Conserved Domain Search(https://www.ncbi.nlm.nih.gov/structure/cdd/wrpsb.cgi)用于其结构域分析。通过NCBI中的BLAST(https://blast.ncbi.nlm.nih.gov)检索HcALDH7B4同源序列,利用MEGA 7.0软件中ClustalW程序进行多序列比对,通过Neighbor-joining邻接法构建系统进化树。
1.2.2 RNA的提取和反转录
取1.5 g盐穗木同化枝,提取总RNA。使用M-MLV(Takara)反转录成cDNA。
1.2.3HcALDH7B4在不同处理下的表达模式
基于盐穗木HcALDH7B4的序列,设计特异性引物HcALDH7B4-p1和HcALDH7B4-p2 。使用SYBR®Select master Mix和ABI 7500实时荧光定量PCR仪进行检测。反应条件:94℃ 5 min,94℃ 30 s,60℃ 30 s,40个循环。每个样本有4个生物学重复。β-actin作为内参基因。相对表达水平用2-ΔΔct定量。相对定量的最终值为基因表达与试验中对照相比的倍数变化。表1

表1 引物
1.2.4 原核表达的重组菌(pET-28a-HcALDH7B4)的鉴定和诱导表达
通过PCR扩增以及双酶切对前期构建的pET28a-HcALDH7B4重组载体进行鉴定。将鉴定正确的含有重组质粒pET28a-HcALDH7B4的Transetta菌种扩大培养至菌液OD600在0.6~0.8时,加入ITPG至终浓度0.6 mmol/L,30℃诱导表达4h,SDS-PAGE检测目的蛋白的表达并用Western blot鉴定[11]。
1.2.5 重组菌株的盐旱胁迫耐受性测定
滴板实验:将重组菌株(pET-28a-HcALDH7B4)和对照菌株(pET-28a)扩大培养至OD6000.5后加入0.6 mmol/L ITPG,诱导培养4 h至OD6000.8,之后以10-1、10-2、10-3和10-4为梯度将菌液进行稀释[12]。将每个稀释的样品(5 μL)分别点于含有500 mmol/L NaCl、500 mmol/L KCl、500、800 mmol/L Manntiol的固体LB培养基上培养12 h后拍照。
液体培养:将达到OD6000.8的2种菌株按1%(V/V)的接种量,分别接种到添加有500 mmol/L NaCl、500 mmol/L KCl、500、800 mmol/L Manntiol的新鲜LB液体培养基中,37℃、220 r/min振荡培养。每隔2 h测菌液在不同处理下OD600的值。
1.3 数据处理
利用GraphPad Prism软件绘图和数据分析。用Duncan法进行差异显著性检验。不同小写字母代表组间有显著差异(P< 0.05)。表1
2 结果与分析
2.1 HcALDH7B4的生物信息学
研究表明,盐穗木HcALDH7B4蛋白的理论等电点为5.91,理论分子量为55kD。该蛋白多肽链中疏水性氨基酸多于亲水性氨基酸,HcALDH7B4属于疏水性蛋白。HcALDH7B4蛋白具有ALDH家族典型的NAD结合位点、四聚体界面、催化残基,HcALDH7B4是ALDH基因超家族的一员。图1

注:A、B分别为HcALDH7B4蛋白的疏水性分析和三级结构预测
HcALDH7B4与拟南芥AtALDH7B4在同一分支且有较高的氨基酸序列相似性,HcALDH7B4与拟南芥AtALDH7B4在耐盐抗旱方面有相似的功能。图2

注:HcALDH7B4由红色显示
2.2 盐旱胁迫下盐穗木HcALDH7B4基因的表达模式
研究表明,HcALDH7B4基因在盐旱胁迫后被显著诱导。600 mmol/L NaCl处理48 h时HcALDH7B4的表达量最高。自然干旱胁迫下,随着胁迫时间的延长,HcALDH7B4基因的表达逐渐增加,30 d时表达量最为显著。图3
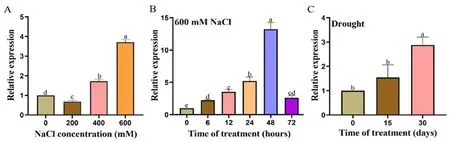
注:不同浓度的NaCl胁迫(A);600 mmol/L NaCl胁迫(B);不同时期的干旱胁迫(C)
2.3 融合蛋白的鉴定与诱导表达
研究表明,将鉴定正确的原核表达载体pET28a和重组质粒pET28a-HcALDH7B4分别转化Transetta(DE3)后,经IPTG诱导表达,12%SDS-PAGE电泳检测,在44~66 kDa有一条差异表达条带,构建原核表达载体正确。在55~70 kDa有一条明显的特异性条带,HcALDH7B4蛋白被准确表达。取超声处理后菌体上清及沉淀进行蛋白可溶性检测。包涵体是目的蛋白存在的主要形式。图4

注: A: SDS-PAGE鉴定。M: 蛋白分子量Marker;1,3,5: 重组菌诱导前;2,4,6: 重组菌诱导后;7: 对照菌诱导前;8: 对照菌诱导后。B: Western blot分析。1,2,3: 重组菌诱导前;4,5,6: 重组菌诱导后。Total: 细胞总粗蛋白;Ins: 不溶性蛋白质;Sol: 可溶性蛋白
2.4 重组菌株的盐旱耐受性
研究表明,重组菌与对照菌在菌落数方面没有明显差异;相较对照菌,重组菌株在500 mmol/L NaCl、500 mmol/L KCl、500、800mmol/L Mannitol胁迫下有更多的菌落数。正常情况下,重组菌和对照菌生长没有差异,20 h后基本达到平稳期,胁迫条件下,两者菌体生长量均有显著差异,并且对照菌的生长受到明显胁迫抑制。HcALDH7B4的表达可正向调节大肠杆菌在盐旱胁迫下的生长。图5,图6
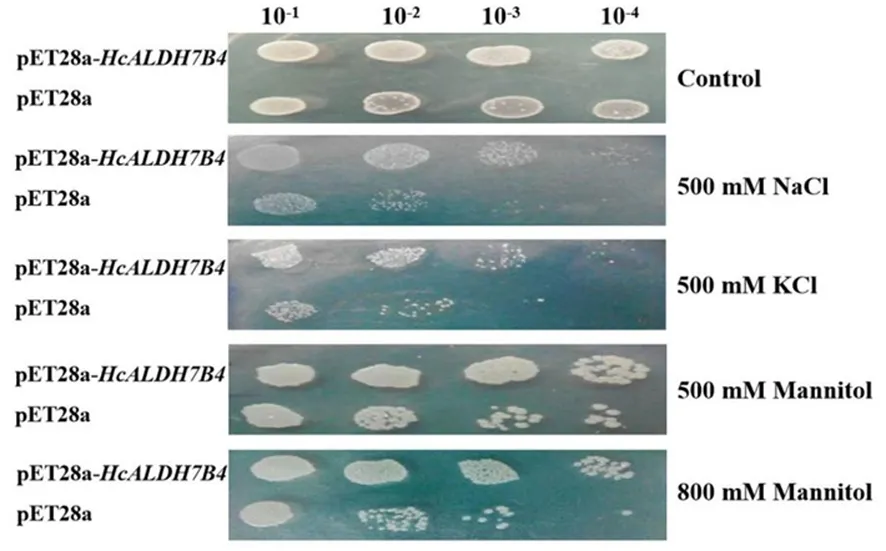
图5 重组大肠杆菌菌株的盐旱抗性

注:(A) 对照;(B) 500 mmol/L NaCl胁迫;(C) 500 mmol/L KCl胁迫;(D) 500 mmol/L Mannitol胁迫;(E) 800 mmmol/L Mannitol胁迫
3 讨 论
3.1醛脱氢酶(ALDHs)是一个进化保守的氧化还原酶超家族,将大量的醛转化为羧酸来缓解毒害。前期对ALDH家族在非生物胁迫上的功能研究主要集中在模式植物拟南芥[13]、玉米[14,15]、水稻[16]中,而对盐生植物中该蛋白家族的研究较少。
3.2前期研究证实ALDH7家族基因在各种非生物胁迫下被显著诱导,并参与植物对非生物胁迫的响应。在盐、旱以及ABA等其他非生物胁迫下,大豆GmALDH7B1[17]、水稻OsALDH7[18]和高粱SbALDH7B2[19]基因的表达显著上调,ALDH7基因参与了植物对多种非生物胁迫的响应。与HcALDH7B4聚为一类的拟南芥AtALDH7B4在脱水、高盐、H2O2或ABA处理后在叶和根中也被强烈诱导[20],且在转基因植物中可提高其盐旱耐性。试验中HcALDH7B4在盐旱胁迫下也被显著诱导。HcALDH7B4可能有助于植物响应盐旱胁迫。
3.3研究结果表明,盐穗木HcALDH7B4基因的原核表达增强了大肠杆菌的盐旱耐性。与Gautam等[21]的结果相一致,油菜BrALDH7B2的过表达也使大肠杆菌和酵母在盐胁迫和氧化胁迫下有更好的适应和生存能力,且过表达BrALDH7B2可提高转基因烟草的耐盐性[22]。盐穗木HcALDH7B4很有可能也在植物的非生物胁迫中发挥正向的调控作用。HcALDH7B4是一个胁迫应答基因,其原核表达可以提高大肠杆菌盐旱耐性。进一步通过植物转基因方式提高作物的非生物抗性后,有望作为候选基因提高作物和林木的耐盐和抗旱性。
4 结 论
根据盐穗木HcALDH7B4基因在600 mmol/L NaCl和自然干旱胁迫下不同时间点的表达量,盐穗木HcALDH7B4基因在盐旱胁迫下被显著诱导;相较对照菌,500 mmol/L NaCl、500 mmol/L KCl、500、800 mmol/L Manntiol胁迫下重组菌的菌落大小和生长活力更优。原核表达HcALDH7B4能够提高大肠杆菌的盐旱抗性。

