不同热处理温度对桂花食用品质的影响
周 菁,崔朝林,岳彭伟,李向阳,郑煜焱*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
桂花为常绿灌木或乔木,属于木犀科木犀属,又名木犀、九里香等,其集鉴赏和食用价值于一体,是我国传统的十大名花之一[1]。根据花色的不同可将其分为‘四季桂’‘金桂’‘丹桂’和‘银桂’4 个经典品种群,其中通常作为食用的品种是‘金桂’‘丹桂’和‘银桂’。两千年前,我国人民就制作出了桂花酒、桂花茶和桂花糕等[2-3],其是我国最早作为食物的花卉。桂花花瓣中除含有较多的矿质元素和蛋白质等营养物质外,具有抗氧化、降血脂和血糖、预防肿瘤、护肝、抑菌等功效的多酚、总黄酮、萜类、连翘脂素、紫罗兰酮等活性成分也是国内外学者关注的重点[4]。此外,桂花花香浓郁飘逸且不甜腻,香味持久,能够赋予食物独特的风味。但桂花花期仅为7~10 d左右,且花朵娇弱,极易遭受破坏,因此目前市场上的桂花食品多集中在盛产桂花的区域,北方地区多食用糖渍桂花和干桂花等进行过初级加工的产品[5]。
热加工是食用花卉最主要的加工方法,研究表明,食物在加热过程中,成分会发生各种变化,如形成夺目的颜色、扑鼻的香气和诱人的味道。然而食品在破碎和加热的过程中会发生淀粉糊化、蛋白质变性、氨基酸与还原糖进行美拉德反应等,易造成营养成分的流失、色泽及风味的变化[6]。温度是影响食品在热加工过程中品质特性的一个重要因素。然而目前对桂花的研究主要集中在食品添加剂、精油等方面[7],对食用桂花在不同加热温度下的成分变化规律鲜有报道[8],因此,探讨不同加热温度对桂花食用品质的影响具有一定的现实意义。本实验通过分析未加热以及80、100、120 ℃(均加热20 min)干法加热下不同品种桂花活性成分、抗氧化性、花色的变化,滋味及香气成分等风味物质的变化,探究加热温度对桂花加工品质特性的影响,以期为食用桂花在热加工过程中品质的控制提供科学有效的依据。
1 材料与方法
1.1 材料与试剂
‘波叶金桂’(Osmanthus fragrans‘Boye Jingui’)由桂林市青罗坊食品有限公司提供,以下简称金桂;‘鄂橙丹桂’(Osmanthus fragrans‘E Cheng’)由温州市浙南农副产品中心市场凤朝茶行提供,以下简称丹桂;‘晚银桂’(Osmanthus fragrans‘Wan Yingui’)由浙江文尚农业科技开发有限公司提供,以下简称银桂。
无水乙醇、盐酸、水杨酸、双氧水 天津市富宇精细化工有限公司;亚硝酸钠、碳酸钠 沈阳市东兴试剂厂;硝酸铝、氢氧化钠、氯化钾、乙酸钠、硫酸亚铁国药集团化学试剂有限公司;芦丁标准品 上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海瑞永生物科技有限公司;没食子酸、福林-酚 北京索宝来科技有限公司;以上试剂均为分析纯。
1.2 仪器与设备
RW10高速万能粉碎机 浙江红景天工贸有限公司;CR400色差仪 日本柯尼卡美能达公司;SA402电子舌、50/30 μm DVB/CAR/PDMS固相微萃取头、固相微萃取手动进样手柄 日本Supelco公司;6890-5973N气相色谱-质谱联用仪(配有氢火焰离子化检测器) 美国安捷伦科技公司;JYL-C91T数显恒温水浴锅 常州智博瑞仪器制造有限公司;MP2002电子天平 上海光正医疗仪器有限公司;KQ5200B超声清洗机 昆山市超声仪器有限公司;TDL-50B离心机 上海安亭科学仪器厂;LD-SY96S酶标仪 山东莱恩德智能科技有限公司。
1.3 方法
1.3.1 样品处理
金桂、丹桂、银桂均为真空冷冻干燥的统一原料,冻干的工艺参数:预冻温度为-24~-32 ℃,时间为2~3 h,物料厚度为8~10 mm,总压力为40 Pa,冷阱温度为-48~-51 ℃,加热板温度为14~16 ℃,干燥时间为14~16 h。
将花梗等杂质去除,分别放进高速万能粉碎机中,粉碎50 s后过100 目筛,得到桂花粉。然后分别称取等量的3 种桂花,置于托盘,放入烤箱中,在80、100、120 ℃下烤制20 min,取出放凉后装入密封袋备用。
1.3.2 功能性成分的测定
1.3.2.1 总黄酮含量的测定
将不同品种桂花粉各称取1 g于50 mL离心管中,以料液比1∶30加入体积分数60%乙醇溶液,放入超声仪中,45 ℃下浸提45 min后,用离心机3 000 r/min离心10 min,取2 mL上清液于10 mL比色管。参考陈培珍等[9]的方法,使用酶标仪在5 1 0 n m 波长处测定吸光度,以芦丁为标准品绘制标准曲线,得到标准曲线方程y=0.012 61+10.716 14x,R2=0.999 2。通过标准曲线方程计算桂花中总黄酮含量,总黄酮含量以每克样品中所含芦丁质量表示,单位为mg/g。
1.3.2.2 总多酚含量的测定
桂花中多酚物质的提取方法同1.3.2.1节。参考蒋孟君等[10]的方法,使用酶标仪在765 nm波长处测定吸光度,以没食子酸为标准品绘制标准曲线,得到标准曲线方程y=37.691 45x-0.098 83,R2=0.999 9。通过标准曲线方程计算桂花中的总多酚含量,总多酚含量以每克样品中所含没食子酸质量表示,单位为mg/g。
1.3.2.3 花色苷含量的测定
参考耿然等[11]的pH示差法测定花色苷含量。称取1 g桂花粉于具塞试管,加入体积分数60%的酸化乙醇溶液(HCl调节pH值为3)15 mL,30 ℃超声30 min,随后离心10 min,重复上述操作3 次,混合3 次提取液。提取液用上述酸化乙醇溶液稀释5 倍后分别移取1 mL于2 支试管中,分别用pH 1.0(0.2 mol/L 335 mL HCl溶液+125 mL 0.2 mol/L KCl溶液)、pH 4.5(27.215 g碳酸钠加入至10 mL 12 mol/L浓盐酸)的缓冲液定容至10 mL。用酶标仪在530 nm和700 nm波长处分别测得pH 1.0缓冲液处理样品和pH 4.5缓冲液处理样品的吸光度,按公式(1)计算花色苷含量。
式中:∆A表示pH 1.0体系的吸光度减去pH 4.5体系的吸光度;V表示提取液总体积/mL;DF表示稀释倍数;M表示矢车菊-3-葡萄糖苷(Cy-3-Glu)相对分子质量(449);ε表示Cy-3-Glu的摩尔消光系数(29 600 L/(mol·cm));L表示光程(0.001 cm);m表示样品质量/g。
1.3.3 抗氧化能力测定
1.3.3.1 DPPH自由基清除率测定
参照黄玲艳[12]的方法测定桂花中总提取物的DPPH自由基清除率,并稍作修改。称取20 mg DPPH用10 mL无水乙醇溶解制备DPPH-乙醇溶液,将不同品种桂花粉各称取1 g于50 mL离心管中,按料液比1∶30加入DPPH-乙醇溶液,45 ℃下超声浸提45 min后,离心10 min,取1 mL上清液用体积分数60%乙醇溶液进行10 倍稀释备用。取20 μL上述样液用酶标仪在517 nm波长处测定吸光度,按公式(2)计算DPPH自由基清除率。
式中:A0表示待测样品+DPPH-乙醇溶液吸光度;A1表示待测样品+体积分数60%乙醇溶液吸光度;A2表示体积分数60%乙醇溶液+DPPH-乙醇溶液吸光度。
1.3.3.2 羟自由基清除率测定
样品的提取方法同1.3.3.1节。取1 mL 9 mmol/L硫酸亚铁+1 mL 9 mmol/L乙醇-水杨酸+11 mL去离子水+1 mL 8.8 mmol/L双氧水+1 mL待测样品提取液,摇匀后37 ℃水浴15 min,用酶标仪在510 nm波长处测定吸光度Ax。以同样的方法去除样品或双氧水后测定的吸光度分别记为A0和Ax0。按公式(3)计算羟自由基清除率。
1.3.4 色泽指标的测定
将桂花粉堆积成2 cm×2 cm×0.5 cm规格的立方体,覆盖上一层塑料薄膜,用色差仪充分接触样品,并选择在3 个不同位置进行测试。测定亮度L*值、红绿度a*值和黄蓝度b*值并按式(4)计算色差值ΔE。
1.3.5 风味分析
1.3.5.1 滋味的分析
参考李敏等[13]的方法并稍作修改进行滋味分析。称取桂花粉3 g加入盛有蒸馏水的玻璃烧杯中,磁力搅拌30 min后放入离心管,10 000 r/min离心10 min,取100 mL上清液放入电子舌专用进样杯中进行电子舌分析。
1.3.5.2 挥发性香气成分的测定
参考杨宇婷等[14]的方法并稍作修改。色谱条件:HP-5MS石英弹性毛细管柱(30.0 m×250 μm,0.25 μm);载气为高纯氦气(99.999%),流速1.0 mL/min;进样口温度250 ℃;色谱柱初始温度50 ℃(保持1.0 min),以3 ℃/min升温至120 ℃(保持2 min),最后以4 ℃/min升温至210 ℃(保持10 min),不分流进样。质谱条件:70 eV、230 ℃的电子轰击电离源,接口温度为250 ℃,质量扫描范围为m/z10~450;溶剂延迟时间为10 min。
定性分析:使用MassHunter软件,对采集到的全扫描信号总离子流图利用Wiley275、Nist11、Flavor2标准图谱库串联检索,根据各化合物的质谱匹配度大于90%进行查找。
定量分析:采用内标法,加入7 μL内标物2,4,6-三甲基吡啶。按公式(5)计算各挥发性组分含量。
式中:ρ表示内标物质量浓度/(μg/mL);V表示内标物的体积/μL;m表示样品量/g;A1表示峰面积;A2表示内标物峰面积;f为换算系数(1 000)。
1.4 数据处理与分析
用Excel 2015软件对数据进行整理,用SPSS 22.0软件对数据进行方差分析,用Origin 2016软件作图。每个实验重复测定3 次取平均值。
2 结果与分析
2.1 热处理温度对桂花活性成分的影响
由图1可知,3 类桂花的活性成分物质含量均随着加热温度的上升逐步下降,不同温度之间存在显著性差异(P<0.05)。80、100 ℃处理组与未加热处理组(CK组)相比,金桂、丹桂、银桂黄酮含量分别下降了1.42、0.83、0.69 mg/g和2.38、1.74、1.91 mg/g(图1A),其损失率较低,但温度上升至120 ℃时,金桂、丹桂、银桂总黄酮损失率达到了28.62%、24.94%和37.44%,可能因为温度升高加快了分子间运动,使总黄酮被氧化分解[15]。

图1 热处理温度对桂花黄酮(A)、多酚(B)和花色苷(C)含量的影响Fig.1 Effect of heat treatment temperature on the contents of flavonoids (A),polyphenols (B) and anthocyanins (C) in Osmanthus fragrans flower
桂花中的多酚类化合物含量较高,但在高温下会发生裂解等反应,因为多酚类化合物的不饱和键易受热氧化,且温度越高,氧化反应越剧烈,损失越大[16]。如图1B所示,100 ℃时金桂、丹桂、银桂多酚的损失率明显升高,分别为14.3%、18.8%、19.79%,120 ℃时分别为26.15%、28.69%、28.74%(P<0.05)。
加热处理会加速花色苷降解。如图1C所示,相较与CK组,80 ℃下金桂、丹桂、银桂花色苷损失率分别为11.91%、8.2%和11.67%(P<0.05)。并且随着温度的升高,损失率显著上升(P<0.05),120 ℃时丹桂花色苷损失率最高,可达49.1%。
综上,3 类桂花的活性成分含量均随温度升高而降低,但不同成分热稳定性不同,总体上多酚类热稳定性>黄酮类热稳定性>花色苷类热稳定性,而3 类桂花热稳定性大小顺序总体为金桂>丹桂>银桂。
2.2 热处理温度对桂花抗氧化能力的影响
抗氧化能力是评价桂花类食品品质的重要指标[17],本实验以DPPH自由基和羟自由基清除率来反映桂花体外抗氧化能力。由图2可知,3 种桂花的体外抗氧化能力均随处理温度的升高呈先下降后上升的趋势。相较于CK组,100 ℃处理组金桂、丹桂、银桂DPPH自由基清除率分别下降了6.63%、12.82%、12.14%,羟自由基清除率分别下降了10.64%、9.78%、10.56%。其原因是桂花含有丰富的活性物质如多酚、黄酮类等,具有很强的抗氧化能力,但高温破坏了这些活性物质的分子结构,使其被热降解,因此自由基清除能力显著下降[18],与2.1节活性成分的分析结果相印证。当温度上升到120 ℃时,因高温美拉德产物具有较强的抗氧化活性,所以对比100 ℃处理组,金桂、丹桂、银桂DPPH自由基清除率分别上升了2.89%、6.43%、4.84%,羟自由基清除率分别上升了4.31%、6.52%、6.01%。Tang Weizhuo等[19]在比本实验更大的处理温度范围内进行的研究也得到类似的变化趋势,因此推断本实验当加热温度持续升高,桂花的体外抗氧化能力也会不断增强。就这3 类桂花比较,金桂在中低温加热时清除率总体上显著高于其他两类(P<0.05),由此可证其活性成分的热稳定性最优,但高温加热后,丹桂的自由基清除率最高,可能是美拉德反应产生的抗氧化物质较多。

图2 热处理温度对桂花DPPH自由基(A)和羟自由基(B)清除率的影响Fig.2 Effect of heat treatment temperature on DPPH (A) and hydroxyl (B) radical scavenging capacity of Osmanthus fragrans flowers
2.3 热处理温度对桂花色泽的影响
色差值是衡量样品色泽变化最直观的指标,能够反映桂花在热加工过程中颜色的总体变化情况,由表1可知,在温度持续升高的情况下,3 种桂花的色差值均显著升高(P<0.05),说明桂花的颜色变化与CK组相比在持续增加。其中,银桂在每个温度下的∆E均显著小于其他两类(P<0.05),说明其褐变程度最小。

表1 不同热处理温度下桂花色泽指标的变化Table 1 Changes in color parameters of Osmanthus fragrans flowers at different heat treatment temperatures
L*、a*、b*值可以直观反映桂花本身颜色变化情况。L*值表示亮度,L*值越大,说明颜色越亮白;a*值则表示红绿度,正值越大说明桂花的颜色越偏红色;b*值则表示黄蓝度,正值越大说明颜色越偏黄色[20]。由表1可知,金桂本身的颜色为明黄色,L*和b*值最大,a*值最小,加热到100 ℃时,与CK组相比,L*和b*值分别降低了13.04和9.51,亮度和黄色变小,a*值增大了5.19,红色调增加。继续增加至120 ℃时,色泽变化不显著(P>0.05),仍呈现以黄色调为主,说明高温加热使其亮度和黄色素破坏较严重并因美拉德反应产生了红棕色物质。丹桂为艳丽的橙红色,a*值最大,随着温度升高,其L*、a*、b*值均显著下降(P<0.05),主要是高温破坏了丹桂本身的色素,并产生了暗色物质,使花色呈红黄色。银桂颜色是淡黄色,本身花色素含量最低,其L*值因温度升高而显著下降(P<0.05),说明褐变产物的积累降低了其亮度[21],在100℃时,a*值较CK组变化显著(P<0.05),b*值变化不显著(P>0.05),120 ℃时a*、b*值与CK组相比有了显著变化,红色调增多,黄色调减小。
2.4 热处理温度对桂花风味的影响
2.4.1 热处理温度对桂花滋味的影响
滋味是味觉产生的感官特性,是评定食物食用品质的重要指标。由图3可知,在不同处理温度下,3 类桂花的鲜味、咸味、酸味和甜味味觉值均没有明显的变化,说明热加工对这些味道的影响极小。但苦味和涩味有明显变化。因此,本实验重点分析了这两种味道。

图3 热处理温度对金桂(A)、丹桂(B)、银桂(C)滋味的影响Fig.3 Effect of heat treatment temperature on the taste of ‘Jingui’ (A),‘Dangui’ (B) and ‘Yingui’ (C)
由图4可知,桂花的苦味味觉值随着加热温度的升高显著增大(P<0.05)。通过大量的研究发现,美拉德反应的副产物具有苦涩味,导致食品风味发生改变[22]。与CK组比较,80 ℃处理组苦味味觉值未显著增加(P>0.05),此时可能处于非酶促褐变的初级阶段,还没有产生苦味物质。随着加热温度升高,桂花的涩味味觉值呈现先降低后升高的趋势(P<0.05)。降低是因为桂花自身含有单宁和酚酸类涩味物质,受热后被分解成其他成分。120 ℃条件下涩味味觉值又升高,但其涩味仍没有CK组高。
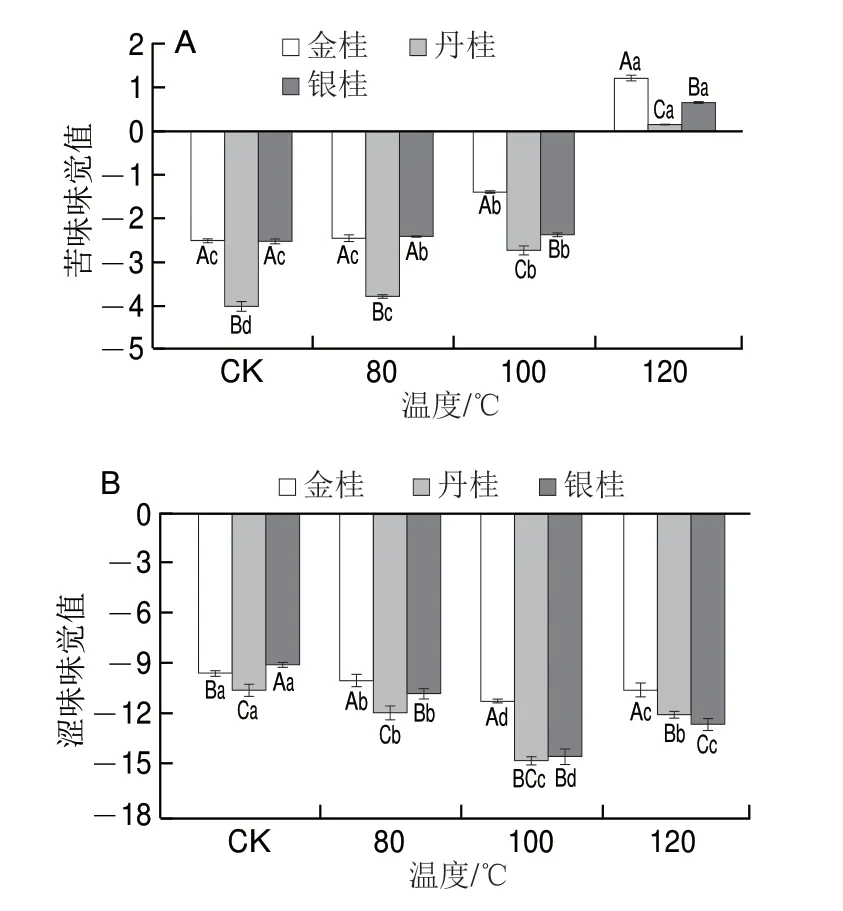
图4 热处理温度对桂花苦味(A)、涩味(B)的影响Fig.4 Effect of heat treatment temperature on bitterness (A) and astringency (B) of sweet-scented osmanthus flowers
综上,中低温对桂花苦味影响较小,并会减弱涩味,而高温会增强苦涩味,3 类桂花中金桂的苦涩味较重;通过电子舌测定结果可看出,无论加热前后,桂花甜味、咸味和鲜味这些会令人味觉愉悦的味道明显强于苦涩味,并占据主导地位。
2.4.2 热处理温度对桂花香气的影响
由表2、3可知,不同温度下的桂花所含香气种类各不相同。未加热的3 类桂花共检出42 种挥发性成分,其中醇类和萜烯类最多,均为9 种,相对含量也较高,酯类和烷烃类相对含量都在20%以上,其分别具有油脂和蜡质气息。未加热条件下3 类桂花共同拥有且含量较高的香气成分是芳樟醇、反式氧化芳樟醇、丁位癸内酯、罗勒烯和β-紫罗酮。芳樟醇类物质的香气鲜嫩柔和,似紫丁香与铃兰的香味;丁位癸内酯具有奶香和香甜的果香;罗勒烯类物质呈淡淡的百合与白柠檬香;紫罗兰酮类是桂花典型香气特征,花香加果香,清甜浓郁[23]。它们共同构成了桂花的特征香味。金桂香味浓郁、甜腻且通透;丹桂香味清甜四溢且浓厚;银桂香味清幽淡雅[24]。

表2 不同热处理温度下桂花香气成分的含量Table 2 Aroma components content in sweet-scented osmanthus flowers at different heat treatment temperatures
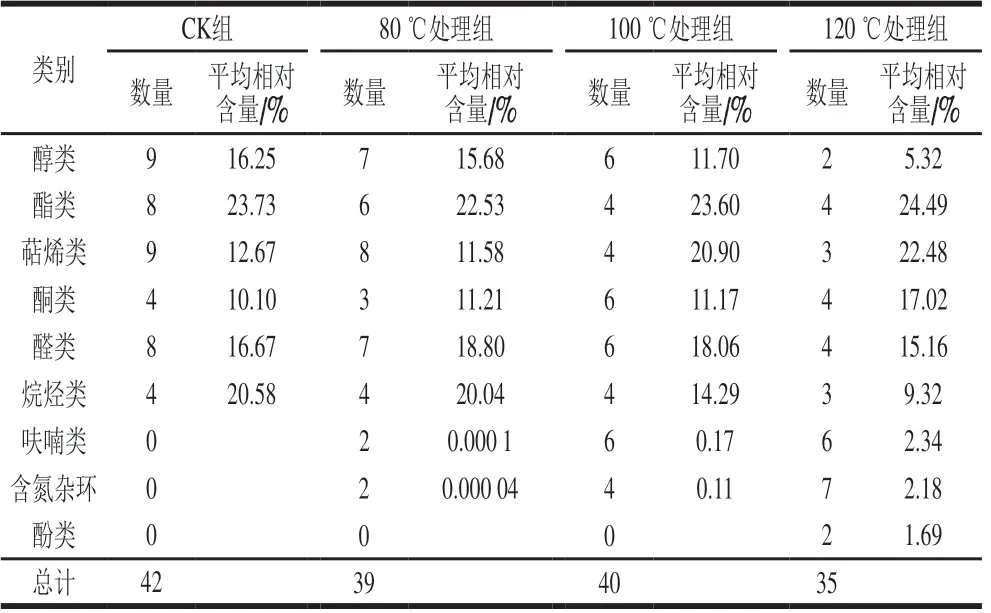
表3 不同加热温度的桂花香气成分种类及相对含量Table 3 Types and relative contents of aroma components in sweetscented osmanthus flowers at different heating temperatures
80 ℃条件下,桂花醇类、酯类、萜烯类、酮类和醛类的种类均减少,含量也明显下降。呋喃类和含氮杂环类新增了2 种,此时可能处于美拉德初级阶段,虽然新产生了糠醛、5-甲基糠醛、2,3-二甲基-5-乙基吡嗪和3,5-二甲基-2-吡咯甲醛,但含量都很低。所以,80 ℃条件下加工只是桂花原有的浓郁香味被减弱。
100 ℃条件下,与CK组相比,桂花醇类、酯类、萜烯类物质的种类和含量明显减少,酮类、呋喃类和含氮杂环的种类和含量总体明显增加。新增的羟基丙酮和辛醛是美拉德反应中间产物。呋喃类的糠醛、5-甲基糠醛在3 类桂花中均被检出,并且含量升高,这类中间产物是热不稳定的,易分解成为麦芽酚和呋喃酮类物质,分解后的成分(2-乙酰基呋喃和2-戊基呋喃)有坚果、焦糖香[25]。同样,氮杂环环化途径则是形成吡嗪的反应途径,而吡嗪是重要的风味物质。如新增加的2,6-二甲基吡嗪具有可可香,2-乙酰基吡咯有烤面包味。呋喃类和含氮杂环相对含量分别为0.17%和0.11%,但因其吡嗪、吡咯类化合物阈值较高,低浓度时风味不明显[26]。因此,100 ℃条件下桂花特有香味明显减弱并且带有轻微的焦香。
120 ℃条件下,与CK组相比,醇类、酯类、萜烯类、醛类和烷烃类物质种类分别减少了7、4、6、4、1 种,并且这些物质因高温被裂解和消耗,含量急剧减少,但相对含量仍占总体的76.77%。糠醛和氯苯氨啶等物质与100 ℃处理组相比显著减少(P<0.05),是因为经过美拉德反应终极阶段,被利用生成棕褐色的色素类物质[27]。120 ℃处理组呋喃类和含氮杂环类的相对含量与100 ℃处理组相比增加了2.17 个和2.07 个百分点,新增的酚类物质相对含量为1.69%,三类物质总相对含量为6.21%。主要因为温度持续升高,产生了更多的呋喃、吡嗪、吡咯和酚类等美拉德特征挥发性成分。它们多能够赋予食物烧烤味、咖啡味、甜味、焦香味、可可味和烟熏味等[28]。综上,120 ℃条件下,桂花烤制后的焦甜和烧烤味明显增强,但本身的花香仍占主体地位。
3 讨 论
桂花以产量高、营养丰富、味香色美的特点深入日常饮食之中,不断创新的加工技术能够带给消费者全新体验,但无论哪种加工方式,食用品质的优劣必然是加工过程中需要考虑的重要因素,而温度则是影响产品品质的关键参数之一。
本研究深入探讨了不同热处理温度对桂花的活性物质热稳定性、抗氧化能力、色差值及风味的影响。结果表明,热处理会加速桂花的活性成分的分解,随着温度的升高,3 种桂花的黄酮、多酚和花色苷含量显著降低(P<0.05),80 ℃条件下损失率最低,在120 ℃条件下损失率达到最高,主要是因为加热处理会对花色苷产生两种效果——破坏结构、增进酶促反应,并且花色苷的热降解是个吸热过程,加热可为其提供更多能量,加速降解[29]。李慧等[16]研究表明桑葚黄酮在90 ℃以下不易分解,而高温下桑葚黄酮含量下降,呈现出不稳定性,本研究结果与其一致。
桂花的抗氧化能力大多与活性物质如多酚、黄酮类等有关,其有很强的抗氧化性,但加热过程中活性物质被破坏,因此自由基清除能力显著下降(P<0.05),但美拉德反应产生的蛋白黑素、还原酮和杂环化合物具有较强的抗氧化活性,其对DPPH自由基和羟自由基均表现出良好的清除能力[30],所以本实验中桂花的抗氧化能力呈先下降后上升的趋势,在100 ℃达到最低,120 ℃有所升高。
加热使桂花内的物质经历氧化、脱水、聚合等一系列复杂反应并产生共聚黑色素的非酶促褐变[31],随着温度的升高,3 种桂花的色差值显著增大(P<0.05),说明其褐变程度加剧,温度越低越能保留原本花色,温度越高可增加烤制后独特的红棕色,其中银桂的∆E始终最小,花色变化最为稳定。
高温生成的美拉德反应副产物带有苦涩味,Bin等[32]研究了烤全麦面包中的苦味物质,分离出了8 种具有苦味的化合物。桂花的苦味随着加热温度的升高逐渐增大,但80 ℃处理组增加不明显。未处理的桂花本身带有单宁和酚酸类涩味物质,涩味味觉值随着温度的升高,先减小后增大,100 ℃条件下涩味味觉值最小可能是因为涩味物质被高温分解,而120 ℃条件下因美拉德反应可能产生了新的涩味物质,因此较100 ℃时涩味味觉值又有所升高。张海生等[33]在研究柿饼脱涩反涩机理时发现,高温处理时使可溶性单宁能够聚合成不可溶性单宁,从而使柿饼脱涩。
未加热桂花共检出42 种挥发性成分,80、100 ℃和120 ℃处理组分别检出39、40、35 种化合物。其中,100 ℃处理组的风味组成最丰富,此时处于美拉德反应的中间阶段,因氮杂环环化途径生成吡嗪、呋喃等重要风味物质,还有醛、醇、烯、酮、酯、烷等挥发性化合物生成;80 ℃条件下,因加热会加速醇类挥发,酯类和萜烯类会发生热裂解,酮类和醛类被分解成其他小分子物质,在经过重排后形成酮糖和醛糖作为美拉德初级产物,但因其热不稳定性,温度再度升高后会脱水和脱氨生成糠醛还原酮等二羰基化合物[34]。100 ℃条件下,桂花醇、酯、萜烯、酮和醛类的数量减少了1~2 种,相对含量也明显下降,新增了少量的呋喃类和含氮杂环类;120 ℃条件下,过高的加热温度使桂花特征香气损失严重,产生了大量的呋喃、含氮杂环和酚类物质,相对含量占6.21%,但其他类物质仍占76.77%。
4 结 论
在本研究中,热加工温度为中低温时(100 ℃以下),桂花活性物质保留最多,体外抗氧化能力最强,褐变程度最小,苦味最小涩味适中,香气得到较好的留存,此加工温度下的桂花更适于生产具有保健作用的食品。高温加工(120 ℃)的桂花,体外抗氧化能力较高,产生独有花色,苦涩味增大但桂花的鲜甜味更明显,除本身特有的桂花香外还获得了焦糖香,所以此加工温度下的桂花更适于生产桂花休闲食品。就本实验中3 类桂花而言,金桂的活性成分热稳定性最优,中低温加热时自由基清除率最高,但高温加热时焦糊味最为明显,褐变程度也最大,因此其适于中低温加工。丹桂颜色明艳,苦涩味最小,高温加热时自由基清除率最高,花香保留最好,因此其适于高温加工。银桂色浅、味淡并且各方面表现不优异,因此其食品应用性不如其他两类,接下来可继续探究热处理温度对不同桂花品种品质影响产生差异的原因。

