Fenton试剂法对苯系物的同步控制研究
谢奕标
(广东轻工职业技术学院,广东 广州 510260)
挥发性有机物(Volatile Organic Compounds,即VOCs)一般是指在常温下常压下饱和蒸汽压大于133.32 Pa、沸点小于260 ℃的有机化合物,按其化学结构的不同,可分为八类:烷类、芳烃类、烯类、卤烃类、酯类、醛类、酮类和其他。VOCs具有很强的毒性,且往往带有恶臭,会引起人体不适,有些会还对人体的损害肝脏、危害肾脏及毒害神经中枢,严重则会引发癌症[1]。Molhave等[2]研究不同浓度的TVOC对人体产生的影响,发现长期接触低浓度的苯、甲苯及甲醛,会使人患贫血和白血病。随着 VOCs 浓度的增加,人体会出现恶心、头痛、抽搐、甚至昏迷等急性症状。1993年苯就被国际癌症研究机构(IARC)(世界卫生组织下属)列为人类Ⅰ类致癌物[3-4]。近年来,由于VOCs对大气和人体产生极大的危害,国际上VOCs排放标准越来越严格,VOCs的污染控制是大气污染控制技术领域中关键问题。
Fenton试剂法(芬顿氧化法)是一种经典的高级氧化技术,具有许多优点:反应无选择性,几乎所有的有机物均能降解;反应条件要求温和,操作简单等,国内外大量研究表明,利用Fenton试剂法处理气态污染物,具有明显的效果。郑思灿[5]研究了光助Fenton试剂降解甲苯,结果表明,紫外光照加快了羟基自由基的生成,显著提高了气体中甲苯的去除率;CO2产率分析表明去除的甲苯全部转化为CO2。田森林[6]利用Fenton试剂在液相中氧化净化了含H2S的气体。李彩亭[7]利用Fenton试剂在液相中利用氧化吸收法同时进行脱硫脱硝实验,获得起始约80%的脱硝效率和98%以上的脱硫效率。魏建平[8]在鼓泡反应器内进行了Fenton试剂氧化降解煤矿瓦斯气体的试验,结果表明,Fenton试剂对煤矿瓦斯有较好的降解效果,瓦斯的最高降解率达25%。莫虹[9]通过研究证明利用Fenton试剂催化氧化法处理甲苯废气是可行的。李甲亮[10]研究了吸收法-Fenton 氧化/光催化氧化对甲苯处理效果,结果表明:在最优的Fenton氧化条件下,甲苯去除率最大达83.5%。陈志星[11]对自配的二甲苯废气采用Fenton试剂法进行处理,实验的结果可以使二甲苯去除率可达到75.3%以上。廖凤[12]采用UV/Fenton法处理硝基苯废气,实验结果表明,UV/Fenton法处理硝基苯废气去除率达70%左右。曹春梅等[13]以Fenton溶液为吸收剂,利用Fenton氧化法在鼓泡反应器内进行烟气脱硝实验,结果表明,在实验条件下,Fenton试剂对模拟烟气中的NO脱除效率可达50%左右。目前,利用Fenton试剂法同步处理多种苯系物的研究还较为少见。
本文组建Fenton试剂处理装置,利用有机气体发生装置同时产生四种苯系物,处理前后四种苯系物的含量由溶液吸收采集后进行GC/MS测定。研究了初始pH值、反应温度、H2O2/Fe2+比值等因素对Fenton试剂处理效果的影响。
1 实 验
1.1 仪器与试剂
(1)主要仪器:雷磁PHS-3C型pH计,上海精密科学仪器有限公司;501A型超级恒温器,上海实验仪器厂有限公司;气相色谱-质谱联用仪(GC/MS:Agilent 7890A/5975C)。
(2)主要试剂:H2O2(30%,使用前先稀释而后用KMnO4法进行标定),汕头市达濠区精细化学品有限公司;FeSO4(分析纯),阿拉丁上海有限公司试剂;苯、甲苯、乙苯、对二甲苯、NaOH、H2SO4(分析纯),广州化学试剂厂;压缩氮气钢瓶(≥99.99%),广州市粤港气体工业有限公司。
1.2 实验装置和方法
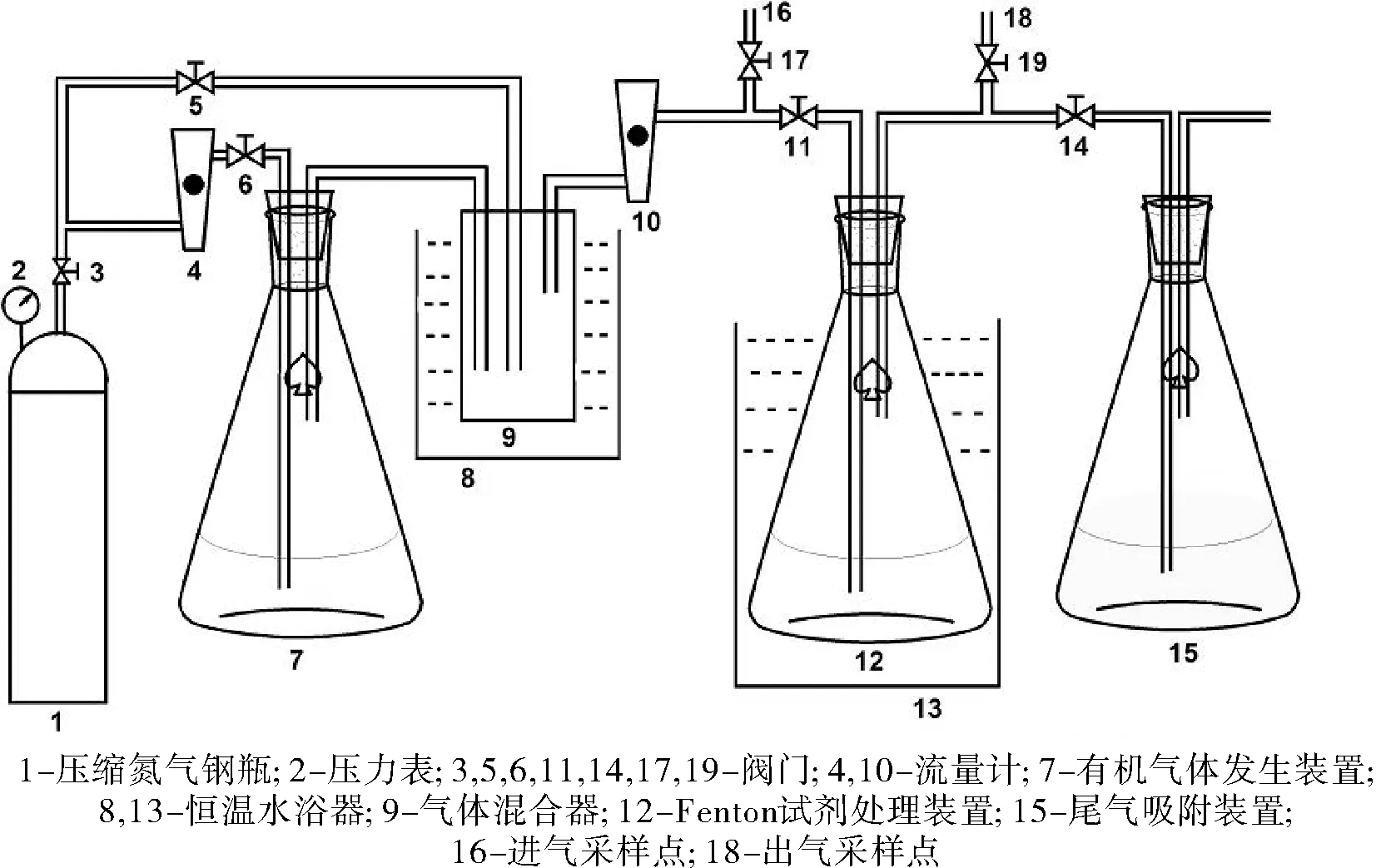
图1 Fenton处理模拟装置Fig.1 Simulation device of Fenton processing
来自气体钢瓶的氮气,经气体流量计进入有机气体发生装置,气体发生器内装有由苯、甲苯、乙苯和对二甲苯组成的液体,通过鼓泡方式产生有机气体,制成的有机气体与另一路氮气在气体混合器内混合,经流量计进入Fenton试剂处理装置,再通过装有活性炭的尾气吸附装置进行吸附。
1.3 有机污染物采集及分析方法
气体中有机污染物采用无水乙醇吸收,串联的两个玻璃筛板吸收瓶置于冰浴中,吸收瓶中分别装有乙醇25 mL,在进气和出气采样点进行采样。采样结束后,将吸收瓶中的溶液全部转移至50 mL比色管中,用少量乙醇补充至标线。将采样后的乙醇溶液经过气相色谱/质谱联用仪(GC/MS型号:Agilent 7890A/5975C)进行分析。色谱条件:30 m×250 μm×0.25 μm HP-5MS弹性石英毛细管柱,流量为1 mL/min,载气为He,分流比100∶1。升温程序为:始温60 ℃,保持1 min,以20 ℃/min速率升到100 ℃,保持2 min,再以20 ℃·min-1升到160 ℃,保持10 min。质谱条件:离子源温度为230 ℃,接口温度250 ℃,EI源电子能量为70 eV,质量扫描范围10~500 amu。谱库采用NIST05.lib,当相似度大于90%时认为鉴定正确。气相中有机污染物的去除率计算公式为:
式中,η为污染物去除率,%;C0为处理前气相中污染物的浓度,mg·m-3;Cx为处理后气相中污染物的浓度,mg·m-3。
1.4 有机污染物采样效率的评价
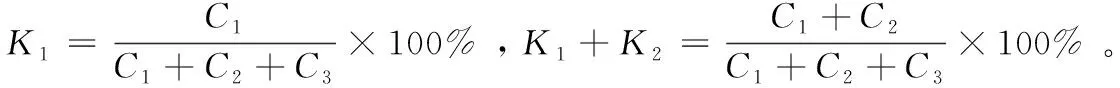
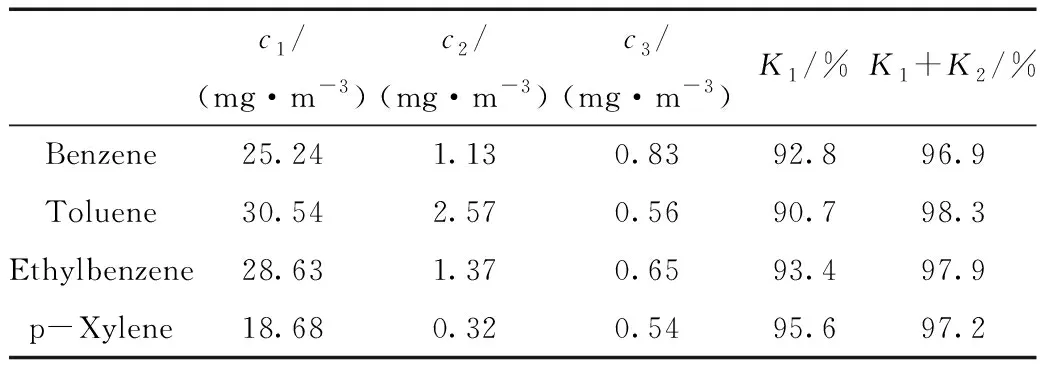
表1 采样效率的评价Table 1 Evaluation of sampling efficiency
2 结果与分析
2.1 Fenton试剂去除有机污染物的动力学分析
在pH=2,H2O2/Fe2+=5,反应温度T=40 ℃条件下,进样并同时采样,在不同时间后装置中有机污染物的相对去除率如表2所示。
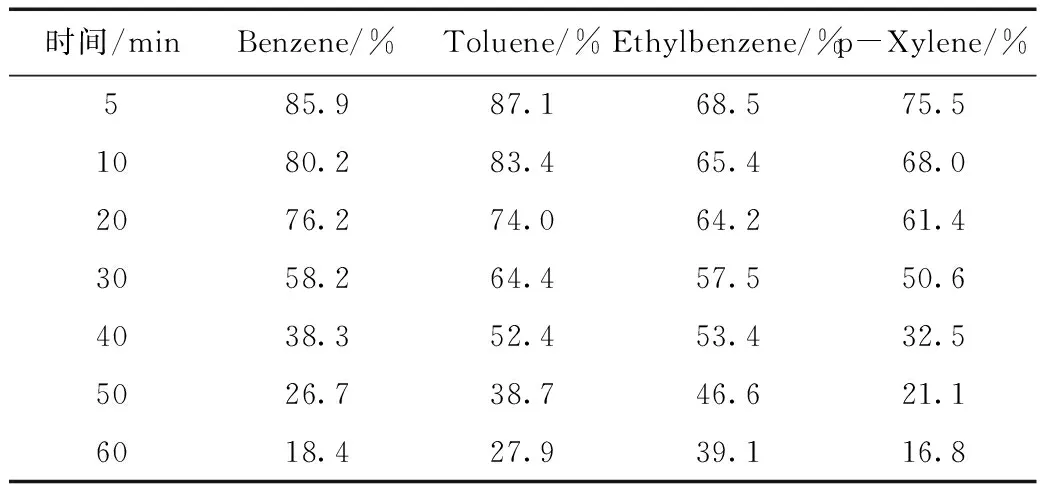
表2 有机污染物的去除率Table 2 Removal rates of organic pollutants
在excel中用有机污染物的去除率相对残余浓度对时间作散点图,再利用最小二乘法进行线性回归分析,结果如图2所示。由于各有机污染物的一元线性回归方程相关系数均大于临界相关系数(R>0.95),所以,在固定pH=2,H2O2/Fe2+为5,反应温度为40 ℃条件下,有机污染物随时间的降解反应符合一级反应动力学模式。
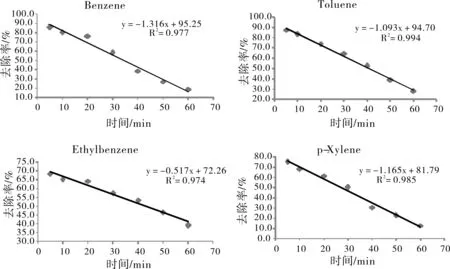
图2 有机污染物一元线性回归方程Fig.2 Unary linear regression equation of organic pollutants
对于一级反应动力学模式,存在ln(C0/Ct)=kt+a。C0为起始浓度,mg·m-3;Ct为处理t时间后浓度,mg·m-3;k为表观速率常数,min-1;a为常数。利用C0/Ct=1/η,求出各种有机污染物的ln(C0/Ct)如表3所示。

表3 有机污染物的ln(C0/Ct)值Table 3 ln(C0/Ct)values of organic pollutants
在excel中用ln(C0/Ct)对时间作散点图,再利用最小二乘法进行线性回归分析,结果见图3,由图3可看出,各动力学方程的线性相关性良好,表观速率常数k(p-Xylene)>k(Benzene)>k(Toluene)>k(Ethylbenzene),表示在固定pH=2,H2O2/Fe2+为5,反应温度为40 ℃条件下,有机污染物的去除速率为:p-Xylene>Benzene>Toluen)>Ethylbenzene,说明Fenton试剂对有机污染物降解的能力大小为:p-Xylene>Benzene>Toluen)>Ethylbenzene。
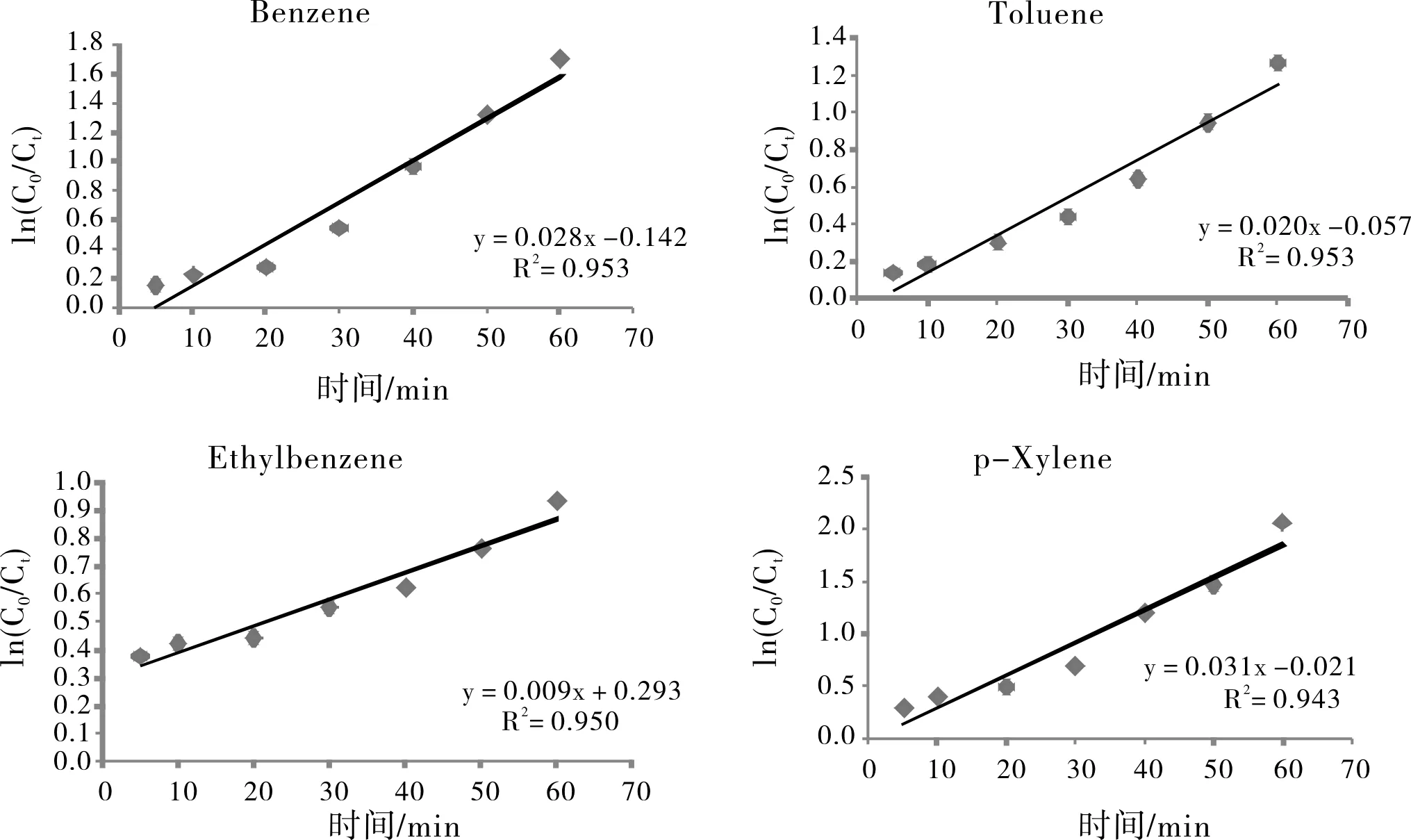
图3 有机污染物降解的动力学方程Fig.3 Kinetic equation of degradation of organic pollutants
2.2 初始pH值对污染物去除率的影响
Fenton废气处理的大量研究结果[14-15]表明,Fenton氧化反应必须在酸性条件下进行,且大多集中于pH值2~4。莫虹[9]认为:在净化甲苯的实验中最佳初始pH值应控制在2.6左右。陈志星[11]研究结果表明,影响二甲苯的去除率最大的因素是pH值:pH值为3时,二甲苯的去除率最大,pH值较低或较高都不利于二甲苯的去除。在H2O2/Fe2+为5,反应温度40 ℃,反应时间30 min条件下,不同初始pH条件下有机污染物的去除率如图4所示,结果表明pH值对有机污染物的去除率有显著的影响。苯、甲苯、乙苯、对二甲苯去除率随pH值的升高呈先升高后下降的趋势,去除率最高分别为pH为2.5、3、2和2.5,随后去除率均大幅下降。pH由3提高到4时,苯和甲苯的下降率最明显,分别下降37.8%和43.6%,由此可看出,在实验条件下,初始pH应控制在2~3之间。这是由于pH直接影响作为催化剂的Fe2+浓度。
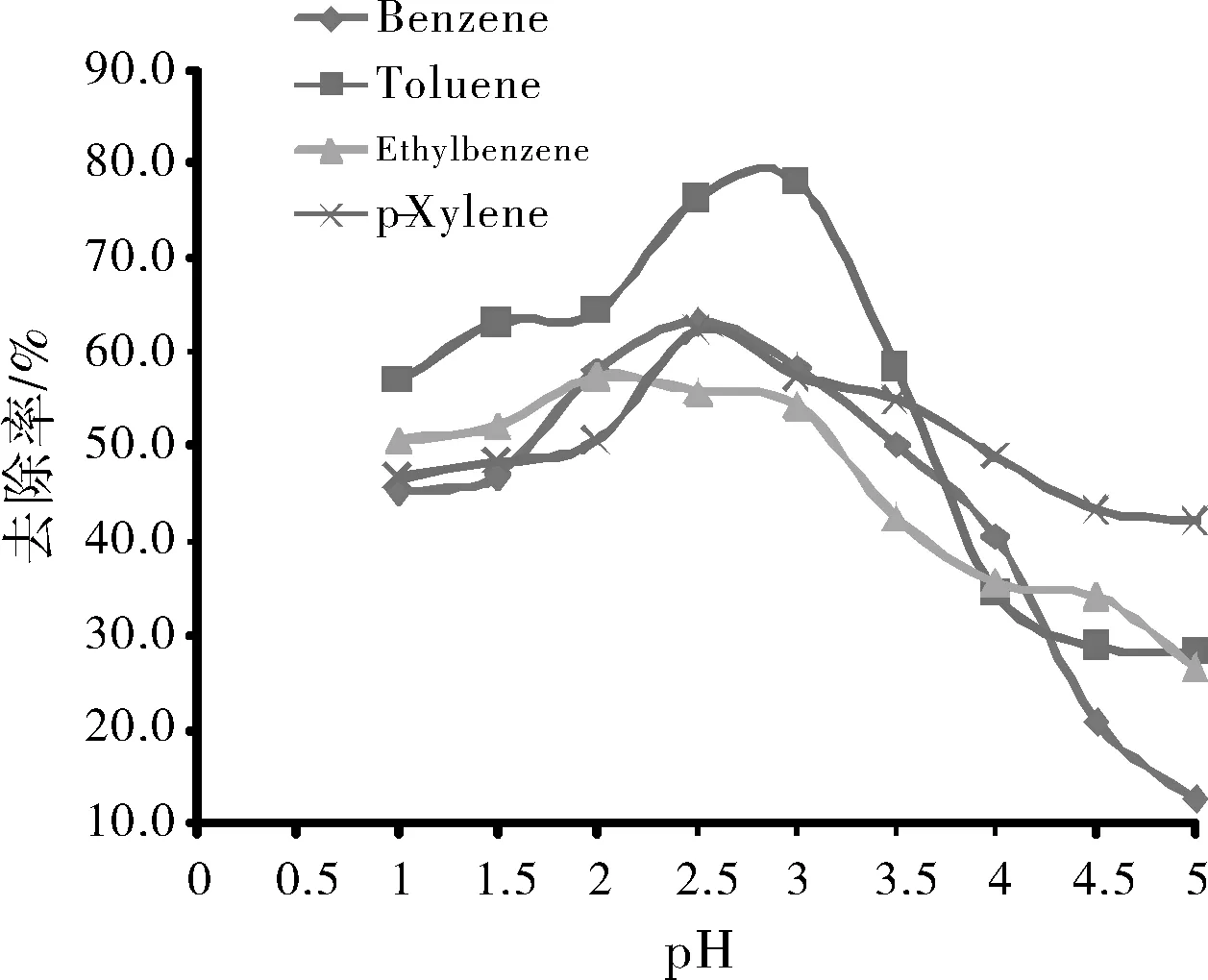
图4 不同初始pH条件下有机污染物的去除率Fig.4 Removal rates of organic pollutants under different initial pH conditions
Fe2++H2O2↔Fe3++HO-+·OH
(1)
Fe3++H2O2↔Fe2++HO2·+H+
(2)
Fe3++HO-↔Fe(OH)3↓
(3)
当pH值过低时,会抑制Fe3+还原成Fe2+,当pH值逐渐升高后,Fe3+还原成Fe2+的量增加,促进有机污染物的去除。当继续升pH高时,Fe3+将会以氢氧化物沉淀形式存在,影响Fe2+和Fe3+之间的平衡,导致Fe2+向Fe3+转化,影响了Fenton试剂的氧化作用[16]。
2.3 反应温度对污染物去除率的影响
在pH=2,H2O2/Fe2+为5,反应时间为30 min条件下,不同温度条件下有机污染物的去除率如图5所示,结果表明随着温度的升高,有机污染物的去除率随着均呈升高趋势。其中对二甲苯在去除率变化最大的温度是40~45 ℃,由50.6%提高到64.8%,提高了14.2%;甲苯的去除率在40~45 ℃时变化最大,由64.4%升高到75.3%,提高了10.9%;苯和乙苯的去除率均随温度上升而提高。说明温度的提高有利于对有机污染物的去除。这是由于一般的化学反应随反应温度的升高反应物分子平均动能增大,反应速率加快[17],结果符合Arrhenius理论[15-20]。从分子动力学角度认为温度升高使反应中分子的平均动能增加,加速Fenton试剂生成·OH,同时升高温度可加速分子运动,提高反应物分子间的碰撞频率,促使氧化反应更快速进行[21]。

图5 不同温度条件下有机污染物的去除率Fig.5 Removal rates of organic pollutants under different temperature conditions
对于Fenton试剂反应体系,适当的温度能激活自由基,但是由于H2O2热稳定性差,过高温度就会出现H2O2分解为O2和H2O,浪费H2O2,使运行成本提升[20],因此适宜的反应温度应该控制在40~50 ℃之间。
2.4 H2O2/ Fe2+比例对污染物去除率的影响
根据Fenton试剂经典的反应理论,Fenton试剂具有非常强的氧化作用,是由Fe2+将H2O2催化分解而产生了具有极强氧化能力的羟基自由基(·OH),并引发链式反应[22-23]。
Fe2++H2O2→Fe3++OH-+·OH
(4)
Fe3++H2O2→Fe2++H++HO2·
(5)
Fe2++·OH→Fe3++OH-
(6)
Fe3++HO2·→Fe2++O2+H+
(7)
·OH+H2O2→H2O+HO2·
(8)
(9)
反应(4)表明催化产生·OH的必要条件是Fe2+,若在无Fe2+,则H2O2难以产生·OH;当Fe2+过低时,反应(4)的速度将会变慢,而·OH的产生速度也会变慢,产生量减小,直接降低Fenton试剂的氧化能力[25]。
在pH=2,反应温度为40 ℃,反应时间为30 min条件下,不同H2O2/Fe2+比例有机污染物的去除率如图6所示,结果表明有机污染物的去除率与H2O2/Fe2+比例有显著关系。在H2O2/Fe2+比例分别为5、6、4、4时,苯、甲苯、乙苯、对二甲苯的去除率最高,分别为58.2%、72.7%、59.5%、54.0%。在Fenton体系中,由于Fe3+催化作用不如Fe2+[24],因此Fe2+是体系产生催化自由基的必要条件,当Fe2+浓度太低时,式(4)的反应速度极慢,自由基的产生速度很慢,产生量不足,使降解受到抑制[17];当Fe2+浓度太高时,它会还原H2O2,且自身被氧化为Fe3+,影响处理的效果。阮洋[25]研究结果表明:过多的Fe2+会造成·OH的消耗,直接影响氧化效果,而过多的Fe2+既消耗药剂又会造成H2O2的无效分解。

图6 不同H2O2/Fe2+比例有机污染物的去除率Fig.6 Removal rate of organic pollutants with different ratios of H2O2/Fe2+
3 结 论
(1)用苯系物的去除率相对残余浓度对时间进行线性回归分析,结果显示各苯系物的一元线性回归方程相关系数均大于临界相关系数(R>0.95),说明Fenton试剂对苯、甲苯、乙苯和对二甲苯的去除过程符合一级反应动力学模式。在pH=2,H2O2/Fe2+=5,T=40 ℃条件下得到的测定数据,用ln(C0/Ct)对时间进行线性回归分析,动力学表观速率常数k(对二甲苯)>k(苯)>k(甲苯)>k(乙苯),表示Fenton试剂对苯系物降解速率大小为:对二甲苯>苯>甲苯>乙苯。
(2)在Fe2+/H2O2体系中,Fe2+主要是作为反应的催化剂,而H2O2通过反应产生的·OH起到氧化作用,当pH值过低时,会抑制Fe3+还原成Fe2+,当pH值逐渐升高后,Fe3+还原成Fe2+的量增加,当继续升pH高时,Fe3+将会以氢氧化物沉淀形式存在,影响Fe2+和Fe3+之间的平衡,导致Fe2+向Fe3+转化,因此过低或过度的pH值均不利于苯系物的去除,通过实验发现,在实验条件下最佳初始pH值为2~3。
(3)温度的升高,从分子动力学角度认为温度升高使反应中分子的平均动能增加,加速Fenton 试剂生成·OH,同时升高温度可加速分子运动,提高反应物分子间的碰撞频率,促使氧化反应更快速进行有利于提高去除率,但过高温度会使H2O2分解,同时提高运行成本,因此适宜的反应温度为40~50 ℃。
(4)催化产生·OH的必要条件是Fe2+,若在无Fe2+,则H2O2难以产生·OH;当Fe2+过低时,H2O2产生·OH的反应速度变慢,产生量减小,会直接降低Fenton试剂的氧化能力。当Fe2+浓度太高时,它会还原H2O2,且自身被氧化为Fe3+,影响处理的效果。实验表明,在H2O2/Fe2+比例4~6之间时,甲苯、乙苯、苯、对二甲苯的去除率最高,分别达72.7%、59.4%、58.2%和54.0%。

