氮添加对戴云山黄山松林土壤有机氮解聚酶活性的影响及其调控因素
林开淼,元晓春,曾泉鑫,徐建国,陈文伟,陈岳民
1 福建师范大学地理科学学院,福州 350007 2 武夷学院旅游学院,武夷山 354300 3 福建戴云山国家级自然保护区管理局,德化 362500
由于化石燃料与农业化肥的大量使用,大气中活性氮的沉降量快速增加,预计到2050年亚热带地区氮沉降量会再翻一番[1]。快速增加的氮沉降提高了土壤氮循环通量和各种含氮化合物间的转化速率,破坏土壤养分元素的平衡[2],成为影响森林土壤有机氮循环及其氮有效性的重要环境因素。土壤有机氮占土壤总氮的90%以上,但大部分有机氮不能被植物和微生物直接吸收,需要通过微生物的矿化作用转化为小分子态有机氮和无机氮成分,才能被植物利用,因此有机氮矿化速率是决定土壤氮供应能力的关键因子[3]。由于有机氮库组成十分复杂,有机氮来源和分子的类型多样[4],土壤有机氮解聚作用成为限制土壤有机氮矿化的关键过程,直接控制有效性氮来源的“瓶颈”[5]。然而,相对于无机氮循环过程,有机氮解聚作用仍然是一个“黑箱”,有机氮解聚酶对氮沉降如何响应仍有待探明[6]。因此,关注氮沉降对森林生态系统土壤有机氮解聚作用的影响,有助于理解氮沉降背景下土壤有机氮矿化和氮素有效性供给的关键过程,进而为森林土壤氮素养分的管理和调控提供一定的实践指导。
土壤有机氮的解聚作用本质上是解聚酶将有机氮大分子聚合物水解,生成能够被植物吸收的低聚物[7]或者小分子单体,如氨基酸、氨基糖、核酸等[8]。因此,解聚酶是解聚作用强度和方向的关键控制因子,其活性的大小常被用来表征解聚作用的强度[9]。然而解聚酶并不是某一种酶,是能够将土壤含氮大分子聚合物逐步水解的一系列酶[8],所以解聚作用的研究首先需要明确解聚酶的类型。例如,有研究发现,蛋白酶、几丁质酶和肽聚糖酶是主要参与有机氮解聚作用的酶[6]。因此,研究氮沉降下土壤有机氮解聚酶的活性及其反应方向是理解有机氮解聚作用调控机理的关键[5]。温带森林土壤的氮添加试验进一步证实了蛋白酶活性可以作为表征解聚作用的有效指标[3]。与温带相比,虽然亚热带森林土壤相对富氮,但是该区域高温多雨,植被生产力旺盛,对氮养分的需求更高[10],氮沉降控制亚热带森林土壤有机氮解聚作用的变化可能比温带地区更为复杂。氮沉降增加了土壤无机氮,微生物和植物对土壤有机氮释放有效性养分需求降低,但是对土壤有机氮解聚酶活性影响并不一致[5]。目前亚热带地区大多数研究都集中在土壤氮循环的无机部分,仅有少数研究中报告了有机氮解聚(蛋白质)的总速率[11]。因此,亚热带森林土壤有机氮解聚作用如何响应及驱动解聚酶活性变化的关键因素仍需要开展更多研究来明确。
黄山松(Pinustaiwanensis)是我国特有树种,主要分布在纬度25°—35°,海拔800—1600 m范围内,为我国东部亚热带中山地区森林演替的先锋树种。戴云山自然保护区内分布着我国东南沿海山地分布最南端、面积最大、保护最完好的黄山松原生性群落[12]。该区属于典型的亚热带海洋性季风气候,夏季高温多雨,土壤风化强烈[13]。此外,一般认为高海拔地区土壤氮库和有效氮含量比低海拔低,植物生长对氮素需求较高[14]。随着全球气候变化和森林演替,戴云山南北坡黄山松出现枯损、被毛竹林和以壳斗科为代表的山地常绿阔叶林替代等现象,并有持续扩大趋势。这可能加大植被对土壤氮素的需求,甚至造成缺氮的状况[15],所以在亚热带中山较高海拔地区,黄山松土壤有机氮解聚提供的小分子有机氮对维持土壤氮矿化供应至关重要。本研究以福建戴云山自然保护区内的黄山松林为研究对象,通过野外模拟大气氮沉降,分析不同氮添加量对土壤有机氮解聚酶活性的影响及其调控因素,研究结果有助于揭示土壤有机氮解聚酶对氮沉降的响应机理,在维持土壤有效氮含量和提高黄山松生态系统生产力发挥作用。
1 材料与方法
1.1 研究区概况
试验样地位于福建戴云山国家级自然保护区的黄山松林内(25°38′26″N,118°8′26″E),该区属于亚热带季风气候,年平均气温17℃,每年有雾期达140 d左右,有霜期达165 d左右。雨量充沛,降雨集中在每年生长季的3—9月,湿度较大,年相对湿度平均在80%以上,常年阴雨较多,日照较少,地貌以低山丘陵为主,地带性土壤为黑云母花岗岩发育的红壤,该地区总氮沉降量为约38 kg N hm-2a-1[16]。样地优势树种为黄山松,林下植被优势种为箬竹(Indocalamus),伴生植物有山茶花(Camelliaflower)、毛稔(Melastomasanguineum)等。
1.2 试验设计
于2017年在黄山松林样地内设置12个10 m×10 m的模拟氮沉降小区,所有试验小区朝向东方向,坡度25°—35°,海拔1480 m。黄山松林平均胸径范围32.93—36.23 cm,平均树高16.29—19.21 m,密度720—723 株/hm2,郁闭度0.80—0.83[17]。通过随机区组设计设置对照(CT,0 kg N hm-2a-1)、低氮(LN,40 kg N hm-2a-1)和高氮(HN,80 kg N hm-2a-1)3种处理,每种处理4个重复,每个试验d小区周围都有大于5 m宽的缓冲区。试验区从2018年5月开始氮添加,氮添加时间为生长季(3—9月),每月进行一次,氮添加形式为分析纯尿素[CO(NH2)2]。每次将尿素(LN,24.49 g;HN,48.98 g)溶解于20 L去离子水中,用背式喷雾器对各样区进行均匀的林下喷洒,对照样区则用等量的去离子水代替尿素溶液进行喷洒。
1.3 样品采集与处理
经过2年的氮沉降模拟实验,于2020年4月份在每个样区利用五点混合取样,去除表面植被后分别钻取0—10 cm和10—20 cm土层的土壤样品,带回实验室,剔除细根、碎石等杂质后,过2 mm筛后置于4℃冰箱储存,一部分样品用于土壤有机氮解聚酶活性、微生物生物量碳(MBC)和微生物生物量氮(MBN)测定;另一部分经过自然风干并过0.125 mm筛,用于测定土壤基本理化性质指标。
1.4 土壤分析方法
土壤酶活性的测定:采用苏州科铭生物技术有限公司的试剂盒测定,按照试剂盒说明书进行操作。在最佳反应条件下,采用比色法进行酶活性的测定。蛋白酶包括酸性蛋白酶(ACPT,EC 3.4.23.18)、中性蛋白酶(NPT,EC 3.4.21.14)和碱性蛋白酶(ALPT,EC 3.4.21.14)。参照Ladd和Butler(1972)[21]的方法,采用福林酚比色法测定;几丁质酶(Chi,EC 3.2.1.14)依据Wirth和Wolf等(1990)[22]的方法,通过二甲氨基苯甲醛比色法测定;漆酶(Lac,EC 1.10.3.2)参照Loncar等(2013)的方法,用ABTS氧化法测定[23];锰过氧化物酶(MnP,EC 1.11.1.13)依照Camarero等(1999)的方法[24],通过愈创木酚比色法测定;谷氨酰胺酶(GLS,EC 3.5.1.2)参考Shirfrin等(1974)的方法,用奈氏比色法测定[25];土壤芳基硫酸酯酶(ASF,EC 3.1.6.1)根据Tabatabai等(1970)的方法,采用对硝基苯胺比色法测定[26]。所测定酶的底物及特征吸收峰如表1所示。

表1 土壤有机氮解聚酶的种类、缩写、相应底物和特征吸收峰
1.5 土壤分析方法
采用Excel 2013和SPSS 21.0软件对数据进行统计分析。采用单因素方差分析(Tukey)检验不同氮添加处理土壤性质、有机氮解聚酶活性的差异显著性(α=0.05)。利用Canaco 5.0软件进行冗余分析,通过前向选择的方法探究氮添加处理下影响土壤有机氮解聚酶活性的关键因子。为消除不同量纲的影响,在进行冗余分析前,将环境因子(土壤性质和微生物生物量)的数据进行z-score标准化;同时,通过方差膨胀系数(VIF)检验了这些变量的多重共线性,发现各因子不存在显著的关联(VIF<15),符合分析要求[27]。绘图由Origin 2018软件完成,图表中数据为平均值±标准差(n=4)。
2 结果与分析
2.1 氮添加对土壤性质的影响
短期氮添加显著降低0—10 cm土层DOC含量(P<0.05),并显著增加0—10 cm和10—20 cm土层矿质氮含量(P<0.05),但对DON含量无显著影响。此外,氮添加显著增加了10—20 cm土层MBC的含量(P<0.05),但对土壤pH,TC,TN,TC/TN均无显著影响(表2)。
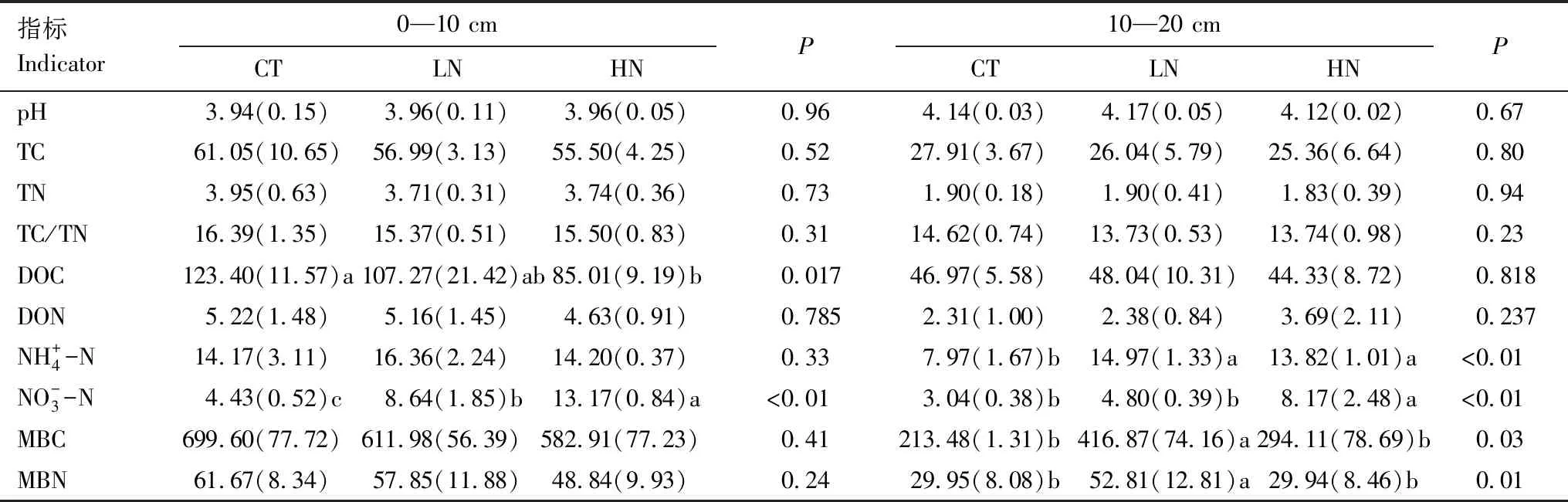
表2 氮添加对土壤性质的影响
2.2 氮添加对土壤有机氮解聚酶活性影响
氮添加显著降低了0—10 cm和10—20 cm土层Lac的含量,对Chi和ASF均无显著影响(图1)。同时,氮添加显著增加了0—10 cm土层MnP含量(P<0.05),但10—20 cm土层低氮处理下MnP含量显著增加(P<0.05)。此外,氮添加对表层部分土壤有机氮解聚活性的影响低于亚表层,其中氮添加对0—10 cm土层ACPT、ALPT、NPT和GLS均无显著影响,但10—20 cm土层高氮处理下的ACPT、ALPT、NPT显著降低,而GLS显著增加(P<0.05)。
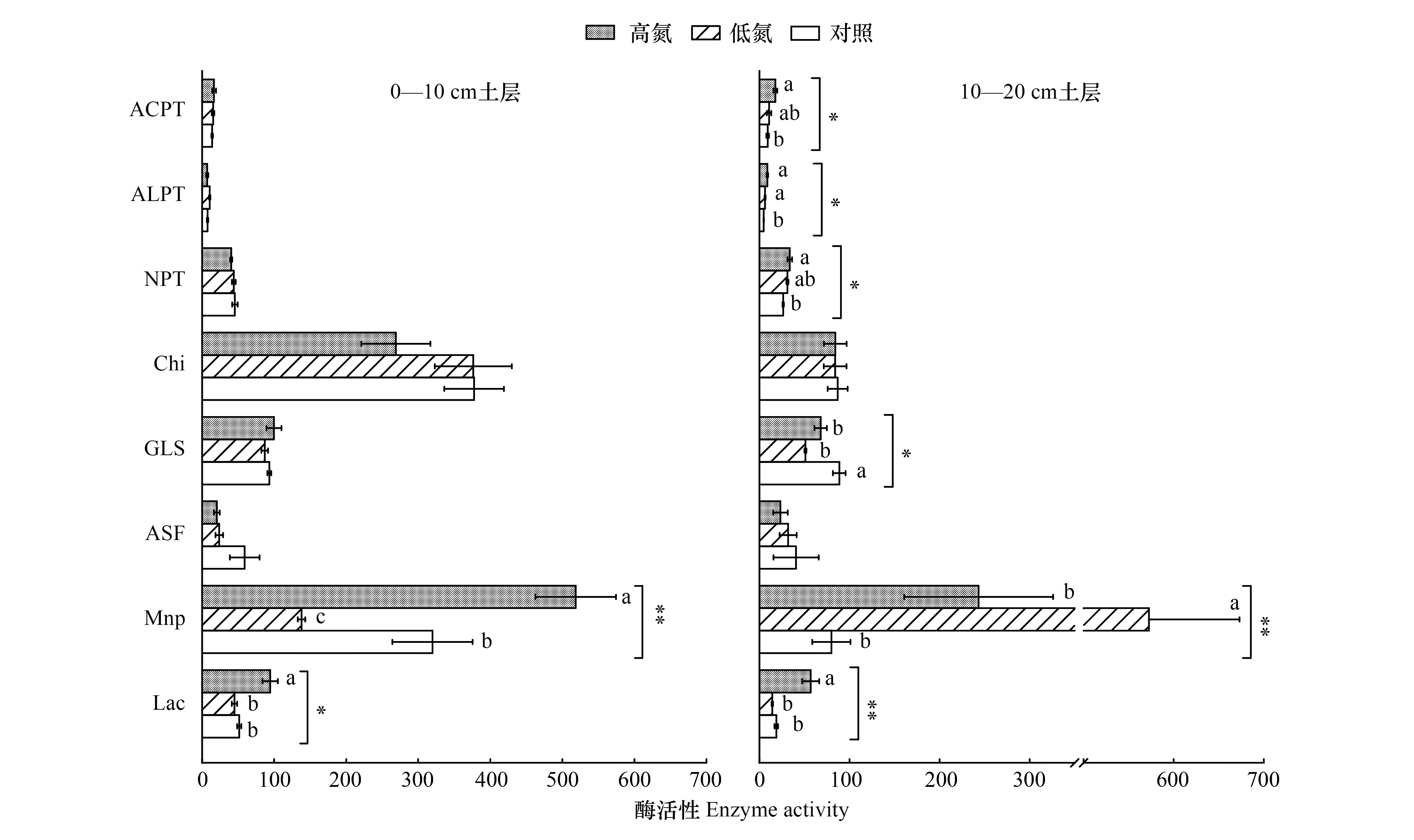
图1 氮添加对黄山松0—10 cm和10—20 cm土壤有机氮解聚酶活性的影响Fig.1 Effect of nitrogen addition on soil organic Nitrogen depolymerase activities of 0—10 cm and 10—20 cm soil layer of Pinus taiwanensis CT: 对照 control;LN: 低氮 low nitrogen; HN: 高氮high nitrogen; ALPT: 碱性蛋白酶 Alcalase protease; ACPT: 酸性蛋白酶 Acid protease; NPT: 中性蛋白酶 Neutral protease; Chi: 几丁质酶活性Chitinase; GLS: 谷氨酰胺酶 Glutaminase;ASF 芳基硫酸酯酶 arylsulfatase; MnP: 锰过氧化物酶 Manganese peroxidase; Lac: 漆酶活性 Laccase. 其中,Lac酶活性单位为nmol/min /g,MnP为nmol/d/g,其余酶活性单位为μg/h/g. 图中星号表示氮处理对酶活性的影响显著(*: P<0.05, **: P<0.05),不同小写字母表示不同氮添加量间差异显著(P<0.05)
2.3 土壤解聚酶活性的驱动因素

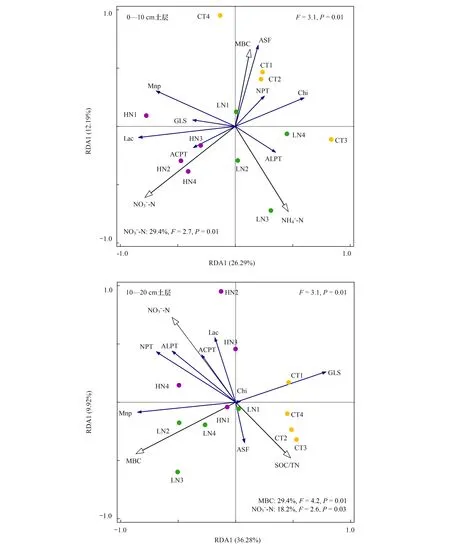
图2 氮添加对黄山松0—10 cm和10—20 cm土壤有机氮解聚酶活性的冗余分析Fig.2 Redundancy analysis of soil organic Nitrogen depolymerase activities of Pinus taiwanensis by simulated nitrogen addition ACPT: 酸性蛋白酶 Acid Protease; NPT: 中性蛋白酶 Neutral Protease; ALPT: 酪蛋白 Alcalase Protease; Chi: 几丁质酶 Chitinase; Lac: 漆酶 Laccase; Mnp: 锰过氧化物酶 Manganese Peroxidase; GLS: 谷氨酰胺酶 D-glutaminase; ASF: 芳基硫酸酯酶 Arylsulfatase
3 讨论
3.1 氮添加对土壤有机氮解聚酶活性的影响

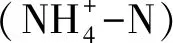
3.2 氮添加下土壤有机氮解聚酶活性的调控因素
尽管已有研究表明土壤底物会影响有机氮解聚酶的释放[9],但在本研究中氮添加对土壤TC、TN、DOC和DON并没有显著影响(表1)。显然,这些因素对有机氮解聚酶的直接影响不显著,这与武夷山黄山松林研究结论一致[11]。过去研究认为土壤pH控制蛋白水解酶的合成,如LAP氨肽酶、金属蛋白酶等在土壤pH值为7.2时活性最大,微生物群落组成受土壤pH值驱动并对肽酶活性有显著影响[43]。但是本研究发现氮添加并未显著影响土壤pH值。显然,底物限制和pH值并不是有机氮解聚活性影响的关键机制。
土壤微生物生物量是调控有机氮解聚酶活性变化的主要因素之一,本研究发现MBC对0—10 cm和10—20 cm土层土壤有机氮解聚酶活性影响最大(图2)。王丽君等[44]认为土壤酶活性和微生物生物量碳氮磷均存在显著的相关性,支持了本结论。郭银花等[45]发现氮添加加剧了土壤微生物碳限制,这可能是微生物生物量调控有机氮解聚酶活性对氮添加的响应的主要原因。本研究发现随着氮添加量增加,土壤MBC和MBN含量先升高后下降(表2),但是大多数解聚酶活性并没有呈现降低趋势。因此,MBC并不能完全解释高氮处理土壤有机氮解聚酶活性仍然保持较高原因。袁颖红等[46]研究表明氮添加处理不仅会增加土壤微生物生物量碳含量,还能提高微生物生物活性和微生物多样性指数。因此,微生物多因子的综合效应可能更有助于解释有机氮解聚酶活性的变化[44],这是未来进一步需要探索的一个方向。

4 结论


