半干旱草地土壤团聚体氮磷转化相关酶活性对氮添加的响应
邓 健,赵 雪,卢笑玥,张 丹,徐莉萍,朱 运,吴林豪,李江文,2
1 延安大学生命科学学院,延安 716100 2 陕西省红枣重点实验室(延安大学),延安 716100
人类活动导致的大气氮沉降影响着陆地生态系统的养分生物地球化学循环过程[1]。尤其是在受养分和水分限制的干旱半干旱地区,生态系统稳定性差,对气候变化十分敏感[2];日益严重的氮沉降导致生态系统氮、磷输入失衡[3],这可能会强烈改变土壤养分吸收和转化过程[4]。土壤微生物是养分循环的核心驱动力,而胞外酶调控是微生物调控养分循环的最主要过程[5]。氮转化相关的酶如β-1,4-N-乙酰氨基葡萄糖苷酶(β-1, 4-N-acetylglucosaminidase,NAG)和L-亮氨酸氨基肽酶(L-leucine aminopeptidase, LAP)主要参与蛋白质、核酸等的水解,促进氮素的释放[6];而磷转化相关的酶如磷酸单酯酶(phosphomonolipase, PME)、磷酸二酯酶(phosphodiesterase, PDE)可水解土壤有机磷中的酯键促进磷素转化,植酸酶(phytases, phyA)能够催化植酸盐水解成肌醇和磷酸,决定着土壤有机磷利用效率和磷素的有效性[7]。氮添加引起的土壤pH下降和养分含量提高会强烈干扰微生物胞外酶的分泌,例如氮添加导致土壤N∶P的升高会刺激微生物分泌更多磷转化相关胞外酶(如碱性磷酸酶)[8],催化稳定态无机磷水解和有机磷矿化[9];此外,N添加还会通过改变土壤pH、有机碳含量等其他途径影响酶活性[10]。然而,现有氮添加对土壤中养分转化相关的酶活性影响的研究存在增加[11]、减少[12]或者中性[13]等不同的影响结果。这说明氮添加影响土壤酶活性的机理还有待进一步深入探讨。
土壤团聚结构强烈地影响着养分转化过程,如不同粒级土壤团聚体中的理化环境和微生物特征存在显著差异[14]。大团聚体主要依靠微生物和有机物质的胶结作用形成,结构疏松,水分和氧气含量较多[15];其中的微生物数量和胞外酶活性也高,因此其养分转化速率较快[16]。小团聚体中氧气和水分少,微生物活性较低,有机质更加稳定,养分周转速率缓慢[17]。氮添加对不同粒级团聚体中土壤养分的差异性影响已经被观察到,如氮添加后,中国内蒙古草地土壤大团聚体中较小团聚体具有更高的磷含量[18],大团聚体中氮含量也会显著提高[19];这种团聚体之间的差异很可能来自于不同团聚体中土壤胞外酶对氮添加的差异化响应。然而目前对不同团聚体水平中养分转化所对应胞外酶的认识还十分有限,尤其是氮添加对团聚体中氮、磷转化相关酶的调控还缺乏深入认识。
黄土丘陵区属于典型的半干旱气候区,草地是该地区主要的土地利用类型之一[20]。当地的草地生态系统受到水分和养分的强烈限制,尤其是土壤磷素有效性较低;近年来不断增加的氮沉降引起不平衡的养分输入加剧了这一问题,并对土壤微生物酶促反应过程产生影响,这可能导致土壤的退化[21]。目前虽然对该区域氮沉降影响土壤养分循环的基本过程有了一定的认识,然而对团聚体水平上土壤性质和氮、磷转化相关的酶活性对氮沉降的响应并不清楚。因此,本研究的目的是分析草地不同粒级土壤团聚体中土壤理化性质和氮、磷转化相关酶活性对短期氮添加的响应特征,和团聚体水平上氮添加调控土壤氮、磷转化相关酶活性的关键影响因素。研究有助于加深对半干旱区氮沉降驱动的土壤养分循环过程的理解。
1 材料与方法
1.1 研究样地概况
研究区位于陕西省安塞区五里湾流域(36°52′N;109°21′E,海拔1061—1371 m)。该地区处于黄土高原腹地,具有典型的黄土丘陵沟壑地貌。研究区属于暖温带半干旱气候,年平均气温8.8℃,多年平均降水量505 mm。土壤主要为黄绵土(Calcaric Cambisols,FAO),平均土壤pH值为8.4。区域氮沉降主要形态为无机氮(铵态氮和硝态氮),自然氮沉降水平在10 kg N hm-2a-1到30 kg N hm-2a-1之间[22];研究样地初始土壤有机碳、全氮和全磷含量分别为3.88 g/kg、0.52 g/kg和0.67 g/kg,速效磷含量低至4.89 mg/kg(仅占全磷含量0.73%),以往研究也表明该区域草地受到强烈的磷限制[23]。
1.2 试验设计
研究采用野外施肥模拟氮添加控制试验,2017年3月在流域内选择典型的自然恢复草地作为试验样地,通过咨询当地农户了解土地利用历史获知该草地恢复年限约为30年。采用单因素随机区组试验设计。根据研究区域氮沉降水平为10—30 kg N hm-2a-1之间且在持续增加的特点,设置5个不同施氮水平的处理(0、10、20、40、80 kg N hm-2a-1,用N0、N1、N2、N3、N4表示),每个处理重复3次,共15个样方,样方面积9 m2(3 m×3 m),样方之间设置1 m的缓冲带以防止相互干扰。将15个样方分为3个区组,以减少潜在地形位置和养分异质性造成的误差。采用尿素(CH4N2O)作为氮添加剂;每年分四次将尿素溶解到1.5 L水中均匀喷洒。根据本区域主要为夏季湿沉降的特点,每年6月和9月分别施入全年氮添加量的1/3;3月和12月分别施入全年氮添加量的1/6;对照样方喷洒等量的水。
1.3 样品采集和土壤理化性质测定
于2020年8月采集土壤样品,沿着每个样方的对角线选择3个点,清除表层杂物后,用铝盒(20 cm×12 cm×6 cm)倒扣压入土中收集表层土,以避免破坏土壤结构。随即将土壤样本运送至实验室,并沿天然裂缝破碎成约1 cm3的小块。去除细根、碎石、动物和植物残留物之后,将同一样方的土样混合。采用最佳湿度筛分法进行团聚体分级[24],具体筛分方法为:首先将土壤鲜样在4℃的条件下进行冷却干燥,以达到10%的含水率。再将混合分取的土壤鲜样放置于由2 mm和0.25 mm孔径筛子组成的套筛上,以200 rpm的转速震动3 min,最终得到大粒级团聚体(>2 mm)、中粒级团聚体(0.25—2 mm)和小粒级团聚体(<0.25 mm)三个粒级的团聚体样品。每个粒级的土壤样本分为两部分,其中一部分储存在4℃下,用于测定土壤酶活性;另一部分置于阴凉处风干后测定土壤的理化性质。
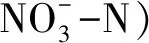
1.4 酶活性测定和计算
土壤酶活性测定采用96微孔板荧光光度法,使用多功能酶标仪(Synergy H4, BioTek)进行测定,其中β-1,4-N-乙酰氨基葡萄糖苷酶,亮氨酸氨基肽酶测定底物分别使用4-甲基伞形酮酰-β-D-吡喃葡糖酸苷(4-MUB-Nacetyl-β-D-glucosaminide)、L-亮氨酸-7-氨基-4-甲基香豆素盐酸盐(L-leucine-7-amino-4-methylcoumarin);磷酸单酯酶、磷酸二酯酶和植酸酶测定底物使用对硝基苯磷酸二钠(PNPP—NA2)和植酸钠(Sodium phytate),详细测定流程参考文献[26],酶活性以干土质量计算。
氮、磷转化相关酶活性计量比(EEAN∶P)采用对数转化后的计量比值:
EEAN∶P= ln(LAP+NAG):ln(PME+PDE+phyA)
1.5 数据处理
数据经过正态性检验和方差同质性检验后采用单因素方差分析(One-way ANOVA)研究氮添加和团聚体对酶活性的影响差异,采用DUNCAN法进行多重比较;采用Spearman相关分析研究不同团聚体水平土壤酶活性与土壤养分及化学计量比间的相关关系;采用偏最小二乘回归(Partial least squares regression, PLS)模型分析了氮添加对氮、磷转化相关酶的影响路径。所有的统计分析过程都通过R 3.6.2 (R Core Team, Vienna, Austria)来完成。数据和柱状图采用平均值±标准误表示,养分计量比均采用摩尔比。
2 结果
2.1 氮添加对土壤团聚体理化性质的影响


表1 氮添加对不同粒级团聚体中土壤理化性质的影响
2.2 氮添加对土壤团聚体氮、磷转化相关酶活性及酶计量比的影响
不同土壤团聚体中的土壤氮、磷转化相关酶活性对氮添加的响应有显著差异(P<0.05,图1)。PME、PDE和phyA活性均在三个粒级团聚体中均总体表现为先降低后升高的变化趋势,均在N2处理下最低(P<0.05)。不同粒级团聚体中LAP和NAG均随着氮添加水平的升高而显著升高(P<0.05)。小粒级和中粒级中氮、磷转化相关酶活性均高于大粒级。EEAN∶P在三个团聚体中都随着氮添加水平显著升高(P<0.05)。
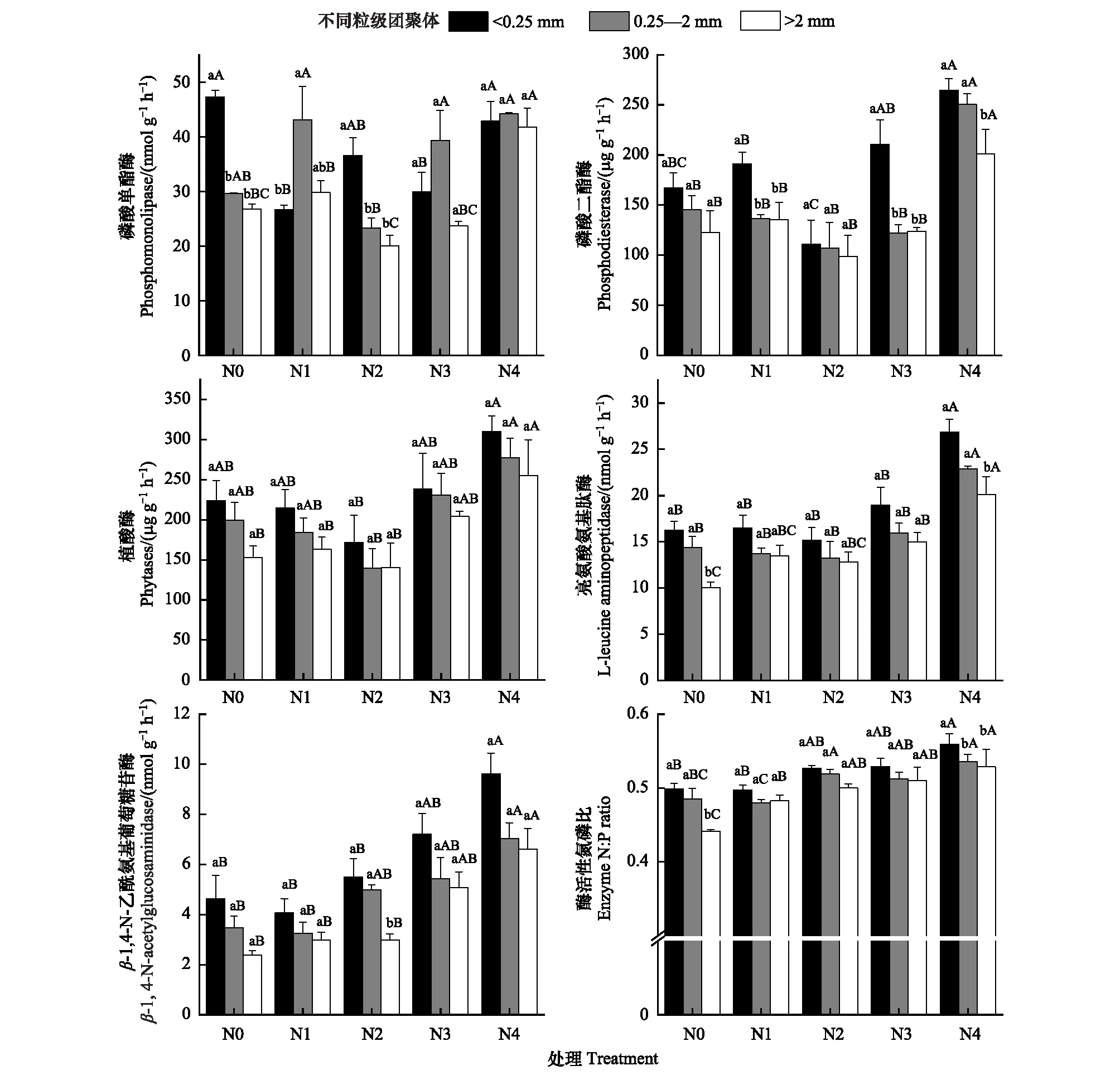
图1 氮添加对不同土壤团聚体中氮、磷转化相关酶活性及其计量比的影响Fig.1 Effects of nitrogen addition on the enzymes activities of related to nitrogen and phosphorus transformation and their stoichiometric ratios in different soil aggregates不同的大写字母表示不同氮添加水平之间存在显著差异(P<0.05);小写字母表示不同粒级土壤团聚体之间存在显著差异(P<0.05);N0、N1、N2、N3、N4表示5个不同施氮水平的处理(0、10、20、40、80 kg N hm-2a-1)
2.3 酶活性及其计量比和土壤基础理化性质的关系
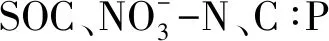
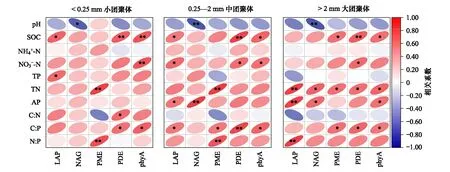
图2 不同团聚体中土壤酶活性和土壤基础理化性质的相关性Fig.2 Correlation coefficients between soil enzyme activities and basic soil physicochemical properties in different aggregatesSOC∶土壤有机碳 soil organic carbon;TN∶土壤全氮 total nitrogen;TP:土壤全磷 total 硝态氮 nitrate 铵态氮 ammonium nitrogen;AP:速效磷 available phosphorus;C∶N∶碳氮比 soil organic carbon: total nitrogen;C∶P:碳磷比 soil organic carbon: total phosphorus;N∶P:氮磷比 total nitrogen: total phosphorus;PME:磷酸单酯酶 phosphomonolipase;PDE:磷酸二酯酶 phosphodiesterase;phyA:植酸酶 phytases;NAG:β-1,4-N-乙酰氨基葡萄糖苷酶 β-1, 4-N-acetylglucosaminidase;LAP:亮氨酸氨基肽酶 L-leucine aminopeptidase;*表示在0.05水平下显著;**表示在0.01水平下显著

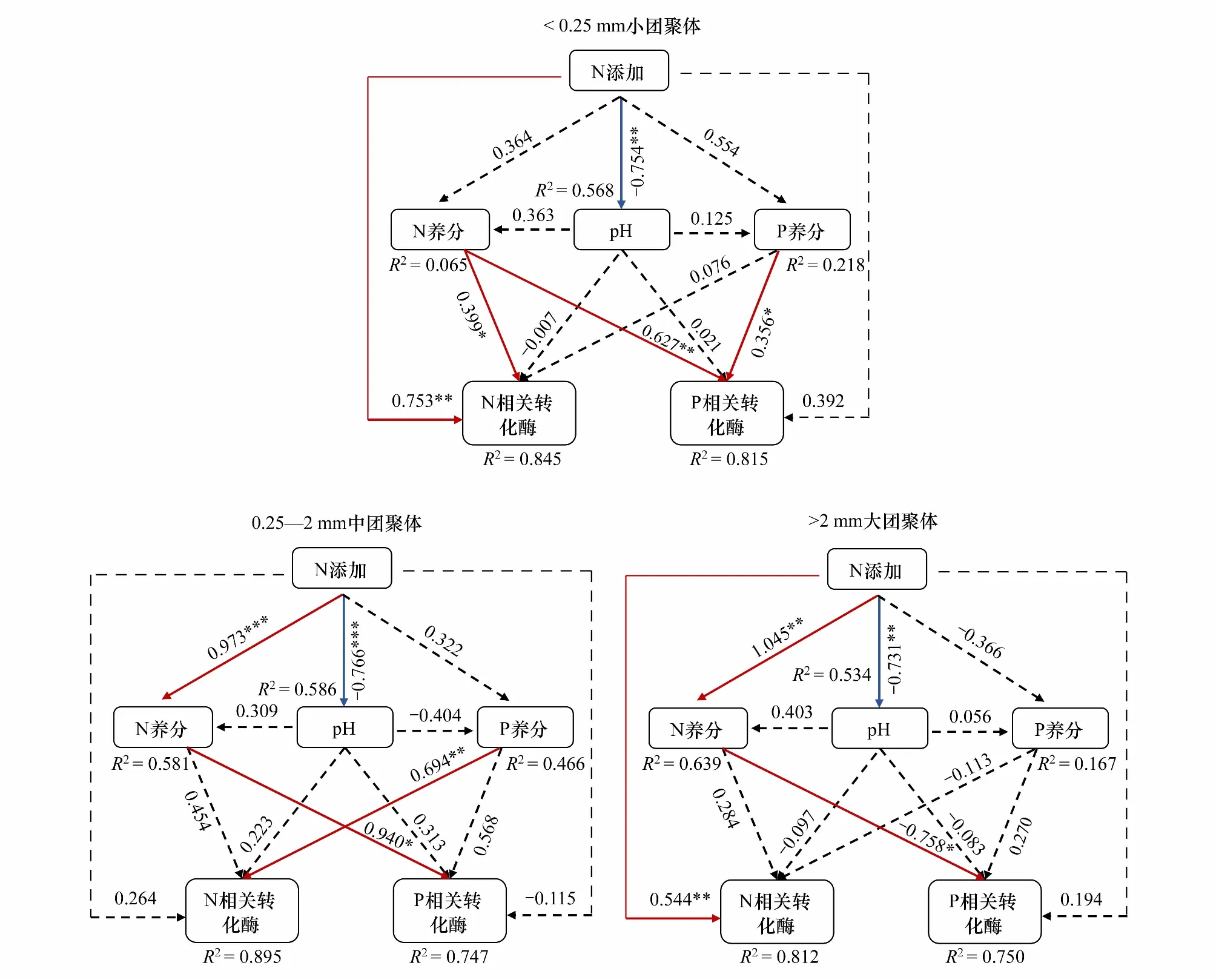
图3 氮添加对不同团聚体土壤氮、磷转化相关酶活性的影响Fig.3 Effects of nitrogen addition on soil enzyme activities related to nitrogen and phosphorus transformation in different aggregates采用氮添加梯度水平表示N添加;采用和表示氮相关养分;采用TP和AP表示磷相关养分;采用NAG和LAP表示氮转化相关酶;采用PME、PDE和phyA表示磷转化相关酶;虚线表示不显著;实线表示显著;红色表示正向影响;蓝色表示负向影响;*表示在0.05水平下显著;**表示在0.01水平下显著;***表示在0.001水平下显著
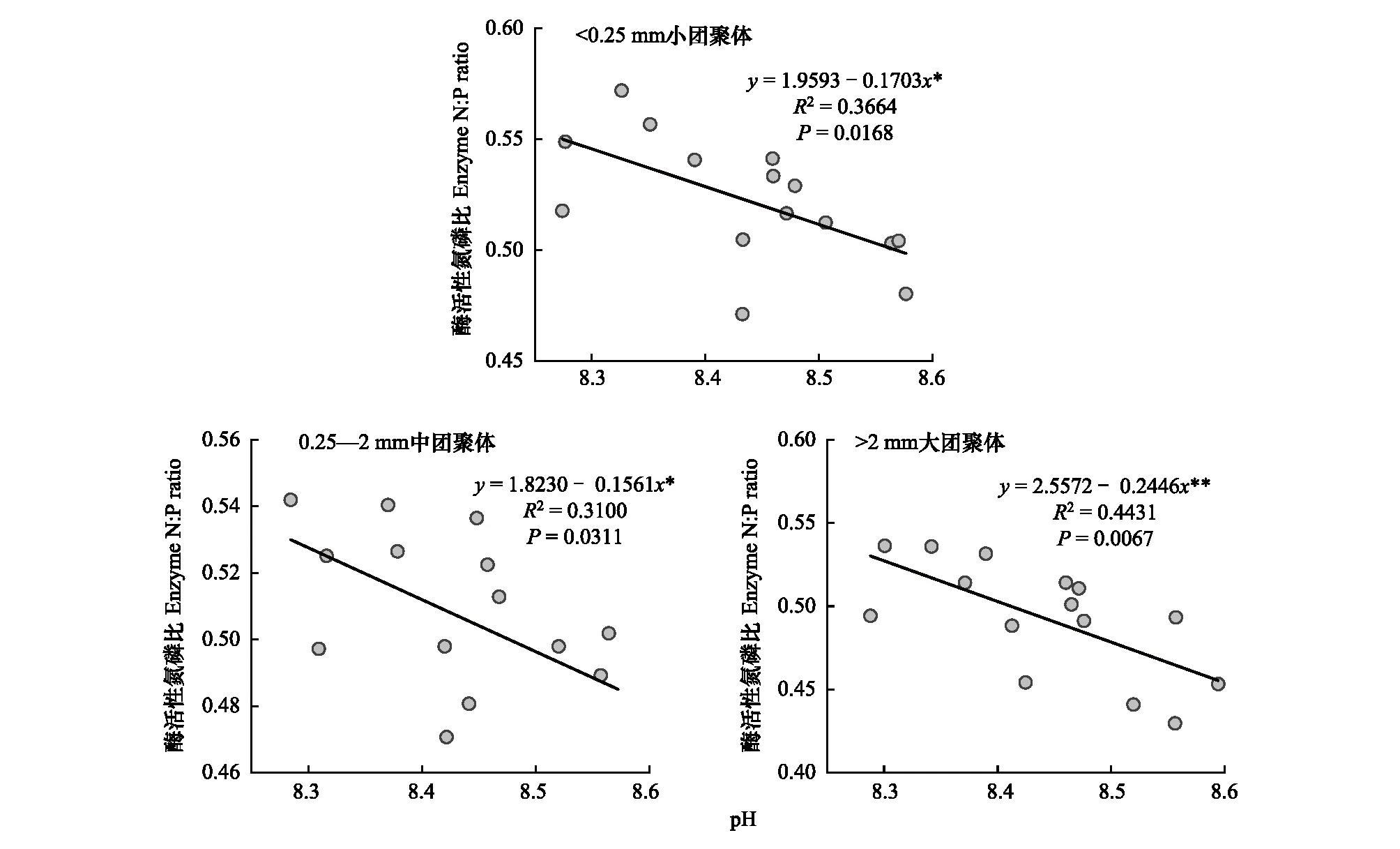
图4 不同团聚体土壤pH和酶活性氮磷比的关系Fig.4 The relationship between soil pH and nitrogen-phosphorus ratio of enzyme activities in different aggregates*表示在0.05水平下显著; **表示在0.01水平下显著
3 讨论和结论
3.1 氮添加后不同粒级团聚体酶活性和养分特征
由于不同土壤粒级的空间异质性和资源可用性不同[27—28],导致其中的微生物群落的组成、活性和多样性以及土壤酶活性也具有显著差异[29],例如随着团聚体粒径的减小,土壤氮、磷转化相关酶的活性反而显著增加[30]。本研究也发现PME、PDE、phyA、NAG和LAP等氮、磷转化相关酶在小团聚体中的活性显著高于大团聚体,此前在黄土高原地区的多项研究也均表明土壤碳、氮、磷转化相关酶活性均随着土壤团聚体粒级的减小而增加[31—32]。一方面,可能是团聚体物理结构差异导致的,小团聚体内部孔径小,养分和水分很容易通过扩散作用进入其内部,为微生物代谢和酶促反应提供更多可用基质,使得酶活性较高[33];而大团聚体孔隙大,结构相对疏松,总体稳定性低,土壤酶活性容易受到环境变化的影响,酶活性较低[34]。另一方面,不同粒级团聚体土壤底物质量的高低对酶活性也有影响[35]。土壤小团聚体通过矿物结合等过程对土壤有机质具有更强的保护作用,其有机质稳定性更高[36],因而其中的微生物需要分泌更多的胞外酶来获取所需养分资源;而大团聚体中新输入有机物多,更容易分解的有机体较含量高,微生物很容易从中获取所需养分[28,37]。此外,从微生物组成的角度,小团聚体中细菌多样性较高,而大团聚体中真菌多样性较高[38],相对于真菌,细菌对氮、磷等养分的需求更大,因而其在小团聚体中需要更多氮磷转化相关的酶来获取营养[27]。最后,本研究发现小团聚体中SOC、TP等养分含量总体高于大团聚体,可能是由于微团聚体中主要以稳定的腐殖质碳为主,而大团聚体中则主要以易分解、矿化的活性有机碳为主[39]。因此,小团聚体中有机碳不断累积富集,而大团聚体中的活性有机碳被微生物分解利用,导致土壤总有机碳含量小团聚体中高于大团聚体。
3.2 氮添加对土壤团聚体氮、磷转化相关酶活性的影响
本研究中氮添加对氮、磷转化相关的酶均有显著影响,尤其是高浓度氮添加导致了土壤团聚体磷转化相关的酶活性的显著增加,这与藏北高寒草地氮添加试验[40]和全球养分添加的Meta分析[41—42]的研究结果类似,都表明土壤磷酸酶活性会随着氮添加浓度的增加而增加。其主要原因是氮添加提高了土壤氮素含量及其有效性,导致土壤N∶P的升高(表1),导致微生物对磷的相对需求增加,因而通过分泌更多植酸酶、磷酸酶等磷转化相关的酶的方式获取代谢所需的磷元素[43],资源分配理论认为微生物胞外酶产量随着复合营养物质的投入和简单营养物质的匮乏而增加[44]。一般来说,氮添加引起土壤氮的可利用性增加[45],最终会限制氮转化相关酶(NAG+LAP)的活性[46]。然而本研究中,氮添加之后氮转化相关酶(NAG+LAP)的活性却有所升高,这与前人氮添加试验的研究结果类似[47—48],其原因可能来自于氮添加剂的影响。尿素作为有机氮被施入土壤之后,不能直接被微生物所利用吸收,因而微生物需要通过提高NAG、LAP酶的分泌来分解利用尿素[49];而如硝酸铵(NH4NO3)等无机氮添加剂施入土壤后,微生物可以直接利用吸收,因此氮转化酶(NAG+LAP)的活性反而降低[50]。
氮添加对土壤氮磷转化相关酶活性的影响特征及其路径在不同粒级团聚体中存在较大差异,这可能主要来自于不同粒级团聚体中基础养分含量及其物理性质的差异(图3)。尤其是在中粒级和大粒级团聚体中,氮添加通过影响土壤N相关的养分,从而显著调控P转化酶的活性(图3)。一方面可能是因为外部输入的养分更容易进入孔隙较大的大团聚体中,而小粒级团聚体对养分的物理保护作用比较强,因而大粒级和中粒级团聚体中氮素相关养分对外部氮添加的响应更加敏感[51],本研究中从N0到N4处理下大粒级团聚体中TN的增加幅度(72.90%)显著高于小粒级团聚体(-11.19%)也证实了这一推测。另一个可能的原因是微生物群落在大和中团聚体中具有更高活性,对土壤养分的周转更快[16],因而磷转化相关酶活性更容易受到土壤氮素变化的干扰;此前的研究结果也表明氮添加会显著改变土壤大团聚体微生物群落和酶活性,而对小团聚体微生物没有显著影响[52]。
氮添加导致的土壤pH下降(即酸化)也是其对酶活性调控的重要路径之一,且已经被广泛证实[53—55],主要是pH的降低可能改变土壤养分如磷、铁等元素有效性,并引起土壤微生物群落和土壤酶活性的显著变化[56]。但本研究虽然观察到了不同团聚体粒级中pH的显著下降(表1),但pH与除NAG活性外的其他酶活性均无显著关系,这与此前研究结论并不一致。尽管如此,本研究却发现土壤pH在不同团聚体粒级中均与土壤EEAN∶P呈显著负相关关系(图4,P<0.05)。这表明pH主要影响氮、磷转化相关酶活性的相对平衡特征,这很可能来自于pH对氮、磷转化功能微生物的调控[57]。土壤酸化可以直接改变土壤微生物群落组成[47],例如细菌的相对丰度和多样性都与pH值呈正相关[58],而且氮、磷转化功能微生物也对土壤pH比较敏感,例如pH是调控土壤phoD基因丰度和功能微生物群落的主要变量,而phoD基因则是编码磷酸酶基因的主要基因[54,59]。因此,未来有必要继续探索不同粒级团聚体氮磷转化功能微生物群落对氮添加引起pH变化的响应。
土壤水分也是影响土壤酶活性的关键因子之一,在半干旱地区一定范围土壤水分的升高能提高微生物活力和土壤氮磷转化相关酶活性[60],而氮添加可能会通过改变地表植被覆盖、有机物输入或改变土壤结构等影响土壤水分特征[61],由此引起土壤酶活性的变化。然而本研究对水分指标并未涉及,这可能导致对氮添加影响团聚体酶活性机理认识的不确定性,因此有必要在今后将水分因子纳入研究中。同时,本研究采用的最佳湿度筛分法在样品处理中需要将土壤水分调节到10%左右,而处理时不同粒级团聚体由于结构差异其水分散失比例不同[62],这有可能引起不同粒级团聚体中的酶活性的改变,这也会对研究结果产生一定的影响。
4 结论
本研究证实了草地不同粒级团聚体中参与土壤氮、磷转化相关的酶活性和土壤性质的差异化响应。总体上,磷转化相关的酶活性在低浓度氮添加下降低而在高浓度氮添加下增加,而氮转化相关的酶活性和EEAN∶P在不同氮添加水平下均显著增加;小粒级团聚体比大粒级具有更高的酶活性;氮添加通过改变土壤养分含量及其计量比(如TN、SOC、C∶P等)调控着土壤氮、磷转化相关的酶活性,其中大粒级和中粒级中对磷转化相关酶活性的调控主要是通过改变土壤氮素养分含量来实现;此外氮添加引起土壤pH的降低显著影响了不同团聚体粒级中土壤氮、磷转化相关的酶计量比。研究结果有助于预测未来氮沉降背景下半干旱区土壤的养分循环过程的变化,为草地管理提供一定理论依据。

