自闭特质对疼痛共情的影响:疼痛负性情绪和认知的中介作用*
张文芸 卓诗维 郑倩倩 关颖琳 彭微微
自闭特质对疼痛共情的影响:疼痛负性情绪和认知的中介作用*
张文芸1,2卓诗维1郑倩倩1关颖琳1彭微微1
(1深圳大学心理学院, 深圳 518060) (2深圳市光明区楼村小学, 深圳 518106)
已有研究提示自闭症个体的疼痛共情缺陷可能源于自身疼痛的异常。鉴于高自闭特质与自闭症的相似性, 本研究分别通过实验范式和问卷调查评估了状态和特质共情, 旨在刻画自闭特质、自身疼痛与共情之间的联系。在假双人疼痛共情范式中, 高自闭特质个体在目睹他人接受疼痛时P2响应更强, 不愉悦度评分更高, 且部分源于对疼痛的高恐惧水平。问卷调查结果发现, 自闭特质水平越高, 在共情特质量表的观点采择维度得分越低, 而个人痛苦维度得分越高, 其中疼痛恐惧和灾难化中介了自闭特质与个人痛苦之间的联系。因此, 高自闭特质个体表现出高水平的状态和特质情绪共情, 且部分源于对疼痛存在更为负面的情绪和认知。这支持从自身疼痛异常的角度去理解高自闭特质和自闭症群体的共情等社会功能障碍, 为临床治疗和干预提供了潜在的靶点。
自闭特质, 疼痛共情, 疼痛恐惧, 疼痛灾难化, 事件相关电位
1 引言
根据第五版《精神疾病诊断与统计手册》(The Diagnostic and Statistical Manual of Mental Disorder, DSM-5), 自闭症谱系障碍(Autism Spectrum Disorder, ASD)被定义为一种以“社会沟通和社会交往缺陷”和“重复刻板的行为和兴趣模式”为两大核心症状的神经发育障碍(American Psychiatric Association, 2013)。自闭特质是与ASD相关的行为、人格和认知特征集合(Sucksmith et al., 2011)。自闭特质在ASD和普通人群中均广泛存在, 只是严重性存在量化差异(Baron-Cohen, Wheelwright, Skinner et al., 2001)。高自闭特质群体的身心健康和社会功能问题不容忽视: 与低自闭特质个体相比, 高自闭特质个体存在更多的心理困扰和更高的自杀风险(Dow et al., 2021; Pelton & Cassidy, 2017), 社交技能相对较差, 参与人际互动的动机更弱, 亲社会行为更少(Austin, 2005; Cetinoglu & Aras, 2022; Kloosterman et al., 2011; Zhao et al., 2019)。双胞胎研究发现, 基因遗传特征解释了自闭特质水平变异的36%~87% (Constantino & Todd, 2003; Ronald et al., 2008), 且ASD个体家庭成员的自闭特质水平显著高于普通对照组(Pickles et al., 2000; Piven et al., 1997), 这提示自闭特质与ASD可能存在共享的基因表征。除了遗传模式上的高相似性, 高自闭特质与ASD个体在情绪、认知和行为等多方面也表现出相似性(Gökçen et al., 2014; Kunihira et al., 2006; Takahashi et al., 2013), 如更多的焦虑、较差的认知灵活性和贫乏的社交技能等。鉴于自闭特质和ASD的高相似性, 自闭特质研究不仅能促进理解ASD的生物学机制和开发干预策略, 还有助于改善高自闭特质群体的心理健康和社会功能。
共情(Empathy)是指个体对他人情绪和想法的感受及理解(Singer & Lamm, 2009), 在人际交往和亲社会行为中发挥着重要作用(Decety & Jackson, 2006; Jackson et al., 2005)。共情主要涉及情绪和认知两个成分, 其中情绪共情(Emotional Empathy)是对他人情绪和状态的感知和分享; 认知共情(Cognitive Empathy)使我们能够准确理解他人想法, 包括观点采择和心理理论能力(Decety & Lamm, 2006; Decety & Svetlova, 2012)。Baron-Cohen (2010)认为共情缺陷可能是ASD个体社会性特征障碍的主要诱因之一。以往研究较为一致地发现, ASD个体的认知共情存在缺陷(Song et al., 2019; Ziermans et al., 2019), 而在情绪共情上的研究结果充满争议。部分研究发现ASD个体表现出更强的情绪共情(Capps et al., 1993; Rogers et al., 2007), 例如Gu等人(2015)发现相比控制组, ASD组在观看躯体疼痛图片时(如刀切到手指等), 皮肤电反应更为强烈, 且前脑岛的激活更强。相反, 有研究发现ASD个体表现出更弱的情绪共情(Minio-Paluello et al., 2009), 如在观看他人讲述自身痛苦经历的视频录像后, ASD组报告了更低的不愉悦度评分(Santiesteban et al., 2021)。还有研究则支持ASD和普通个体在情绪共情上没有显著差异(Bird et al., 2010; Blair, 1999), 如在多维度共情任务中, ASD组对痛苦情境图片的唤起程度以及图片中主人公的同情关心程度评分均与对照组无显著差异(Dziobek et al., 2008)。因此, 尽管ASD个体存在共情缺陷的观点得到了广泛的认可, 有关共情缺陷的具体表现却有不同的观点, ASD个体在情绪共情上的异常及其机制有待进一步研究。
神经影像学研究表明, 个体在亲身经历疼痛和目睹他人疼痛时会激活相似的神经表征, 包括前脑岛、前中扣带回皮层和初级感觉皮层等(Lamm et al., 2011)。除了相似的神经表征外, 当普通个体的疼痛敏感性受药理学或非药理学操纵而升高或降低时, 其对他人遭受疼痛刺激的疼痛评分和脑响应也随之升高或降低(Mischkowski et al., 2016; Rütgen, Seidel, Riečanský& Lamm, 2015; Rütgen, Seidel, Silani et al., 2015), 例如服用了对乙酰氨基酚(一种止痛药)的被试不仅自身的疼痛敏感性降低, 对他人承受的痛苦也更不敏感, 说明止痛药在抑制自身躯体疼痛的同时, 也抑制了对他人痛苦的感知, 进而减少了共情体验(Mischkowski et al., 2016)。先天性疼痛不敏感的病人由于生理原因(体内缺乏疼痛受体), 自身没有体验过疼痛, 也较难对他人的疼痛感同身受(Danziger et al., 2009; Danziger et al., 2006)。这些研究结果均支持了共情的共享神经表征模型(Shared-representation Model of Empathy), 即个体对他人共情与自我感知有相似的心理和神经表征(Decety & Jackson, 2004; Jackson et al., 2005)。鉴于自身疼痛与疼痛共情的联系, ASD个体的疼痛共情缺陷可能源于自身疼痛异常。已有研究探讨了ASD个体的疼痛异常, 然而研究结果存在较大的异质性(Moore, 2015)。有的研究发现ASD个体对疼痛反应过度(Rattaz et al., 2013), 有的则发现ASD个体对疼痛反应不足或反应正常(Fründt et al., 2017; 李晋等, 2015)。最新的一项元分析研究系统考察了ASD和普通个体在疼痛敏感性上的差异(张文芸等, 2021), 结果发现ASD个体在压力疼痛和现实医疗疼痛上的高敏感性。
目前仅有两个研究探讨了ASD个体自身疼痛和疼痛共情之间的联系(Chen et al., 2017; Fan et al., 2014)。Fan等人(2014)发现ASD个体对自身疼痛表现出高敏感性(低压力疼痛阈限); 在观看他人处于疼痛情境的图片时, ASD个体在初级/次级躯体感觉皮层的激活更强, 而前中扣带回, 前脑岛等情绪共情相关脑区的激活更弱, 且对他人疼痛的不愉悦度评分更低; 自身疼痛敏感性介导了疼痛共情相关的初级/次级躯体感觉皮层响应和不愉悦度评分的关系。研究者认为这可能是由于ASD个体自身疼痛感知的高敏感性, 在被动观看他人疼痛时躯体感觉皮层的感觉运动共振响应会增强, ASD个体倾向于通过注意回避的方式来避免自身陷入过度的情感痛苦, 从而表现为情绪共情脑区的激活反而较弱,以及较低的不愉悦度评分。Chen等人(2017)的研究同样发现了相比发展障碍组和控制组, ASD组的压力疼痛阈限更低, 对他人疼痛的不愉悦度评分更低,且压力疼痛阈限和对他人疼痛的不愉悦度评分显著正相关, 这进一步支持了ASD疼痛共情的异常可能源于自身疼痛感知异常的观点。以上两个研究通过压力疼痛阈限评估了疼痛的感觉维度, 并建立了在ASD群体中疼痛感觉维度异常与疼痛共情异常的联系。然而, 疼痛是一种多维的主观体验, 不仅包括感觉层面(如对伤害性刺激的性质、位置和强度信息的辨别), 还包括情绪(如疼痛相关的恐惧和焦虑)和认知(如疼痛相关的灾难化和预期)等多个层面(Tracey, 2011; Wiech et al., 2008)。ASD个体疼痛相关的情绪和认知维度与疼痛共情的联系还有待研究。
ASD个体的认知和行为特征限制了对研究方法的选择, 例如普遍存在的言语和认知等障碍, 开展相关研究工作难度较大, 导致ASD相关研究被试样本量小, 结果可重复性低, 异质性高; 与ASD个体相比, 高自闭特质个体更能容忍结构化的测试环境, 完成更复杂的实验任务。为此, 本研究以高自闭特质群体为研究对象, 从状态和特质两个层面考察自闭特质对共情的影响。其中, 状态共情(State Empathy)是指由当下的相关情境所诱发的一种即时且暂时性的共情状态, 强调共情者与被共情者在暂时性的交互过程中所产生的共情状态(Davis, 1980); 特质共情(Trait Empathy)是一种相对稳定的人格特质, 指个体对他人情绪、疼痛等感受产生共情的一种普遍能力(Decety & Moriguchi, 2007)。实验1将以高低自闭特质被试为研究对象, 采用假双人范式, 刻画高低自闭特质组在亲身经历和目睹他人接受疼痛时的行为反应和事件相关电位(Event-related Potentials, ERPs)响应, 考察自闭特质是如何通过影响自身疼痛从而进一步影响对他人的状态共情反应。实验2将随机招募健康成年被试, 采用问卷调查方法, 考察普通人群中自闭特质、疼痛相关特质以及共情特质之间的联系, 检验疼痛相关特质在自闭特质与共情特质联系中的中介作用。
先前疼痛共情的ERP研究表明, 额顶叶N1、P2和N2成分更多地反映了早期加工过程, 与自下而上的情绪分享有关; 顶枕叶P3和LPP成分更多地反映了晚期加工过程, 与自上而下的认知评估有关(Cheng et al., 2014; Decety, 2011; Fan & Han, 2008; Sessa et al., 2014)。Fan等人(2014)的研究发现, 当要求被试判断图片材料为疼痛或非疼痛时, ASD组在加工疼痛和非疼痛图片刺激的N2响应上存在显著差异, 而在对照组上没有观察到这种差异, 这可能说明了ASD个体在疼痛共情的早期自动化加工阶段(如对他人疼痛的感知、情绪分享)的神经响应增强。鉴于高自闭特质和ASD群体的相似性, 本研究对实验结果提出假设1:相对于低自闭特质个体, 高自闭特质个体在特质和状态情绪共情上更强, 表现在特质共情量表的情绪共情维度得分更高, 在目睹他人接受疼痛时诱发更强的早期ERP响应(如N1和P2成分); 高自闭特质个体在特质和状态认知共情上更弱, 表现在特质共情量表的认知共情维度得分更低, 在目睹他人接受疼痛时诱发更弱的晚期ERP响应(如P3成分)。根据共情的共享表征理论, 个体对他人疼痛的共情反应部分依赖于自身疼痛的心理和神经表征。为此, 我们进一步提出假设2:自闭特质对疼痛共情的影响可能源于自身疼痛的改变, 即自身疼痛的特质或状态可以解释高自闭特质人群的疼痛共情表现。
2 实验1:高低自闭特质个体对他人疼痛共情的差异
2.1 方法
Baron-Cohen, S., Wheelwright, S., Skinner, R., Martin, J., & Clubley, E. (2001). The autism-spectrum quotient (AQ): Evidence from asperger syndrome/high-functioning autism, males and females, scientists and mathematicians.(1), 5−17.
由于式(18)中的模型似然函数是通过局部测量和局部测量单元的估算计算的,因此,如果有多个传感器测量可用,可以通过融合其他局部模型似然函数来更新.每个动作模式的更新局部似然函数表示为累积似然函数,即
依据已有的自闭特质研究(Dunn et al., 2016; Li et al., 2020; Meng et al., 2017; Meng et al., 2019; Peled-Avron & Shamay-Tsoory, 2017), 首先采用自闭商数量表(Autism-Spectrum Quotient, AQ)中文版(Liu, 2008)测查了1131名大学生的自闭特质, 根据AQ总分的分布情况(±20.08 ± 0.17), 按照前、后10%划分为低自闭特质组(LAQ; AQ ≤ 13)和高自闭特质组(HAQ; AQ ≥ 27), 然后从中随机招募一部分被试参加后续实验。根据G-Power软件(Faul et al., 2007)计算样本量, 使用中等的效果量(η2p= 0.25), 期望的功效值(1 – β = 0.80)以及显著性水平(= 0.05), 计算需要被试总样本量不少于24人。最终, 参加实验的LAQ组的被试数量为30名(男性16名; 年龄:20.77 ± 0.34岁), HAQ组被试数量为30名(男性15名; 年龄:21.30 ± 0.31岁)。所有被试均为右利手, 视力或矫正后视力正常, 且不存在急性、慢性疼痛或当前使用任何药物的医疗状况, 无精神病史。所有被试在实验前均被告知了实验程序, 并签署了知情同意书, 实验程序经深圳大学伦理委员会批准(PN-2021-022)。
2.1.2 量表施测
被试到达实验室后先进行量表填写, 其中AQ量表用于评估自闭特质, 疼痛特质量表(疼痛敏感性量表、疼痛恐惧量表和疼痛灾难化量表)用于评估疼痛相关的感知、情绪和认知, 以及人际反应指针量表用于评估共情特质。
2.1.5 实验任务
疼痛敏感性量表(Pain Sensitivity Questionnaire, PSQ, Quan et al., 2018; Ruscheweyh et al., 2009)包含17条目, 涵盖了日常生活中常见的疼痛类型, 分为2个维度:轻度疼痛和中度疼痛。采用0~10级计分, 0代表“无痛”, 10表示“极度疼痛”。PSQ总分越高, 代表个体的疼痛敏感性越高。本研究中, 该量表的Cronbach's α系数为0.90。
动物学家发现,在自然界中,很多动物都非常重情谊,会对死亡的同类进行悼念,其“葬礼”五花八门,有些“葬礼”还非常隆重呢!
Chamberlain, P. D., Rodgers, J., Crowley, M. J., White, S. E., Freeston, M. H., & South, M. (2013). A potentiated startle study of uncertainty and contextual anxiety in adolescents diagnosed with autism spectrum disorder.(1), 1−11
疼痛灾难化量表(Pain Catastrophizing Scale, PCS, Sullivan et al., 1995; Yap et al., 2008)包含13条目, 用来评估个体关于疼痛的情感和认知态度, 分为3个维度:反复思虑、夸大和无助。采用0~4级计分, 0代表“从来没有”, 4代表“总是如此”。PCS总分越高, 代表个体的疼痛灾难化水平越高。本研究中该量表的Cronbach's α系数为0.92。
育成期饲养试验结束后(鸡只13周龄末),随鸡群转入产蛋舍进行后续产蛋性能的记录。从见蛋开始记录每个处理产蛋数与产蛋率,连续观察10 d。
一任任东家如同走马灯,旧调重弹的背后是新人不再年轻,昔年盛誉篮坛的“山东青年军”已然老去,他们在黄金年龄没有匹配上一家有着足够耐心、足够专注的俱乐部,夺冠的梦想渐行渐远,山东男篮的商业品牌价值也在这一轮轮折腾中逐渐式微。
人际反应指针量表(Interpersonal Reactivity Index, IRI, Davis, 1983; Siu & Shek, 2005)包含22条目, 从共情的认知和情绪两个方面评估个体的特质共情能力, 分为4个维度:观点采择(Perspective Taking, PT)、个人痛苦(Personal Distress, PD)、共情关心(Empathic Concern, EC)和想象(Fantasy, FS)。采用0~4级计分, 0代表“不恰当”, 4代表“很恰当”。其中, 观点采择和想象维度被认为测量的是认知共情, 个人痛苦和共情关心被认为测量的是情绪共情。本研究中, 该量表的Cronbach's α系数为0.71。
A:问题既复杂也很简单:“你需要学会做妈妈”。学什么?怎么和孩子保持良好的互动?怎么和孩子对话?有质量的陪伴的基础就是亲子互动,在互动中,孩子的求知欲获得满足,你随时帮助孩子提高认知,学会思考与表达自己的想法和需求。你孩子没有这些该有的能力,这和你的陪伴质量直接相关。
2.1.3 疼痛刺激强度的校准
HAQ组对疼痛线索的恐惧均显著高于LAQ组, 面对他人疼痛时HAQ组的不愉悦度评分均显著高于LAQ组。采用中介分析探索了自闭特质、预期阶段线索诱发的疼痛恐惧、以及面对他人疼痛诱发的不愉悦之间的联系。如图3所示, 预期阶段疼痛恐惧中介了LAQ组和HAQ组在目睹他人疼痛时的不愉悦度评分差异。在这个中介模型中, 自闭特质(LAQ组和HAQ组)是预测因子, 线索诱发的疼痛恐惧是中介因子(自身疼痛, 他人疼痛和不确定条件的均值), 他人疼痛不愉悦度评分(确定和不确定条件的均值)是结果因子。Bootstrap中介效应检验显示, 总效应显著(= 0.40,= 0.12, 95%CI = [0.16, 0.64]), 直接效应显著(′ = 0.29,= 0.12, 95%CI = [0.05, 0.53]), 间接效应显著(×= 0.11,= 0.06, 95%CI = [0.01, 0.25])。这说明线索诱发的疼痛恐惧在自闭特质与疼痛情绪共情之间起到了部分中介作用。
2.1.4 实验设计
本实验为2 (组别:LAQ组, HAQ组) × 2 (疼痛对象:自身, 他人) × 2 (确定性:确定, 不确定)三因素混合设计, 其中组别为被试间变量, 疼痛对象和确定性为被试内变量。
AQ量表包含50条目, 涵盖了主要的自闭症状和行为模式, 分为5个维度:注意转换、社交技能、言语交流、细节注意和想象力。采用0~1级计分, 其中正向计分题选择“完全同意”或者“部分同意”计1分, 选择“部分不同意”或者“完全不同意”不计分, 反向题则相反。AQ总分分布在0~50分之间, 总分越高, 代表个体的自闭特质越高。本研究中, 该量表的Cronbach's α系数为0.91。
孵化厂的铁门这次是开的,周泽赡走进去,跟一个小伙子交涉起来。周泽赡用手比划着,小伙子点头,进屋抱了一只稍大的小鸡。他伸出手掌比划了个“五”,周泽赡给他钱,他点头装进兜里。
被试到达实验室后, 被告知将与一名搭档(实际为假被试, 由一名固定女主试扮演) (Cui et al., 2015; Peng et al., 2019; Rütgen, Seidel, Riečanský& Lamm, 2015)一起进行双人实验。如图1A所示, 被试在完成疼痛校准之后, 与假被试搭档坐在同一房间内相邻但以屏风相隔的两张桌子前, 开始正式的实验任务。
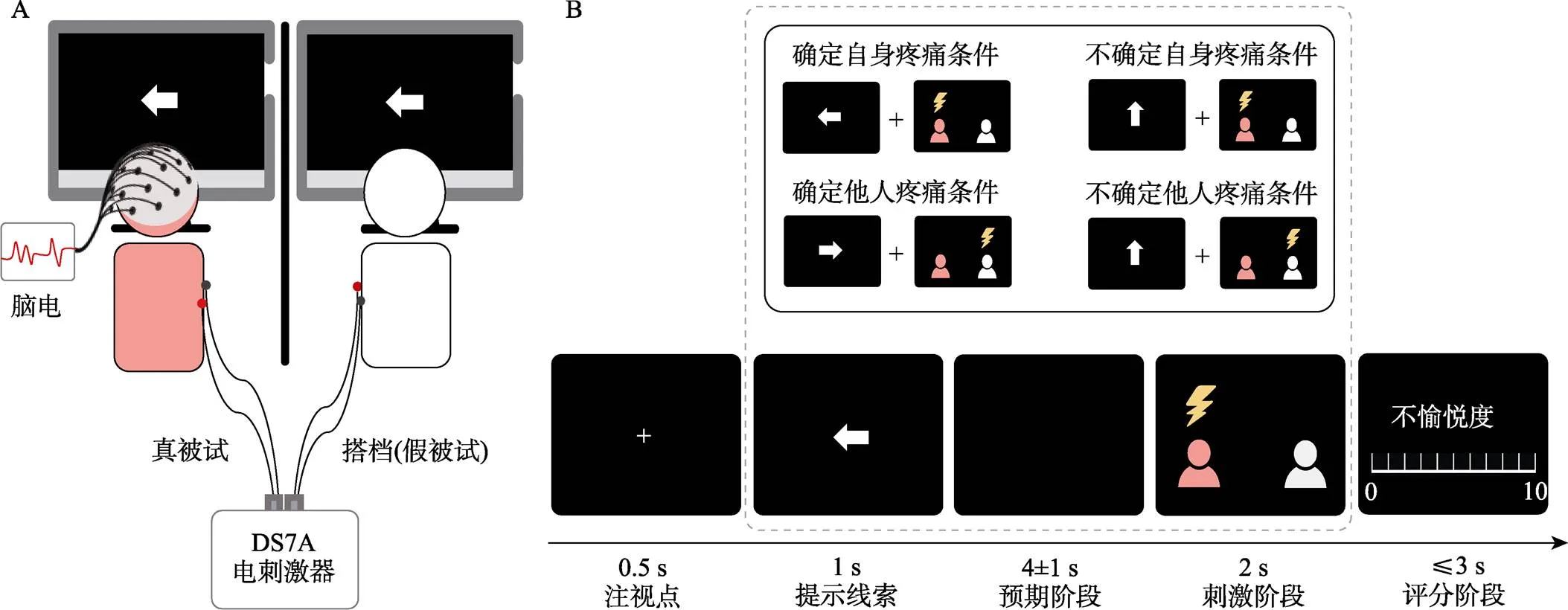
图1 假双人疼痛共情范式流程图
实验包含4个block, 每个block包含40个试次。正式实验开始前有5个练习试次以帮助被试熟悉实验流程。实验过程中, 被试左手无名指戴上一对指环电极。在指导语阶段, 告知被试整个实验过程中双方接受电刺激的比例均为50%。具体实验流程如图1B所示:首先屏幕中央会出现“+”注视点, 随后出现形为箭头的提示线索, 箭头方向预示接下来的疼痛的接受对象(左箭头:自身接受疼痛; 右箭头:他人接受疼痛; 上箭头:随机一方接受疼痛; 三种箭头的比例分别为:25%, 25%, 50%)。提示线索消失4 ± 1 s后, 疼痛刺激给出, 刺激结束后要求被试对自身体验到的不愉悦度进行按键评分(范围为0~10, 0代表“没有任何不愉悦”, 10代表“极度不愉悦”)。在每个block结束后, 被试评价看到三种不同类型箭头时的恐惧程度(评分范围为0~10, 0代表“没有任何恐惧感觉”, 10代表“极度恐惧”)。每两个block之间休息3~5分钟。实验过程中, 采用E-prime 3.0记录被试的行为数据, 并全程记录被试脑电。
2.1.6 脑电数据采集与分析
采用德国Brain Products公司的ERP记录系统, 按国际10-20系统扩展的64导电极帽记录被试的脑电活动情况。记录时参考电极位于FCz点上, 接地电极位于AFz点上。滤波带通为0.01~100 Hz, 采样频率为1000 Hz, 电极与头皮间的阻抗小于10 kΩ。
Heinzerling等[31]研究了8例使用ICIs免疫相关性严重心脏不良反应的病例,其中1例88岁转移性黑色素瘤患者使用帕博利珠单抗后出现心脏骤停,电除颤抢救4次,冠状动脉造影结果发现伴有冠状动脉痉挛所导致的冠脉一过性狭窄,超声心动图提示LVEF降至45%,临床伴随心功能不全症状。Plimack等[32]在1项非随机、开放的ⅠB期研究中应用帕博利珠单抗治疗局部晚期或转移性泌尿道癌(KEYNOTE-012),其中有33例PD-L1阳性患者,4例出现严重不良反应,心脏骤停1例。帕博利珠单抗治疗晚期转移性泌尿道癌(KEYNOTE-052)的试验中出现了1例Ⅲ级心力衰竭[33]。
EEG数据的预处理和分析采用MATLAB R2016b和EEGLAB 14.1.2工具包(Delorme & Makeig, 2004)。离线分析时, 将参考转换为双侧乳突平均值作为参考, 滤波带通为0.2~30 Hz。分析时程截取疼痛刺激呈现前500 ms至呈现后1000 ms, 并以刺激呈现前500 ms作为基线。对有严重伪迹干扰的试次进行手动排除, 眼动伪迹通过独立成分分析算法进行校正。
操作上,笔者建议的是采取逢低分批买入的策略,不建议大家总是试图想着一笔买在最低点,一笔卖在最高点。建议逢急跌、分批次、每次一点点的加仓建仓。同时,在介入前必须要做好相应的策略应对。每笔介入前,必须做到以下四点:
当自身接受疼痛刺激, 分析疼痛诱发的N1和P2成分; 当目睹他人接受疼痛刺激, 分析疼痛共情诱发的P2和P3成分。根据波形图, 地形图以及相关文献选取电极点和时间窗用于计算ERP成分的平均波幅(Liao et al., 2018; Peng et al., 2019)。在自身接受疼痛条件下, N1成分测量的电极点为C1、Cz、C2和FCz, 时间窗为110~140 ms; P2成分测量的电极点为C1、Cz、C2和CPz, 时间窗为270~ 300 ms。在他人接受疼痛条件下, P2成分测量的电极点为C1、Cz、C2和FCz, 时间窗为220~250 ms; P3成分测量的电极点为CP1、CPz、CP2和Pz, 时间窗为400~550 ms。
2.1.7 统计分析
采用SPSS 22.0及其插件PROCESS 3.2 (Hayes, 2012)进行统计分析。使用独立样本检验或卡方检验比较LAQ和HAQ组在性别、年龄、使用的刺激强度以及量表得分上的差异, 并采用了错误发现率法(False Discovery Rate, FDR)进行多重比较矫正。疼痛共情任务中的行为数据有预期阶段被试的疼痛恐惧水平评分, 以及疼痛阶段的不愉悦度评分。对疼痛恐惧水平评分进行2 (组别:LAQ组, HAQ组) × 3 (线索类型:自身, 他人, 不确定)的二因素重复测量方差分析, 对不愉悦度评分进行2 (组别:LAQ组, HAQ组) × 2 (疼痛对象:自身, 他人) × 2 (确定性:确定, 不确定)的三因素重复测量方差分析。对自身疼痛和他人疼痛诱发ERP成分的平均波幅, 分别进行2 (组别:LAQ组, HAQ组) × 2 (确定性:确定, 不确定)的二因素重复测量方差分析。若重复测量方差分析球形检验不通过则采用Greenhouse-Geisser法矫正。统计结果中进一步的两两比较均采用Bonferroni法进行矫正。中介分析采用偏差校正bootstrap方法。Bootstrap次数设置为5000次, 如果bootstrap 95%的置信区间不包含0, 则说明参数估计值显著; 反之, 则说明参数估计值不显著(Preacher & Hayes, 2008)。
2.2 结果
2.2.1 人口学变量和量表结果
如表1所示, LAQ组和HAQ组被试在性别和年龄上无显著差异。实验中用于诱发疼痛的电刺激强度无显著组间差异。在疼痛敏感性量表和疼痛恐惧量表得分上, LAQ组和HAQ组无显著差异。在疼痛灾难化量表得分上, HAQ组的PCS量表总分显著高于LAQ组((58)= −3.39,< 0.001), 表明HAQ组对疼痛存在更多的负面情绪和认知。在人际反应指针量表得分上, HAQ组的观点采择维度分数低于LAQ组(边缘显著) ((58)= 2.35,= 0.060), 表明HAQ组的认知共情能力更弱; HAQ组的个人痛苦维度分数显著高于LAQ组((58)= −5.33,< 0.001), 表明HAQ组的情绪共情能力更强; 在共情关心和想象维度上的得分不存在显著组间差异。
2.2.2 行为数据
预期阶段的疼痛恐惧评分如图2A所示。线索类型的主效应显著,(2, 57) = 30.43,< 0.001, η2p= 0.52。事后检验结果显示, 对不确定对象疼痛线索的恐惧水平显著大于自身疼痛线索(3.09 ± 0.31 vs. 2.70 ± 0.29,< 0.001), 对自身疼痛线索的恐惧水平显著高于他人疼痛线索(2.70 ± 0.29 vs. 1.34 ± 0.18,< 0.001); 组别的主效应显著((1, 58) = 63.90,= 0.014, η2p= 0.10), 即HAQ组对疼痛线索的恐惧水平显著高于LAQ组(2.97 ± 0.33 vs. 1.78 ± 0.33)。线索类型和组别的交互作用不显著。
4.3 术中放疗的职业防护 放射线和放射性核素对其从业人员的健康状况有很大的影响,在现代设备先进的情况下,仍应严格加强放射线装置及放射性核素的管理和监护,强化从业人员的防护意识[7]。放疗时,巡回护士应注意将手术间的所有门及通道控制好,将感应门由电动状态切换成手动状态,放疗前确认手术间内工作人员全部撤离,并在门及通道前摆放明显标识,防止职业暴露,避免职业损伤。
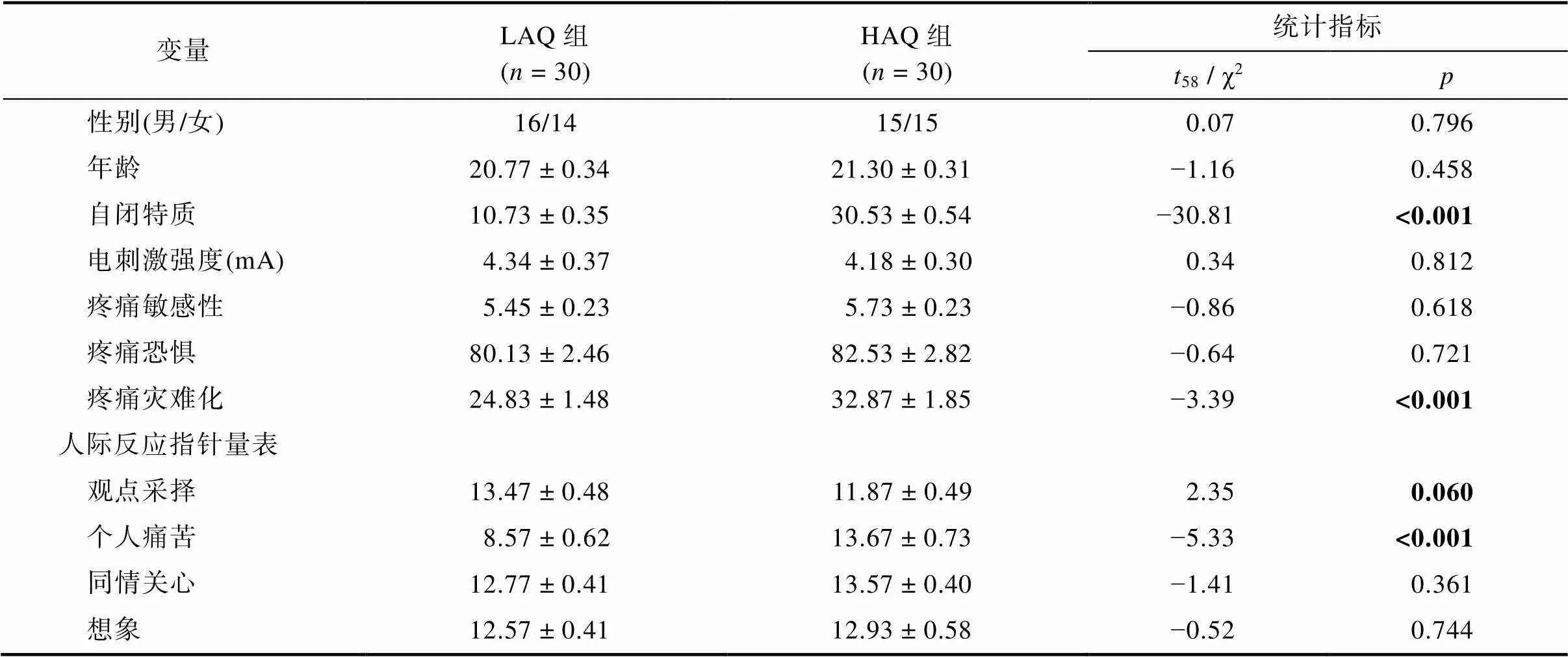
表1 LAQ组和HAQ组被试的人口学变量和量表统计结果(M ± SE)
注:LAQ:低自闭特质; HAQ:高自闭特质;:样本量; 显著性水平(< 0.05), 加粗表示显著。
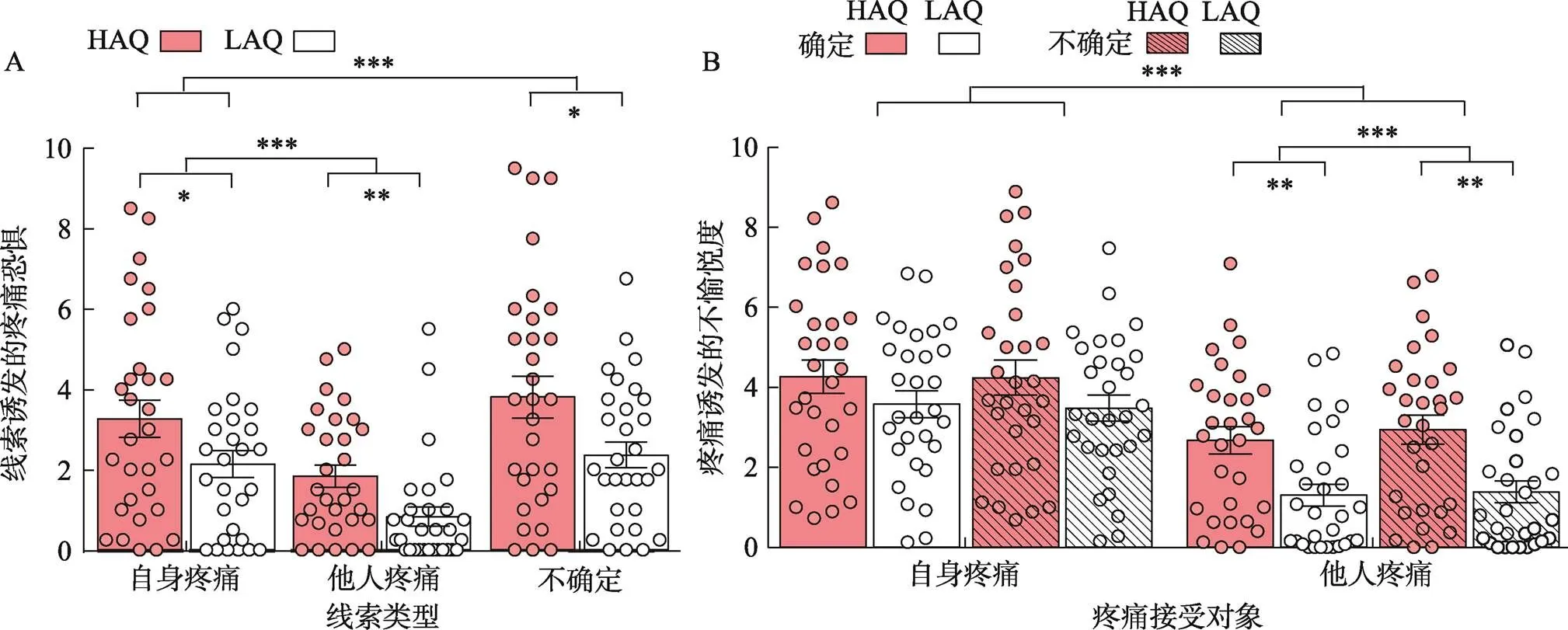
图2 假双人疼痛共情任务中的行为学结果
注:LAQ:低自闭特质; HAQ:高自闭特质; *< 0.05, **< 0.01, ***< 0.001。
疼痛体验阶段的不愉悦度评分如图2B所示。疼痛对象的主效应显著((1, 58) = 41.68,< 0.001, η2p= 0.42), 即自身疼痛的不愉悦度评分显著大于他人疼痛(3.89 ± 0.27 vs. 2.08 ± 0.22)。组别的主效应显著((1, 58) = 7.28,= 0.009, η2p= 0.11), 即HAQ组的不愉悦度评分显著大于LAQ组(3.53 ± 0.29 vs. 2.44 ± 0.29)。疼痛对象和确定性的交互作用显著,(1, 58) = 15.18,< 0.001, η2p= 0.21。简单效应分析发现, 当目睹他人疼痛时, 不确定情境下的不愉悦度评分显著大于确定情境下的评分(2.16 ± 0.25 vs. 1.99 ± 0.23,= 0.001); 当自身接受疼痛时, 不愉悦度评分在不确定和确定情境无显著差异(3.86 ± 0.28 vs. 3.92 ± 0.27,= 0.157)。疼痛对象和组别的交互作用边缘显著,(1, 58) = 3.06,= 0.086, η2p= 0.05。简单效应分析发现, 面对他人疼痛时HAQ组的不愉悦度评分均显著高于LAQ组(2.81 ± 0.35 vs. 1.34 ± 0.27,= 0.002), 而在面对自身疼痛时两组的不愉悦程度无显著差异(4.25 ± 0.43 vs. 3.53 ± 0.33,= 0.184)。其它主效应和交互效应均不显著。
疼痛刺激由一台恒压电刺激仪产生(DS7A, Hertfordshire, UK)。正式实验前, 被试需进行两轮的刺激响应曲线测量, 用于确定实验中所用的疼痛刺激强度。在被试左手无名指上戴上一对指环电极, 一系列电流刺激通过指环电极传递给被试。每个刺激由若干个快速连续的恒流方波脉冲组成, 电刺激的起始电流强度为0.5 mA, 步长为0.5 mA, 刺激间隔为4000~6000 ms, 脉宽为0.5 ms。每个刺激结束之后, 被试对体验到的疼痛强度进行评分, 评分范围为0~10, 0代表“没有疼痛”, 10代表“极度疼痛”。两轮测量的间隔为3分钟左右。根据平均的刺激响应曲线, 确定能够诱发疼痛评分为6分的刺激强度(Yao et al., 2021; Zhou et al., 2019), 用于正式实验中的疼痛刺激。

图3 自闭特质对情绪共情的影响:疼痛恐惧的中介作用
注:LAQ:低自闭特质; HAQ:高自闭特质; 图中路径系数均为标准化回归系数; *:< 0.05, **:< 0.01。
2.2.3 电生理数据
自身疼痛和目睹他人疼痛诱发的ERP波形图和地形图如图4所示。当自身接受疼痛时, 对疼痛诱发的N1和P2成分的波幅进行二因素方差分析。对于N1成分, 主效应和交互作用均不显著(所有> 0.05)。对于P2成分, 确定性的主效应显著((1, 58) = 5.19,= 0.026, η2p= 0.08), 即不确定的情境下诱发的P2波幅显著大于确定的情境(20.37 ± 1.22 μV vs. 19.27 ± 1.16 μV, 图4 B)。组别的主效应, 组别与确定性的交互作用不显著(所有> 0.05)。
当目睹他人接受疼痛时, 对疼痛共情诱发的P2和P3成分的波幅进行二因素方差分析。对于P2成分, 组别的主效应显著((1, 58) = 4.39,= 0.041, η2p= 0.07), 即HAQ组在目睹他人疼痛时的P2波幅显著大于LAQ组(5.68 ± 0.74 μV vs. 3.50 ± 0.74 μV, 图4 D)。确定性的主效应边缘显著((1, 58) = 3.85,= 0.054, η2p= 0.06), 即不确定的情境下诱发的P2波幅大于确定的情境(4.92 ± 0.58 μV vs. 4.25 ± 0.54 μV)。组别与确定性的交互作用不显著(> 0.05)。对于P3成分, 确定性的主效应显著((1, 58) = 103.45,< 0.001, η2p= 0.64), 即不确定的情境下的P3波幅显著大于确定的情境(10.71 ± 0.80 μV vs. 5.62 ± 0.61 μV 图4 D)。组别的主效应, 组别与确定性的交互作用均不显著。
2.2.4 相关分析
在目睹他人疼痛时, HAQ组的P2的波幅显著大于LAQ组, 且不愉悦度评分显著高于LAQ组。进一步采用斯皮尔曼相关分析探索目睹他人疼痛诱发的P2响应与不愉悦程度之间的联系。如图5所示, HAQ组在目睹他人疼痛时P2的波幅与不愉悦度评分显著正相关,(28) = 0.43,= 0.017。然而, 在LAQ组, 目睹他人疼痛诱发的P2波幅和不愉悦度评分的相关不显著,(28) = −0.23,= 0.229。
3 实验2:自闭特质、疼痛和共情特质的联系
3.1 方法
3.1.1 被试
根据G-Power软件计算样本量, 参考以往探讨自闭特质和共情相关性的研究(Zhang et al., 2022; Zhao et al., 2019), 实验2设定相关系数绝对值为0.20, 期望的功效值(1 –= 0.80)以及显著性水平(= 0.05), 计算需要被试样本量不少于193人。最终实验2招募了381名健康大学生被试(男性202名; 年龄:20.95 ± 0.12岁)填写量表。所有被试不存在急性、慢性疼痛或当前使用任何药物的医疗状况, 无精神病史。
3.1.2 数据采集与分析
被试来到实验室后填写一系列的问卷量表, 包括AQ量表, 疼痛特质量表(疼痛敏感性量表、疼痛恐惧量表和疼痛灾难化量表), 以及人际反应指针量表。
采用SPSS 22.0和AMOS 24.0进行描述统计、相关分析和结构方程模型分析。使用皮尔逊相关分析检验自闭特质、疼痛特质和共情特质的关系, 并对值采用FDR进行多重比较矫正。在结构方程模型分析中,χ2、GFI、AGFI、CFI、NFI和RMSEA表示模型的拟合指数:(1) χ2/上限应小于2; (2) GFI和AGFI下限应大于0.90; (3) CFI和NFI下限应大于0.95; (4) RMSEA上限应小于0.06 (Hu & Bentler, 1999; Kline, 2016)。采用偏差校正bootstrap方法检验中介效应的显著性。Bootstrap次数设置为5000次, 如果bootstrap 95%的置信区间不包含0, 则说明参数估计值显著; 反之, 则说明参数估计值不显著(Preacher & Hayes, 2008)。
等把镇子上的这一季的柚子全卖光以后,除去付给乡亲们的柚子款和工资,宋娟足足净赚了40万元。次年,宋娟用这笔钱投资创办了一家农副产品公司,并先后把笋尖、土蕨、腌菜等数十种传统土特产开发成半成品或即食品,跻身全国各地超级市场,每年创值千万余元。

图4 自身接受疼痛和目睹他人接受疼痛诱发的ERP波形图、地形图和平均波幅
注:在波形图中, 红色虚线代表HAQ组在确定的情境(HAQ-Cer), 红色实线代表HAQ组在不确定的情境(HAQ-Uncer), 黑色虚线代表LAQ组在确定的情境(LAQ-Cer), 黑色实线代表低LAQ组不确定的情境(LAQ-Uncer); 白色突出显示的电极点为该成分纳入分析的电极点。平均波幅差异性检验结果如柱形图所示, 用±表示柱形图中的数据。Cer:确定; Uncer:不确定; *:< 0.05; ***:< 0.001。

图5 目睹他人疼痛诱发P2波幅与不愉悦度评分的相关散点图
注:LAQ:低自闭特质; HAQ:高自闭特质。*< 0.05。
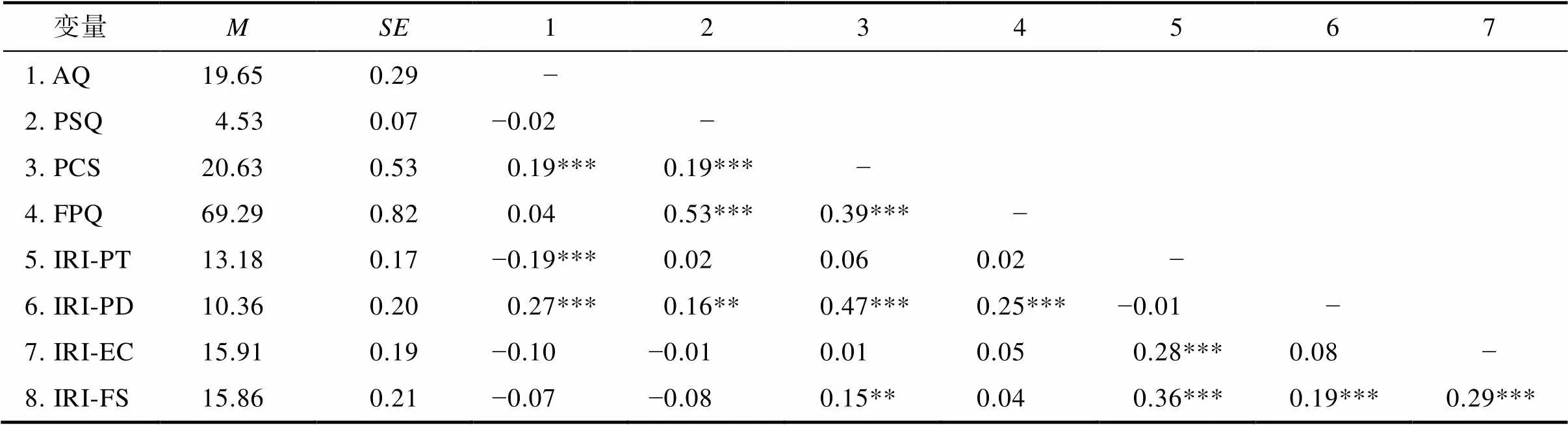
表2 各研究变量的描述统计结果及相关矩阵
注::平均值;:标准误; AQ:自闭商数量表; PSQ:疼痛敏感性量表; PCS:疼痛灾难化量表; FPQ:疼痛恐惧量表; IRI-PT:人际反应指针量表观点采择维度; IRI-PD:人际反应指针量表个人痛苦维度; IRI-EC:人际反应指针量表共情关心维度; IRI-FS:人际反应指针量表想象维度; *< 0.05; **< 0.01; ***< 0.001。
3.2 结果
3.2.1 共同方法偏差检验
本实验所有变量都采用自陈报告法收集数据, 可能会出现共同方法偏差问题。采用 Harman单因素检验进行检验, 将所有变量的项目进行未旋转的主成分因素分析。结果显示, 第一个因子解释的变异量为11.03%, 小于40%的临界值。这表明本实验的数据不存在严重的共同方法偏差。
3.2.2 描述性统计与相关分析
表2列出了各变量的平均数、标准误及变量间的相关系数。皮尔逊相关分析发现, 在自闭特质和疼痛特质的关系上, 自闭特质和疼痛敏感性、疼痛恐惧不存在相关关系; 自闭特质和疼痛灾难化显著正相关((379) = 0.19,< 0.001), 即自闭特质水平越高的个体, 对疼痛存在更强的负性情绪和认知。在自闭特质和共情特质的关系上, 自闭特质与观点采择显著负相关,(379) = −0.19,< 0.001; 自闭特质与个人痛苦显著正相关,(379) = 0.27,< 0.001; 自闭特质与共情关心和想象维度不存在相关关系。这说明高自闭特质个体在共情时表现出较弱的观点采择能力和较强的个人痛苦。此外, 在疼痛特质和共情特质的关系上, 疼痛相关的认知和特质情绪共情显著正相关, 即个体的疼痛灾难化水平越高, 人际反应指针量表的个人痛苦维度得分越高,(379) = 0.47,< 0.001; 疼痛相关的情绪和特质情绪共情显著正相关, 即个体的疼痛恐惧水平越高, 人际反应指针量表的个人痛苦维度得分越高((379) = 0.25,< 0.001), 即疼痛灾难化和疼痛恐惧水平越高的个体, 共情时越容易陷入个人痛苦。
对于职业院校学生来说,最重要的学习是学会学习,最有效的知识是自我控制的知识。学会学习、学会自我控制的知识是元学习的内容。在课堂教学中,在传授知识的同时要注重认知策略的渗透教学。“元学习的实质是通过认知结构的改善、非认知心理结构的改善来改善学习本身,优化学习品质”。所以,使学生学会学习培养学生的元学习能力有非常重要的价值:它不仅能调动学生学习的主动性、自觉性,充分发挥其主体作用,从而增进学习效率,而且是培养学生自主精神和责任心的重要途径。
3.2.3 中介分析
在相关分析的基础上, 我们进一步测试了疼痛负性情绪和认知是否中介了自闭特质和个人痛苦之间的联系。以自闭特质为预测因子, 个人痛苦为结果因子, 疼痛负性情绪和认知为中介因子(荷载因子为疼痛恐惧和疼痛灾难化)。构建的结构方程模型如图6所示, 相关的因子载荷均大于0.4。模型拟合指标如下:χ2/= 1.604 (= 0.205), GFI = 0.998, AGFI = 0.979, CFI = 0.997, NFI = 0.992, RMSEA = 0.040, 说明模型的拟合度较好。结果显示, 总效应显著(= 0.27,= 0.05, 95%CI = [0.17, 0.36],< 0.001), 直接效应显著(′ = 0.16,= 0.05, 95%CI = [0.07, 0.25],= 0.002), 间接效应显著(×= 0.11,= 0.04, 95%CI = [0.05, 0.19],< 0.001)。这说明疼痛负性情绪和认知在自闭特质对情绪共情的影响中起到了部分中介作用。
⑧方闻:《超越再现:8世纪至14世纪中国书画》,李维琨译,杭州:浙江大学出版,2011年,第164页。
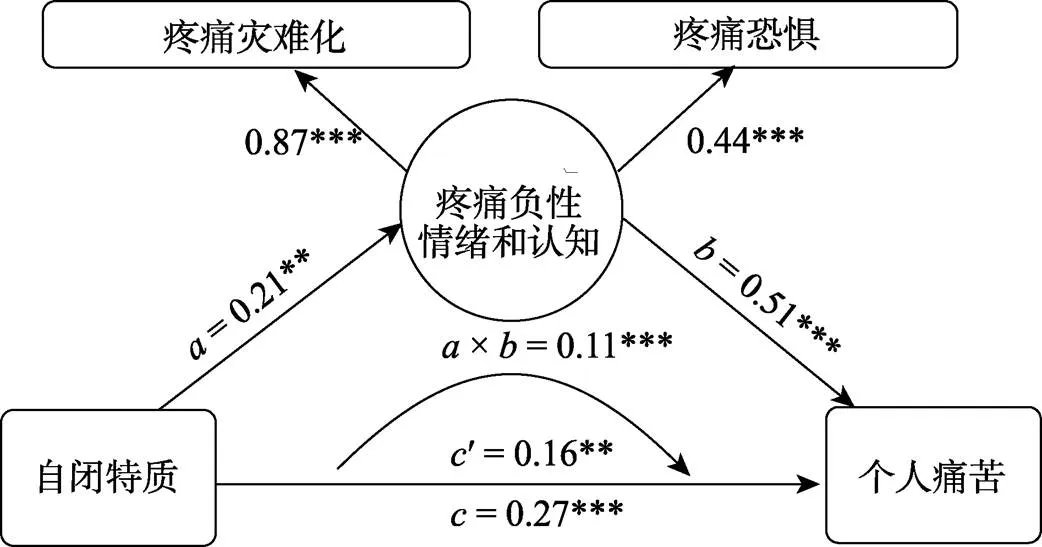
图6 自闭特质对情绪共情的影响:疼痛负性情绪和认知的中介作用
注:图中路径系数均为标准化回归系数; **< 0.01; ***< 0.001。
4 讨论
本研究结合假双人疼痛共情实验范式和问卷调查, 考察了自闭特质、自身疼痛与共情的联系。在假双人疼痛共情实验范式中, HAQ个体在目睹他人接受疼痛时P2响应更强, 不愉悦度评分更高, 且部分源于对疼痛的高恐惧水平。问卷调查结果发现, 自闭特质水平越高, 在共情特质量表的观点采择维度得分越低, 而个人痛苦维度得分越高, 其中疼痛恐惧和灾难化中介了自闭特质与个人痛苦之间的联系。因此, 来自状态共情和特质共情的研究结果均支持高自闭特质与高情绪共情有关, 且部分源于高自闭特质个体对疼痛存在更为负面的情绪和认知。
实验1采用“拟自闭症”研究(Robinson et al., 2011; 关荐等, 2015), 筛选普通人群中的高低自闭特质个体, 结合行为和ERP技术, 探究高低自闭特质个体在状态共情上的差异。在实验范式上, 本研究通过呈现线索刺激, 提示被试将亲身经历或目睹同伴(假被试)接受疼痛刺激, 并要求被试评价疼痛预期和感受阶段的情绪反应, 这可以实现在较为自然的情境下来刻画疼痛共情加工特点。当要求被试对即将到来的疼痛刺激进行评分时, HAQ组被试报告了更高的疼痛恐惧, 且与疼痛对象无关, 这说明HAQ组对疼痛存在更为负面的情绪反应。当亲身经历疼痛时, HAQ和LAQ组在疼痛诱发响应上无显著差异, 包括与感觉辨别有关的N1成分与情绪动机相关的P2成分, 且行为层面的不愉悦度评分也无显著差异。这主要是因为两组被试接受的疼痛刺激强度是经过个性化校准的, 也就是说实验中的疼痛刺激强度均可诱发中等强度的疼痛体验(评分为6/10)。当目睹他人接受疼痛时, 不管是确定还是不确定的情境, HAQ组的疼痛共情诱发P2响应显著强于LAQ组, 不愉悦度评分也更高。共情诱发的P3响应在HAQ和LAQ组无显著差异, 这提示自闭特质不能显著地影响疼痛共情的晚期认知评价过程。与此相似地, Fan等人(2014)采用躯体疼痛图片诱发共情反应, 发现当要求被试判断图片材料为疼痛或非疼痛时, ASD组和控制组在ERP的晚期成分(如LPP成分)上没有显著差异, 这提示ASD个体在疼痛共情的晚期认知评价加工阶段表现出与普通个体相似的神经响应。然而, 元分析结果表明ASD个体的认知共情显著弱于普通个体(Song et al., 2019), 其中认知共情的评估主要采用眼神读心任务(Baron-Cohen et al., 2015; Baron-Cohen, Wheelwright, Hill et al., 2001; Murray et al., 2017; Ponnet et al., 2004)、多维度共情任务(Dziobek et al., 2008; Mul et al., 2018)和情绪辨别任务(Eyuboglu et al., 2018; Zuluaga Valencia et al., 2018)。这些研究结果的差异性可能是因为不同的研究采用了不同的共情评估范式。目睹他人疼痛诱发的P2响应与早期、自下而上的情绪唤起和分享过程有关, 而P3成分更多地与晚期、自上而下的认知评价过程有关(Cheng et al., 2014; Decety, 2011; Fan & Han, 2008; Sessa et al., 2014)。其中, P2成分被认为主要产生于中扣带回皮层(Mobascher et al., 2009; Perchet et al., 2008), 该脑区被认为主要编码了疼痛的情感维度(Baumgärtner et al., 2006)。因此, HAQ组被试在面对他人疼痛时, 有更强的情绪唤起, 体验到更多的个人痛苦, 即存在更强的情绪共情反应。相关分析发现, 对于HAQ组被试, 共情诱发的P2响应越大, 个人不愉悦度评分越高, 这一结果支持了P2响应可以反映共情有关的情绪唤起。鉴于HAQ组被试对即将到来的疼痛的恐惧程度以及面对他人疼痛的个人不愉悦度均强于LAQ组被试, 进一步的中介分析揭示了自闭特质通过增强了对疼痛的恐惧水平, 从而进一步增强疼痛共情的个人痛苦程度。这为自闭特质、疼痛相关的负性情绪与情绪共情之间的联系提供了证据, 并强调了疼痛负性情绪在自闭特质影响情绪共情中所发挥的作用。
先前研究发现ASD个体的不确定性容忍度低(Chamberlain et al., 2013; Neil et al., 2016), 例如Vasa等人(2018)对比57名7~16岁ASD儿童与 32名典型发展儿童发现, 无论是父母报告还是自我报告, ASD儿童的不确定性容忍度均极其显著的低于典型发展儿童。为此, 本研究在实验设计时引入了确定性这一变量。结果发现确定性会影响面对他人疼痛的不愉悦度评分、P2和P3响应(确定性主效应显著), 即不确定情境下的他人疼痛会诱发更高的不愉悦度评分, 以及更强的P2和P3响应, 然而自闭特质对共情的影响与确定性无关(确定性与组别的交互作用不显著)。目前还尚未有研究探讨ASD群体的疼痛和共情异常是否与确定性有关。未来研究可以在ASD群体的疼痛和共情研究中引入确定性这一变量, 进一步验证本研究的结果。
实验2通过问卷调查来考察随机招募的普通人群中自闭特质、疼痛与共情特质之间的联系。在共情特质量表中, 观点采择维度考察个体理解且同时具有他人在真实生活中的心理或观点的倾向性, 被认为反映认知共情; 个人痛苦维度考察个体面对他人处于困境或压力情境时产生的自我中心式反应, 被认为反映情绪共情(Davis, 1983)。研究结果发现, 高自闭特质在面对他人痛苦时表现出较低的观点采择能力和较强的个体痛苦。因此, 在普通人群中, 高自闭特质与较差的认知共情能力和较强的情绪共情能力有关, 进一步支持了实验1中自闭特质与状态性情绪共情之间的联系(即HAQ个体在面对他人疼痛时表现出更为强烈的个人痛苦和情绪唤起)。在疼痛特质量表上, 疼痛恐惧和疼痛灾难化程度与共情特质的个人痛苦维度显著正相关, 且自闭特质和疼痛灾难化程度呈现正相关。鉴于自闭特质、疼痛负性情绪和认知以及共情特质的联系, 结构方程模型揭示了疼痛负性情绪和认知在自闭特质提高特质情绪共情中的中介作用, 进一步验证了实验1中的研究发现。在认知共情上, 本研究结果表明高自闭特质个体在特质和状态认知共情上存在不同的表现:在特质共情上, 自闭特质与认知共情呈现负相关, 即高自闭特质个体表现出更弱的认知共情能力; 在状态共情上, 高、低自闭特质个体在在目睹他人接受疼痛时诱发的P3成分无显著差异, 提示了自闭特质不会显著影响状态性的认知共情。与本研究相似地, 有研究报告了特质和状态共情的分离, 例如观察他人疼痛诱发的ERP响应均与共情特质量表得分无关(Galang et al., 2020; Li & Han, 2010); 目睹他人疼痛时双侧脑岛的激活与共情特质量表得分无显著关联(Jackson et al., 2005)。未来研究可以采用其他的共情评估范式, 如眼神读心任务和多维度共情任务, 进一步验证本研究的结果。
综合实验1和实验2的研究结果, 高自闭特质与更强烈的情绪共情有关, 即面对他人处于痛苦情景时呈现出更为强烈的自我中心式痛苦; 高自闭特质与更弱的认知共情有关, 即难以采择和理解他人的观点和想法。鉴于高自闭特质与ASD个体在感觉、情绪和认知等方面的高相似性, 本研究从亚临床的角度补充ASD人群共情缺陷的相关证据。以往研究表明:ASD个体普遍存在认知共情的缺陷(Song et al., 2019; Ziermans et al., 2019), 然而在情绪共情上结果分歧较大(Bird et al., 2010; Gu et al., 2015; Santiesteban et al., 2021)。例如, 有研究发现ASD个体能够自动模仿他人的面部情绪表情, 不存在情绪共情障碍(Oberman et al., 2009); 有研究发现在观看面部情绪表情图片时, ASD个体的皮电反应显著低于普通个体, 由此推断ASD个体的情绪共情能力较弱(Clark et al., 2008); 也有研究发现ASD个体对高兴和害怕表情的肌电反应显著强于对照组, 认为ASD个体存在情绪共情过度的情况(Magnée et al., 2007)。本研究结果提示高自闭特质和ASD群体可能并非系统性的共情受损, 而表现为较弱的认知共情和过度的情绪共情。其中, Fan等人(2014)认为过度的情绪共情可以部分解释ASD个体冷漠等外显社会行为表现:ASD个体在面对他人的痛苦时更容易引起过度的情绪共情, 因此倾向于通过注意回避的方式来进行避免, 故而外显出如冷漠、更少的亲社会行为等表现。因此, 在针对这些群体的共情干预上, 应该注意“扬长补短” (霍超等, 2021), 关注其在不同维度的不同表现, 才能指导共情缺陷干预方案的精准制定, 提升共情干预效果。
在自身疼痛上, 高自闭特质个体在疼痛灾难化量表的得分更高, 且在任务中对疼痛线索的恐惧水平更高, 即存在更为负面的情绪和认知; 但自闭特质与疼痛的感觉维度没有显著的联系。这提示我们自闭特质和疼痛之间的联系可能是维度特异的, 高自闭特质个体仅在情感和认知维度上反应更为敏感。与此相似地, 元分析研究发现ASD个体在疼痛阈限上与对照组没有显著差异, 但受到刺激模态的调节作用, ASD组的压力疼痛阈限更低(更敏感); 在疼痛诱发生理反应上, ASD组对现实医疗疼痛的生理反应强于对照组(张文芸等, 2021)。疼痛是一种多维的主观体验, 包括感觉、情感和认知等维度(Wiech et al., 2008)。疼痛阈限反映疼痛的感觉维度, 疼痛诱发生理反应往往反映疼痛的情绪和认知维度。因此, 元分析结果支持ASD个体在疼痛感觉维度上总体与普通个体无显著差异, 仅在情绪和认知维度上反应更为敏感。例如, ASD组在热痛阈限上和普通个体无显著差异, 但对于阈上热刺激的疼痛强度评分显著高于控制组, 且ASD组在疼痛焦虑量表和疼痛恐惧量表上的得分均显著高于控制组(Failla et al., 2020), 这支持了ASD群体在疼痛情感和认知维度的高敏感性。Gu等人(2018)对比了ASD 组和对照组在疼痛预期和加工阶段的神经响应, 结果发现, 在疼痛预期阶段, ASD 组在背侧和喙侧前扣带回的激活程度显著高于对照组, 而在疼痛加工阶段, 两组被试在疼痛相关脑区(如前扣带回和脑岛)的激活上无显著差异, 这说明ASD 个体可能在等待疼痛刺激时(预期阶段)存在更大程度的焦虑和恐惧。因此, 在自身疼痛上, 来自高自闭特质与ASD个体的研究结果存在相似性, 即高自闭特质和ASD个体对疼痛均存在更负面的情绪和认知方式。具体来说, 在面对实际疼痛或潜在疼痛时, 高自闭特质和ASD个体可能对疼痛的认知更负面, 在情感上存在更为焦虑和恐惧的反应倾向。鉴于高自闭特质和ASD群体对疼痛的反应倾向, 在现实医疗场景中(如打针或抽血等), 对待这些群体, 医务人员需要更加贴心和耐心, 如可以尝试事先跟其进行交流解释, 缓解他们的紧张恐惧情绪等。
来自状态共情和特质共情的研究结果均支持了疼痛相关的负性情绪和认知在自闭特质和情绪共情的联系中发挥着中介作用。高自闭特质个体在面对他人接受疼痛时报告更强的个人痛苦是由于自身对疼痛存在过度的负性情绪和认知。对疼痛相关信息的认知偏向矫正能有效缓解疼痛相关的负性情绪和认知(An et al., 2020; Elomaa et al., 2009; Sharpe et al., 2012; 杨周等, 2016) 。例如, 接受注意偏向矫正训练的急性和慢性疼痛患者(被训练将注意资源分配到中性信息), 在6个月后的追踪研究中, 其焦虑敏感性和功能丧失程度均比控制组更低(Sharpe et al., 2012); 接受解释偏向矫正训练的慢性疼痛患者(被训练将疼痛相关信息解释为中性), 其疼痛相关的负性情绪程度更低(An et al., 2020)。还有研究发现认知行为疗法能有效降低慢性疼痛患者对运动的恐惧、疼痛焦虑和疼痛警觉水平, 降低疼痛对患者日常生活的干扰(Elomaa et al., 2009)。因此, 未来研究可以进一步考察认知偏向矫正训练和认知行为疗法是否能通过降低疼痛的负性情绪和认知从而有效改善高自闭特质和ASD个体的社交技能。高自闭特质群体在人群中数量庞大, 该群体的身心健康和社会功能问题同样不容忽视, 因此本研究结果有助于理解普通人群中高自闭特质群体的疼痛和共情问题及其积极干预措施的开发, 促进其身心健康和社会性功能发展。此外, 鉴于高自闭特质和ASD群体的相似性, 本研究从亚临床的角度补充ASD人群共情缺陷的相关证据, 提示从自身疼痛异常的角度去解释他们的共情和社会功能的障碍, 还为ASD人群社会功能的改善提供新思路。
然而, 来自ASD群体的研究主要支持了疼痛感觉维度的高敏感性可以解释ASD群体的情绪共情问题(Chen et al., 2017; Fan et al., 2014)。Fan等人(2014)、Chen等人(2017)结合心理物理疼痛测量和图片诱发共情范式探索了ASD个体自身疼痛和疼痛共情的关系, 结果发现ASD个体的压力疼痛阈限低于普通个体, 且和图片诱发范式中对他人疼痛的不愉悦度显著正相关, 这说明了ASD个体在疼痛的感觉维度的高敏感性一步导致了疼痛共情时的高情感唤起。来自普通个体的研究发现, 疼痛感觉维度的敏感性通过影响疼痛相关情绪和认知进而影响情绪共情能力(Ren et al., 2020); 高疼痛灾难化的个体倾向于夸大自身疼痛, 也倾向于高估他人的痛苦(Sullivan et al., 2006); Serbic等人(2020)还发现观察者自身的疼痛恐惧水平能够正向预测观看躯体疼痛图片时的疼痛共情水平。这些证据均支持了观察者自身疼痛相关情绪和认知对疼痛共情的影响。有一种可能的解释是高自闭特质和ASD群体是因为对自身疼痛的高敏感性, 包括在疼痛感觉、情绪和认知维度上的高敏感性, 导致了在面对他人疼痛时表现出更为强烈的情绪唤起和个人痛苦。未来研究有必要结合主体的主观报告、生理反应、电生理和神经影像技术等系统考察高自闭特质和ASD群体在不同层面的疼痛加工模式, 包括感觉、情感和认知等层面的差异及其神经机制, 构建自身疼痛加工异常与共情障碍之间的联系。
本研究存在几处不足和局限。首先, 本研究的被试为来自同一所高校的健康大学生, 智力水平正常, 然而实验中我们并未测查被试的智力水平和其他的基本心理特质, 无法完全排除智力水平等因素对实验结果的影响。未来研究可以在匹配高低自闭特质群体智力水平等因素的前提下, 进一步验证自闭特质对疼痛和共情的影响。其次, 本研究的假被试(被共情者)为同一位女性实验人员, 这是为了降低不同假被试对实验结果造成的影响。然而, 考虑到ASD患病率的性别差异, 自闭特质对共情的影响可能受到被共情者性别这一因素的调节。未来研究可以引入不同性别的假被试, 验证共情者和被共情者的性别一致性是否会影响本研究的结果。再次, 在疼痛刺激强度的选择上, 本研究仅采用能诱发中等强度疼痛的刺激, 无法揭示刺激强度对实验结果造成的影响。未来研究可以采用不同强度的疼痛刺激, 并引入非疼痛的刺激条件作为对照条件, 考察自闭特质对共情的影响是否是疼痛特异的。最后, 本研究的研究对象为高自闭特质群体, 其结果能否迁移到ASD群体还有待研究。鉴于自闭特质和ASD的在遗传、认知和行为模式上的相似性, 本研究结果能促进ASD生物学机制的理解和干预策略的开发。然而, 高自闭特质不等同于ASD (Sasson & Bottema-Beutel, 2022)。自闭特质被视为除大五人格之外独立的第六特质(Wakabayashi et al., 2006), 自闭特质并非与ASD特异相关, 如焦虑症和精神分裂症等非ASD群体往往也表现出较高的自闭特质(Barlati et al., 2019; Lau et al., 2014; Tonge et al., 2016)。未来研究应在ASD群体中进一步验证ASD症状、自身疼痛与疼痛共情之间的联系。
5 结论
本研究结合假双人疼痛共情范式和问卷调查, 探讨了自闭特质、疼痛和共情之间的联系。高自闭特质与更强烈的情绪共情有关, 即面对他人处于痛苦情境时表现出更强烈的个人痛苦, 且部分来源于自身对疼痛存在更为负面的情绪和认知。然而, 高自闭特质与更弱的认知共情有关, 即难以采择和理解他人的观点和想法。鉴于高自闭特质和ASD群体的相似性, 相关研究结果不仅能促进理解ASD的生物学机制和开发干预策略, 还有助于改善高自闭特质群体的心理健康和社会功能。如从自身疼痛异常的角度去解释高自闭特质和ASD群体的共情和社会功能的障碍。未来研究应该结合多种疼痛刺激模态和多维度疼痛评估系统刻画高自闭特质和ASD个体的疼痛加工特点, 建立疼痛反应类型与共情障碍等核心症状之间的特异性关系。
Baron-Cohen, S., Bowen, D. C., Holt, R. J., Allison, C., Auyeung, B., Lombardo, M. V., Smith, P., & Lai, M.-C. (2015). The “reading the mind in the eyes” test: Complete absence of typical sex difference in ~400 men and women with autism.(8), e0136521.
An, J., Wang, K.-S., Jung, Y.-H., & Cho, S. (2020). Efficacy of interpretation bias modification in patients with chronic pain.(5–6), 648–662
Austin, E. J. (2005). Personality correlates of the broader autism phenotype as assessed by the Autism Spectrum Quotient (AQ).(2), 451−460
Barlati, S., Deste, G., Gregorelli, M., & Vita, A. (2019). Autistic traits in a sample of adult patients with schizophrenia: Prevalence and correlates.(1), 140−148
Baron-Cohen, S. (2010). Empathizing, systemizing, and the extreme male brain theory of autism., 167−175.
我国是一个水稻生产大国,水稻机械化种植水平却较低。全国水稻机械种植水平为16.71%,而重庆地区水稻种植机械化水平远低于全国水稻种植机械化水平,仅为7.69%[1]。机插秧技术的推广有利于突破制约水稻生产全程机械化的“瓶颈”,减轻劳动强度,提高当前的农业生产效率[2]。水稻作为重庆的主要粮食产物,其过低的种植机械化水平严重影响到了其产量的稳定性。因此,本文针对影响重庆地区水稻种植机械化的原因进行分析,总结插秧机在示范推广、使用过程中遇到的问题,提出有利于插秧机推广应用的建议。
American Psychiatric Association, DSM-5 Task Force. (2013).(Vol. 5): American psychiatric association Washington, DC.
Baron-Cohen, S., Wheelwright, S., Hill, J., Raste, Y., & Plumb, I. (2001). The “Reading the Mind in the Eyes” Test revised version: A study with normal adults, and adults with Asperger syndrome or high-functioning autism.(2), 241−251
2.1.1 被试
Baumgärtner, U., Buchholz, H.-G., Bellosevich, A., Magerl, W., Siessmeier, T., Rolke, R., ... Schreckenberger, M. (2006). High opiate receptor binding potential in the human lateral pain system.(3), 692−699.
Bird, G., Silani, G., Brindley, R., White, S., Frith, U., & Singer, T. (2010). Empathic brain responses in insula are modulated by levels of alexithymia but not autism.(5), 1515−1525.
Blair, R. J. R. (1999). Psychophysiological responsiveness to the distress of others in children with autism.(3), 477−485.
Capps, L., Kasari, C., Yirmiya, N., & Sigman, M. (1993). Parental perception of emotional expressiveness in children with autism.(3), 475−484.
Cetinoglu, E., & Aras, S. (2022). The Autism-Spectrum Quotient (AQ) Adolescent’s Version in Turkey: Factor Structure, Reliability and Validity.(7), 3260−3270.
疼痛恐惧量表(Fear of Pain Questionnaire, FPQ, McNeil & Rainwater, 1998; Yang et al., 2013)包含30条目, 用来评估个体的疼痛相关恐惧水平, 分为3个维度:轻微疼痛、严重疼痛和医疗疼痛。采用0~4级计分, 0代表“一点也不恐惧”, 4表示“极度恐惧”。FPQ总分越高, 代表个体的疼痛恐惧水平越高。本研究中, 该量表的Cronbach's α系数为 0.90。
Chen, C., Hung, A. Y., Fan, Y. T., Tan, S., Hong, H., & Cheng, Y. (2017). Linkage between pain sensitivity and empathic response in adolescents with autism spectrum conditions and conduct disorder symptoms.(2), 267−275.
Cheng, Y., Chen, C., & Decety, J. (2014). An EEG/ERP investigation of the development of empathy in early and middle childhood., 160−169.
Clark, T. F., Winkielman, P., & McIntosh, D. N. (2008). Autism and the extraction of emotion from briefly presented facial expressions: Stumbling at the first step of empathy.(6), 803−809.
Constantino, J. N., & Todd, R. D. (2003). Autistic traits in the general population: A twin study.(5), 524−530
Cui, F., Abdelgabar, A.-R., Keysers, C., & Gazzola, V. (2015). Responsibility modulates pain-matrix activation elicited by the expressions of others in pain., 371−378
Danziger, N., Faillenot, I., & Peyron, R. (2009). Can we share a pain we never felt? Neural correlates of empathy in patients with congenital insensitivity to pain.(2), 203−212.
Danziger, N., Prkachin, K. M., & Willer, J.-C. (2006). Is pain the price of empathy? The perception of others' pain in patients with congenital insensitivity to pain.(9), 2494−2507.
Davis, M. H. (1980). A multidimensional approach to individual differences in empathy., 10(85).
Davis, M. H. (1983). Measuring individual differences in empathy: Evidence for a multidimensional approach.(1), 113− 126.
Decety, J. (2011). Dissecting the neural mechanisms mediating empathy.(1), 92−108.
Decety, J., & Jackson, P. L. (2004). The functional architecture of human empathy.(2), 406−412.
Decety, J., & Jackson, P. L. (2006). A social-neuroscience perspective on empathy.(2), 54−58.
Decety, J., & Lamm, C. (2006). Human empathy through the lens of social neuroscience., 1146−1163.
Decety, J., & Moriguchi, Y. (2007). The empathic brain and its dysfunction in psychiatric populations: Implications for intervention across different clinical conditions., 22.
Decety, J., & Svetlova, M. (2012). Putting together phylogenetic and ontogenetic perspectives on empathy.(1), 1−24.
Delorme, A., & Makeig, S. (2004). EEGLAB: An open source toolbox for analysis of single-trial EEG dynamics including independent component analysis.(1), 9−21.
Dow, D., Morgan, L., Hooker, J. L., Michaels, M. S., Joiner, T. E., Woods, J., & Wetherby, A. M. (2021). Anxiety, depression, and the interpersonal theory of suicide in a community sample of adults with autism spectrum disorder.(2), 297−314.
Dunn, S. A., Freeth, M., & Milne, E. (2016). Electrophysiological evidence of atypical spatial attention in those with a high level of self-reported autistic traits.(6), 2199−2210.
Dziobek, I., Rogers, K., Fleck, S., Bahnemann, M., Heekeren, H. R., Wolf, O. T., & Convit, A. (2008). Dissociation of cognitive and emotional empathy in adults with Asperger syndrome using the Multifaceted Empathy Test (MET).(3), 464−473.
Elomaa, M. M., Williams, A. C. D. C., & Kalso, E. A. (2009). Attention management as a treatment for chronic pain.(10), 1062−1067.
Eyuboglu, M., Baykara, B., & Eyuboglu, D. (2018). Broad autism phenotype: Theory of mind and empathy skills in unaffected siblings of children with autism spectrum disorder.(1), 36−42.
Failla, M. D., Gerdes, M. B., Williams, Z. J., Moore, D. J., & Cascio, C. J. (2020). Increased pain sensitivity and pain-related anxiety in individuals with autism.(6), e861.
Fan, Y., & Han, S. (2008). Temporal dynamic of neural mechanisms involved in empathy for pain: An event-related brain potential study.(1), 160−173.
Fan, Y. T., Chen, C., Chen, S., Decety, J., & Cheng, Y. (2014). Empathic arousal and social understanding in individuals with autism: Evidence from fMRI and ERP measurements.(8), 1203−1213.
Faul, F., Erdfelder, E., Lang, A.-G., & Buchner, A. (2007). G*Power 3: A flexible statistical power analysis program for the social, behavioral, and biomedical sciences.(2), 175−191.
Fründt, O., Grashorn, W., Schöttle, D., Peiker, I., David, N., Engel, A. K., ... Bingel, U. (2017). Quantitative sensory testing in adults with autism spectrum disorders.(4), 1183−1192.
Galang, C. M., Jenkins, M., & Obhi, S. S. (2020). Exploring the effects of visual perspective on the ERP components of empathy for pain.(2), 186−198.
Gökçen, E., Petrides, K. V., Hudry, K., Frederickson, N., & Smillie, L. D. (2014). Sub‐threshold autism traits: The role of trait emotional intelligence and cognitive flexibility.(2), 187−199.
Gu, X., Eilam-Stock, T., Zhou, T., Anagnostou, E., Kolevzon, A., Soorya, L., Hof, P. R., Friston, K. J., & Fan, J. (2015). Autonomic and brain responses associated with empathy deficits in autism spectrum disorder.(9), 3323−3338.
Gu, X., Zhou, T. J., Anagnostou, E., Soorya, L., Kolevzon, A., Hof, P. R., & Fan, J. (2018). Heightened brain response to pain anticipation in high‐functioning adults with autism spectrum disorder.(6), 592−601.
Guan, J., & Zhao, X. (2015). Sub-threshold autistic traits in normal population: Its concept, structure and influencing factors.,(9), 1599−1607.
[关荐, 赵旭东. (2015). 基于正常人群的阈下自闭特质: 概念、结构和影响因素.(9), 1599−1607.]
Hayes, A. F. (2012).. In: University of Kansas, KS.
Hu, L.-T., & Bentler, P. M. (1999). Cutoff criteria for fit indexes in covariance structure analysis: Conventional criteria versus new alternatives.(1), 1−55.
Huo, C., Li, Z., & Meng, J. (2021). Empathy interventions for individuals with autism spectrum disorders: Giving full play to strengths or making up for weaknesses?.,(5), 849−863.
[霍超, 李祚山, 孟景. (2021). 自闭症谱系障碍个体的共情干预:扬长还是补短?.(5), 849−863.]
Jackson, P. L., Meltzoff, A. N., & Decety, J. (2005). How do we perceive the pain of others? A window into the neural processes involved in empathy.(3), 771−779.
Kline, R. B. (2016).. Guilford Publications.
Kloosterman, P. H., Keefer, K. V., Kelley, E. A., Summerfeldt, L. J., & Parker, J. D. A. (2011). Evaluation of the factor structure of the Autism-Spectrum Quotient.(2), 310−314.
Kunihira, Y., Senju, A., Dairoku, H., Wakabayashi, A., & Hasegawa, T. (2006). “Autistic” traits in non-autistic Japanese populations: Relationships with personality traits and cognitive ability.(4), 553−566.
Lamm, C., Decety, J., & Singer, T. (2011). Meta-analytic evidence for common and distinct neural networks associated with directly experienced pain and empathy for pain.(3), 2492−2502.
Lau, W. Y.-P., Gau, S. S.-F., Chiu, Y.-N., & Wu, Y.-Y. (2014). Autistic traits in couple dyads as a predictor of anxiety spectrum symptoms.(11), 2949−2963.
Li, J., Song, T., Meng, F., Li, H., Dai, Y., Han, S., Zhang, R., Han, J. (2015). Pain threshold in children with autism and age-matched typically developed children: A comparative study.,(12), 908–913.
[李晋, 宋天佳, 孟凡超, 李汉霞, 戴玉川, 韩松平, 张嵘, 韩济生. (2015). 孤独症与正常儿童的痛阈比较研究.(12), 908−913]
Li, W., & Han, S. (2010). Perspective taking modulates event-related potentials to perceived pain.(3), 328−332.
Li, X., Li, Z., Xiang, B., & Meng, J. (2020). Empathy for pain in Individuals with autistic traits influenced by attention cues: Evidence from an ERP study.(3), 294−306.
Liao, C., Wu, H., Guan, Q., Luo, Y., & Cui, F. (2018). Predictability and probability modulate the neural responses to other’s pain: An event-related potential investigation., 11−18.
Liu, M. (2008). Screening adults for asperger syndrome and high-functioning autism by using the Autism-Spectrum Quotient (AQ) (Mandarin Version).(1), 73−92.
[刘萌容. (2008). 自闭症光谱量表─autism-spectrum quotient 中文成人版之预测效度及相关因素分析.,(1), 73−92.]
Magnée, M. J. C. M., de Gelder, B., van Engeland, H., & Kemner, C. (2007). Facial electromyographic responses to emotional information from faces and voices in individuals with pervasive developmental disorder.(11), 1122−1130.
McNeil, D. W., & Rainwater, A. J. (1998). Development of the fear of pain questionnaire-III.(4), 389−410.
Meng, J., Li, Z., & Shen, L. (2017). Responses to others’ pain in adults with autistic traits: The influence of gender and stimuli modality.(3), e0174109.
Meng, J., Shen, L., Li, Z., & Peng, W. (2019). Top-down effects on empathy for pain in adults with autistic traits.(1), 8022.
Minio-Paluello, I., Baron-Cohen, S., Avenanti, A., Walsh, V., & Aglioti, S. M. (2009). Absence of embodied empathy during pain observation in Asperger syndrome.(1), 55−62.
Mischkowski, D., Crocker, J., & Way, B. M. (2016). From painkiller to empathy killer: Acetaminophen (paracetamol) reduces empathy for pain.(9), 1345−1353.
Mobascher, A., Brinkmeyer, J., Warbrick, T., Musso, F., Wittsack, H.-J., Saleh, A., Schnitzler, A., & Winterer, G. (2009). Laser-evoked potential P2 single-trial amplitudes covary with the fMRI BOLD response in the medial pain system and interconnected subcortical structures.(3), 917−926.
Moore, D. J. (2015). Acute pain experience in individuals with autism spectrum disorders: A review.(4), 387−399.
Mul, C.-L., Stagg, S. D., Herbelin, B., & Aspell, J. E. (2018). The feeling of me feeling for you: Interoception, alexithymia and empathy in autism.(9), 2953−2967.
Murray, K., Johnston, K., Cunnane, H., Kerr, C., Spain, D., Gillan, N., ... Happé, F. (2017). A new test of advanced theory of mind: The “Strange Stories Film Task” captures social processing differences in adults with autism spectrum disorders.(6), 1120−1132.
Neil, L., Olsson, N. C., & Pellicano, E. (2016). The relationship between intolerance of uncertainty, sensory sensitivities, and anxiety in autistic and typically developing children.(6), 1962−1973.
Oberman, L. M., Winkielman, P., & Ramachandran, V. S. (2009). Slow echo: Facial EMG evidence for the delay of spontaneous, but not voluntary, emotional mimicry in children with autism spectrum disorders.(4), 510−520.
Peled-Avron, L., & Shamay-Tsoory, S. G. (2017). Don't touch me! autistic traits modulate early and late ERP components during visual perception of social touch.(6), 1141−1154.
Pelton, M. K., & Cassidy, S. A. (2017). Are autistic traits associated with suicidality? A test of the interpersonal‐psychological theory of suicide in a non‐clinical young adult sample.(11), 1891−1904.
Peng, W., Huang, X., Liu, Y., & Cui, F. (2019). Predictability modulates the anticipation and perception of pain in both self and others.(7), 747−757.
Perchet, C., Godinho, F., Mazza, S., Frot, M., Legrain, V., Magnin, M., & Garcia-Larrea, L. (2008). Evoked potentials to nociceptive stimuli delivered by CO2or Nd: YAP lasers.(11), 2615−2622.
Pickles, A., Starr, E., Kazak, S., Bolton, P., Papanikolaou, K., Bailey, A., Goodman, R., & Rutter, M. (2000). Variable expression of the autism broader phenotype: Findings from extended pedigrees.(4), 491−502.
Piven, J., Palmer, P., Jacobi, D., Childress, D., & Arndt, S. (1997). Broader autism phenotype: Evidence from a family history study of multiple-incidence autism families.(2), 185−190.
Ponnet, K. S., Roeyers, H., Buysse, A., de Clercq, A., & van der Heyden, E. (2004). Advanced mind-reading in adults with Asperger syndrome.(3), 249−266
Preacher, K. J., & Hayes, A. F. (2008). Asymptotic and resampling strategies for assessing and comparing indirect effects in multiple mediator models.(3), 879−891.
Quan, X., Fong, D. Y. T., Leung, A. Y. M., Liao, Q., Ruscheweyh, R., & Chau, P. H. (2018). Validation of the Mandarin Chinese version of the pain sensitivity questionnaire.(2), 180−193.
Rattaz, C., Dubois, A., Michelon, C., Viellard, M., Poinso, F., & Baghdadli, A. (2013). How do children with autism spectrum disorders express pain? A comparison with developmentally delayed and typically developing children.(10), 2007−2013.
Ren, Q., Lu, X., Zhao, Q., Zhang, H., & Hu, L. (2020). Can self‐pain sensitivity quantify empathy for others' pain?(10), e13637.
Robinson, E. B., Koenen, K. C., McCormick, M. C., Munir, K., Hallett, V., Happé, F., Plomin, R., & Ronald, A. (2011). Evidence that autistic traits show the same etiology in the general population and at the quantitative extremes (5%, 2.5%, and 1%).(11), 1113−1121.
Rogers, K., Dziobek, I., Hassenstab, J., Wolf, O. T., & Convit, A. (2007). Who cares? Revisiting empathy in Asperger syndrome.(4), 709−715.
Ronald, A., Happé, F., & Plomin, R. (2008). A twin study investigating the genetic and environmental aetiologies of parent, teacher and child ratings of autistic-like traits and their overlap.(8), 473−483.
Ruscheweyh, R., Marziniak, M., Stumpenhorst, F., Reinholz, J., & Knecht, S. (2009). Pain sensitivity can be assessed by self-rating: Development and validation of the Pain Sensitivity Questionnaire.(1−2), 65−74.
Rütgen, M., Seidel, E.-M., Riečanský, I., & Lamm, C. (2015). Reduction of empathy for pain by placebo analgesia suggests functional equivalence of empathy and first-hand emotion experience.(23), 8938−8947.
Rütgen, M., Seidel, E.-M., Silani, G., Riečanský, I., Hummer, A., Windischberger, C., Petrovic, P., & Lamm, C. (2015). Placebo analgesia and its opioidergic regulation suggest that empathy for pain is grounded in self pain.(41), E5638−E5646.
Santiesteban, I., Gibbard, C., Drucks, H., Clayton, N., Banissy, M. J., & Bird, G. (2021). Individuals with autism share others’ emotions: Evidence from the continuous affective rating and empathic responses (CARER) task.(2), 391−404.
Sasson, N. J., & Bottema-Beutel, K. (2022). Studies of autistic traits in the general population are not studies of autism.(4), 1007−1008.
Serbic, D., Ferguson, L., Nichols, G., Smith, M., Thomas, G., & Pincus, T. (2020). The role of observer’s fear of pain and health anxiety in empathy for pain: An experimental study.(2), 74−81.
Sessa, P., Meconi, F., Castelli, L., & Dell’Acqua, R. (2014). Taking one’s time in feeling other-race pain: An event-related potential investigation on the time-course of cross-racial empathy.(4), 454−463.
Sharpe, L., Ianiello, M., Dear, B. F., Perry, K. N., Refshauge, K., & Nicholas, M. K. (2012). Is there a potential role for attention bias modification in pain patients? Results of 2 randomised, controlled trials.(3), 722−731.
Singer, T., & Lamm, C. (2009). The social neuroscience of empathy.(1), 81−96.
Siu, A. M., & Shek, D. T. (2005). Validation of the interpersonal reactivity index in a Chinese context.(2), 118−126.
Song, Y., Nie, T., Shi, W., Zhao, X., & Yang, Y. (2019). Empathy impairment in individuals with autism spectrum conditions from a multidimensional perspective: A meta-analysis., 1902.
Sucksmith, E., Roth, I., & Hoekstra, R. A. (2011). Autistic traits below the clinical threshold: Re-examining the broader autism phenotype in the 21st century.(4), 360−389.
Sullivan, M. J. L., Bishop, S. R., & Pivik, J. (1995). The pain catastrophizing scale: Development and validation.(4), 524−534.
Sullivan, M. J. L., Martel, M. O., Tripp, D. A., Savard, A., & Crombez, G. (2006). Catastrophic thinking and heightened perception of pain in others.(1−2), 37−44.
Takahashi, J., Tamaki, K., & Yamawaki, N. (2013). Autism spectrum, attachment styles, and social skills in university student.(8), 514−520.
Tonge, N. A., Rodebaugh, T. L., Fernandez, K. C., & Lim, M. H. (2016). Self-reported social skills impairment explains elevated autistic traits in individuals with generalized social anxiety disorder., 31−36.
Tracey, I. (2011). Can neuroimaging studies identify pain endophenotypes in humans?(3), 173−181.
Vasa, R. A., Kreiser, N. L., Keefer, A., Singh, V., & Mostofsky, S. H. (2018). Relationships between autism spectrum disorder and intolerance of uncertainty.(4), 636−644.
Wakabayashi, A., Baron-Cohen, S., & Wheelwright, S. (2006). Are autistic traits an independent personality dimension? A study of the Autism-Spectrum Quotient (AQ) and the NEO-PI-R.(5), 873−883.
Wiech, K., Ploner, M., & Tracey, I. (2008). Neurocognitive aspects of pain perception.(8), 306−313.
Yang, Z., Jackson, T., Chen, H., Huang, C. Z., Su, L., & Gao, T. (2016). The attention bias related to fear of pain and its modification.,(4), 547−555.
[杨周, Todd, J., 陈红, 黄承志, 苏琳, 高婷. (2016). 疼痛恐惧相关的注意偏向及其矫正.(4), 547−555. ]
Yang, Z., Todd, J., Meng, J., & Chen, H. (2013). The reliability and validity of the Fear of Pain Questionnaire-III.(5), 768−770.
[杨周, Todd, J., 孟景, 陈红. (2013). 中文版疼痛恐惧问卷-III的信效度.,(5), 768−770]
Yao, J., Li, X., Zhang, W., Lin, X., Lyu, X., Lou, W., & Peng, W. (2021). Analgesia induced by anodal tDCS and high-frequency tRNS over the motor cortex: Immediate and sustained effects on pain perception.(5), 1174−1183.
Yap, J. C., Lau, J., Chen, P. P., Gin, T., Wong, T., Chan, I., Chu, J., & Wong, E. (2008). Validation of the Chinese Pain Catastrophizing Scale (HK-PCS) in patients with chronic pain.(2), 186−195.
Zhang, W., Li, X., Yao, J., Ye, Q., & Peng, W. (2021). Abnormalities in pain sensitivity among individuals with autism spectrum disorder: Evidence from meta-analysis.,(6), 613−638.
[张文芸, 李晓云, 姚俊杰, 叶倩, 彭微微. (2021). 自闭症谱系障碍个体的疼痛敏感性异常:来自元分析的证据.(6), 613−628. ]
Zhang, W., Zhuo, S., Li, X., & Peng, W. (2022). Autistic traits and empathy for others’ pain among the general population: Test of the mediating effects of first-hand pain sensitivity., 10.1007/s10803-022-05471-9.
Zhao, X., Li, X., Song, Y., & Shi, W. (2019). Autistic traits and prosocial behaviour in the general population: test of the mediating effects of trait empathy and state empathic concern.(10), 3925−3938
Zhou, L., Wei, H., Zhang, H., Li, X., Bo, C., Wan, L., Lu, X., & Hu, L. (2019). The influence of expectancy level and personal characteristics on placebo effects: Psychological underpinnings., 20
Ziermans, T., de Bruijn, Y., Dijkhuis, R., Staal, W., & Swaab, H. (2019). Impairments in cognitive empathy and alexithymia occur independently of executive functioning in college students with autism.(6), 1519−1530.
Zuluaga Valencia, J. B., Marín Correa, L. Y., & Becerra Espinosa, A. M. (2018). Theory of mind and empathy in children with Asperger syndrome diagnosis and a control group.(39), 88−101.
Autistic traits influence pain empathy: The mediation role of pain-related negative emotion and cognition
ZHANG Wenyun1,2, ZHUO Shiwei1, ZHENG Qianqian1, GUAN Yinglin1, PENG Weiwei1
(1School of Psychology, Shenzhen University, Nanshan District, Shenzhen 518060, China)(2LouCun Primary school, Guangming District, Shenzhen 518106, China)
Individuals with autism spectrum disorders (ASD) are typically characterized by impaired social interactions that are thought to be related to deficits in empathy. While cognitive empathy deficit in ASD is widely recognized, it remains controversial whether individuals with ASD have a deficiency in emotional empathy. According to the shared representation theory, psychological and neuronal mechanisms involved in the personal experience of an emotional or somatosensory state are also engaged while empathizing with other individuals in those states. It suggests that the deficits of empathy seen in the ASD population could arise from the atypical experience of first-hand pain. Mild, subclinical forms of the characteristics associated with ASD are referred to as autistic traits. Individuals with high autistic traits exhibit sensory, emotional, and social behaviors similar to those with ASD. Given the relationship between pain empathy and first-hand pain as well as the similarity between autistic traits and ASD, the present study tested the hypothesis that autistic traits in the general population would influence pain empathic responses, which could be contributed by first-hand pain-related profiles.
In Experiment 1, we adopted an ecological pain empathy paradigm and compared behavioral and neural activity between individuals with high scores on the Autism-Spectrum Quotient Test (HAQ, with high autistic traits) and those with low scores (LAQ, with low autistic traits). During the pain empathy paradigm, the participants either perceived the painful electrical stimuli themselves or witnessed the delivery of painful electrical stimuli to their partners in certain and uncertain contexts. When perceiving pain themselves, behavioral and brain responses were comparable between HAQ and LAQ groups. When witnessing others in pain, participants in the HAQ group had greater amplitudes of the P2 component on the event-related potentials and reported higher ratings of unpleasantness than those in the LAQ group. The between-group differences in the behavioral and neural responses related to pain empathy were not moderated by certainty of the context (certain or uncertain). Mediation analysis further revealed that the between-group differences in the unpleasantness elicited by witnessing others’ pain could be contributed by the greater fear of pain while anticipating the upcoming painful stimuli.
In Experiment 2, the relationship among autistic traits, pain-related profiles, and trait empathy was assessed in randomly recruited participants. We found that autistic trait levels were negatively correlated with scores on the perspective-taking subscale of the Interpersonal Reactivity Index and positively correlated with the personal distress subscale. Importantly, pain-related fear and pain catastrophizing mediated the link between autistic traits and personal distress.
Data from Experiments 1 and 2 demonstrated that autistic traits heighten emotional empathy, which can be explained by the negative emotion and cognition toward pain. Given the similarities between individuals with high autistic traits and ASD, this finding may help to expand the biological mechanisms underlying ASD, such as explaining empathy deficits or other social difficulties seen in the ASD from the perspective of atypical pain-related profiles. Future studies should combine multiple modalities of painful stimulations and multidimensional pain assessments to comprehensively characterize pain-related profiles among individuals with high autistic traits or ASD, and establish linkage between pain-related profiles and empathy or social deficits. This understanding has the potential to provide targets for clinical interventions and treatments of ASD.
autistic traits; pain empathy; pain-related fear; pain catastrophizing; event-related potentials
2022-08-23
* 国家自然科学基金(32271105), 深圳市基础研究面上项目(JCYJ20190808154413592)和广东省“脑科学与类脑研究”重大科技专项:自闭症诊疗方法研究(2018B030335001)资助。
彭微微, E-mail: ww.peng0923@gmail.com
R395

