冷冻面团中酵母菌抗冻机制研究进展
李海峰,吕玉兰,吴子君,李冰冰,贾 峰,周 佳,王喜凤
河南工业大学 生物工程学院,河南 郑州 450001
我国传统发酵面制品主要有包子、馒头、花卷等,通常就地加工或者由加工中心批量生产后配送至经营门店售卖。现场制作的加工方式难以保证品质,加工中心批量生产的方式虽然保证了加工质量的稳定性,但在储存、配送的过程中会使产品的新鲜度、风味和口感等出现不同程度的下降[1]。因此,冷冻面团技术应运而生,冷冻面团是一种通过冷冻加工而成的半成品,可长期储存,解冻后即可得到成品[2],同时可以尽可能保持面团的食用品质。
冷冻面团技术最先应用于西方的面包制作中,包括牛角包、吐司、法棍等,与欧美国家相比,我国的发酵主食以馒头为主,但因其水分含量高,淀粉易老化,货架期短,因此市场上多出售冷冻成品馒头[3]。冷冻面团技术为制作新鲜面包提供了一种更简便的方法,并逐渐取代了传统的面包制作工艺[4]。因其有效地解决了食品易老化、货架期短的问题,是食品工业中最具发展前景的技术之一[5]。
然而,冷冻面团行业仍然面临着一些重大的挑战,如酵母菌活性的降低,以及面团面筋-淀粉网络结构的破坏[6]。酵母菌活性的降低是由酵母菌细胞膜发生变化引起的[7]。细胞膜的柔韧性在细胞的生存中起着重要作用,低温容易使细胞膜压缩,流动性降低,特别是当不饱和脂肪酸含量较低时,膜破裂的可能性大大增加[8];海藻糖是一种由两个葡萄糖单体连接而成的双糖,可以通过抑制冰晶的形成、保持细胞膜的完整性和蛋白质的固有构象来保护酵母菌[9];甘油作为一种常见的低温保护剂,通过抑制冰晶不再成核生长来维持细胞形态以抵御环境压力[10];脯氨酸是一种多功能氨基酸,不仅可以为酵母菌提供氮源,还可以作为活性氧清除剂保护细胞减少环境压力以维持细胞稳态[11];谷胱甘肽(glutathione,GSH)作为一种强大的抗氧化剂,在氧化还原平衡反应中起着关键作用,保护细胞减少氧化胁迫[12];水通道蛋白在冷应激条件下使酵母菌在高渗环境下快速排出胞内水分,减少冰晶的形成[13]。
在冻融胁迫下,酵母菌细胞膜和蛋白质会直接或间接地被损害,并导致胞内活性氧的产生,这些胁迫在一定程度上能够诱导酵母菌内部的生物代谢网络发生一系列动态变化[14]。因此作者拟从海藻糖积累、甘油合成与转运、脯氨酸增加、GSH合成、细胞膜流动性改变以及水通道蛋白基因的表达等方面阐述酵母菌的耐冷冻机制,以期为酵母菌株抗冻能力提升与冷冻面团的品质改良等研究提供参考。
1 冷冻面团中的酵母菌组成
酸面团是由面粉、水以及多种微生物组成的传统面食发酵剂[15]。由酸面团制作的冷冻面团比商业活性干酵母制作的冷冻面团具有更好的口感。酸面团中菌种种类丰富,其中已鉴定的酵母菌种类超过30种[16],主要包括酿酒酵母(Saccharomycescerevisiae)、假丝酵母(Candidahumilis)、少孢酵母(Saccharomycesexiguus)、异常毕赤酵母(Pichiaanomala)和汉逊德巴利酵母(Debaryomyceshansenii)等[17]。
优良耐冻酵母菌株的获得是冷冻面团生产中至关重要的前提。路雪纯等[18]从低温贮藏的老面中筛选出一株耐冷冻酵母菌AY005,该菌株在-18 ℃冷冻贮存60 d后仍有较好的发酵力,存活率为62.5%;郭薇丹等[19]通过冻融法从面肥、苹果、葡萄等食品中分离出了8株耐冷冻异常威克汉姆酵母(Wickerhamomycesanomalus),这几株酵母在4 ℃下,24 h内就开始产气,而普通S.cerevisiae在4 ℃下基本不生长产气;薛美翠等[20]采用模拟面团预发酵法筛选出了D.hansenii,该菌株冷冻7 d后存活率仍高达86%。除了对耐冷冻酵母菌株进行筛选外,也可以通过诱变等方法来提高酵母菌的耐冷冻性。陈君等[21]采用低温等离子体诱变结合定向驯化和筛选的方法,开发了一株耐冻酵母菌株AFY-1,该菌株在-20 ℃和-80 ℃冻藏120 d后,细胞存活率保持在83.2%和82.0%,显著高于原始酵母菌的35.6%和29.7%;也有研究旨在通过鉴定耐冻酵母菌株的冻融耐受性相关基因,如破坏S.cerevisiae中的YCP4基因[22]、去除PDR3位点上的等位基因(A148T/A229V/H336R/L541P)[23]来解释S.cerevisiae的耐冷冻机制,提高酵母菌的耐冻性能。
2 冷冻面团中酵母菌的耐冷冻机制
2.1 海藻糖的积累
普遍认为,冷冻面团中酵母菌的抗冻性与胞内海藻糖含量有关,海藻糖又称酵母糖、漏芦糖、蕈糖等,是一种由两分子葡萄糖通过α-1,1-糖苷键连接而成的非还原性二糖,是处于高温、冷冻、辐射、干燥、高渗透压等条件下合成的应激代谢物[24]。关于海藻糖对冷冻面团中酵母菌的抗冻保护机理尚未达成一致说法,但目前普遍比较认可的是“水替代”假说和“玻璃态”假说,其中,“水替代”假说是指细胞在冷冻胁迫条件下脱水,使得胞内大分子物质脂质和蛋白质等表面的水保护膜丧失,而海藻糖使水分子形成的氢键被失水部位的羟基和分子形成的氢键所取代,从而保护生物膜,维持生物大分子的活性;“玻璃态”假说是指细胞受到低温胁迫后,海藻糖把相邻的分子紧紧包住,形成一种糖玻璃体,降低分子玻璃基质中的分子运动和化学反应速率,维持生物分子特定的空间结构[25]。海藻糖可以抑制谷胱甘肽还原酶的作用,从而提高冷冻面团中酵母菌的存活率,当冷冻面团中海藻糖含量低于5%时,酵母菌抗冻性下降,海藻糖含量大于12%时,酵母菌抗冻性与海藻糖含量没有直接的相关性[26]。
冷冻面团的冷冻和解冻会导致S.cerevisiae的细胞氧化和凋亡,此时,酵母菌通过提高海藻糖合成酶或降低水解酶含量提高海藻糖含量,从而提高酵母菌的抗冻性[27]。冷冻面团中酵母菌胞内海藻糖的积累主要包括尿苷二磷酸葡萄糖(UDPG)依赖的海藻糖合成途径和腺苷二磷酸葡萄糖(ADPG)依赖的海藻糖合成途径[28]。UDPG途径是将葡萄糖转化为葡萄糖6-磷酸(G6P),与UDPG共同促进海藻糖合成的一条代谢途径;MAL62(麦芽酶编码基因)参与ADPG依赖性海藻糖合成途径,MAL62的表达诱导海藻糖的积累,与TPS1(海藻糖合成酶编码基因)过表达相比,MAL62过表达对细胞内海藻糖积累的增强作用较小,但可促进发酵前海藻糖的合成,增强麦芽糖代谢,从而促进酵母菌中海藻糖的积累,此外,在NTH1(海藻糖水解酶基因)缺失下过表达MAL62和TPS1,冷冻面团中的酵母菌表现出更高的抗冻性[29]。然而,与MAL62基因相关的海藻糖合成和传统UDPG依赖性海藻糖合成途径之间的差异尚不清楚,仍需继续深入探究。
2.2 甘油的合成与转运
甘油是一种类似海藻糖的冷冻保护剂,有研究表明,酵母菌内甘油的积累和外源添加甘油均能够提高冷冻面团中酵母菌的存活率和发酵力[30]。外源甘油通过增加胞内甘油含量提高酵母菌的耐冷冻性,Izawa等[31]在甘油培养基中培养的S.cerevisiae胞内富集甘油,对冷冻胁迫具有较高的耐受性,同样,此S.cerevisiae在冷冻面团中也保持了较高的发酵力。甘油不断积累的过程也是S.cerevisiae细胞耐冷冻性能增强的标志。在冷冻面团中,S.cerevisiae的变异株通过积累甘油,不断提升发酵力,有研究表明,编码甘油通道蛋白FPS1基因缺失的突变体可以在细胞内积累甘油,冷冻面团冷冻7 d后仍保持较高的发酵力,FPS1突变体是一个开发优质冷冻面团的优势菌株,具有商业优势[32]。
在冷冻面团技术的研究中,利用甘油的代谢途径研发了许多新的耐冷冻性更强的S.cerevisiae菌种。甘油由甘油3-磷酸脱氢酶(GPD)和甘油3-磷酸酶(GPP)催化磷酸二羟丙酮(DHAP)合成,甘油降解是通过甘油激酶完成的,面团在冷冻过程中,甘油激酶活性降低,甘油积累增加,S.cerevisiae抗冻性增加[33]。另外,低温环境激活了冷冻面团中S.cerevisiae高渗甘油(HOG)途径,诱导GPD、GPP基因的转录和表达,促进甘油的合成[34]。HOG途径还能调节糖转运蛋白STL1的表达,激活FPS1的表达,FPS1在两个甘油通道调节蛋白RGC1和RGC2的协助下,迅速封闭甘油转运通路,将甘油截留在细胞中,维持胞内外渗透压平衡[35]。此外,酵母菌还可以通过转运蛋白GUP1和GUP2从胞外吸收甘油抵御冻害[36]。
2.3 脯氨酸的积累
脯氨酸由特定的代谢途径产生,是一种自由基清除剂,可以调节细胞质渗透平衡,提高胞内酶和细胞膜的稳定性,还可以抑制脱水和冰成核、降低DNA溶解温度以及清除活性氧[37]。冷冻面团中酵母菌胞内的脯氨酸含量是影响其抗冻性的关键因素,脯氨酸积累赋予酵母菌更高的抗冻融性,并使其在冷冻后保持更高的发酵能力[38]。
在S.cerevisiae细胞中,脯氨酸转化为谷氨酸需要脯氨酸氧化酶和脱氢酶的参与,这两个酶分别由PUT1和PUT2基因编码,如果将PUT1基因破坏,细胞内会积累更高水平的脯氨酸,从而增强细胞对冷冻胁迫的抵抗力;如果将PUT2基因破坏,细胞活力则显著下降,这表明脯氨酸分解代谢的中间产物Δ′-吡咯啉-5-羧酸脱氢酶对酵母菌有明显的毒性作用,另外酵母菌在液泡中积累了脯氨酸,这表明有一个系统可以将多余的脯氨酸运输到液泡中,这种液泡积累可能对酵母菌的抗冻性起重要作用[39]。谷氨酸合成脯氨酸需要γ-谷氨酰激酶(GK),GK的活性受脯氨酸含量的调节,PRO1基因编码GK,当PRO1基因发生突变时,脯氨酸积累量增多,突变体酵母菌株在-20 ℃冷冻后,细胞会积累更多的脯氨酸,对冻融胁迫的耐受性明显增加[40]。
2.4 GSH的合成
对冷冻面团的冻藏处理会在一定程度上诱导酵母菌产生应激反应,合成多种具有自我修复功能的物质以抵御环境变化,GSH是一种三肽化合物,由L-半胱氨酸、L-谷氨酸和甘氨酸脱水缩合而形成,它可以参与三羧酸循环和糖代谢[41],有解毒[42]、抗氧化[43]的作用。酵母菌在冷冻面团中处于高渗状态,胞内活性氧水平增加,GSH含量升高[44],GSH在氧化应激反应中起关键作用,能够通过谷胱甘肽过氧化物酶作用将二硫键还原成巯基(—SH),巯基能有效地清除酵母菌中的氧自由基,减缓对细胞膜、DNA和膜蛋白的过氧化作用,减少GSH向氧化型谷胱甘肽(GSSH)的转化[45]。
酵母菌胞内GSH的合成由ATP依赖性的两步酶促反应过程组成,第一步是由谷氨酸和半胱氨酸在限速酶(GSH1)催化下生成γ-谷氨酸半胱氨酸,第二步是γ-谷氨酸半胱氨酸在谷胱甘肽合成酶(GSH2)的作用与甘氨酸结合形成γ-谷氨酰半胱氨酸甘氨酸,即GSH[46]。GSH1的缺失导致酵母菌不能生长,GSH在酵母菌中是必不可少的物质。王立梅等[47]用转录组学的手段分析S.cerevisiae受到氧化胁迫后,GSH合成限速酶活性增强,与抗氧化酶产生协同效应,提高了还原型辅酶Ⅱ(NADPH)含量,为合成GSH提供了充分的还原能力。
2.5 水通道蛋白基因的过表达
在提高冷冻面团中S.cerevisiae抗冻性的实验中,通过对水通道蛋白活性分析,并对质膜水运输蛋白的基因表达进行记录可以发现其活性与S.cerevisiae的冷冻敏感性直接相关[48]。S.cerevisiae的水通道蛋白是膜蛋白的一种,主要包括AQY1和AQY2,它的作用是运输水和中性小分子溶质比如甘油等物质,它对水分子的主动转运功能是维持细胞内外渗透压平衡的关键因素[49]。
当酵母菌缺乏营养时,AQY1基因就会高表达,而AQY2基因则会在指数增长的正常细胞中表达,删除这些基因中的任何一个都能使它们对冻融胁迫更加敏感,而它们的过表达可以提高酵母菌的冻融耐受力[50]。当引入外源表达hAQY1基因时,S.cerevisiae细胞会在渗透作用下快速排出水分,从而减少细胞内冰晶的形成和破坏,增加酵母菌的抗冻性[51]。同样,在冻融胁迫下,质膜中内源性水通道蛋白的表达水平越高,水的外排速度越快[52]。这些发现都支持了质膜水运输蛋白活性在测定酵母菌冻融耐受性方面的作用[53],并且为改善工业酵母菌株在冷冻面团中的生存能力,开发应用于冷冻面团的抗冻酵母菌株打开了新的前景。
2.6 细胞膜流动性的改变
酵母菌的细胞膜主要由蛋白质和磷脂组成,作为隔离细胞器与外界环境的一道屏障,细胞膜的功能与细胞的生存能力密切相关[54]。冷冻面团中酵母菌能够通过改变膜的流动性和相变以及激活细胞对膜化学成分的控制来感知和适应环境胁迫,而过强的氧化胁迫会引发细胞膜脂质层组成的变化,导致脂质过氧化,进而引发膜解体和细胞死亡[55]。一般认为,具有高不饱和、低链长脂肪酸组成的细胞膜具有较高的流动性[56]。
面团在冷冻过程中,酵母菌自身可以通过自我调节来保持细胞膜的正常流动,最常见的变化是降低脂肪酸的饱和度、减少脂肪酸链的平均链长和增加生物膜内胆固醇含量来抵消膜流动性的下降[57]。另外,甾醇是影响酵母菌膜流动性的基本结构和调节脂类,在脂肪酸链中插入甾醇,能够稳定和加强膜脂双分子层,尽管甾醇组成通常不随温度变化,但在较低温度下,甾醇/磷脂相对比例的降低是增加酵母菌膜流动性的一个重要特征[58]。近年来,许多学者利用代谢工程技术对S.cerevisiae进行了改造,虽然已完成了多不饱和脂肪酸合成途径的构建,但所产生的脂肪酸含量相对较少,因此需要对其进行更深入的研究。
3 总结与展望
冷冻面团具有很大的市场潜力,耐冷冻酵母菌的筛选和能力提升研究一直是国内外学者的研究热点。在冷冻条件下,酵母菌经受着高渗、低温和氧化胁迫,如图1所示,细胞膜作为细胞的保护屏障,通过降低脂肪酸的饱和度、减少脂肪酸链的平均链长和增加生物膜内胆固醇含量来抵消膜流动性的下降,另外甾醇/磷脂相对比例的降低是增加真核微生物膜流动性的一个重要特征;MAL62基因参与ADPG途径增加海藻糖含量,与TPS1基因的过表达相比,MAL62基因过表达对细胞内海藻糖积累的增强作用较小,但可促进发酵前海藻糖的合成,增强麦芽糖代谢,促进海藻糖的合成。此外,在NTH1基因缺失下过表达MAL62和TPS1基因可进一步增强酵母菌株的抗冻性;Hog1途径调控GPD1、GPP1基因的转录和表达从而促进甘油的合成,此外,Hog1还可以调节STL1的表达,激活酵母菌对甘油的摄取,并激活FPS1的表达,FPS1在Hog1、RGC1和RGC2的协助下,迅速封闭甘油转运通路,将甘油截留在细胞中,酵母菌还可以通过GUP1和GUP2从胞外吸收甘油抵御冻害;谷氨酸合成脯氨酸需要PRO1基因编码GK,当PRO1基因发生突变时,脯氨酸积累量增多,脯氨酸转化为谷氨酸需要脯氨酸氧化酶和脱氢酶,这两种酶分别由PUT1和PUT2基因编码,如果将PUT1基因破坏,细胞内积累了更高水平的脯氨酸,增强了细胞对冷冻胁迫的抵抗力,如果将PUT2基因破坏,细胞活力显著下降,这表明脯氨酸分解代谢中间产物Δ′-吡咯啉-5-羧酸脱氢酶对酵母菌有明显的毒性作用;GSH的合成首先是由谷氨酸和半胱氨酸在GSH1催化下生成γ-谷氨酸半胱氨酸,然后γ-谷氨酸半胱氨酸在GSH2的作用与甘氨酸结合形成GSH,冷冻过程中,GSH合成限速酶活性增强,GSH合成增多;AQY1和AQY2基因过表达使酵母菌在高渗环境下加快胞内水分的外排,从而抑制胞内冰晶的形成,提高细胞的抗冻性。面团在冷冻过程中,酵母菌为适应低温发生的一系列动态变化,为酵母菌的抗冻能力提升与冷冻面团的品质改良等研究提供了参考。
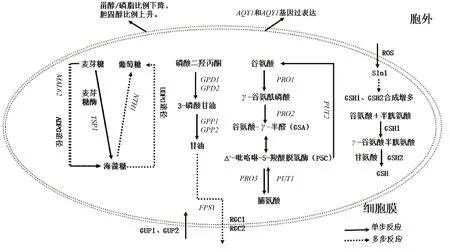
图1 冷冻面团中酵母菌的耐冷冻机制Fig.1 Antifreeze mechanism of yeast in frozen dough
冷冻面团技术自引入我国之后得到飞速发展,但相对国外来说,我国对其工艺体系的研究还不成熟,最终的产品质量仍不及新鲜产品,酵母菌作为影响其品质的重要因素,目前国内外对其耐冷冻机制的研究还不够广泛和深入。据报道,深入甘油合成和转运基因的挖掘能够加深人们对冷冻面团中酵母菌冷冻胁迫应答机制的理解。海藻糖是一种重要的蛋白质稳定剂,关于海藻糖与蛋白质的相互作用,目前仍是一个悬而未决的问题,另外,与MAL62基因相关的海藻糖合成和UDPG途径之间的差异也尚不清楚,还需要进一步研究。同样地,尽管人们对甘油在较高温度下稳定蛋白质的机理进行了广泛的研究,但是对其低温条件下稳定蛋白质的机理研究却很少,蛋白质冷变性的起源目前还不完全清楚,此外,人们利用代谢工程手段改造S.cerevisiae合成的多不饱和脂肪酸含量普遍较低,这些都需要在今后的研究中进一步探索。

