环化酶阻断剂对三孢布拉氏霉菌发酵生产番茄红素的影响
丁长河,白璐佳,尹 萌
河南工业大学 粮油食品学院, 河南省天然色素制备重点实验室, 河南 郑州 450001
番茄红素是一种脂溶性的四萜碳氢化合物[1],由于其多烯烃的结构而具有良好的抗氧化活性[2]。此外,在清除自由基、抑制癌细胞增殖、诱导癌细胞凋亡、抗炎和预防心血管疾病等方面都表现出良好的功效[3-5]。但它不能在人体内合成,只能通过饮食摄入含有类胡萝卜素的食物得到补充[6-7],多存在颜色偏红的水果中,如西瓜、葡萄柚[8]、红肉脐橙[9]、樱桃、木鳖果、红果仔[10]等,但含量较低。当前人们对于番茄红素的需求量越来越高,因此,需要生产出更多的番茄红素来满足实际需要。在工业化生产中,自然提取法和化学合成法都存在一定的缺点,微生物发酵法因不受限制且产量高,所以成为优选[11]。
在利用微生物发酵生产番茄红素的众多菌种(如酵母、细菌、藻类、丝状真菌等)中,三孢布拉氏霉菌(Blakesleatrispora)利用正负菌混合发酵,具有生长迅速、菌体生物量大、色素产量高的特点,是目前唯一实现工业化生产类胡萝卜素的菌株,而类胡萝卜素的“原型”就是番茄红素,番茄红素可通过环化、氧化或还原等形成其他的类胡萝卜素[12]。对B.trispora合成番茄红素代谢过程进行调控,阻断番茄红素向β-胡萝卜素转化。目前的研究发现多种吡啶和咪唑及其衍生物被用作番茄红素环化酶阻断剂[13-14]。在Vereshchagina 等[15]的研究中,向B.trispora发酵过程中添加2-氨基-6-甲基吡啶可显著增加番茄红素含量,并在类胡萝卜素总量中占比90%~95%;在王婧等[16]的研究中,添加2,6 -二甲基吡啶有效阻断番茄红素向β-胡萝卜素转化;在Pegklidou等[13]的研究中,2-甲基咪唑的安全使用范围为200~800 mg/L,在此范围内可使番茄红素占总类胡萝卜素的90%以上;在Wang等[17]的研究中,2-异丙基咪唑通过增加番茄红素合成途径中关键酶的表达水平,增强番茄红素的代谢流动,在添加量为0.3 g/L时几乎完全抑制番茄红素环化酶活性,用量较少,且容易从番茄红素中去除,减少食物毒性。综上,加入环化酶阻断剂可使发酵过程停留在番茄红素积累阶段,进而提高番茄红素的积累量。
利用B.trispora发酵生产番茄红素,可采用加入各类环化酶阻断剂、溶氧载体、表面活性剂和抗氧化酶等[18]。本研究在选用环化酶阻断剂参与调控代谢时,主要选择含氮杂环胺类化合物,其安全性更可靠,但剂量问题仍是一个潜在的危险,未来是否有更安全的阻断剂获得高产番茄红素仍有待研究[19-20]。
作者研究多种环化酶阻断剂对B.trispora发酵生产番茄红素的影响,选择两类(吡啶类和咪唑类)4种环化酶阻断剂进行比较,筛选出发酵效果最好的阻断剂,在此基础上进行单因素试验和正交试验,以此获得产番茄红素的最优条件,为工业化生产番茄红素提供参考。
1 材料与方法
1.1 材料与试剂
三孢布拉氏霉正菌(CCTCC AF 97006)、负菌(CCTCC AF 96002):中国典型培养物保藏中心。2-氨基-6-甲基吡啶(BR)、2,6-二甲基吡啶(BR)、2-甲基咪唑(BR):上海麦克林生化科技有限公司;2-异丙基咪唑(BR):上海阿拉丁生化科技股份有限公司;番茄红素标准品(EP):Sigma-Aldrich公司;石油醚(HPLC)、乙腈(HPLC)、甲醇(HPLC)、二氯甲烷(HPLC)等试剂均为国产产品。
活化培养基 (PDA):马铃薯去皮后称取200 g煮沸30 min,纱布过滤后定容至1 000 mL,加入葡萄糖40 g,琼脂30 g,煮沸溶解后,121 ℃灭菌20 min。
种子培养基:玉米粉44 g/L,黄豆粉19 g/L,磷酸二氢钾0.5 g/L,VB10.004 g/L,调至pH 6.5,121 ℃灭菌20 min。
发酵培养基:玉米粉20 g/L,黄豆粉45 g/L,大豆油16 g/L,磷酸二氢钾 1.5 g/L,硫酸镁 0.6 g/L,VB10.004 g/L,调至pH 6.5,121 ℃灭菌20 min。
1.2 仪器与设备
LRH-250生化培养箱:上海一恒科学仪器有限公司;Sigma 1-14非冷冻微型离心机:德国Sigma-Aldrich公司;UV-6000PC紫外可见分光光度计:上海元析仪器有限公司;Agilent 1260高效液相色谱仪:美国安捷伦科技有限公司;101电热鼓风干燥箱:北京市永光明医疗仪器有限公司;ZKXF-2电热真空干燥箱:上海树立仪器仪表有限公司;SW-CJ-1F无菌操作台:苏州安泰空气科技有限公司。
1.3 试验方法
1.3.1 菌种活化
挑取B.trispora斜面划线于PDA培养基上,置于生化培养箱中26 ℃培养5 d。
1.3.2 种子培养
250 mL锥形瓶中装入50 mL种子培养基和0.85%生理盐水,121 ℃高压蒸汽灭菌20 min。灭菌后将种子培养基和生理盐水放在无菌操作台上冷却。在无菌条件下吸取5 mL生理盐水分别反复抽吸冲洗B.trispora正菌和负菌斜面培养基,将正菌和负菌孢子悬浮液振荡混匀后,吸取1 mL接入种子培养基中,26 ℃、180 r/min振荡培养48 h。
1.3.3 发酵培养
250 mL锥形瓶中装入50 mL发酵培养基,灭菌后放置在无菌操作台上冷却。将B.trispora正菌和负菌种子培养基以体积比1∶5进行混合,混合均匀后按照10%的接种量接入发酵培养基中,26 ℃、180 r/min振荡培养120 h。
1.3.4 番茄红素的提取
取10 mL发酵液,3 500 r/min离心处理10 min,水洗3次后,菌泥放至已烘干称重的玻璃平板上,置于45 ℃真空干燥箱中干燥。干燥后的菌丝经研磨后转移到棕色具塞锥形瓶中,加入20 mL石油醚置于振荡器中,室温下180 r/min振荡提取1 h。研磨至振荡的过程中尽量避光。
1.3.5 菌体生物量的测定
菌体在45 ℃真空干燥箱中干燥至恒重。
生物量(g/L)=W/V×1 000 ,
式中:W为菌体干重,g;V为发酵液体积,mL。
1.3.6 番茄红素的测定
参考Sevgili等[21]的方法,并加以修改。使用高效液相色谱仪对番茄红素产量进行测定,色谱柱为C18(5 μm,250 mm×4.6 mm)。色谱条件:流动相为A,5%娃哈哈水;B为12%甲醇;C为60%乙腈;D为23%二氯甲烷;流速1 mL/min;进样量10 μL;检测波长469 nm,柱温28 ℃。
1.3.7 番茄红素纯度的测定
纯度=S1/S2×100%,
式中:S1、S2为番茄红素峰面积、总峰面积,mAU。
1.4 三孢布拉氏霉菌发酵生产番茄红素的环化酶阻断剂优化设计
1.4.1 单因素试验设计
使用基础发酵培养基发酵生产番茄红素,选择不同添加量(2-氨基-6-甲基吡啶:0.2、0.5、0.8、1.1 g/L;2,6-二甲基吡啶:0.2、0.8、1.4 、2.0 g/L;2-甲基咪唑:0.2、0.5、0.8、1.1 g/L;2-异丙基咪唑:0.2、0.4、0.6、0.8 g/L)的4种环化酶为阻断剂,以番茄红素产量作为筛选指标。在此基础上观察该环化酶阻断剂以不同添加量(0.3、0.4、0.5、0.6、0.7、0.8 g/L)、不同添加时的发酵时间(以下简称“添加时间”)(30、36、42、48、54、60 h)以及不同发酵时间(84、96、108、120、132、144 h)对菌体生物量和番茄红素产量的影响,根据番茄红素的产量筛选影响显著的因素和最佳水平。
1.4.2 正交试验设计
在单因素试验的基础上,以菌体生物量和番茄红素产量为指标,进行正交试验设计。
1.5 数据统计与分析
所有试验均重复3次,数据用平均值±标准差表示。采用Excel 2010统计数据,采用Origin 2022作图,采用SPSS 24.0软件分析显著性,采用正交设计助手设计正交试验。
2 结果与分析
2.1 番茄红素高效液相色谱分析
将番茄红素标准品进行高效液相色谱分析,结果如图1(a)所示,出峰时间在12.321 min左右;发酵产物色谱图如图1(b)所示,出峰时间在12.318 min左右,与番茄红素标准品出峰时间相一致,但还有其他杂峰存在,应该是菌株发酵液中还存在其他成分,需做进一步研究。

注:(a)为标准品色谱图;(b)为发酵产物色谱图。图1 番茄红素高效液相色谱Fig.1 High performance liquid chromatogram of lycopene
2.2 不同环化酶阻断剂对B. trispora产番茄红素的影响
根据番茄红素的代谢途径,环化酶阻断剂加入的时间对菌体生长尤为重要。因此,本试验初步选择在发酵48 h时分别加入不同添加量的阻断剂,以不加任何阻断剂的作为空白对照。结果表明,选用的4种阻断剂均可积累大量的番茄红素,可知阻断剂抑制了番茄红素的环化。
从表1可知,当2-氨基-6-甲基吡啶作为阻断剂时,添加量为0.5 g/L时番茄红素产量最高;当2,6-二甲基吡啶作为阻断剂时,添加量为1.4 g/L时番茄红素产量最高;添加0.5 g/L的2-甲基咪唑作为阻断剂时,番茄红素产量最高;添加0.4 g/L的2-异丙基咪唑作为阻断剂时,番茄红素产量最高。与空白组相比,随着4种阻断剂添加量的增加,菌体生物量呈降低趋势,这是由于阻断剂本身具有一定的毒性,对菌体生长产生抑制作用;番茄红素产量均呈先增再减的趋势;番茄红素纯度持续增加。综上,以番茄红素产量作为筛选阻断剂的标准,当2-氨基-6-甲基吡啶作为阻断剂时,番茄红素产量最高为(402.37±24.61) mg/L,所以选择2-氨基-6-甲基吡啶作为阻断剂进行后续试验。

表1 不同阻断剂对B. trispora产番茄红素的影响Table 1 Effects of different blocking agents on lycopene production by B. trispora
2.3 环化酶阻断剂2-氨基-6-甲基吡啶添加量对B. trispora产番茄红素的影响
在Tereshina 等[22]的研究中添加0.01 g/L 2-氨基-6-甲基吡啶实现了抑制β-胡萝卜素的合成,推测添加微量阻断剂就能对发酵过程产生影响。由图2可知,随着阻断剂的添加,番茄红素产量先增后减,说明环化酶阻断剂有效地抑制了番茄红素的环化,番茄红素不断积累,实现产量增加,相应地β-胡萝卜素积累减少,番茄红素纯度增加;而阻断剂添加越来越多,相应的安全风险也会增加,对菌体的生长造成损害,番茄红素产量下降,但纯度仍在增加。综上,添加0.4 g/L 2-氨基-6-甲基吡啶时番茄红素产量最高,为(434.31±13.86) mg/L,故选择2-氨基-6-甲基吡啶的添加量为0.4 g/L。
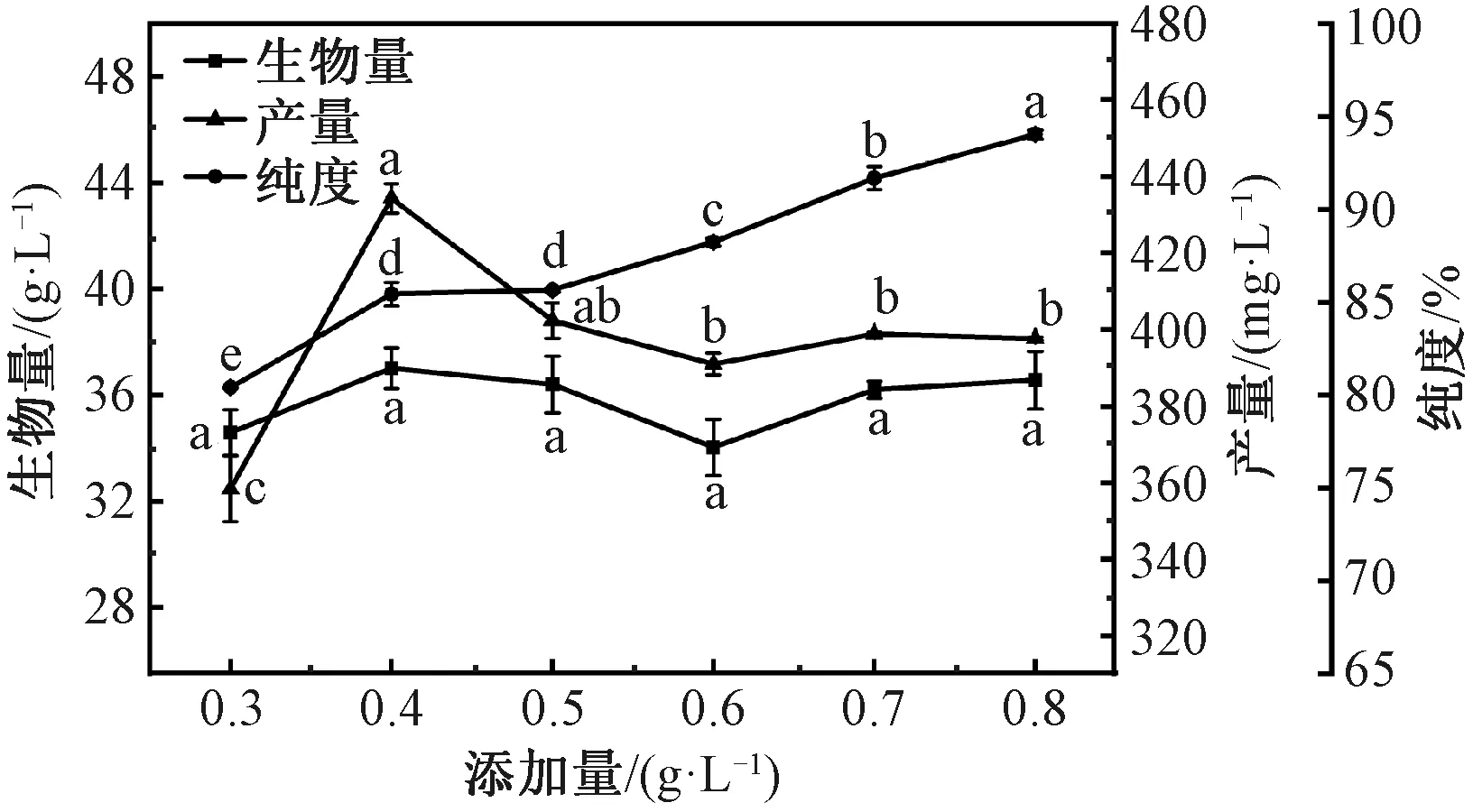
注:曲线中不同字母表示差异显著(P<0.05)。图3和图4同。图2 环化酶阻断剂2-氨基-6-甲基吡啶添加量对B. trispora产番茄红素的影响Fig.2 Effect of cyclase blocker 2-amino-6-methylpyridine addition on lycopene production by B.trispora
2.4 环化酶阻断剂2-氨基-6-甲基吡啶添加时间对B. trispora产番茄红素的影响
由图3可知,随着阻断剂添加时间的延长,番茄红素产量和菌体生物量均呈现出先增后减的趋势,在42 h时产量和菌体生物量达到最高,而番茄红素纯度在42 h后不断增加,但差异性不显著。在王常玲[23]的研究中,发酵40 h时添加咪唑阻断剂的产量最大,推测过早添加阻断剂会对菌体造成损害,导致番茄红素产量不高。在裴敏[24]的研究中B.trispora发酵会产生三孢酸,可显著促进类胡萝卜素的合成。阻断剂过早加入,造成三孢酸合成不足,番茄红素产量不高,过晚加入会使番茄红素环化生成类胡萝卜素,导致番茄红素产量降低。在发酵42 h时添加0.4 g/L 2-氨基-6-甲基吡啶的番茄红素产量最高,为(254.83±41.00) mg/L。故选择添加时间为42 h。
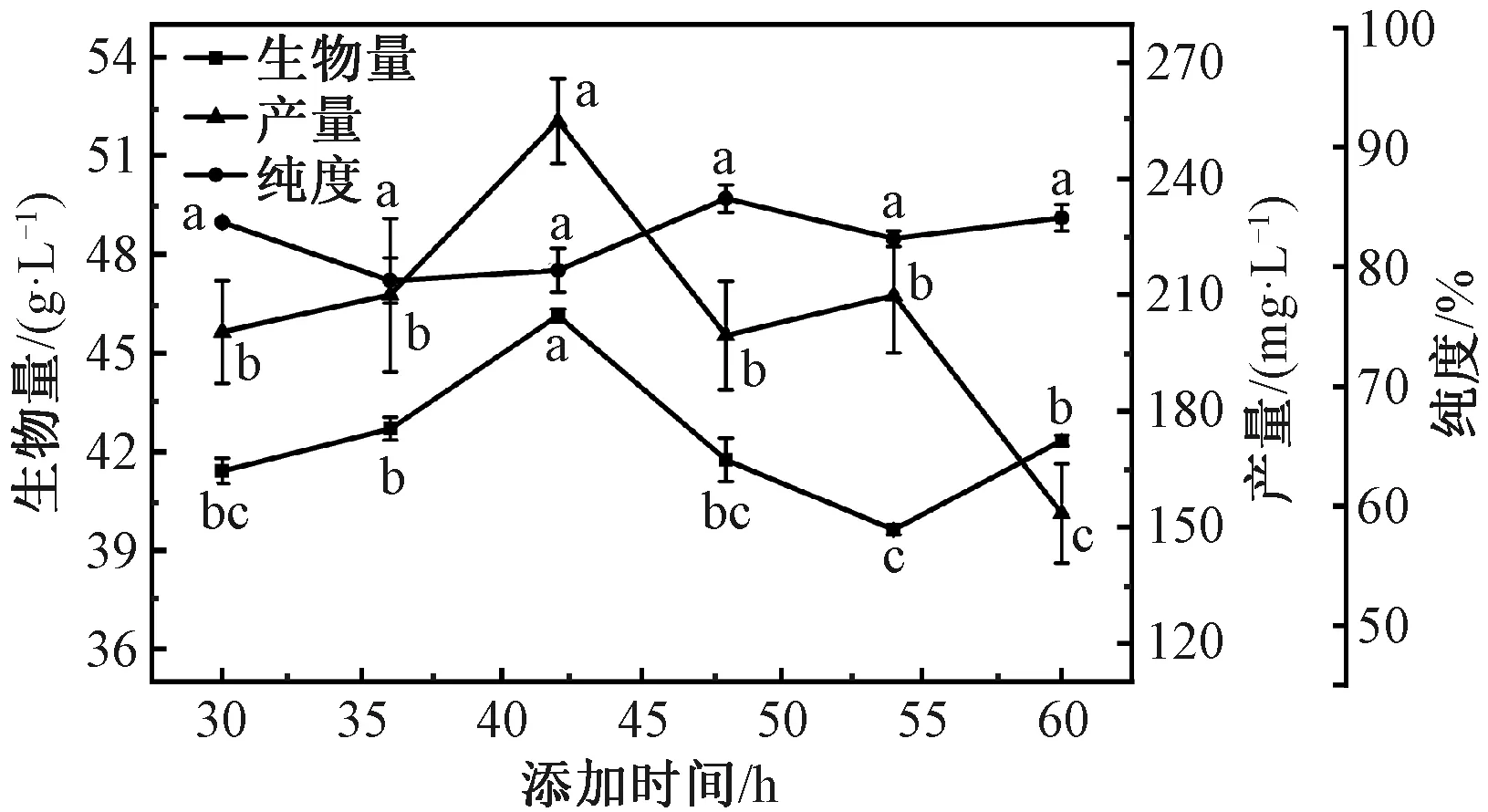
图3 环化酶阻断剂2-氨基-6-甲基吡啶添加时间对B. trispora产番茄红素的影响Fig.3 Effect of the timing of addition of the cyclase blocker 2-amino-6-methylpyridine on lycopene production by B. trispora
2.5 发酵时间对B. trispora产番茄红素的影响
在添加时间42 h,添加量0.4 g/L的基础上,对B.trispora的发酵时间进一步研究。由图4可知,随发酵时间延长,番茄红素产量持续增加而后再减少,在132 h时达到最高,同时菌体生物量也达到了最大值,而纯度在108 h后趋于稳定。原因是B.trispora在连续的发酵过程中,时间越长产生代谢物质越多,培养基中营养成分也不断被消耗,造成菌体生物量达到最大值后再减少,番茄红素产量也下降,但对纯度影响不大。综上,选择番茄红素产量最高的发酵时间132 h作为最佳发酵时间。
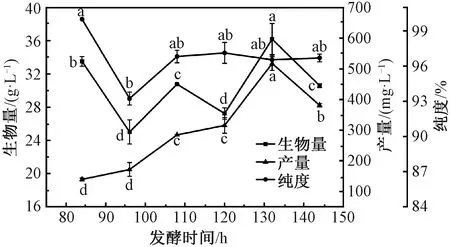
图4 发酵时间对B. trispora产番茄红素的影响Fig.4 Effect of fermentation time on lycopene production by B. trispora
2.6 正交试验优化工艺
根据单因素试验结果,选用2-氨基-6-甲基吡啶作为环化酶阻断剂,采用L9(34),以2-氨基-6-甲基吡啶添加时间(A)、添加量(B)和发酵时间(C)为三因素,正交试验因素与水平如表2所示。

表2 正交试验因素与水平Table 2 Factors and levels for orthogonal tests
由表3可知,菌体生物量最优组合为A2B3C3,即阻断剂添加时间42 h、添加量0.5 g/L、发酵时间144 h,因素主次顺序依次是添加时间>发酵时间>添加量;产量的最优组合为A2B2C3,即阻断剂添加时间42 h、添加量0.4 g/L、发酵时间144 h,因素主次顺序为发酵时间>添加时间>添加量。对比菌体生物量和番茄红素产量发现,添加量之间存在差异,但其影响最小,同时考虑实际应用,选择B2即添加量0.4 g/L。
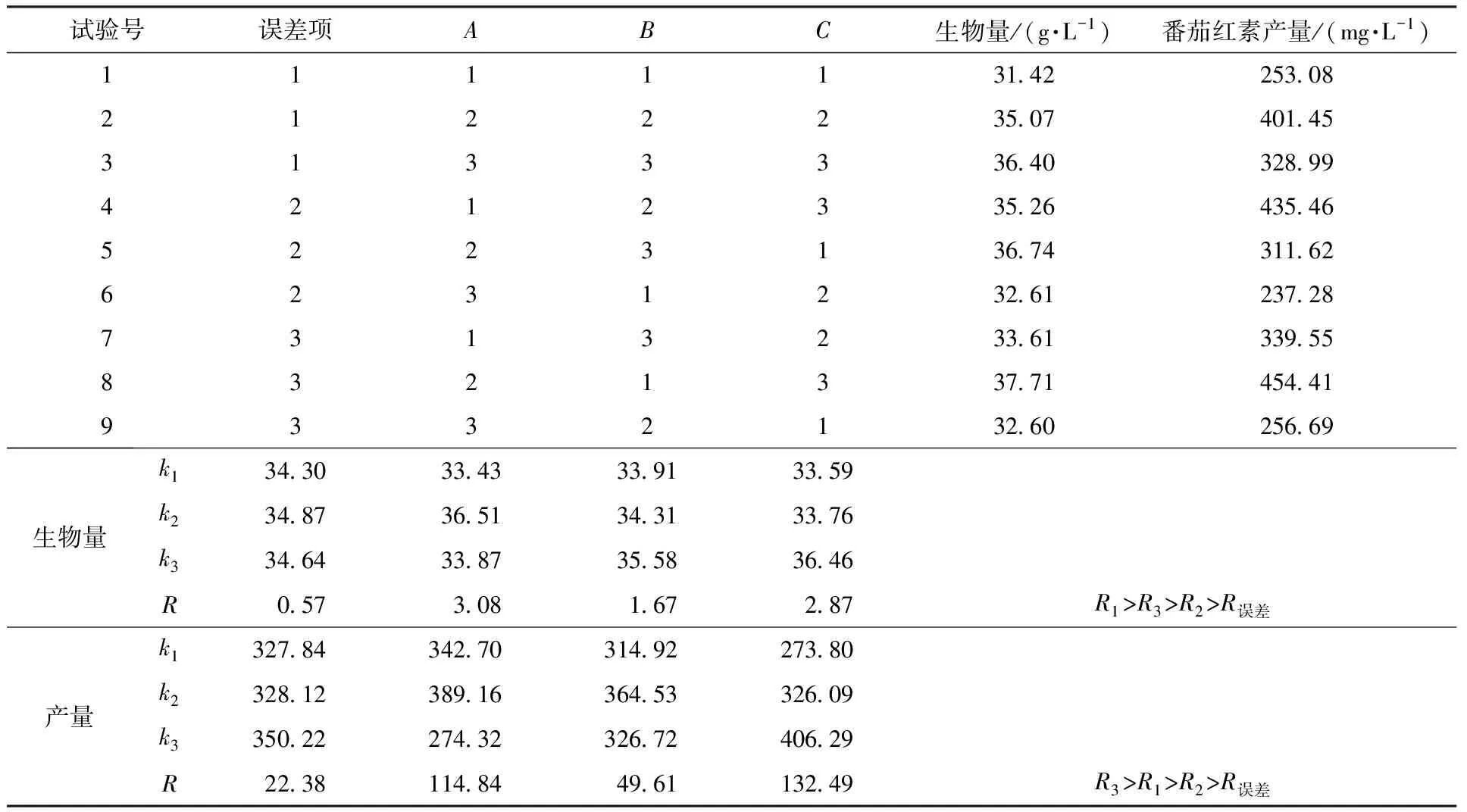
表3 正交试验结果Table 3 Results of the orthogonal test
方差分析如表4所示,3个因素中,阻断剂添加时间和发酵时间对番茄红素产量、生物量均有显著的影响(P<0.05),方差分析结果与极差分析一致。

表4 正交试验方差分析Table 4 Analysis of variance for orthogonal test
验证试验结果显示最优组合A2B2C3实现菌体生物量38.85 g/L,番茄红素产量498.59 mg/L,番茄红素纯度90.11%。
3 结论
本试验通过对比4种环化酶阻断剂(2-氨基-6-甲基吡啶、2,6 -二甲基吡啶、2-甲基咪唑、2-异丙基咪唑)对番茄红素产量的影响,筛选出2-氨基-6-甲基吡啶作为阻断剂,在此基础上对2-氨基-6-甲基吡啶的添加量、添加时间和发酵时间进行单因素试验和正交试验,得到最优组合:添加量0.4 g/L,添加时间42 h,发酵时间144 h。方差分析得出环化酶阻断剂添加时间和发酵时间对菌体生物量和番茄红素产量有显著影响(P<0.05)。验证试验实现菌体生物量38.85 g/L,番茄红素产量498.59 mg/L。
利用微生物发酵法提高番茄红素的产量和选用合适的环化酶阻断剂仍是B.trispora工业化生产的关键问题,在工艺优化和生产成本控制等方面依然有提升的空间和研究的必要。因此,希望本研究为工业化生产番茄红素提供技术支撑。

