血清HGB、SA、STP水平与老年重症肺炎患者病情及预后的相关性分析
靳冬一,刘启龙,李宏宾,魏丹,马宁,訾盼盼,杜玉明
(郑州大学第一附属医院 重症医学科,河南 郑州 450000)
肺炎好发于各年龄段群体,因老年人群多存在基础疾病,免疫功能下降,发病率较其他群体明显升高。其临床表现主要为发热、咳嗽、咳痰、呼吸状态改变等,严重可致呼吸衰竭,对患者生存质量造成严重影响[1]。有研究表明,重症肺炎为人体呼吸道常见危重疾病,具有病情复杂且进展迅速的特点,能够造成多器官功能受累,临床病死率高[2]。以往研究指出,老年重症肺炎患者病死率为33.7%~60%,较重症肺炎总体病死率29.5%更高[3]。现阶段,病原菌培养依然是重症肺炎诊断的主要依据,能够有效指导患者用药,但其耗时较长,且患者病情进展快;同时抗生素滥用使得细菌耐药性升高,病原体检测手段的局限性与假阳性率升高增加了重症肺炎诊断、病情与临床预后评估难度。寻找简单有效的血清学指标,对快速进行重症肺炎病情程度与预后评估具有积极指导作用及意义。近年来,多项研究指出,营养不良与老年群体多种疾病发展及患者预后密切相关,如心力衰竭、慢性阻塞性肺部疾病等[4-5]。血清白蛋白(serum albumin,SA)水平变化与肺炎严重程度紧密相关,并且可指导预后判断[6]。血红蛋白(hemoglobin,HGB)、血清总蛋白(serum total protein,STP)均为机体营养状态检测指标。基于此,本文分析了血清HGB、SA、STP水平与老年重症肺炎患者病情及预后关系,旨在为临床诊治提供指导。
1 对象与方法
1.1 研究对象
选取2020年1月至2022年12月郑州大学第一附属医院收治的90例老年重症肺炎患者作为研究对象。使用均数抽样公式估算样本量为85例,考虑可能产生样本遗失、剔除以及脱落,将其扩展为90例。纳入标准:(1)与《成人社区获得性肺炎基层诊疗指南(2018年)》[7]中有关诊断标准相符;(2)≥60岁;(3)精神意识正常;(4)签署知情同意书。排除标准:(1)合并自身免疫性疾病或者血液疾病;(2)合并心功能障碍、肾衰竭或者肝功能不全;(3)临床资料不全;(4)恶性肿瘤;(5)合并其他肺部疾病;(6)近3个月内接受过外科手术治疗或有创伤史。根据是否存在多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)将其分为合并MODS组与无MODS组。本研究经医院医学伦理委员会批准。
1.2 资料收集
收集患者一般资料,包括性别、年龄、体重指数、基础疾病等。在患者入院24 h内,评估其临床肺部感染评分(clinical pulmonary infection score,CPIS)[8]与急性生理学与慢性健康状况评分系统Ⅱ评分(acute physiology chronic health evaluation Ⅱ,APACHEⅡ)[9],CPIS总分12分,评分越高表示肺部感染越严重;APACHEⅡ评分为急性生理学评分、慢性健康评分以及年龄评分之和,评分越高表示病情越严重。同时,抽取患者空腹静脉血3 mL,进行离心处理(2 000 r·min-1,连续离心10 min)后分离血清样本,以全自动生化分析仪(型号7180,日立公司)检测HGB、SA、STP水平。所有患者接受常规内科治疗,根据病原菌培养结果使用抗生素药物,随访并记录其28 d内生存情况,根据随访结果将患者分为死亡组与存活组。
1.3 统计学分析
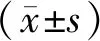
2 结果
2.1 合并MODS组与无MODS组患者一般资料
两组性别、年龄、体重指数、糖尿病及高血压情况比较差异无统计学意义(P>0.05),见表1。
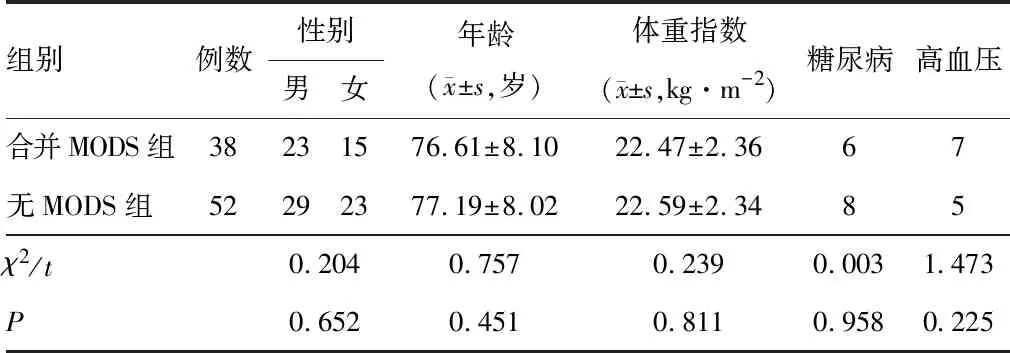
表1 合并MODS组与无MODS组患者一般资料比较
2.2 合并MODS组与无MODS组患者HGB、SA、STP比较
两组STP水平比较差异无统计学意义(P>0.05),合并MODS组HGB、SA水平低于无MODS组(P<0.05),见表2。

表2 合并MODS组与无MODS组患者HGB、SA、STP比较
2.3 老年重症肺炎患者血清相关性分析
老年重症肺炎患者血清HGB、SA水平与CPIS评分、APACHEⅡ评分呈负相关(P<0.05),见表3。

表3 老年重症肺炎患者血清相关性分析
2.4 不同预后患者HGB、SA、STP水平
两组STP水平比较差异无统计学意义(P>0.05);死亡组血清HGB、SA水平低于存活组(P<0.05),见表4。

表4 不同预后患者HGB、SA、STP水平比较
2.5 HGB、SA与预后相关性分析
血清HGB、SA水平与患者预后呈正相关(r=0.402、0.396,P<0.05)。
3 讨论
血清蛋白为人体血液中脂肪酸主要携带者,在其获取脂肪细胞分泌的脂肪酸之后,能够为机体的运行提供能量补充。以往研究表明,老年重症肺炎患者常伴随慢性营养不良[10]。本研究中,不同病情患者STP水平无明显差异,可能与STP受多种因素影响有关。老年患者因为骨髓造血能力下降,可导致血清HGB减少[11]。SA具有维持胶体渗透压的功能,且为各种内源性与外源性物质的主要载体,可有效反映机体营养情况及基础疾病病情[12]。当人体存在急、慢性消耗性疾病或处于营养不良状态时,白蛋白在不同组织里面被细胞摄取,其分解产物氨基酸参与组织的修补,故机体营养不良以及急、慢性消耗性疾病可导致SA水平降低[13]。本研究中,合并MODS组HGB、SA水平低于无MODS组,且与CPIS评分、APACHEⅡ评分呈负相关,提示HGB、SA与老年重症肺炎患者病情密切相关,其水平越低,病情越严重。分析原因,病情越严重,机体蛋白摄入量与肝脏合成蛋白减少,而全身症状(如发热与呼吸道症状等)使得分解代谢水平及消耗水平升高,且从血管渗出增多,导致HGB、SA水平越低;同时胰腺功能降低,合成的消化酶减少,可对营养物质消化以及吸收造成严重影响。有研究发现,对于伴随贫血的感染性疾病患者,若仅给予抗感染治疗,忽略对贫血的纠正,使其长期存在,将提高反复感染风险,影响其预后[14]。本研究中,死亡组血清HGB水平较存活组低,与上述观点基本相符,说明血清HGB可能影响患者预后;相关性分析显示,HGB水平与患者预后呈正相关,HGB水平越高,患者预后越好。HGB越低,贫血越严重,患者机体免疫功能越差,感染概率升高,因此患者预后不良风险更大。有研究指出,SA属于负急性时相蛋白,人体SA水平变化与炎症触发程度存在紧密联系[15]。以往报道称,SA与重症肺炎患者临床预后存在密切联系[16]。本研究也证实了这一点,发现死亡组SA水平较存活组更低,SA水平与患者预后呈正相关,表明SA水平越低,患者预后越差。重症肺炎患者合并低蛋白血症能够对肺组织修复产生影响,使得胸腔积液程度加重,进一步损伤到肺功能[17-18];同时可导致机体免疫功能减弱,增加二重感染可能性,导致感染迁延不愈,促进病情恶化,增加病死风险。
4 结论
血清HGB、SA水平变化与老年重症肺炎患者病情程度存在相关性,病情越重,HGB、SA水平越低,且其水平与患者预后有关,可用于患者病情及预后评估。

