苗药金乌健骨胶囊对胶原诱导关节炎模型大鼠肠道、滑膜炎症及IL-17?琢/TRAF6/NF-κB信号通路的影响
李湖帆,钟琴,马武开,朱玲,朱丹,张潇东,王敏慧,易寒知,龚文涛,刘中静,陈昌明


〔摘要〕 目的 探讨苗药金乌健骨胶囊对胶原诱导关节炎(collagen-induced arthritis, CIA)模型大鼠肠道、滑膜炎症及参与NF-κB信号通路基因IL-17受体信号分子ACT1(nuclear factor kappa B activator 1, ACT1)、泛素化TRAF6(TNF receptor associated factor 6, TRAF6)、转化生长因子β激活激酶1(transforming growth factor-β-activated kinase 1, TAK1)、核因子-κB上游激酶(IκB kinase α, IKKα)、核因子κB/p65、核因子κB/p50表达的影响。方法 将70只SPF级6~8周龄雌性Wistar大鼠随机分为7组,分别为空白对照组、模型组、金乌健骨胶囊低劑量组、金乌健骨胶囊中剂量组、金乌健骨胶囊高剂量组、甲氨蝶呤组及益生菌组,每组10只。适应性喂养后除空白对照组外,其余6组构建CIA模型,两次免疫造模成功后分别进行药物金乌健骨胶囊、甲氨蝶呤、益生菌灌胃治疗,治疗4周后静脉取血,处死大鼠,分离大鼠滑膜组织及肠道组织。利用HE染色法检测大鼠滑膜及大肠组织病理情况;ELISA法检测大鼠血清TGF-β1、IL-1α、IL-17α、IL-21、IL-23的含量;Western blot法检测大鼠肠道组织ACT1、TRAF6、TAK1、IKKα、P65、P50蛋白的表达水平;RT-qPCR法检测大鼠肠道ACT1、TRAF6、TAK1、IKKα、P65、P50基因的表达情况。结果 滑膜病理结果显示,与模型组相比,金乌健骨胶囊中、高剂量组和甲氨蝶呤组炎性浸润、增生、血管新生组织有明显改善;肠道病理结果显示,与模型组相比,金乌健骨胶囊低、中、高剂量组及甲氨蝶呤组、益生菌组肠道组织细胞可见少量炎性细胞浸润,肠道组织细胞病变情况较模型组有不同程度的改善;ELISA结果显示,与模型组相比,各给药组血清含量显著降低(P<0.05或P<0.01); Western blot结果显示,各给药组大鼠肠道组织ACT1、TRAF6、TAK1、IKKα、P65、P50的蛋白表达显著降低(P<0.05或P<0.01);RT-qPCR结果显示,各给药组ACT1、TRAF6、TAK1、IKKα、P65、P50基因的表达显著降低(P<0.05或P<0.01);金乌健骨胶囊高剂量组的作用最佳。结论 苗药金乌健骨胶囊能够减轻CIA大鼠肠道、滑膜炎症,同时能够影响肠道IL-17α/TRAF6/NF-κB信号途径相关基因的表达情况。
〔关键词〕 类风湿关节炎;胶原诱导关节炎;金乌健骨胶囊;炎症;IL-17α/TRAF6/NF-κB信号通路
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.08.006
Effects of Jinwu Jiangu Capsule, the Miao medicine, on intestinal and synovial inflammation and IL-17?琢/TRAF6/NF-κB signaling pathway in
rats with collagen-induced arthritis
LI Hufan1, ZHONG Qin1,2, MA Wukai1,2, ZHU Ling1, ZHU Dan1, ZHANG Xiaodong1, WANG Minhui1,
YI Hanzhi1, GONG Wentao1, LIU Zhongjing3, CHEN Changming1,2*
1. Guizhou University of Chinese Medicine, Guiyang, Guizhou 550002, China; 2. Department of Rheumatology and Immunology, the Second Hospital of Guizhou University of Chinese Medicine, Guiyang, Guizhou 550001, China; 3. Research Center for Clinical Medicine, the Hospital of Guizhou Medical University, Guiyang, Guizhou 550001, China
〔Abstract〕 Objective To investigate the effects of Jinwu Jiangu Capsule (JWJGC), the medicine from the Chinese Miao nationality, on intestinal and synovial inflammation in rat models with collagen-induced arthritis (CIA), and on the expressions of genes involved in NF-κB signaling pathway, including IL-17 receptor signaling molecule nuclear factor kappa B activator 1 (ACT1), TNF receptor associated factor-6 (TRAF6), transforming growth factor-β-activated kinase 1 (TAK1), and the nuclear factors of IκB kinase α (IKKα), κB/p65, and κB/p50. Methods Seventy female Wistar rats aged 6-8 weeks of SPF grade were randomly divided into seven groups: blank control group, model group, low-, medium- and high-dose JWJGC groups, methotrexate group, and probiotic group, with 10 rats in each group. After adaptive feeding, except for the blank control group, CIA models were established in the other six groups. After two successful immune modeling attempts, rats in JWJGC groups, methotrexate group, and probiotic group were treated with JWJGC, methotrexate, and probiotics by gavage, respectively. After four weeks of treatment, blood of rats was collected via vein. Then the rats were sacrificed and the synovial tissues and intestinal tissues were separated from the bodies. The histopathological condition of rat synovium and intestine was checked by HE staining, the content of serum TGF-β1, IL-1α, IL-17α, IL-21, and IL-23 in rats was tested by ELISA, the expression levels of ACT1, TRAF6, TAK1, IKKα, P65, and P50 proteins in rat intestinal tissues were determined by Western blot, and the expression levels of ACT1, TRAF6, TAK1, IKKα, P65, and P50 genes in rat intestinal tissues were checked by RT-qPCR. Results The synovial pathological results showed that the medium- and high-dose JWJGC groups and methotrexate group had a significant reduction in inflammatory infiltration and proliferation, and a significant improvement in angiogenesis compared with the model group; the intestinal pathological results showed that a small amount of inflammatory cell infiltration could be seen in intestinal tissue cells of low-, medium- and high-dose JWJGC groups, methotrexate group, and probiotic group, and the pathological changes of intestinal tissue cells were improved to different degrees compared with the model group; the ELISA results showed that the content of serum TGF-β1, IL-1α, IL-17α, IL-21, and IL-23 in each medication group was significantly reduced compared with the model group (P<0.05 or P<0.01); the Western blot results showed that the expression levels of ACT1, TRAF6, TAK1, IKKα, P65, and P50 proteins in rat intestinal tissues in each medication group were significantly lower compared with the model group (P<0.05 or P<0.01); the RT-qPCR results showed that the expression levels of ACT1, TRAF6, TAK1, IKKα, P65, and P50 genes in each medication group significantly decreased compared with the model group (P<0.05 or P<0.01); the high-dose JWJGC group had the best effects (P<0.05 or P<0.01). Conclusion JWJGC, the Miao medicine, can reduce the intestinal and synovial inflammation in CIA rats, and it can affect the expressions of genes related to intestinal IL-17α/TRAF6/NF-κB signaling pathway at the same time.
〔Keywords〕 rheumatoid arthritis; collagen-induced arthritis; Jinwu Jiangu Capsule; inflammation; IL-17α/TRAF6/NF-κB signaling pathway
类风湿关节炎(rheumatoid arthritis, RA)是一种以侵蚀性关节炎为主要表现的全身性自身免疫疾病,临床表现为对称性、持续性多关节炎,其发病机制尚未完全明确,宿主和环境之间存在复杂的相互作用,决定了RA疾病易感性、持久性及严重程度。而微生物群失调及共病免疫介导作为重要的因素在RA的发病及病情进展中发挥重要作用[1]。据最新的文献报道,RA患者易出现肠道炎症,失调的肠道微生物会改变机体肠道上皮黏膜细胞的通透性,发生肠道炎症,产生大量自身抗体或促炎免疫细胞,自身抗体和免疫细胞产生的细胞因子运输到关节部位,造成关节滑膜组织炎症及骨质破坏[2]。此外,肠道促炎细胞因子可触发RA免疫介导炎症的信号通路,促炎和抗炎细胞因子的失衡可促进自身免疫的诱导,激活的信号通路产生促炎细胞因子,导致RA病情加重[3]。
对早期RA患者进行的研究表明,几乎所有患者都存在亚临床肠道炎症,其特征是浸润性单核细胞、T细胞、B细胞和CD68+巨噬细胞数量增加,以及淋巴滤泡的存在[4]。一项涵盖6 776名受试者(包括2 686名RA患者)的横截面研究表明,普雷沃菌属与RA的遗传风险显著相关,普雷沃菌属可能通过介导Th17细胞的炎症反应促进RA发病[5]。因此,进一步了解IL-17在RA患者中的肠道炎症作用将对探讨该病的发病机制具有重要意义。
目前发现,RA的发生发展与IL-17?琢密切相关,Th17细胞主要分泌IL-17?琢、IL-17F和IL-22,而IL-17?琢是Th17细胞分泌的最重要的效应物,IL-17?琢通过与细胞表面受体IL-17RA结合,进而与IL-17RC形成异源二聚体介导下游信号,胞内接头分子ACT1可以结合到受体复合物上与IL-17RA和IL-17RC上的SEFIR结构域结合,泛素化TRAF6从而激活NF-κB转录因子,促进炎症基因的表达[6]。一方面,IL-17通过IKKα激活和IκBa降解触发NF-κB的激活。NF-κB随后上调IκBζ和B细胞淋巴瘤3编码蛋白的表达,从而促进IL-17/NF-κB驱动的促炎和抗微生物感染基因的表达[7]。另一方面,TRAF6还能促进丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)信号途径的激活。此外,IL-17/NF-κB信号传导通路可抑制多种NF-κB负反馈回路的激活[8]。在自身免疫性疾病和机体防御反应中,IL-17发挥着重要作用。而TGF-β1、IL-1?琢、IL-17?琢、IL-21、IL-23在IL-17形成过程中起着积极地促进作用[9]。
由于RA发病原因尚未完全明确,临床治疗以抗炎、镇痛及延缓病情进展为主。传统抗RA药物如甲氨蝶呤、来氟米特、糖皮质激素或者生物制剂如肿瘤坏死因子抑制剂、IL-1受体拮抗剂、IL-6受体拮抗剂、B细胞耗竭剂、T细胞等靶向药物等虽对RA有较好的疗效,但具有恶心、呕吐、感染、口腔溃疡等不良反应[10]。而苗药金乌健骨胶囊是贵州中医药大学第二附属医院长期用于治疗风湿病的有效经验方,已在课题组应用十余年。课题组前期大量的临床研究证实金乌健骨胶囊对RA的治疗有着良好的疗效,能够有效改善RA患者临床症状和体征,降低抗风湿药如甲氨蝶呤等的毒副作用[11-13],但该药治疗RA的作用机制尚未明确。本研究主要探讨苗药金乌健骨胶囊对胶原诱导关节炎模型(collagen induced arthritis, CIA)大鼠肠道、滑膜炎症及IL-17?琢/TRAF6/NF-κB信号途径的影响,为阐述苗药金乌健骨胶囊治疗RA的作用机制提供参考。
1 材料
1.1 实验动物
6周龄SPF级雌性Wistar大鼠(体质量150~180 g)购自长沙市天勤生物技术有限公司,实验动物生产许可证号:SCXK(湘)2019-0013。所有动物饲养于贵州中医药大学甲秀校区实验动物中心清洁环境,适应性喂养1周,活动、进食、排便均无异常后进行实验。所有实验大鼠的使用和喂养严格遵照贵州中医药大学伦理委员会规章制度执行,批准批号:ky2020035。
1.2 实验试剂
金乌健骨胶囊(藥物由金毛狗脊15 g、乌梢蛇10 g、千年健15 g、黑骨藤10 g、小花青风藤15 g、姜黄20 g、白芍15 g、三七3 g、甘草3 g组成。每粒0.45 g,贵州中医药大学第二附属医院药剂科,黔药制字Z20160028,批号:170701)。甲氨蝶呤片(metho?鄄trexate tablets, MTX,上海上药信谊药厂有限公司,批号:H31020644);双歧杆菌乳杆菌三联活菌片(内蒙古双奇药业股份有限公司,批号:S19980004);牛Ⅱ型胶原冻干粉(Chondrex,批号:200078);弗氏完全佐剂(批号:SLCD4457),苏木素(批号:H9627)均购自Sigma公司;磷酸酶抑制剂(碧云天,批号:S1873);伊红Y(国药集团,批号:71014544);PMSF(阿拉丁,批号:P105539);RIPA裂解液(碧云天,批号:P0013B);小鼠单抗β-actin(批号:BM0627);HRP标记羊抗小鼠二抗(批号:BA1051)均购自武汉博士德生物工程有限公司;兔多抗ACT1(abclonal,批号:A6776);兔多抗TRAF6(批号:AF5376)、兔多抗TAK1(批号:AF7616)、兔多抗IKKα(批号:DF6047)、兔多抗P65(批号:AF5006)、兔多抗P50(批号:AF6217)均购自Affinity公司;TGF-β1酶免疫吸附试剂盒(批号:E-EL-0162c)、IL-1?琢酶联免疫吸附试剂盒(批号:E-EL-R0011c)、IL-17?琢酶联免疫吸附试剂盒(批号:E-EL-R0566c)、IL-21酶联免疫吸附试剂盒(批号:E-EL-R0568c)、IL-23酶联免疫吸附试剂盒(批号:E-EL-R0569c)均购自伊莱瑞特公司;胞浆胞核蛋白提取试剂盒(南京凯基生物,批号:KGP150)。
1.3 实验仪器
病理切片机(德国Leica RM 2016轮转式切片机,批号:2016);垂直电泳槽(北京六一仪器厂,批号:DYCZ-24DN);离心机(湖南湘仪实验室仪器开发有限公司,批号:HI650);电转仪(北京六一仪器厂,批号:DYCZ-40);磁力搅拌器(江苏省金坛市中大仪器厂,批号:T8-1);酶标仪(Thermo,批号:mμlISKANMK3);电热恒温鼓风干燥箱(上海精宏实验设备有限公司,批号:DHG 9203A);PCR仪(东胜创新生物科技有限公司,批号:580BR10905);紫外分析仪(北京君意东方电泳设备有限公司,批号:JY02S)。
2 方法
2.1 实验分组与动物模型制备
将购入的70只雌性SPF级Wistar大鼠,随机分为空白对照组、模型组、金乌健骨胶囊低剂量组、金乌健骨胶囊中剂量组、金乌健骨胶囊高剂量组、甲氨蝶呤组及益生菌组,每组10只。CIA模型按照参考文献[14]制备,在0.1 mol/L冰乙酸5 mL中加入10 mg牛Ⅱ型胶原冻干粉,置于4 ℃冰箱过夜,造模前与弗氏完全佐剂等体积混合,冰浴乳化,使配制浓度为1 mg·mL-1。除空白对照组外,其余各组大鼠待尾根部及右后足垫部消毒后,注射胶原乳剂0.2 mL/只致炎。7 d后再次加强免疫,于尾根部及右后足垫部皮内注射0.4 mL/只致炎。加强免疫后关节肿痛进一步加重,出现精神萎靡、食欲不振、脱毛等症状,这些表现符合CIA大鼠造模成功的标志[15]。
2.2 实验动物灌胃
加强免疫后一天开始灌胃给药,灌胃时间为4周。空白对照组及模型组每日按照大鼠体质量100 g·mL-1生理盐水灌胃,其余各组按照成人与动物给药等效计量换算给药,等效剂量人鼠换算=S(药物剂量g·60 kg-1)×0.625[16]。金乌健骨胶囊组每日分别给予金乌健骨胶囊(低剂量组:0.225 g·kg-1,中剂量组:0.45 g·kg-1和高剂量组:1.35 g·kg-1);甲氨蝶呤组每周给予0.001 g·kg-1的甲氨蝶呤;益生菌組每周给予0.35 g·kg-1益生菌。
2.3 检测指标及方法
2.3.1 大鼠一般情况观察 期间观察造模前后大鼠的毛色变化、活动状态、饮食、饮水及关节肿胀情况。末次给药后各组大鼠禁食不禁水,采集血清后用10%的水合氯醛麻醉大鼠,处死大鼠后分离关节滑膜组织及结肠组织,用于观察组织病理变化及后续实验。
2.3.2 足趾肿胀度测定 致炎后第7天开始观察大鼠右后足关节病变程度。参考相关文献,采用关节炎指数积分法评定法[17]。没有关节受累则为0分,一个关节或关节区为1分,两个关节或两个关节区为2分,两个或两个以上关节区则为3分,整个肢体则为4分。不同的关节区为趾骨关节、跗骨关节、踝关节、膝关节,分别测量第1、2、3、4周大鼠右后足关节肿胀度。
2.3.3 HE染色法检测滑膜及大肠组织病理情况 取10%福尔马林对大鼠滑膜及大肠组织进行标本固定,使用梯度乙醇对标本脱水,浸透蜡的标本包裹在石蜡块中。包埋好的蜡块使用徕卡病理切片机进行切片,将切片放入组织摊烤片机进行烤片,烤好的切片放入二甲苯及乙醇中脱蜡,切片依次放入蒸馏水浸洗5 min再入苏木素染液染5 min,自来水洗浸返蓝后的切片再放入1%水溶性伊红染液染色5 min,自来水洗浸洗。风干后用中性树胶封片,镜检。
2.3.4 TGF-β1、IL-1?琢、IL-17?琢、IL-21、IL-23的含量的测定 按试剂盒说明书加入标准品和待测样品,取大鼠血清3 000 r/min,离心10 min,取上清样检测。往空白孔加标准品及样品稀释液100 μL,标准孔和待测样品孔分别加标准品和待测样品100 μL。覆膜后37 ℃孵育后弃去孔内液体,甩干,每孔加入抗体100 μL,覆膜后37 ℃温育1 h。弃去液体,洗板3次。每孔加酶100 μL,覆膜后37 ℃温育30 min。弃去液体,甩干,洗板5次。每孔加显色剂90 μL,覆膜后37 ℃避光孵育15 min。每孔加终止液50 μL,此时蓝色立转黄色。立即用酶标仪在450 nm波长测量各孔的光密度。根据检测顺序测量各基因血清中的含量。
2.3.5 ACT1、TRAF6、TAK1、IKKα、P65、P50基因检测 取大肠组织,加入200 μL氯仿,混匀后室温放置5 min,在4 ℃,离心8 min后转移上层水相于新1.5 mL EP管中,加入400 μL异丙醇,静置10 min,在4 ℃,离心10 min,管底可见白色的RNA沉淀。弃上清,加入无RNase的75%乙醇1 mL,混匀后,在4 ℃,离心5 min。弃上清,将沉淀物溶于20 μL
DEPC水中。取溶解后的RNA 2 μL用微量分光光度计测定OD260/OD280值,根据公式计算RNA的浓度:总RNA浓度(μg/μL)=OD260×40×10-3,分别利用RT1和RT2将总RNA逆转录成cDNA,结果以β-actin为内参,利用2-ΔΔCt法计算其相对定量,使用引物序列如下表1。
2.3.6 ACT1、TRAF6、TAK1、IKKα、P65、P50蛋白检测 将大肠组织加蛋白裂解液,置冰上40 min,在4 ℃、离心10 min,取上清。用Bradford法对上清进行蛋白定量。取20 μg蛋白样品,进行电泳,100 V转移1 h至硝酸纤维素薄膜,37 ℃封闭1 h,一抗4 ℃过夜。用TBST液孵育作为阴性对照。洗膜后,将膜与碱性磷酸酶(AP)标记的抗IgG抗体孵育,洗去一抗。用TBST稀释相应的HRP标记二抗,室温孵育2 h,然后洗去二抗。将增强液与过氧化物酶按1:1比例混匀,滴加工作液于PVDF膜上,覆膜后用X光胶片压片后依次放入显影液显影、定影液定影,冲洗胶片。用图像分析测定各带吸光度(A)值作定量分析。
2.4 统计学处理
每组实验重复3次及以上,各组实验数据均采用SPSS 26.0统计软件分析,计量资料以“x±s”表示,若检验样本资料符合正态分布并且满足方差齐性,则采用方差分析及t检验,不符合的采用非参数检验。以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
3 结果
3.1 大鼠一般情况表现
造模前,各组大鼠表现并无差异。造模后,与对照组比较,模型组大鼠饮食、饮水情况下降,部分大鼠出现毛发脱落,关节肿胀导致运动缓慢、行走不稳,呼吸加快,对外界反映情况较急躁。给与金乌健骨胶囊及甲氨蝶呤、益生菌干预后,与模型组比较,给药组一般情况都有改善,尤以甲氨蝶呤及金乌健骨胶囊高剂量组明显。
3.2 金乌健骨胶囊对CIA大鼠右后足关节炎症指数评分的影响
结果如表2比较,与正常对照组比较,模型组在各时间点右后足关节炎症指数评分均显著升高(P<0.05或P<0.01)。与模型组比较,各给药组在给药第3周时右后足关节炎症指数评分增长缓慢,第4周时右后足关节炎症指数评分已显著降低(P<0.05或P<0.01)。
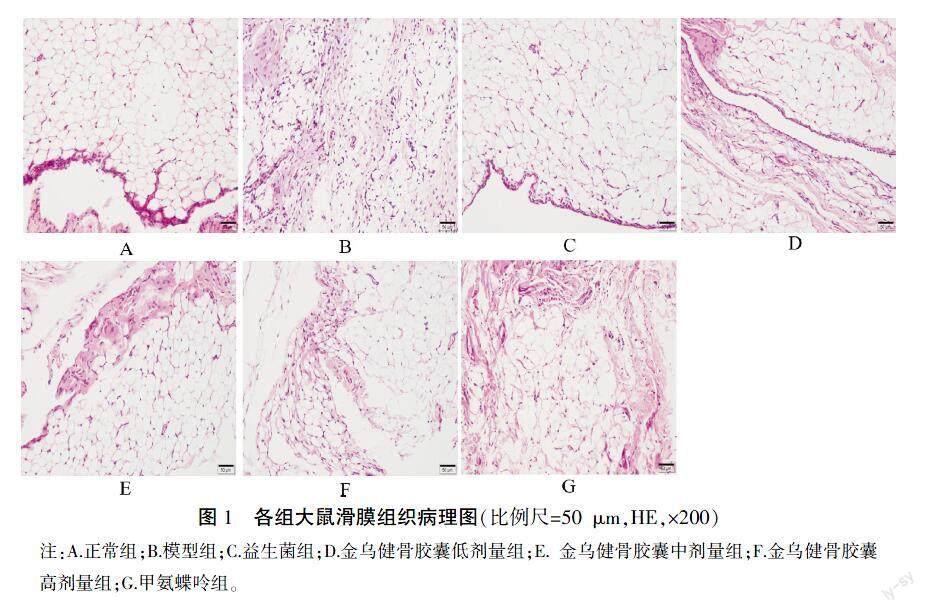
3.3 金乌健骨胶囊对CIA大鼠滑膜组织病理学的影响
正常对照组滑膜组织无血管翳形成及炎性细胞浸润,滑膜细胞排列整齐。模型组滑膜组织可见滑膜细胞增生,大量淋巴细胞成弥漫性浸润,并可见肉芽肿改变,血管翳形成。金乌健骨胶囊低剂量组及益生菌组滑膜间质内可见炎细胞浸润,滑膜组织增生水肿,滑膜细胞排列紊乱,与模型组比较无明显改善。金乌健骨胶囊中、高剂量组和甲氨蝶呤组可见少量新生血管形成及滑膜轻度增生,炎性细胞浸润少,与模型组大鼠比较,炎性浸润、增生、血管新生组织有明显改善,金乌健骨胶囊高剂量组和甲氨蝶呤组作用效果较为接近。详见图1。
3.4 金乌健骨胶囊对CIA大肠组织病理学的影响
正常对照组大肠组织黏膜层及黏膜下层可见周围黏膜大致正常及无炎细胞浸润,黏膜层及黏膜下层细胞排列整齐。模型组大肠组织黏膜层及黏膜下层可见大量细胞增生并水肿,大量炎性细胞成弥漫性浸润,并可见棉絮状假膜及纤维素样物形成。金乌健骨胶囊低剂量组内大肠黏膜层及黏膜下层可见稍中等量炎细胞浸润,大肠组织轻度增生水肿,大肠黏膜层及黏膜下层细炎性胞排列紊乱,与模型组比较无明显改善。金乌健骨胶囊中、高剂量组和甲氨蝶呤组可见少量棉絮状假膜及纤维素样物形成,炎性細胞浸润少,与模型组大鼠比较,炎性浸润、增生及弥漫性浸润有明显改善,金乌健骨胶囊高剂量组和甲氨蝶呤组作用效果较为接近。详见图2。
3.5 金乌健骨胶囊对CIA大鼠血清TGF-β1、IL-1?琢、IL-17?琢、IL-21、IL-23含量的影响
与正常对照组比较,模型组血清TGF-β1、IL-1?琢、IL-17?琢、IL-21、IL-23含量显著升高(P<0.05或P<0.01)。与模型组比较,甲氨蝶呤组及金乌健骨高剂量组血清TGF-β1、IL-1?琢、IL-17?琢、IL-21、IL-23含量显著降低(P<0.05或P<0.01)。详见图3。
3.6 金乌健骨胶囊对CIA大鼠大肠ACT1、TRAF6、TAK1、IKKα、P65、P50 mRNA的表达量影响
与正常对照组比较,模型组ACT1、TRAF6、TAK1、IKKα、P65、P50基因表达显著升高(P<0.05或P<0.01)。与模型组比较,各给药组ACT1、TRAF6、TAK1、IKKα、P65、P50基因表达显著降低(P<0.05或P<0.01)。详见图4。
3.7 金乌健骨胶囊对CIA大鼠大肠中ACT1、TRAF6、TAK1、IKKα、P65、P50蛋白的表达水平影响
与正常对照组比较,模型组ACT1、TRAF6、TAK1、IKKα、P65、P50蛋白表达显著升高(P<0.05或P<0.01),与模型组比较,金乌健骨胶囊组、甲氨蝶呤组及益生菌组ACT1、TRAF6、TAK1、IKKα、P65、P50蛋白表达显著降低(P<0.05或P<0.01)。详见图5—6。
4 讨论
RA是一种以侵袭性、对称性多关节炎为主要临床表现的慢性、全身性自身免疫性疾病。确切的发病机制不明,可导致关节畸形和功能丧失。有证据表明,肠道菌群失调在RA的发生发展中起着重要作用,肠道的通透性及损伤和炎症标志物的变化影响着关节炎症,肠道屏障完整性有助于关节炎的好转[18]。当肠道屏障的完整性被打破,其肠道微生物就会打破平衡产生肠道炎症,RA患者可观察到的常见微生物群变化包括细菌比重的降低,例如革兰氏阳性菌类和革兰氏阴性菌比例失衡,以及某些物种的过量或枯竭,其中普雷沃菌群可见大量增多[19]。早期RA患者肠道微生物失调导致的肠道炎症中以亚群普雷沃为主,同时发现RA患者肠道微生物中肠Th17细胞数量增加,Th17细胞表现出分泌IL-17响应于NF-κB迅速诱导RA[20]。
NF-κB是一种蛋白质复合物,其控制转录DNA及细胞因子的产生和细胞存活。NF-κB几乎存在于所有动物细胞类型中,并参与细胞刺激的反应,如应激、细胞因子、肠道炎症和自身免疫疾病[21]。IL-17是Th17细胞因子的原型。IL-17?琢通过有效介导中性粒细胞,参与肠道炎症反应。在本实验中通过造模以后血清中IL-17?琢明显升高,当给予金乌健骨胶囊以后IL-17?琢显著下降。此外IL-17?琢在氨基酸水平上的同源性较强,在不同的自身免疫性疾病中起着重要的作用[22]。IL-17?琢受体细胞通路,首先招募ACT1启动,其具有活化NF-κB的功能,ACT1在机体免疫反应的作用极为广泛。如在B细胞中,其可以通过调节CD40信号来影响B细胞的存活率。此外,也是NF-κB介导的炎症反应下游信号通路的重要分子。ACT1也被认为是IL-17?琢受体信号激活必需的分子,ACT1具有E3泛素连接酶活性,在IL-17?琢信号传递后,ACT1迅速招募并泛素化TRAF6与使用TRAF6的其他受体一样。研究表明,RA中成纤维细胞样滑膜细胞通过产生炎性细胞因子和蛋白酶导致软骨破坏,TRAF6升高的在RA滑膜与滑膜炎的严重性和炎症细胞浸润的数量显著相关[23]。IL-17通过IKK激酶激活IKKα降解触发NF-κB的激活。NF-κB随后上调IKKα和B细胞淋巴瘤3编码蛋白基因的表达,而NF-κBp50/NF-κBp65能与免疫球蛋白k轻链基因转录增强序列特异性结合。从而驱动了IL-17?琢/TRAF6/NF-κB信号促炎导致自身免疫疾病的发生[24]。本实验的滑膜病理及大肠病理结果表明,金乌健骨胶囊高剂量组和甲氨蝶呤组改善RA的滑膜炎及肠道炎症作用效果较为接近,各组ACT1、TRAF6、TAK1、IKKα及P65、P50下降水平及血清TGF-β1、IL-1?琢、IL-17?琢、IL-21、IL-23含量降低水平与甲氨蝶呤组类似,这也证明了苗药金乌健骨胶囊可能通过抑制IL-17?琢/TRAF6/NF-κB信号的表达来改善大鼠肠道、滑膜炎症。
中醫学认为RA属于“痹病”范畴,苗医医学认为其属于“痹毒”范畴。金乌健骨胶囊具有补肾活血、祛风除湿、通络止痛的作用,为贵州中医药大学第二附属医院长期用于治疗贵州人民RA的经验用方,对RA都能起到治愈或者缓解其关节肿痛的情况。前期研究者多通过体外培养RA-FLS或构建CIA模型大鼠,通过对炎症因子(IL-17、IL-1、IL-6等)、自噬相关基因(LC3、Beclin-1、Bcl-2等)、RA-FLS增殖与凋亡率等一系列数据的测定,得出金乌健骨胶囊防治RA具有良好疗效的结论[25]。但与肠道菌群失衡导致的肠道炎症方面未有研究,通过探讨苗药金乌健骨胶囊对胶原诱导关节炎模型CIA大鼠肠道、滑膜炎症及参与NF-κB信号通路基因ACT1、TRAF6、TAK1、IKKα、P65、P50表达的影响。对于RA的治疗具有广阔的临床应用前景以及较大的社会和经济效益。
从本实验结果来看,与正常对照组比较,模型组关节滑膜中ACT1、TRAF6、TAK1、IKKα及P65、P50 蛋白表达及血清TGF-β1、IL-1?琢、IL-17?琢、IL-21、IL-23含量显著升高,给予金乌健骨胶囊干预后,大肠组织中ACT1、TRAF6、TAK1、IKKα及P65、P50蛋白表达及血清TGF-β1、IL-1?琢、IL-17?琢、IL-21、IL-23含量降低,尤其以金乌健骨胶囊高剂量及甲氨蝶呤组显著降低,益生菌稍降低,而甲氨蝶呤片是临床上用于治疗RA的一线药物,况且肠道菌群失调导致的肠道、滑膜炎症与RA密切相关。由此可知,适当剂量的金乌健骨胶囊可通过抑制IL-17?琢/TRAF6/NF-κB信号途径来治疗RA。同时,病理切片显示苗药金乌健骨胶囊可抑制RA滑膜血管翳增生、降低滑膜细胞的侵润及抑制大肠棉絮状假膜及纤维素样物形成,炎性细胞浸润。可得出金乌健骨胶囊可抑制胶原诱导关节炎模型CIA大鼠的肠道、滑膜炎症。
综上所述,金乌健骨胶囊可改善大鼠肠道、滑膜炎症来治疗RA的作用机制可能是通过下调ACT1、TRAF6、TAK1、IKKα及P65、P50蛋白基因表达,降低炎症因子含量,抑制IL-17?琢/TRAF6/NF-κB信号途径的表达,防止滑膜细胞增生、血管翳形成,从而抑制RA炎症水平,使炎症障碍建立,快速代谢和快速消除全身的炎症。最终起到通过调控炎症,从而抑制类风湿关节炎病情的进展,缓解关节肿胀,降低炎症反应,防止骨破坏。这些可能为苗药金乌健骨胶囊的基础研究提供理论依据,为中医药治疗RA提供理论和实验依据。
参考文献
[1] 孙君阳, 李蒋凤, 张 勇, 等.微创针刀镜辅助治疗类风湿关节炎临床疗效的Meta分析[J]. 中医药导报, 2022, 28(12): 211-219.
[2] MAEDA Y, KURAKAWA T, UMEMOTO E, et al. Dysbiosis contributes to arthritis development via activation of autoreactive T cells in the intestine[J]. Arthritis & Rheumatology, 2016, 68(11): 2646-2661.
[3] KITAMURA K, SASAKI M, MATSUMOTO M, et al. Protective effect of Bacteroides fragilis LPS on Escherichia coli LPS-induced inflammatory changes in human monocytic cells and in a rheumatoid arthritis mouse model[J]. Immunology Letters, 2021, 233: 48-56.
[4] TAJIK N, FRECH M, SCHULZ O, et al. Targeting zonulin and intestinal epithelial barrier function to prevent onset of arthritis[J]. Nature Communications, 2020, 11: 1995.
[5] INAMO J. Non-causal association of gut microbiome on the risk of rheumatoid arthritis: A Mendelian randomisation study[J]. Annals of the Rheumatic Diseases, 2021, 80(7): e103.
[6] YANG P, QIAN F Y, ZHANG M F, et al. Th17 cell pathogenicity and plasticity in rheumatoid arthritis[J]. Journal of Leukocyte Biology, 2019, 106(6): 1233-1240.
[7] MANKAN A K, CANLI O, SCHWITALLA S, et al. TNF-alpha-dependent loss of IKKbeta-deficient myeloid progenitors triggers a cytokine loop culminating in granulocytosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(16): 6567-6572.
[8] LI M M, ZHANG D M, GE X, et al. TRAF6-p38/JNK-ATF2 axis promotes microglial inflammatory activation[J]. Experimental Cell Research, 2019, 376(2): 133-148.
[9] AARTS J, VAN CAAM A, CHEN X L, et al. Local inhibition of TGF-β1 signaling improves Th17/Treg balance but not joint pathology during experimental arthritis[J]. Scientific Reports, 2022, 12: 3182.
[10] 曹芝艳, 于 泓. 类风湿关节炎治疗研究进展[J]. 山东医药, 2019, 59(21): 108-111.
[11] 元晓龙, 马武开. 苗药金乌健骨方治疗类风湿关节炎疗效观察[J]. 亚太传统医药, 2018, 14(10): 188-190.
[12] 马武开, 钟 琴, 姚血明, 等. 苗药金乌健骨汤治疗类风湿关节炎临床观察[J]. 中华中医药杂志, 2010, 25(12): 2190-2192.
[13] 馬武开, 钟 琴, 姚血明, 等. 金乌健骨汤对甲氨喋呤耐药类风湿关节炎患者的影响[J]. 中医杂志, 2010, 51(11): 993-995.
[14] 苏云龙, 王雪梅. 胶原诱导性类风湿关节炎大鼠模型制备及早期表现评价[J]. 内蒙古医科大学学报, 2020, 42(1): 53-55, 58.
[15] 宁 燕, 罗康华, 蒋催蓉, 等. 苗药五香血藤提取物对CIA大鼠血清VEGF、ASIC3表达的影响[J]. 中国老年学杂志, 2022, 42(15): 3831-3834.
[16] 黄 颖, 马武开, 王 莹, 等. 苗药金乌健骨胶囊对糖皮质性骨质疏松模型大鼠Hedgehog信号的影响[J]. 中药材, 2021, 44(11): 2673-2676.
[17] 黄 禾, 卢 苇, 刘 勤, 等. 胶原诱导性关节炎大鼠18F-NaF micro-PET/CT和μCT评分与组织病理学的相关性分析[J]. 中国介入影像与治疗学, 2018, 15(4): 238-242.
[18] MATEI D E, MENON M, ALBER D G, et al. Intestinal barrier dysfunction plays an integral role in arthritis pathology and can be targeted to ameliorate disease[J]. Med, 2021, 2(7): 864-883.
[19] KASSELMAN L J, VERNICE N A, DELEON J, et al. The gut microbiome and elevated cardiovascular risk in obesity and autoimmunity[J]. Atherosclerosis, 2018, 271: 203-213.
[20] CHEN Y, CHEN H Q, DING J H, et al. Bifidobacterium longum ameliorates dextran sulfate sodium-induced colitis by producing conjugated linoleic acid, protecting intestinal mechanical barrier, restoring unbalanced gut microbiota, and regulating the toll-like receptor-4/nuclear factor-κB signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2021, 69(48): 14593-14608.
[21] GEORGANA I, MALUQUER DE MOTES C. Cullin-5 adaptor SPSB1 controls NF-κB activation downstream of multiple signaling pathways[J]. Frontiers in Immunology, 2020, 10: 3121.
[22] LIU X Y, SUN S Y, LIU D Y. IL-17D: A less studied cytokine of IL-17 family[J]. International Archives of Allergy and Immunology, 2020, 181(8): 618-623.
[23] ZHU L J, YANG T C, WU Q, et al. Tumor necrosis factor receptor-associated factor (TRAF) 6 inhibition mitigates the pro-inflammatory roles and proliferation of rheumatoid arthritis fibroblast-like synoviocytes[J]. Cytokine, 2017, 93: 26-33.
[24] FENG Y, ZHENG C J, ZHOU Z P, et al. IL-17A neutralizing antibody attenuates eosinophilic meningitis caused by Angiostrongylus cantonensis by involving IL-17RA/Traf6/NF-κB signaling[J]. Experimental Cell Research, 2019, 384(1): 111554.
[25] 蔡 鑫, 唐 芳, 马武开, 等. 苗药金乌健骨方治疗类风湿关节炎的研究进展[J]. 中国老年学杂志, 2021, 41(9): 2001-2004.
(本文编辑 苏 维)

