一种快速检测和定量土壤中尖孢镰刀菌的选择性培养基
王泽华,王 梓,方香玲
(草种创新与草地农业生态系统全国重点实验室 / 兰州大学草地微生物中心 /兰州大学草地农业科技学院, 甘肃 兰州 730020)
苜蓿(Medicagosativa)是一种多年生豆科牧草,其营养价值高、适口性好、耐受性强,是我国畜牧业生产的优质牧草[1-3]。尖孢镰刀菌(Fusarium oxysporum)引起的苜蓿枯萎病是苜蓿上的重要病害之一,会严重影响苜蓿的产量和品质,在我国东北、西北和华北等苜蓿种植区普遍发生,严重制约着苜蓿产业的发展[2]。尖孢镰刀菌是一种在全世界各种土壤中广泛分布的土传病原真菌[4],寄主范围广,能够引起100 多种作物发生枯萎病或根腐病[5-6]。在没有合适寄主植物的情况下,尖孢镰刀菌分生孢子可以在植物表面存活较长时间,或者以厚垣孢子在土壤种存活数年[6-7]。土壤中微生物区系复杂,普通培养基难以直接分离出尖孢镰刀菌。为了从土壤中快速高效地分离尖孢镰刀菌,本研究对特异性培养基进行了探索,从而为该菌的快速检测定量以及病害的发生机制和监测预警等研究提供基础。
1 材料与方法
1.1 试验材料
供试土壤采集自兰州大学榆中半干旱区生态农业实践基地,采样前去除土壤表面的植物残体等之后,取0-10 cm 深的土壤,过2 mm 孔径土筛后备用。
尖孢镰刀菌选择性分离培养基(selective isolation media forFusarium oxysporum, SIMF)的配置方法:取马铃薯葡萄糖肉汤培养基(potato dextrose broth,PDB)干粉4.8 g,用蒸馏水将其溶解,加CuSO4·5H2O 0.5 g、MgSO4·7H2O 0.5 g、KH2PO40.3 g、琼脂15.0 g,后加蒸馏水补足至1 L,利用1.0 mol·L-1NaOH 溶液调节pH 至6.5,121 ℃高压灭菌20 min。冷却至45 ℃左右时加入95%酒精10 mL、敌磺钠饱和溶液10 mL、20%硫酸链霉素4 mL、5%氯霉素溶液1 mL,搅拌均匀,倒制平板[8-10]。马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基的配制方法:取PDB 粉末4.8 g 和琼脂15.0 g,用1 L 蒸馏水溶解,121 ℃高压灭菌20 min,倒制平板。PDB 液体培养基的配制方法:称取PDB 干粉4.8 g,用1 L 蒸馏水溶解,分装于100 mL锥形瓶,121 ℃高压灭菌20 min 备用。
1.2 选择性培养基的分离验证
采用稀释平板法,取发病植株根围土壤1.0 g,用9 mL 无菌蒸馏水稀释;吸取稀释液1 mL,用9 mL无菌蒸馏水稀释后将稀释液0.1 mL 于选择性培养基上涂布,以涂布等量无菌水的PDA 培养基为对照。室温静置10 min,将涂布的平板和对照倒置放在培养箱内,25 ℃恒温黑暗培养5~7 d。挑取分离得到的菌落于PDA 培养基和SIMF 培养基,25 ℃培养4~5 d,采用十字交叉法,每天测量菌株直径,并依据Booth 的镰刀菌分类标准[11],进行形态学鉴定。
将分离的菌株接种于PDB 培养基120 r·min-1、25 ℃摇床培养3 d。参考Fang 等[12]的方法提取菌株DNA。利用引物ITS1 (5′-TCCGTAGGTGAACC TGCGG-3′) / ITS4 (5′-TCCTCCGCTTATTGATATG C-3′)[13],和EF1 (5′-ATGGGTAAGGARGACAAGA C-3′) / EF2 (5′-GGARGTACCAGTSATCATG-3′)[14]分别扩增供试菌株ITS 和TEF 序列。PCR 产物经1.2%琼脂糖凝胶电泳检测后,送上海生工测序。测序结果在NCBI 网站进行BLAST 比对,根据比对结果获得同源性最高镰刀菌的ITS 和TEF 序列[13,15-17]。
1.3 土壤中尖孢镰刀菌的分离率
将分离得到的菌株进行PDB 摇瓶培养并收集孢子悬浮液106个·mL-1,然后按照梯度稀释法稀释为不同的浓度,与灭菌土壤按比例混匀,制作成每克 土 含 量 为50 000个、5 000 个 和500 个 的 土 壤 样品,利用选择性培养基进行分离和计数,每隔24 h统计菌落数,并计算分离率。分离率 = (样品涂布定量结果/样品中孢子实际数量) × 100%。
1.4 数据分析
数据统计和图表利用Excel 2010 进行。测序结果通过BLAST 比对分析,从GenBank 下载镰刀菌属代表种序列,利用MEGA (6.0)通过邻接法(Neighbor-Joining)构建系统发育树,同时利用Bootstrap(1 000 次重复)检验各分支的置信度。
2 结果与分析
2.1 SIMF 培养基特异性验证
通过涂布发病土壤稀释液于不同的培养基上验证了尖孢镰刀菌选择性分离培养基的特异性。发病土壤稀释液涂布于PDA 培养基上,培养5 d 后培养基上滋生了多种菌,菌落形态各异(图1A),而发病土壤稀释液涂布于SIMF 培养基上,长出形态一致的菌落(图1B)。将在SIMF 培养基上的单菌落接种于PDA 培养基上培养4~5 d,分离到的菌株菌落淡紫色,菌丝呈条纹状、绒毛状至丛卷毛状(图1C、D)。小型分生孢子大量产生,椭圆形无隔或仅有一个分隔;大型分生孢子两端尖,呈梭形或镰刀形,通常有3 个分隔(图1E)。
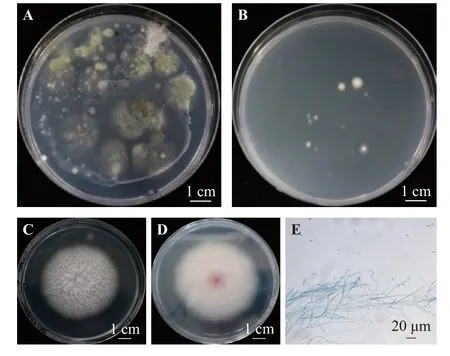
图1 SIMF 培养基的特异性验证Figure 1 Specificity of SIMF medium
对分离菌株进行ITS 和TEF 的PCR 扩增及测序,并将序列测定结果在NCBI 进行比对。该菌株的序列与已知尖孢镰刀菌苜蓿专化型如LZ22 (GenBank ITS序列号MW036290,TEF 序列号MW560899)[17]的序列同源性为100%。根据ITS和TEF 序列,采用邻近连接法构建系统发育树,分离得到的菌株与尖孢镰刀菌聚为一支(图2、图3)。
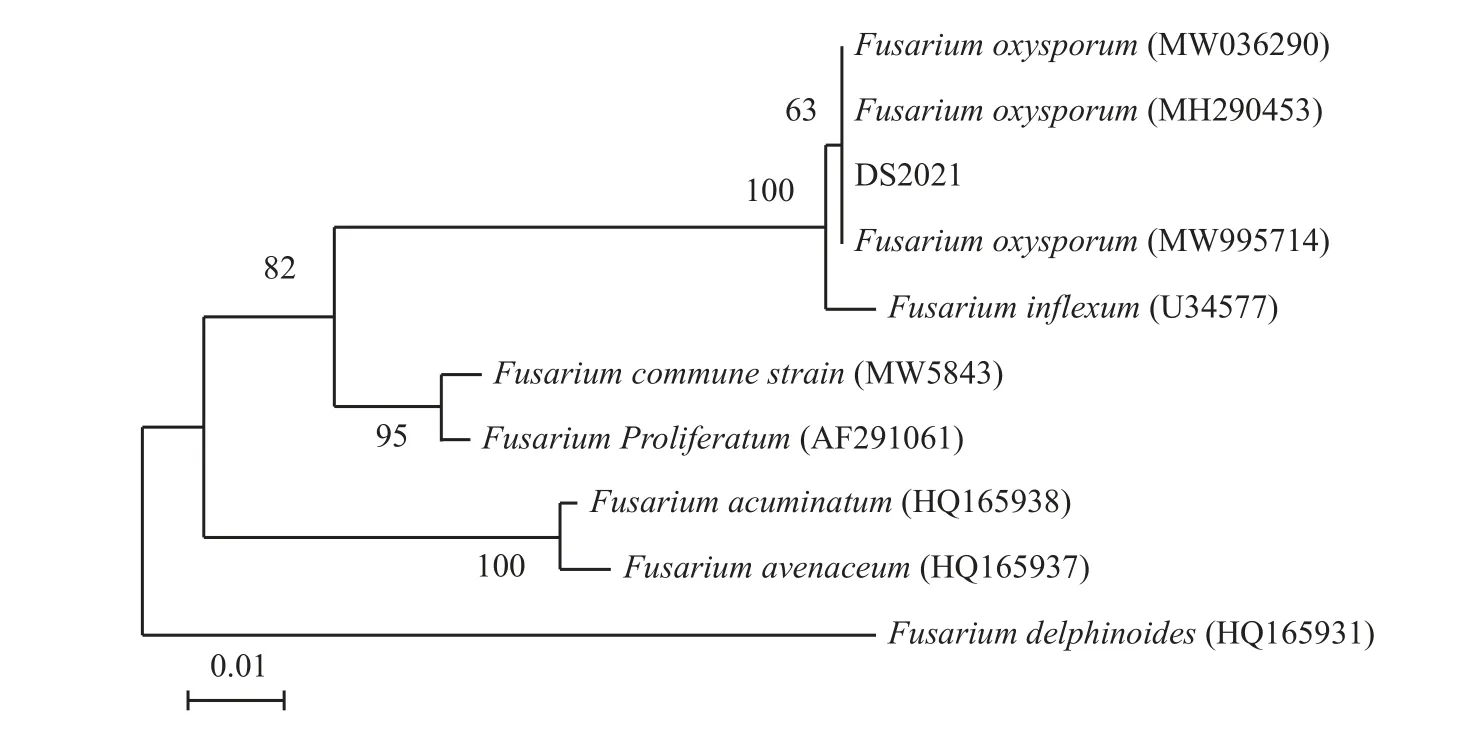
图2 基于rDNA-ITS 序列构建的镰刀菌系统发育树Figure 2 Fusariumphylogenetic tree constructed based on the rDNA-ITS sequence
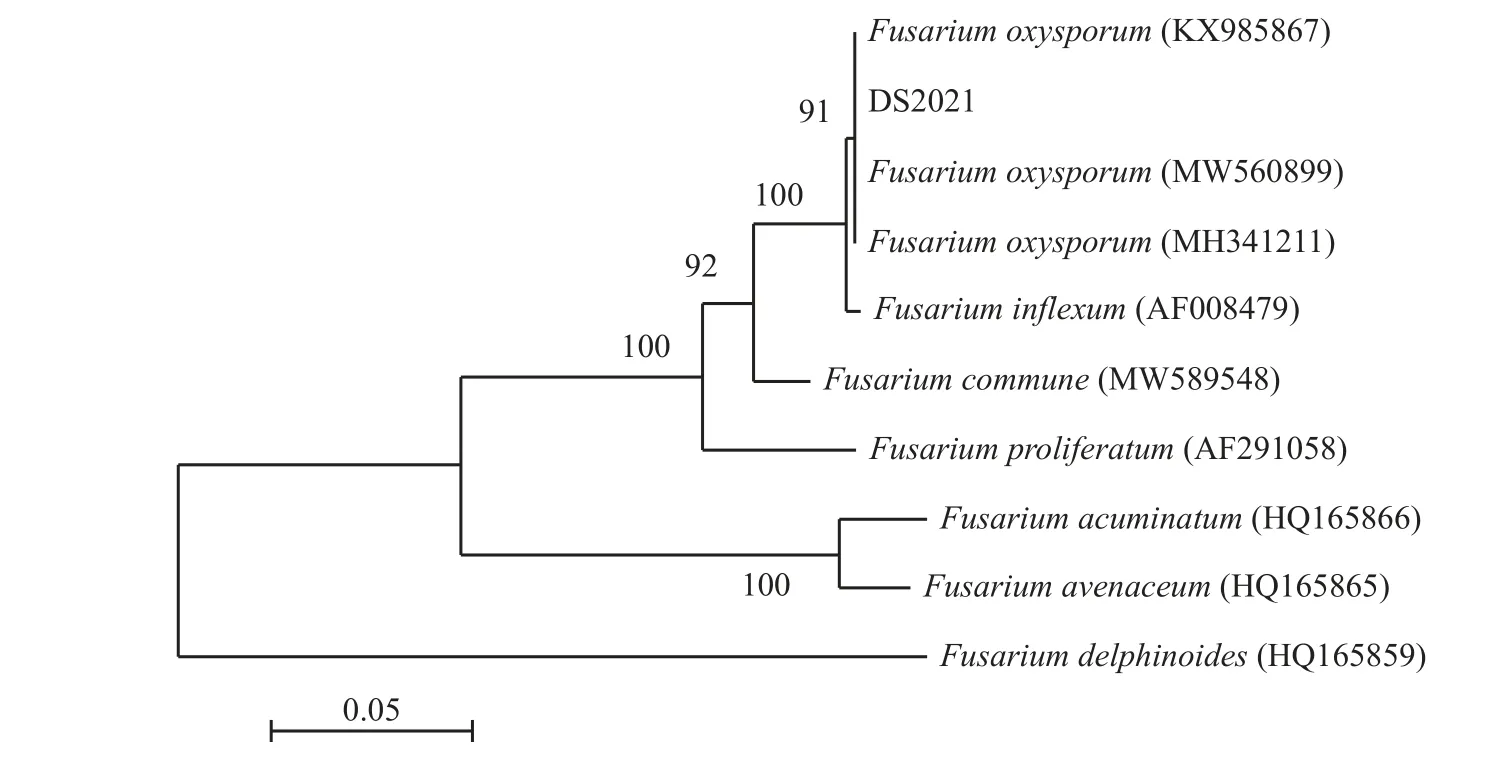
图3 基于TEF 序列构建的镰刀菌系统发育树Figure 3 Fusariumphylogenetic tree based on the TEF sequence
2.2 尖孢镰刀菌在SIMF 培养基上的生长特性
尖孢镰刀菌在SIMF 培养基上生长初期,菌落呈白色圆形且菌丝质密;培养5 d 后菌丝呈松散绒毛状,中间密边缘稀疏;菌落边缘有缺口呈锯齿状,中心呈淡黄色,菌落直径为22 mm,生长速度为4.4 mm·d-1(图4A)。在PDA 培 养 基 上 培 养5 d 后 直 径为66 mm,SIMF 培养基上菌落生长速度小于PDA上的生长速度。平板中有多个菌落时,菌落生长慢,培养5 d 时菌丝呈辐射状生长,菌落形态为白色不规则状,在平板上容易辨认 (图4B)。
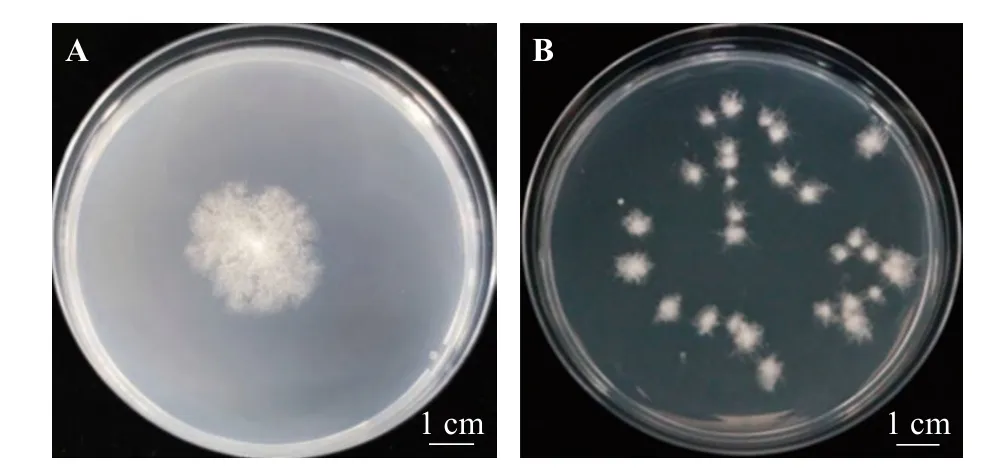
图4 尖孢镰刀菌在SIMF 培养基上的菌落形态Figure 4 Colony morphology of Fusarium oxysporumon SIMF medium
2.3 分离率随培养天数的变化
利用孢子含量为5 000 个每克带菌土壤验证培养基的分离率,统计不同培养天数的菌落数发现,随着培养天数的增加,分离率逐渐增加,初期生长较快,期间有一个生长缓慢的阶段(图5)。培养7 d时,菌落数趋于稳定,分离率达86.4%,培养7 d 后菌落有交叉重叠的现象,不利于计数。
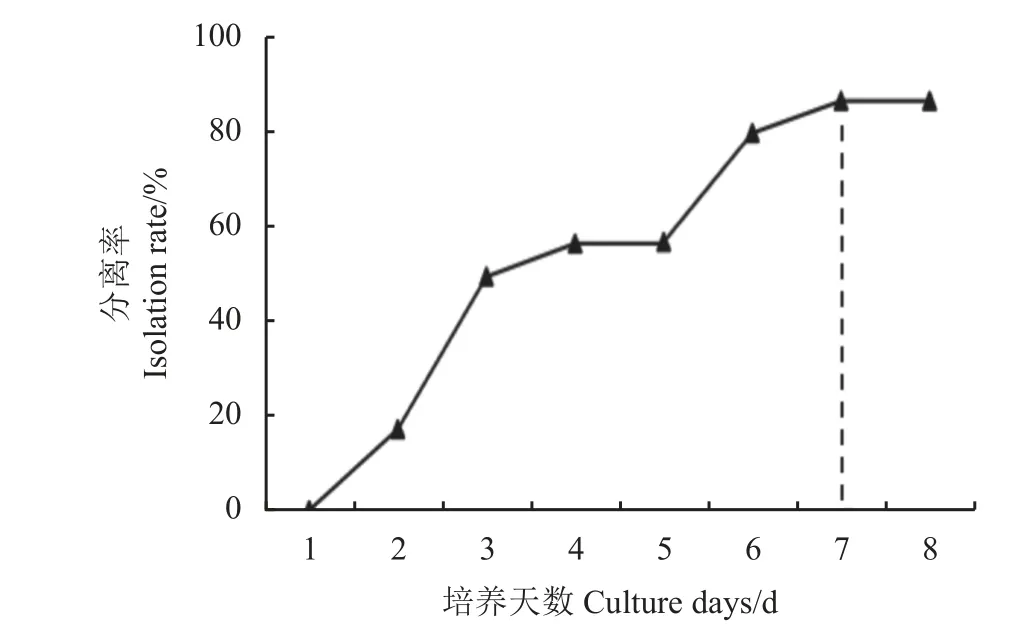
图5 不同培养天数分离率Figure 5 Changes in isolation rate at different culture days
2.4 土壤中不同含量尖孢镰刀菌的分离率
将孢子含量分别为每克土500、5 000、50 000 个的土壤涂布于选择性培养基上,测定土壤携菌分离率,发现分离率在50%~94%,平均分离率为79.3%,表明该选择性培养基检测效果较好。不同含菌量土壤的分离率不同,这与稀释浓度和平板菌落数相关。本研究中,孢子含量为每克土500 个~5 000 个时,平板菌落数介于30~50 个时计数最准确。孢子浓度为每克土50 000 个时,菌落数过多,有菌落重叠的现象不利于计数。
3 讨论
尖孢镰刀菌是土壤习居菌,可以在土壤中存活多年,一旦条件适宜,能够从根部入侵植物,危害植物健康[18]。常用的分离纯化土壤真菌的方法需要将土壤悬浮液涂布于培养基平板上,根据菌落形态特征初步鉴定,然后挑单菌落进行分离纯化3~4 次,从而获得目标菌株。但是这种操作过程复杂且费时,而使用选择性培养基能够从土壤中快速分离出尖孢镰刀菌,通过1 次纯化即可获得单一的纯菌株。已有关于尖孢镰刀菌选择性培养基的报道,筛选出特异性分离尖孢镰刀菌古巴专化型(F.oxysporumf.sp.cubense)和棉花专化型(F.oxysporumf.sp.vesinfectum)的选择性培养基[8,19-20],但是关于苜蓿专化型的选择性培养基未见报道。本研究在这些报道的基础上[8],对培养基配方进行了优化。碳源是微生物生长发育、孢子萌发的重要影响因素[21]。景晓辉等[8]以土豆(Solanum tuberosum)提取物为碳源,但土豆品种和个体之间差异会造成培养基碳源含量的差异,本研究利用成品PDB 干粉为碳源,为分离菌株提供了稳定一致的碳源,从而提高了培养基的稳定性。培养基中添加的敌磺钠对多种土壤真菌如丝囊菌(Aphanomyces)等具有抑制作用;链霉素对多种细菌如变形杆菌属(Proteus)和沙门菌属(Salmonella)具有抑制作用,但对多种革兰氏阳性细菌的抑制作用较差;而氯霉素是抑菌性广谱抗生素,对革兰氏阳性细菌和革兰氏阴性细菌均具有抑制作用,能够有效防止细菌的污染[22]。
本研究研制的尖孢镰刀菌选择性培养基能够快速分离出土壤中的尖孢镰刀菌。该培养基平均分离率为79.3%,平板菌落数在30~50 个时计数最为准确。培养7 d 后菌落数趋于稳定。结合稀释平板涂布法,可以将选择性培养基用于土壤中尖孢镰刀菌数量的定量研究。平板涂布法测定的菌为具有活性的菌数量,常与荧光定量方法一起用于土壤中尖孢镰刀菌的定量研究[23]。利用选择性培养基发现了香蕉(Musa nana)枯萎病发生率及严重程度与初始接种浓度有关,病害发生初期,土壤中病原菌的含量与病害严重程度正相关。同时还发现,发病香蕉根际土壤中病原菌的含量高于根围土[24-25]。通过利用Komada 选择性培养基对尖孢镰刀菌进行计数发现,间作模式有利于降低西瓜(Citrullus lanatus)根际尖孢镰刀菌数量,从而降低西瓜枯萎病的严重程度[26]。本研究的选择性培养基将为研究尖孢镰刀菌在苜蓿种植地土壤中的富集和定殖及病害发生规律等提供基础。
4 结论
本研究研制了一种快速分离和定量土壤中尖孢镰刀菌的特异性培养基。该培养基的成分及配置方法:马铃薯葡萄糖肉汤培养基(PDB)干粉4.8 g,用蒸馏水溶解后加CuSO4·5H2O 0.5 g、MgSO4·7H2O 0.5 g、KH2PO40.3 g、琼脂15.0 g,加蒸馏水补足至1 L,利用1 mol·L-1NaOH 溶液调节pH 至6.5,121 ℃高压灭菌20 min。冷却至45 ℃左右时加入95%酒精10 mL、敌磺钠饱和溶液10 mL、20%硫酸链霉素4 mL 和5%氯霉素溶液1 mL,搅拌均匀后倒制平板备用。

