多模态超声技术在乳腺良恶性病灶诊断及乳腺癌新辅助化疗疗效评估中的应用
井巧,胡园园,马宁飞,陈炎卿
乳腺癌是全球女性常见恶性肿瘤,死亡率较高,且其发病率呈逐年递增趋势,严重影响女性健康[1]。既往研究[2]表明,原位乳腺癌患者5年生存率可高达99%,但晚期乳腺癌患者生存仅为26%,因而临床早期诊断并给予有效治疗是改善患者预后的关键。新辅助化疗是一种在手术治疗前开展全身化疗进行肿瘤降期,获取化疗药物敏感性、指导后续治疗的有效治疗方式[3]。既往研究[4]表明,新辅助化疗有效性可达到60%~90%,但存在部分患者对新辅助化疗敏感不佳。因而临床需寻找有效方式对新辅助化疗疗效进行准确评估,利于调整化疗方案,提高生存期。超声检查是临床广泛使用的良恶性乳腺病灶鉴别诊断方式,常规超声(ultrasonic,US)可通过乳腺病灶形态、内部回声、方位、周围组织变化、边缘等诊断乳腺病灶良恶性[5]。超声造影(contrast-enhanced ultrasound,CEUS)、超声弹性成像 ( ultrasound elastography,UE)、自动乳腺全容积成像( automated breast vol- ume scanner, ABVS)是新型超声诊断技术,较传统超声诊断可提供很多价值性信息。但临床有关四项联合多模态超声诊断乳腺良恶性病灶的相关研究较少。基于此,本研究旨在探讨多模态超声技术对乳腺良恶性病灶的诊断及在乳腺癌新辅助化疗疗效评估中的应用价值。结果如下。
1 资料和方法
1.1 一般资料 选取2019年5月—2021年5月本院就诊的60例女性乳腺病变患者临床资料进行回顾性分析。年龄24~70(40.18±9.58)岁,病变最大径0.8~8.5(3.45±1.68)cm。患者均在本院行US、CEUS、UE、ABVS检查与病理活检。纳入标准:(1)病灶未经任何相关处理与治疗(切除或放化疗);(2)乳腺癌患者新辅助化疗前均经病理活检,明确病理类型,且无化疗禁忌证,完成4~8期新辅助化疗后行手术治疗患者;(3)分别于新辅助化疗前后进行US、CEUS、UE、ABVS检查;(4)患者及家属均知情同意并签署承诺书者。排除标准:(1)伴脏器严重器质性病变影响治疗或疗效评判者;(2)乳腺明显囊性病灶或有乳腺植入体存在;(3)既往乳腺切除术或活检术者;(4)其他部位肿瘤转移者;(5)其他部位原发灶者;(6)妊娠期、哺乳期女性;(7)认知障碍不能配合本研究者。本研究经我院医学伦理委员会审批同意。
1.2 方法 仪器为S2000西门子超声诊断仪,且具备CEUS、 UE 及ABVS成像系统,18L6HD手持式高频探头,设置频率为5.5~18 MHz,14L5BV ABVS成像系统探头,设置频率为5~14 MHz。取侧卧位、上举双上肢,双乳充分暴露。适当足量涂抹耦合剂,叮嘱患者保持平稳呼吸,探头轻置于乳房表面且垂直于皮肤表面,依次从双乳正位、健侧、患侧、乳晕、双侧腋窝扫查。调整参数便于清晰显示病灶,行全方位扫查,记录病灶的位置、边缘、大小、形态、纵横比、内部回声、血流信号与周围组织关系等。扫查后数据上传,处理工作站行图像容积重建,获取乳腺矢状面、横切面、冠状面图像。启动UE模式,明确抽样框大小后对肿块进行UE检查,采取实时图像压缩弹性、二维图像双显示模式,垂直皮肤予以探头低于10%均匀外力,60~70质量指数进行图像有效记录,并记录图像特征,估测弹性成像硬度评分。确定病灶血流信号最丰富的切面后开启CEUS模式,并调整输出声功率,保证处于低机械指数状态,通过双幅成像调节焦点至病灶后侧,图像稳定后经肘前静脉弹丸式注射造影剂4.8 mL(25 mL 声诺维(BraccoImagingB.V.)与0.9%氯化钠5 mL配置为混悬液,振摇均匀),并推注5 mL 0.9%氯化钠注射液进行静脉冲洗,叮嘱患者保持呼吸平静后记录3 min动态造影视频,分析造影动态过程,保存图像并进行脱机分析。结合US声像图特征、冠状面ABVS特征、UE评分、CEUS图像综合判断病变良恶性。上述检查均由同组医师完成,检查医生为具有多年超声影像工作经验的医生,检查测量过程存在不一致时经讨论完成。
乳腺癌新辅助化疗方案:按照NCCN指南标准,根据患者免疫组化结果与病理结果制定化疗方案,包括TC、TEC、CTF与CEF方案。其中HER2阳性患者需增加使用曲妥珠单抗。均在手术前接受4~8个周期新辅助化疗,21d 为1个周期,最后1个周期结束后间隔2周进行手术切除治疗,根据手术所取病理评价化疗疗效。所有乳腺癌患者均于新辅助化疗1个周期结束3 d后接受各项检查评估疗效。
1.3 观察指标 (1)US诊断乳腺良恶性病变[6]:参照BI-RADS标准,根据病灶二维声像图特征进行分类,总分为1、2、3、4(4A、4B、4C)、5类。本研究将≤4A 类视为良性病变,≥ 4B类视为恶性病变。(2)CEUS诊断乳腺良恶性病变[7]:CEUS过程无造影剂进入肿块为1分;CEUS模式下未明确肿块轮廓,且存在等增强状肿块与周边乳腺组织为2分;均匀或不均匀增强肿块,肿块增强范围同二维模式检查等大,且规整、边界清晰为3分;均匀或不均匀增强肿块,肿块增强范围较二维模式检查大,且边界不规则状为4分;不均匀增强肿块,肿块局部伴或不伴增强,且周边增强蟹爪样为5分。CEUS分数≥4分为恶性病变,≤3分为良性病变。(3)UE诊断乳腺良恶性病变[6]:整体病灶/大部分病灶呈绿色为1分;病灶中央蓝色,病灶周围呈绿色为2分;病灶区域存在相当蓝绿范围为3分;病灶伴少许绿色,红色为主为4分;病灶中央及周边均呈红色为5分。病灶红蓝绿相间为0分。弹性评分分数≥4分为恶性病变,≤3分为良性病变。(4)ABVS诊断乳腺良恶性病变[6]:根据ABVS 冠状面出现“虫蚀征”、“汇聚征”中任一征象则诊断为恶性病变。(5)多模态超声诊断乳腺良恶性病变:US、CEUS、UE、ABVS中任一诊断出恶性病变则视为多模态超声诊断乳腺恶性病变,US、CEUS、UE、ABVS均诊断为良性病变视为多模态超声诊断乳腺良性病变。(6)新辅助化疗疗效病理分级根据MilleroPayne(Miller-Paynedegree system)[8]标准分级,1~3级为组织学反应非显著(Non-major histological response,NMHR)/(无效组),4~5级为组织学反应显著(Major histological response,MHR)/(有效组)。根据实体瘤化疗疗效评价标准进行影像学评估新辅助化疗疗效[9]。有效为部分缓解+完全缓解,无效为疾病进展+疾病稳定。

2 结果
2.1 病理诊断结果 60例患者中,诊断出病灶62个,其中恶性病灶28个,包括浸润性导管癌17个、导管原位癌9个,黏液性癌1个、浸润性乳头状癌1个。良性良性病灶34个,其中纤维腺瘤21个、良性叶状肿瘤3个、导管内乳头状瘤4个、乳头腺瘤1个、乳腺炎症细胞浸润2个、乳腺腺病3个。
2.2 US、CEUS、UE、ABVS及多模态超声对乳腺良恶性病灶的诊断价值 以病理结果作为金标准,US诊断乳腺良恶性病灶的灵敏度为78.57%(22/28),特异度为85.29%(29/34);CEUS诊断乳腺良恶性病灶的灵敏度为78.57%(22/28),特异度为82.35%(28/34);UE诊断乳腺良恶性病灶的灵敏度为85.71%(24/28),特异度为73.53%(25/34);ABVS诊断乳腺良恶性病灶的灵敏度为75.00%(21/28),特异度为85.29%(29/34);多模态超声诊断乳腺良恶性病灶的灵敏度为96.43%(27/28),特异度为97.06%(33/34),见表1。
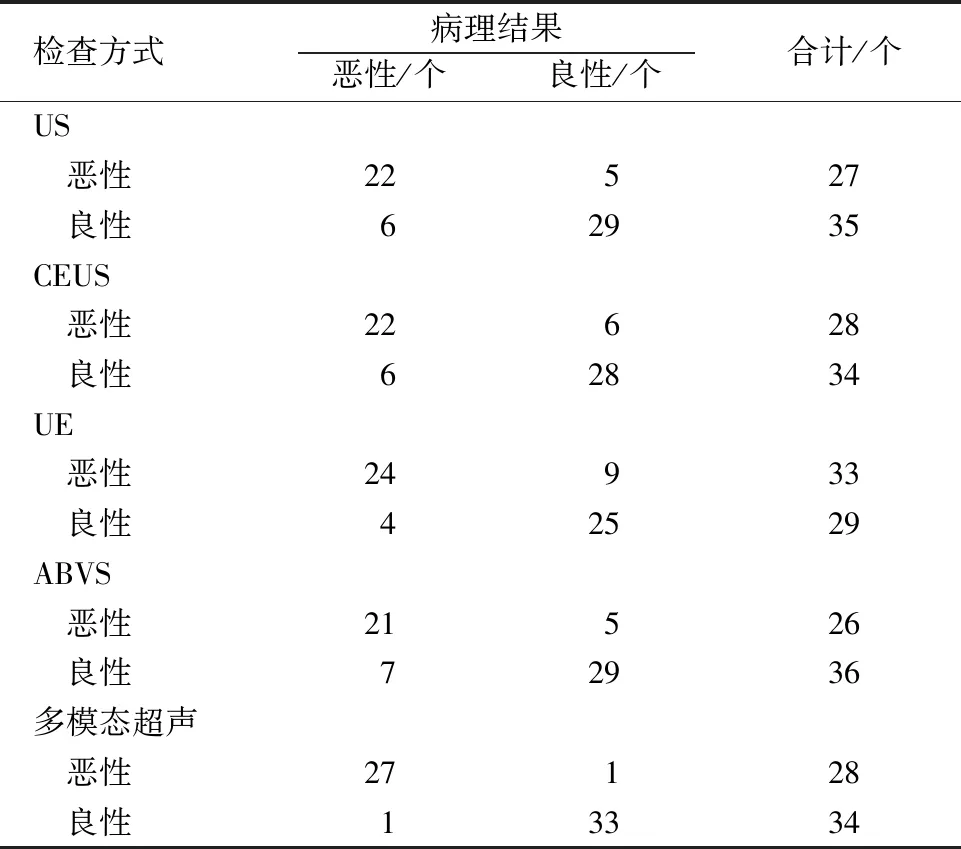
表1 US、CEUS、UE、ABVS及多模态超声对乳腺良恶性病灶的诊断价值
US、CEUS、UE、ABVS诊断乳腺良恶性病灶与病理结果相比,Kappa值分别为0.641、0.009、0.583、0.607,两者一致性均为一般;多模态超声诊断乳腺良恶性病灶与病理结果相比,Kappa值为0.935,两者一致性较好。多模态超声诊断乳腺良恶性病灶与病理结果Kappa值高于US、CEUS、UE、ABVS诊断Kappa值(P<0.05)。见表2。
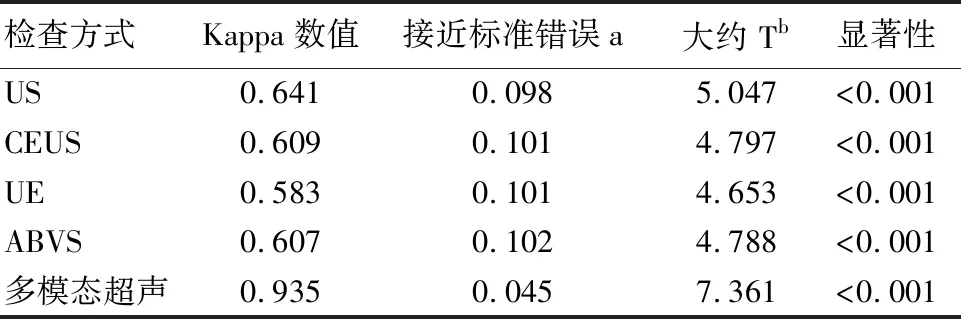
表2 US、CEUS、UE、ABVS及多模态超声对乳腺良恶性病灶与病理结果一致性
2.3 US、CEUS、UE、ABVS及多模态超声诊断乳腺良恶性病灶检出情况比较 5种检查方式的诊断漏检率与误诊率比较差异无统计学意义(P>0.05),诊断符合率比较差异有统计学意义(P<0.05),多模态超声诊断符合率明显高于其他检查方式(P<0.05),见表3。
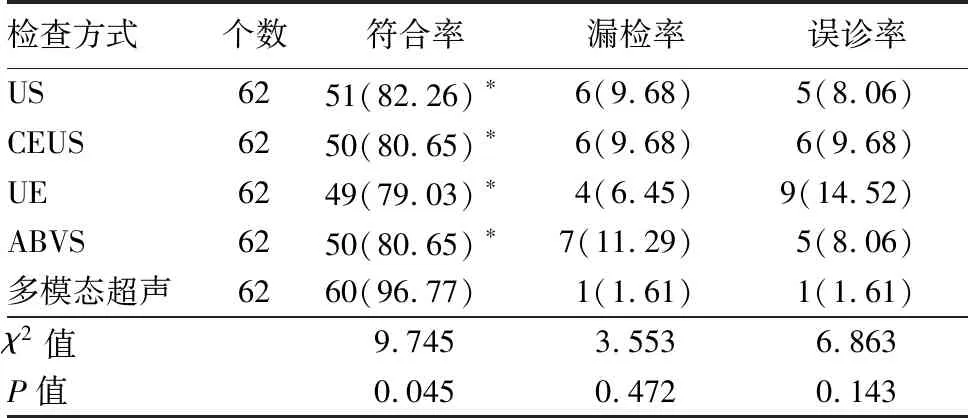
表3 US、CEUS、UE、ABVS及多模态超声诊断乳腺良恶性病灶检测情况比较
2.3 US、CEUS、UE、ABVS及多模态超声评估乳腺癌新辅助化疗疗效价值 病理检查结果显示,28例乳腺癌患者新辅助化疗MHR 21例,NMHR 7例。以病理结果作为金标准,US、CEUS、UE、ABVS评估乳腺癌新辅助化疗疗效的灵敏度分别为80.95%(17/21)、80.95%(17/21)、85.71%(18/21)、90.48%(19/21),特异度分别为71.43%(5/7)、85.71%(6/7)、71.43%(5/7)、85.71%(6/7);多模态超声评估乳腺癌新辅助化疗疗效的灵敏度为100.00%(21/21),特异度为85.71%(6/7),见表4。
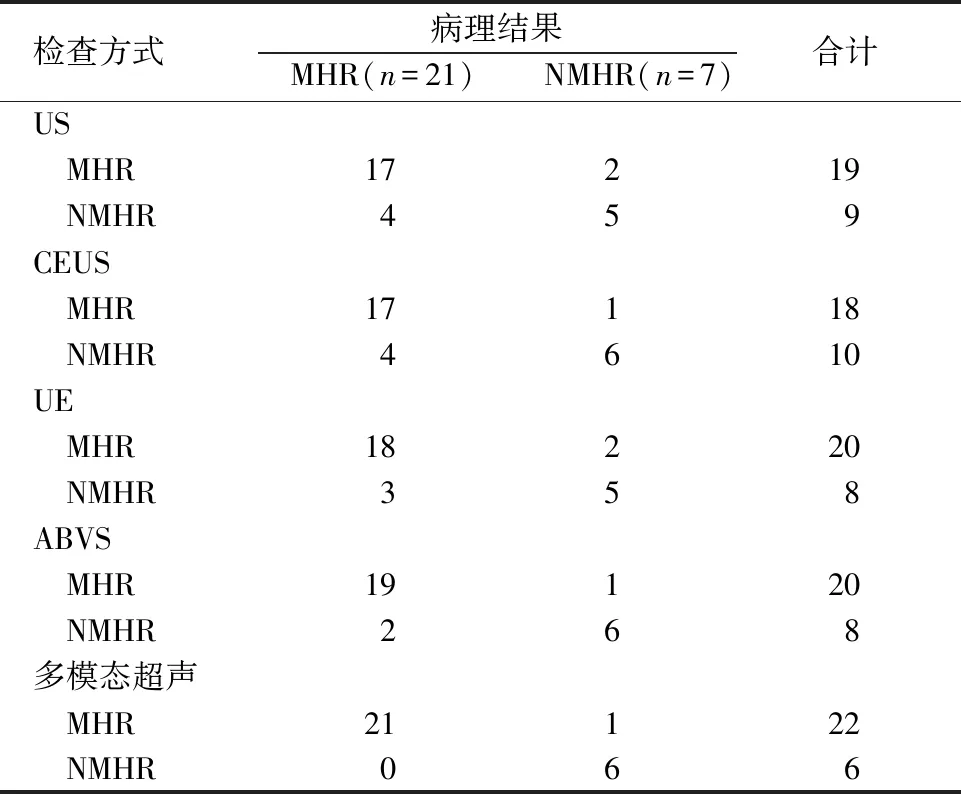
表4 US、CEUS、UE、ABVS及多模态超声评估乳腺癌新辅助化疗疗效价值
US、CEUS、UE、ABVS评估乳腺癌新辅助化疗疗效与病理结果相比,Kappa值分别为0.478、0.583、0.545、0.727,两者一致性均一般;多模态超声评估乳腺癌新辅助化疗疗效与病理结果相比,Kappa值为0.900,两者一致性较好。见表5。
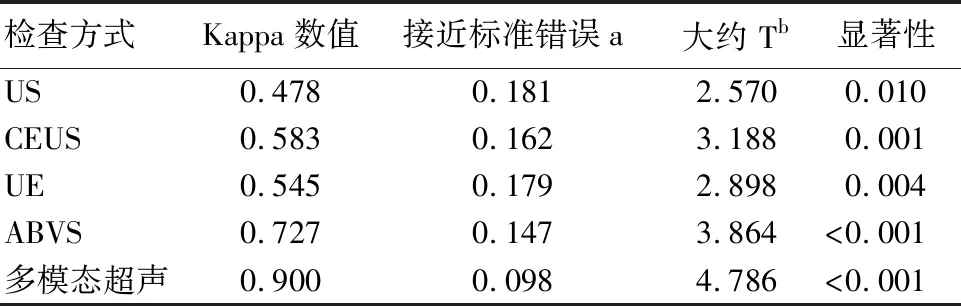
表5 US、CEUS、UE、ABVS及多模态超声评估乳腺癌新辅助化疗疗效与病理结果一致性
2.4 US、CEUS、UE、ABVS评估乳腺癌新辅助化疗疗效指标 US检查新辅助化疗前病灶最大直径比较差异无统计学意义(t=1.797,P>0.05),CEUS检查辅助化疗前后MTT、RT、TTP比较差异无统计学意义(t=1.754、0.310、1.868,P>0.05),但新辅助化疗后AUC、PI均低于新辅助化疗前(t=3.303、6.950,P<0.05),UE检查新辅助化疗后EI值、Emin值、Emax值、Emean值均低于新辅助化疗前(t=9.356、13.546、15.245、9.830,P<0.05),ABVS检查新辅助化疗后肿瘤体积、面积、厚、长、宽均低于新辅助化疗前(t=23.167、16.006、8.787、14.838、7.495,P<0.05),见表6。

表6 US、CEUS、UE、ABVS评估乳腺癌新辅助化疗疗效指标
3 讨论
超声技术因无辐射、无创优点被广泛应用于乳腺癌临床筛查与诊断,但针对典型特征恶性病变,临床易存在漏诊与误诊[10]。基于此,为提高临床诊断符合率,本研究提出多模态超声技术,在US显示病灶二维声像图特征基础上,创新性提出结合CEUS、UE、ABVS进行综合诊断乳腺病变良恶性。
本研究中,US诊断乳腺良恶性病灶与病理结果诊断Kappa值为0.641,两者一致性一般,诊断符合率为82.26%。误诊漏诊原因分析可能为[11]:(1)乳腺炎症细胞浸润US声像图表现与恶性病变相似度较高,临床易发生误诊;(2)而针对病灶直径较小,恶性征象不明显者(导管内乳头状瘤与导管内癌)容易导致误诊;(3)病灶内部成分复杂,出现坏死、液化等,呈现为良性病变特征易发生漏诊。CEUS技术可通过注射含微小气泡的造影剂进入静脉,显影于检查相应部位,从而观察检测区肿块微循环情况,CEUS可通过将造影前后肿块内血管灌注达峰时间、廓清时间与灌注过程进行对比,进而判断乳腺良恶性病变性质。既往研究[12]表明:乳腺恶性病变典型表现为向心性不均匀高增强,快进慢出或快进快出,内部可存在充盈缺损。根据超声造影检查时间强度曲线可发现,恶性病变增强开始时间较良性病变更早,峰值强度更高。本研究中,CEUS诊断乳腺良恶性病灶与病理结果诊断Kappa值为0.609,两者一致性一般,诊断符合率为80.65%,与US比较无显著差异,与既往研究结论一致[12]。误诊漏诊原因分析可能为:CEUS技术感兴趣选择受主观因素影响,且针对直径较小恶性病灶,内部未形成坏死,CEUS表现均匀高增强,且边界清晰,临床易出现漏诊。UE技术是通过生物组织弹性差异成像提供病灶组织硬度信息,且可清晰显示病灶边界,利于乳腺病灶良恶性诊断[13]。本研究中,UE诊断乳腺良恶性病灶与病理结果诊断Kappa值为0.583,两者一致性一般,诊断符合率为79.03%,具有较高误诊率。UE主要包括剪切波弹性成像、应变弹性成像。剪切波弹性成像无法实时多点测量,且重复性差,诊断肿块内部液化坏死,或纤维增生、钙化良性肿块,易造成误诊。ABVS可通过容积重建图像来获取病灶冠状面图像信息,冠状面ABVS“汇聚征”是乳腺癌主要特征,其主要病理为癌灶浸润性周边生长,并牵拉周边形成高低回声相间的放射状结构[14]。本研究中,ABVS诊断乳腺良恶性病灶与病理结果诊断Kappa值为0.607,两者一致性一般,诊断符合率为80.65%,具有较高诊断价值。其诊断不足原因分析可能为:ABVS不能扫查双侧腋下淋巴结,且无法显示病灶内部新生血管,无法评估乳腺病变淋巴结转移情况,因而临床单独诊断存在不足。超声技术作为乳腺癌临床筛查方法,不同检查方式诊断乳腺癌恶性病变敏感性与特异度均存在差异,且单一诊断存在局限性,临床可合理利用联合多种技术方法,提高鉴别诊断乳腺恶性病变符合率。本研究多模态超声诊断乳腺良恶性病灶与病理结果相比,Kappa值为0.935,两者一致性较好。诊断符合率为96.77%,诊断价值与符合率均较高。且多模态超声诊断乳腺良恶性病灶与病理结果Kappa值高于单一US、CEUS、UE、ABVS诊断Kappa值。分析原因为:多模态超声将多种超声检查技术结合,优势互补,提高乳腺良恶性病灶诊断率。
既往研究[15]表明:新辅助化疗疗效与包含肿瘤遗传学特征在内的多种个体因素密切相关,临床部分患者对新辅助化疗敏感性欠缺,且该类患者在疗效未达预期同时,会增加耐药性与化疗毒性。因而临床准确评估新辅助化疗疗效,是指导乳腺癌制定治疗方案,避免非必要化疗毒副作用的关键环节。现阶段评估新辅助化疗疗效主要依靠病理学、影像学检查与体检触诊。病理学检查是新辅助化疗疗效评估金标准,但其仅能在术后进行检查,检查存在滞后性,临床指导手术制定存在缺陷[16]。因而临床需寻找有效、快捷、简单的新辅助化疗疗效评估方式。US检测可明确显示病灶治疗前后体积变化,但其难以鉴别纤维化病灶与残余癌。US评估乳腺癌新辅助化疗疗效与病理结果相比,Kappa值为0.478;且新辅助化疗前后病灶最大直径比较无明显差异。提示US评估新辅助化疗疗效准确性不高。CEUS通过对比化疗前后肿块内造影剂灌注情况,可清晰直观显示肿块内血管网减少情况。新辅助化疗后肿瘤存在形态学改变,血流灌注减少,病灶内部微血管大量减少,CEUS评估新辅助化疗疗效具有可行性[17]。且新辅助化疗后AUC、PI均低于新辅助化疗前。新辅助化疗后肿瘤内部癌细胞凋亡,血管内皮生长因子生长减少,肿瘤微血管密度降低,而PI、AUC是血流灌注水平综合描述指标,PI、AUC值降低代表肿瘤血供减少,乳腺癌新辅助化疗有效。CEUS评估乳腺癌新辅助化疗疗效与病理结果相比,Kappa值为0.583,一致性一般。提示单一CEUS评估具有不足。乳腺癌患者新辅助化疗后肿瘤内部与周边组织发生改变,硬度也发生改变。UE检测可在乳腺癌新辅助化疗前后提供各弹性参数,分析弹性参数变化可有效评估疗效,临床潜能巨大。本研究中新辅助化疗后EI值、Emin值、Emax值、Emean值均低于新辅助化疗前,结果与上述结论一致。研究[18]表明:肿瘤内部与周围基质基因信号利于乳腺癌新辅助化疗疗效评估。本研究中UE评估乳腺癌新辅助化疗疗效与病理结果相比,Kappa值为0.545;UE评估新辅助化疗疗效高于US,但UE检测成像质量易受周围血管搏动、呼吸等干扰,且取样框无法全部取样,因而临床诊断存在缺陷。研究表明:ABVS可弥补US超声检查不足,后处理技术可获取多个切面图像,且三维立体图像可提供更多准确信息[19]。本研究中,新辅助化疗后体积、面积、厚、长、宽均低于新辅助化疗前。提示ABVS检查可通过三维立体图像准确测量病灶大小,为医师提供治疗依据。本研究中,ABVS评估乳腺癌新辅助化疗疗效与病理结果相比,Kappa值为0.727,具有较高一致性。为提高乳腺癌新辅助化疗疗效评估准确性,本研究创新性联用多模态超声技术,结果显示,多模态超声评估乳腺癌新辅助化疗疗效与病理结果相比Kappa值为0.900,两者具有较好一致性,高于单一US、CEUS、UE、ABVS评估Kappa值。提示多模态超声可全方面、多参数评估新辅助化疗疗效,指导临床治疗,改善患者预后。
综上所述,多模态超声技术在乳腺癌诊断与评估新辅助化疗疗效具有较高灵敏度与符合率,具有较好应用前景。本研究不足为研究样本量较少,因此仍有待进一步行大样本研究验证。

