人参皂苷Rg3对鱼藤酮纳米脂质载体诱导的帕金森病模型大鼠黑质神经元的保护作用
侯晓丽,张亚慧,唐迎乐,程宏*
帕金森病(parkinson’s disease, PD) 是一种常见的影响中老年人运动功能的中枢神经系统慢性变性疾病[1-2]。临床表现为静止性震颤、肌僵直、运动迟缓和姿势步态异常等,病理特征为黑质多巴胺能神经元缺失、残存神经元内出现Lewy小体,迄今为止,PD发病机制不清[3-5]。鱼藤酮作为一种杀虫剂可能对人体神经系统的功能产生影响,鱼藤酮诱导的PD动物模型是一个较成功的环境毒素PD模型[6]。本课题组采用具有缓释作用的鱼藤酮纳米脂质载体(rotenone nanostructured lipid carriers,R-NLC)建立了一种长期的慢性鱼藤酮暴露,个体差异小、死亡率低的PD大鼠模型[7-8]。
人参皂苷Rg3是人参的重要活性成分,对人体内分泌系统、免疫系统、心血管系统、神经系统、物质代谢等生命过程均有作用[9-10]。最近研究[11-12]认为Rg3对非小细胞肺癌以及新冠病毒引起的部分症状都有较好的治疗效果,Rg3能降低自由基水平,维持正常线粒体膜电位,改善受损线粒体氧化磷酸化功能,减少神经细胞凋亡。本研究以R-NLC制备PD大鼠模型,通过行为学实验、黑质HE染色和透射电镜观察,检测人参皂苷Rg3对PD模型大鼠行为学表现、神经细胞形态以及细胞凋亡的影响。
1 材料和方法
1.1 动物与分组 Sprague Dawley (SD)雄性成年大鼠36只,体质量(185±20)g,由扬州大学实验动物中心提供,SPF级,许可证号:SYXK(苏)2007-0005,自由饮食饮水及活动。SD大鼠随机分为对照组、模型组、低剂量组、中剂量组、高剂量组和阳性药物组,每组6只,分别编号1~6号。各组大鼠均于造模前3 d开始给药,每天1次,连续31 d,低剂量组给予3 mg/kg Rg3灌胃、中剂量组给予6 mg/kg Rg3灌胃、高剂量组给予12 mg/kg Rg3灌胃、阳性药物组给予11 mg/kg司来吉兰灌胃,对照组及模型组给予同等剂量羧甲基纤维素钠CMC-Na灌胃。灌胃3天后,除对照组外其余5组大鼠均皮下注射R-NLC,首剂量给予0.5 mg/kg,第2次给予0.8 mg/kg,此后每次1 mg/kg,2 d一次,连续28 d,对照组皮下注射同等剂量空白纳米脂质载体。采用肌僵直实验和评分法考察外观行为学表现;黑质HE染色和透射电镜观察神经元形态和细胞超微结构情况。
1.2 试剂与仪器 人参皂苷-Rg3(纯度98%)购自吉林大学植化室;盐酸司来吉兰片购自南京思科药业;羧甲基纤维素钠(CMC-Na)购自天津光复精细化工研究所;鱼藤酮购自广东省丰顺化工厂;泊洛沙姆188(F-68)购自南京威尔化工有限公司;大豆磷脂购自上海太伟药业有限公司;辛酸/癸酸三甘油酯购自浙江嘉兴市沪东日用助剂厂;三硬脂酸甘油酯购自上海化学试剂有限公司。配制R-NLC[7]:称取处方量鱼藤酮、三硬脂酸甘油酯、辛酸/癸酸三甘油酯至一大试管中,加热、超声溶解,作为油相;称取处方量F-68、大豆磷脂,搅拌溶解,作为水相。将水相用针管缓缓加入油相中,边加边搅拌,在75 ℃、20 000 r/min条件下高速搅拌10 min,然后在75 ℃水浴中超声,放冰箱低温固化,得R-NLC混悬液。不加入鱼藤酮,其他步骤同上,得空白NLC混悬液。配制人参皂苷Rg3溶液:称取60 mg人参皂苷Rg3加入0.5% CMC-Na 20 mL,振摇、混旋,得3 mg/mL人参皂苷Rg3溶液,此为高剂量组,再将该溶液分别稀释1倍和2倍得中剂量组和低剂量组。配制司来吉兰溶液:136 mg司来吉兰溶解于0.5% CMC-Na 20 mL溶液。使用仪器:数显恒温水浴锅(常州国华电器有限公司);电子天平(Sartorius,德国);台式离心机(MODEL550,德国Eppendorf);恒温磁力搅拌器(常州国华电器有限公司);高速均质乳化机(PT-3100,瑞士POLYTRON);高功率数控超声波清洗器(昆山市超声仪器有限公司);超低温冰箱(-86 ℃,美国Thermo Scientific Revco);石蜡切片机(德国莱卡公司);透射电子显微镜(Tecnai,荷兰PHILIPS)。
1.3 外观行为表现评分 对大鼠的行为表现进行评分[13]:大鼠出现拒捕行为减弱,毛色变黄变脏,弓背,主动活动减少记为1分;动作迟缓,并有震颤或有步态不稳记为2分;步态不能成一条直线,出现单侧旋转记为4分;单侧瘫痪,行走困难,进食困难记为6分;完全瘫痪,不能进食记为8分;濒临死亡或死亡记为10分。
1.4 肌僵直实验 大鼠肌僵直实验反映的是大鼠运动的启动难易,用移动潜伏期时间来表示,时间短表明启动容易,而时间长表明启动困难,对应PD患者的症状是运动迟缓。应用网格试验:实验装置为一个与水平面垂直的金属网格(60 cm×40 cm,格间距为1 cm);将大鼠头朝上置于金属网格中央,使与地面垂直,趾爪均抓住金属网格;用秒表记录大鼠静止状态至任意一爪移动时所需的时间,即为移动潜伏期[14]。
1.5 HE染色 各组大鼠取一半用1%戊巴比妥钠麻醉后,迅速断头,取脑,置于4 ℃的40%多聚甲醛溶液中固定。石蜡包埋切片,切片厚5μm,HE染色,光学显微镜下观察各细胞的形态并摄片[15]。
1.6 黑质透射电镜观察 各组大鼠取一半用1%戊巴比妥钠麻醉后,迅速断头,取黑质组织,双面刀片把样品切割成1 mm×1 mm×1 mm小块,置于4 ℃的2.5%戊二醛溶液中固定,环氧树脂包埋,超薄切片,乙酸双氧铀和枸橼酸铅双重染色,透射电子显微镜下观察超微结构变化[16]。

2 结果
2.1 人参皂苷Rg3对PD模型大鼠外观行为表现的影响 对照组外观行为表现正常,外观行为表现评分为0分;模型组大鼠出现姿态不稳、精神萎靡等症状,外观行为表现评分高于1分,且随造模时间增加而升高,至第28天外观行为表现评分平均值高于5分;Rg3低剂量组及中剂量组大鼠自发活动正常,肌肉不强直,外观行为表现评分均低于或接近1分;Rg3高剂量组及阳性药物组大鼠步态稳定,精神亢奋,自发活动多,未见异常表现,外观行为表现评分为0分。见表1、图1。
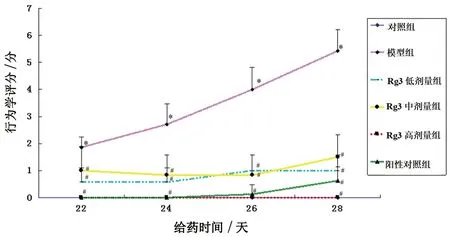
图1 Rg3对PD模型大鼠行为学评分的影响

表1 Rg3对PD模型大鼠行为学评分的影响
2.2 人参皂苷Rg3对PD模型大鼠移动潜伏期的影响 对照组大鼠移动潜伏期小于1.5秒,表现正常;模型组大鼠移动潜伏期平均值从4.32秒到14.17秒,高于对照组(P<0.05);低、中、高剂量人参皂苷Rg3组与阳性药物组均见潜伏期缩短,潜伏期平均值在0.26秒至3.35秒之间,低于模型组(P<0.05)。见表2、图2。

图2 Rg3对PD模型大鼠移动潜伏期的影响

表2 Rg3对PD模型大鼠移动潜伏期的影响
2.3 人参皂苷Rg3对PD模型大鼠神经元形态的影响
2.3.1 HE染色观察黑质神经元形态 与对照组相比,模型组大鼠神经元减少,尼氏体减少,神经元出现核固缩,胞体缩小,细胞内物质出现边集现象,有的出现嗜酸性细胞;低、中、高剂量人参皂苷Rg3组与阳性药物组可见更多正常形态神经元,减少尼氏体的消失,减少细胞死亡。见图3。
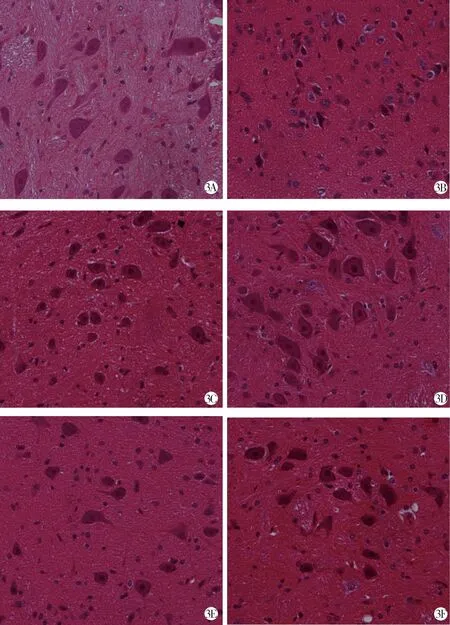
3A 对照组 3B 模型组 3C Rg3低剂量组 3D Rg3中剂量组 3E Rg3高剂量组 3F 司来吉兰组
2.3.2 透射电镜观察黑质神经元超微结构 对照组神经元细胞核大而圆,核膜完整,可见膜间隙,核膜上有较多的核糖体,细胞核内着色均匀,可见常染色质与异染色质,核仁大且圆,着色较深,无明显异染色质边聚现象,细胞质中可见较多完整的线粒体和内质网结构,线粒体中可见清晰的嵴,内质网多为粗面型的,上有较多核糖体,较多为扁平囊状,无肿胀扩张现象(图4A)。模型组神经元细胞稍有皱缩,细胞体积变小,细胞核膜边界不清晰,少见膜间隙,核膜上少见核糖体,核仁体积变小,染色质凝聚成块并有边聚倾向;胞浆体积变小,细胞质中细胞器数量减少,内质网上核糖体数量减少,线粒体出现嵴部分溶解现象,线粒体和内质网出现肿胀、扩张现象,有空泡产生(图4B)。经过低、中、高剂量人参皂苷Rg3干预,与模型组相比,神经元细胞的超微结构正常,少见细胞皱缩,细胞核膜清晰,核仁大而圆,细胞质中可见正常完整的细胞器,与正常组接近;高剂量Rg3及阳性药物干预后未见结构异常细胞(图4C-4F)。

4A 对照组 4B 模型组 4C Rg3低剂量组 4D Rg3中剂量组 4E Rg3高剂量组 4F 阳性药物组。
3 讨论
近年来,鱼藤酮作用于培养的神经细胞或动物模型后导致细胞凋亡的现象被广泛研究[17-18]。本实验室前期研究结果提示人参皂苷Rg3在体外能够抑制MPP+(1-甲基-4-苯基-1,2,3,6-四氢吡啶)诱导的PC12细胞凋亡[19]。此外也有报道[20-21]证实鱼藤酮可激活Caspase-3等凋亡途径参与PC12细胞的凋亡过程,发现鱼藤酮可通过升高NO含量引起线粒体膜通透性增加,由此产生一系列关键性变化,包括Cyt c的释放、线粒体跨膜电位的下降等,最终导致Caspase-3激活,并进一步激活下游的Caspase引起细胞凋亡。本实验室通过前期研究表明,应用R-NLC制备PD大鼠模型比用鱼藤酮溶液效果更好,因此,本实验选用R-NLC来制备PD大鼠模型,进一步探讨人参皂苷Rg3对PD模型大鼠黑质神经元的保护作用。
PD患者的症状主要有静止性震颤、肌强直、运动迟缓和姿势不稳等,本研究对各组大鼠进行外观行为表现评分,检测各组大鼠的行为学表现。结果显示,模型组出现了毛色变脏、弓背、动作迟缓,并有震颤、步态不稳甚至瘫痪等症状,外观行为表现评分集中在4~7分左右,与对照组相比有统计学差异;与模型组相比,低、中、高剂量Rg3组显示PD症状减轻,自主活动能力增强,运动协调能力改善,外观行为表现评分集中在1~2分之间,差异有统计学意义。从大鼠外观行为表现评分可见,人参皂苷Rg3可改善PD模型大鼠行为学表现,且与阳性药物组效果相似,这与之前的研究[19]结果一致。
本项研究还开展了肌僵直实验,分析大鼠移动潜伏期的变化。与对照组相比,模型组的移动潜伏期时间明显延长,差异有统计学意义;与模型组相比,低、中、高剂量Rg3给药组移动潜伏期时间明显缩短,差异有统计学意义。这些结果提示人参皂苷Rg3和阳性药物司来吉兰均对PD模型大鼠的行为学障碍有改善作用。
PD的主要病理改变是中脑腹侧特别是黑质致密部DA能神经元进行性变性缺失。近年资料[22]表明,细胞凋亡可能是PD发病机制涉及的一条共同通路,细胞凋亡是受特定基因经特定信号传导途径调控的细胞死亡的一种形式,其形态改变主要在细胞核,有区别于坏死的典型特征。本研究应用HE染色和透射电镜技术检测人参皂苷Rg3对模型大鼠神经元形态的影响。HE染色结果显示,模型组黑质多巴胺能神经元数目减少,凋亡细胞比例增多。透射电镜可更直观地观察到神经元凋亡的形态特征,如细胞核皱缩、染色质凝集成块状或新月形小体并聚集于核膜,或出现凋亡小体等。本研究应用透射电镜观察发现,模型组黑质致密带虽无凋亡小体形成,但神经元有早期凋亡的形态学改变,这可能与观察时机和凋亡细胞数量有限有关。经一定剂量的人参皂苷Rg3预处理后,存活神经元数量增多,神经元缺失现象减少,凋亡细胞比例也随之下降。以上研究结果提示,人参皂苷Rg3对R-NLC诱导黑质神经元凋亡有阻断作用,并且此作用与Rg3的剂量呈一定的量效关系:Rg3高剂量组>Rg3中剂量组>Rg3低剂量组。本课题组前期研究曾应用TUNEL法检测发现,模型组黑质TUNEL染色阳性细胞数目增高,经人参皂苷Rg3预处理后,TUNEL染色阳性细胞数目减少;应用Annexin V-FITC/PI双染PC12细胞,流式细胞仪测定细胞凋亡率,吖啶橙/溴化乙锭染色观察细胞凋亡形态,结果发现人参皂苷Rg3能够使MPP+诱导升高的凋亡率下降[19]。至此,本课题组应用三种细胞凋亡检测方法,用体内和体外实验均证实了人参皂苷Rg3能改善神经元形态,减少细胞器变形,抑制黑质神经元凋亡,发挥对黑质神经元的保护作用。
本研究使用的阳性药物司来吉兰是临床治疗PD的上市药物。司来吉兰为选择性单胺氧化酶-B(MAO-B)抑制剂,能迅速通过血脑屏障,抑制多巴胺的降解,相对增加多巴胺含量,补充神经元合成多巴胺能力的不足,它的代谢产物可抑制多巴胺的再摄取,这些作用可加强脑中多巴胺能神经功能,从而达到治疗震颤性麻痹的作用[23]。本实验应用司来吉兰作为阳性药物的目的主要在于判断人参皂苷Rg3对PD动物模型的保护作用。结果表明司来吉兰可改善PD模型大鼠的行为学评分,减少细胞凋亡,发挥神经保护作用;而Rg3对R-NLC诱导的黑质能神经元损伤有保护作用,可减少神经元的凋亡,尤其是Rg3高剂量组的干预效果与司来吉兰组的效果接近。为了选择合适的司来吉兰使用浓度,本课题组参考相关文献并做了预实验。有文献针对小鼠灌胃采用了10 mg/kg司来吉兰有较好效果并作为阳性对照,本课题组则发现11 mg/kg司来吉兰对大鼠有明显的效果,因此采用11mg/kg司来吉兰作为针对大鼠PD模型的阳性对照组[24]。
本项研究采用外观行为表现评分、肌僵直实验、HE染色及透射电镜检测等方法,分析了人参皂苷Rg3对R-NLC诱导的PD模型大鼠的影响。研究结果表明人参皂苷Rg3有助于改善PD模型大鼠的外观行为表现评分,缩短移动潜伏期时间,改善大鼠运动能力,维持正常神经元形态,抑制黑质神经元细胞凋亡,提高神经元存活率,发挥神经保护作用。该研究的开展有助于进一步探讨PD的发病机制,有助于探讨Rg3对PD模型的保护作用,有助于进一步探索Rg3发挥神经保护作用的分子机制,为临床应用人参皂苷Rg3治疗神经退行性疾病提供实验依据。
虽然本项研究明确了人参皂苷Rg3对PD模型大鼠有神经保护作用,但其作用的分子机制如何,是否涉及诱导多种类型的细胞死亡,如细胞凋亡、细胞坏死、细胞自噬、细胞焦亡、铁死亡等,是否涉及多条细胞信号转导通路,是否涉及抑制氧化应激反应等都值得进一步探讨。

