球毛壳菌ND35 对枸杞扦插苗根系发育的影响
马深成,王 杰,李 旭,吕新民,吴俊东,高尚坤,田叶韩*
(1.泰安市泰山森林病虫害防治检疫站 山东 泰安 271000;2.平度市大泽山林场 山东 平度 266700;3.泰安市徂徕山林场 山东 泰安 271000;4.山东农业大学植物保护学院/山东省林业有害生物防控工程技术研究中心,山东 泰安 271018)
球毛壳菌(Chaetomium globosum)隶属于子囊菌门(Ascomycota),核菌纲(Pyrenomycetes),粪壳菌目(Sordariales),毛壳菌科(Chaetomiaceae),毛壳菌属(Chaetomium),是公认的生产碳水化合物活性酶和抗生素的真菌,也是公认的植物生防菌[1-3]。球毛壳菌(C.globosum)ND35 是分离自健康毛白杨的一株具有促生、抗逆和防病功能的植物内生真菌。大量试验数据表明,球毛壳菌ND35 能够在宿主植物体内长期定殖,促进植物生长发育,提高植物抗逆性,同时对多种植物病原菌产生拮抗作用[4-10]。
枸杞(Lycium),茄科枸杞属多年生木本植物,起源于中国,多分布于温带和亚热带地区,在中国北方多数省区都有栽培。枸杞喜光,喜冷凉气候,耐寒、耐寒、耐盐碱能力较强,在干旱荒漠地、盐碱地动能生长。扦插育苗是枸杞是规模化育苗的主要无性繁殖方式的,具有保持品种遗传特性、繁殖系数高、成苗快速、成本低等特点。目前,枸杞扦插育苗的研究主要集中在提高插穗成活率的技术措施,如促生根剂的选择及使用方法、采条时间、促进生根等措施[11-13]。为了解决枸杞扦插育苗成活率低,扦插育苗病虫害等问题。本试验通过采用植物内生菌处理宁夏枸杞扦插苗,观测球毛壳菌ND35 处理对宁夏枸杞扦插苗根形态生长发育的影响,筛选枸杞苗木繁育筛选新型微生物生根剂,为枸杞扦插育苗繁育质量和产量提供理论依据。
2 材料与方法
2.1 供试材料
供试的球毛壳菌ND35 菌株由山东农业大学高克祥教授馈赠,枸杞扦插枝(宁枸7 号)由宁夏农林科学院李越鲲研究员馈赠,并于2022 年—2023 年分别在平度市大泽山林场、泰安市徂徕山林场的温室内进行引种定植。2023 年5 月从各林场挑选苗高、地径较均匀一致的健康枸杞扦插苗共60 株,随机选择20 株为一组,共3 组处理。球毛壳菌ND35 对枸杞扦插苗根系发育影响的试验均在山东农业大学微生物实验室开展。
2.2 试验方法
2.2.1 试验设计
枸杞扦插枝清水浸泡30 分钟后进行试验处理,本试验设置2 个处理,即对照组(CK),枸杞扦插时不加ND35 菌剂;处理组(ND),枸杞扦插时接种球毛壳菌ND35(使用蘸根法接种球毛壳菌ND35 菌剂(孢子浓度2×107 个/g),要求球毛壳菌ND35 菌剂均匀覆盖扦插枝表皮,ND35 菌剂用量约为1.0 g),并于扦插后60 天取样调查,调查侧根数量、根系活力和叶绿素含量等指标。
2.2.2 根系活力测定
根系活力测定的样品应该保证扦插苗根系的完整,取0.2 g 根系生命活动力最为旺盛的部位是根尖(根分生区)作为测定根系活力的材料。采用北京索莱宝科技有限公司所生产的植物根系活力检测试剂盒(TTC法,BC5270)测定不同处理下枸杞根系活力。
2.2.3 根系木质素含量及其合成相关酶活性测定
根系木质素测定的样品应该保证扦插苗根系的完整,取0.2 g 根系成熟区(靠近扦插条的部位)作为测定根系木质素含量、苯丙氨酸解氨酶(PAL)活性和过氧化物酶(POD)活性的材料。采用北京索莱宝科技有限公司所生产的木质素含量检测试剂盒(BC4200)、苯丙氨酸解氨酶(PAL)活性检测试剂盒(BC0210)、过氧化物酶(POD)活性检测试剂盒(BC0090)测定不同处理下枸杞根系活力及其合成相关酶活性。
2.2.4 叶绿素含量测定
将材料叶片表面的灰尘清洗干净,用打孔器取直径约1 cm 的叶片组织,取样时注意避开主脉和较粗大的副脉。每一重复称取0.2 g 样品组织并剪成细丝,可使叶绿素提取更加充分。处理完成后放入试管内,加入10 mL 丙酮乙醇等比例混合液,充分摇晃使提取液完全浸没叶片细丝,置于30℃黑暗条件下提取至细丝完全变白,提取过程中轻轻摇晃试管几次可以有效缩短提取时间。分别在波长为663 nm 和645 nm 下测定提取液吸光度值,记录吸光度D 的值。将吸光度D 带入对应公式中计算叶绿素a 含量、叶绿素b 含量和叶绿素总量并求均值。
叶绿素含量的计算公式如下:
2.3 数据处理
用IBM SPSS Statistics 21 软件对不同处理扦插苗的根系活力、叶绿素总含量和侧根数量进行检验分析。用WPS 2023、OriginPro 2017 软件对试验数据进行统计并作图。
3 结果与分析
3.1 球毛壳菌ND35 对枸杞根系生长发育的影响
试验结果表明,球毛壳菌ND35 处理对宁枸7 号扦插苗的成活率没有影响,但对枸杞扦插苗的根系生长发育存在影响(表1)。相比于对照组(CK),球毛壳菌ND35 处理组(ND)的枸杞扦插苗侧根数量、根系活力、根系木质素含量和叶绿色含量显著增加(P<0.05),分别提高了 44.83%、14.28%、9.49%和49.05%。

表1 球毛壳菌ND35 对枸杞根系生长发育的影响Table 1 The effect of C.globosum strain ND35 on the root growth and development of Lycium barbarum
3.2 球毛壳菌ND35 对枸杞根系酶活性的影响
从宁枸7 号扦插苗生长时期的苯丙氨酸解氨酶(PAL) 活性和过氧化物酶(POD) 活性活性变化趋势可以看出,球毛壳菌ND35处理的枸杞扦插苗的PAL活性和POD 活性总体上高于对照组(CK)。球毛壳菌ND35 处理的枸杞扦插苗的生长前期 (7 天和14 天)PAL 活性和POD 活性与对照组(CK)无显著差异。球毛壳菌ND35 处理的枸杞扦插苗的生长后期 (21~49 天)PAL 活性显著高于对照组(CK),分别提高了25.86%、20.27%、18.35%、19.22%、23.62%(图2A)。球毛壳菌ND35 处理的枸杞扦插苗的生长后期 (21~49 天)POD活性总体上高于对照组(CK),分别提高了20.55%、27.12%、-11.94%、20.01%、17.51%,其中,第21 天、第28 天和第42 天时ND 处理组POD 活性显著高于对照组,第35 天时ND 处理组POD 活性低于对照组(图2B)。

图1 球毛壳菌ND35 对枸杞根系生长发育的影响Figure 1 The effect of C.globosum strain ND35 on the root growth and development of L.barbarum
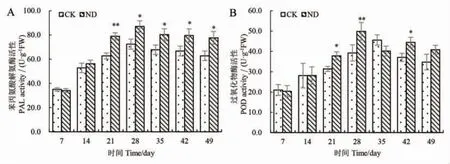
图2 球毛壳菌ND35 对枸杞根系PAL 活性(A)和POD 活性(B)的影响Figure 2 The effect of C.globosum strain ND35 on PAL activity (A) and POD activity(B) of L.barbarum roots
4 结论与讨论
植物内生菌是广泛分布于自然界植物体内的微生物资源,由于内生菌长期生活在植物体的特殊和环境里,并和宿主协同进化,在演变过程中二者形成了互利共生关系,一方面植物为内生菌提供光合产物和矿物质供内生菌生长需要,另一方面内生菌在宿主的生长发育和系统演化过程中起重要作用[14]。目前研究表明,植物内生菌具有促进植物生长发育,诱导植物抗病性,增强抵抗非生物胁迫的抗性如干旱、寒冷、重金属,抑制病原微生物生长等功能[15]。植物内生菌促进植物生长发育的方式,主要体现在以下几方面:1)增进宿主植物对N、P、K 等营养元素的吸收[16],如植物内生菌Neotyphodium coenophialum 可显著促进高羊茅的氮积累和氮代谢[17];2)通过调节植物的激素分泌调节植物内部激素水平来促进植物生长[18],如植物内生菌印度梨形孢(Piriformospora indica)可通过诱导宿主植物细胞分裂素、生长素的产生,促进了寄主植物的生长[19];3)植物内生菌能生成与宿主植物相同或相似的次生代谢产物,如高温胁迫环境下内生菌(Paecilomyces formosus)能够产生植物激素和有机酸促进粳稻生长[20]。
球毛壳菌(Chaetomium globosum)ND35 是分离自健康毛白杨的一株具有促生、抗逆和防病功能的植物内生真菌。前期试验数据表明,球毛壳菌ND35 能够促进杨树、核桃、板栗、平邑甜茶、楸树、小麦、草莓、黄瓜、番茄、菜豆、烟草、生姜等十余种植物的生长发育[5-7,21-26]。球毛壳菌ND35 能够通过诱导植物内源赤霉素(GA)、生长素(IAA)、水杨酸(SA)、茉莉素(JA)等激素产生促进黄瓜胚根的生长发育[5],同时,球毛壳菌ND35 能够通过诱导PAL、POD 和多酚氧化酶(PPO)活性的提高,增加植物对病原微生物的抗性[9]。本研究证明球毛壳菌ND35 能够显著促进枸杞扦插苗生长发育,对枸杞侧根生长和木质化具有积极影响。本研究论文进一步验证了球毛壳菌ND35 的广谱促生效果,同时也为球毛壳菌ND35 在枸杞繁育、栽培生产中的开发应用提供理论依据。

