肾衰泄浊汤对腺嘌呤致慢性肾衰大鼠TGF-β1/Smads通路的影响*
李怀玉,邱丽瑛,陈 微,李玮婷,付 勇,简钰乘,杨军平**
(1. 江西中医药大学研究生院 南昌 330004;2. 江西中医药大学附属医院 南昌 330006)
慢性肾脏病(Chronic kidney disease,CKD)是全球主要的公共卫生问题。预计在2040年,CKD将成为世界范围内的第5 大常见疾病死因[1-2]。一旦CKD 进入慢性肾衰竭(Chronic renal failure,CRF)阶段,透析治疗是大多数患者的治疗首选。然而透析在延长CRF患者寿命的同时,也不可避免地对患者的经济和生活质量产生一些负面影响,透析作为CRF 主要的治疗手段其实际效益并不理想[3]。
中医对CRF 的认识可追溯至《内经》[4]。病名上,参考CRF 的临床部分表现特征,可归属于中医“腰痛”和“水肿”等范畴。CRF 的基本病机为本虚标实,本虚与标实二者随病变趋势其侧重有所不同。国医大师皮持衡认为CRF 标实虽杂,但以湿浊毒邪瘀血互结为主,正虚虽累及多脏,但治疗大抵应从脾肾入手,肾衰泄浊汤便是皮持衡教授针对CRF 这一病机而设立的。该方治法上以清热化湿解毒与活血通腑泄浊为主,补益脾肾为辅,作为院内制剂有效运用于临床治疗。肾纤维化是多种肾脏疾病导致CRF 的共同表现,转化生长因子-β1(Transforming growth factor beta1,TGF-β1)作为肾间质纤维化(Renal interstitial fibrosis,RIF)的关键因子,其介导的TGF-β1/Smads 信号通路在肾瘢痕形成过程中起重要的调控作用[5-6]。
鉴于肾衰泄浊汤对TGF-β1/Smads 信号通路的影响尚不清楚,本实验通过构建CRF 大鼠模型,探究不同浓度肾衰泄浊汤对该通路中TGF-β1、Smad3 和Smad4 的影响,进而为肾衰泄浊汤抗RIF 的相关机制提供部分理论支持。
1 材料与方法
1.1 动物
选用SD 大鼠(SPF 级)64 只,雌雄各半,体质量180±20 g,由江西中医药大学实验动物中心提供,实验动物生产许可证号:SCXK(赣)2018-0003。饲料充足,于室温20-25℃中适应性喂养1周。实验方案由江西中医药大学动物实验伦理委员会批准(JZLLSC20220001)。
1.2 主要药物与试剂
肾衰泄浊汤由江西省中医院药房提供,组成包括生大黄20 g、白蔻仁10 g、生牡蛎30 g、蒲公英30 g、川芎10 g、白马骨30 g和黄芪30 g等,煎煮和浓缩步骤由江西省中医院药剂科完成。腺嘌呤(北京索莱宝科技有限公司,批号:104N052);氯沙坦钾(科素亚,杭州默沙东制药有限公司,批号:T034534);β2-MG 试剂盒和TGF-β1检测试剂盒均购自江苏酶免实业有限公司(批号均为202105);水合氯醛(上海麦克林生化科技有限公司公司,批号:C12195151);cDNA 合成和TB Green试剂盒均购于北京TaKaRa 公司;Smad3 抗体和Smad4抗体均购自美国CST 公司(批号均为800vlal);引物由深圳华大基因科技有限公司合成,序列见表1。

表1 PCR引物序列
1.3 主要仪器
P800 型全自动生化分析仪(日本,Roche),Multiskan FC 型酶标仪(美国,Thermo Fisher),ABI 7500 型实时荧光定量PCR 仪(美国,Thermo Fisher),3K15 型4℃离心机(德国,Sigma),37XB 型倒置生物显微镜(上海,精科)。
1.4 分组、模型制备与给药
64只大鼠随机抽取12只分为正常组,剩余均采用21 天腺嘌呤灌胃法造模处理:前14 天以200 mg·kg-1剂量灌服2.5%的腺嘌呤混悬液,后7 天灌服时浓度减半。两组均保持雌雄对半。造模结束时两组均随机抽取2 只,检测血清Scr 与BUN 水平,并观察肾组织病理以判断造模状况。结果表明造模后大鼠的Scr 与BUN 水平显著高于正常组,肾组织出现大量炎性细胞浸润以及部分纤维化,初步提示造模成功。将造模后的大鼠随机分为模型组、中药9.375 g·kg-1、18.75 g·kg-1、37.5 g·kg-1组和氯沙坦钾组各10 只,每组雌雄各半。中药9.375 g·kg-1、18.75 g·kg-1、37.5 g·kg-1组分别灌胃给予相应浓度的肾衰泄浊汤,氯沙坦钾组给予1.8 mg·kg-1浓度的氯沙坦钾作为阳性对照,其余组给予生理盐水,连续28天,每日1次。
1.5 取样
第28 天给药后,大鼠进行12 h 禁食不禁水处理。麻醉后收集血液,处死后迅速摘除肾脏,肾脏均脱被膜处理。血样静置后以3000 r·min-1离心10 min,取上清液装于EP 管。肾脏取部分于4%多聚甲醛溶液中固定,剩余组织和血清均置于-80℃冰箱中保存。
1.6 检测指标
1.6.1 血清Scr、BUN、β2-MG和TGF-β1含量测定
按照试剂盒说明书操作,其中Scr 采用苦味酸法,BUN采用酶法,β2-MG与TGF-β1均采用ELISA法。
1.6.2 肾组织HE染色病理形态观察
已固定的肾组织经脱水、包埋、切除处理后,实施HE染色,在显微镜下观察肾组织的病理变化。
1.6.3 RT-PCR 法测定肾组织中Smad3 与Smad4 的mRNA表达水平
TRIzol 法提取肾组织总RNA,进行RNA 浓度及纯度测定。对RNA 进行去除基因组DNA 以及逆转录处理合成cDNA,逆转录条件设定:37℃ 15min,85℃ 5 s,4℃保持。PCR 扩增反应体系为20 µL,反应条件设定:95℃ 30 s 预变性处理,两步法(95℃ 5 s、55℃ 40 s)循环40 次,融解曲线分析。以GAPDH 为内参,采用2-ΔΔCt法计算Smad3与Smad4的相对含量。
1.6.4 Western blot 法测定肾组织中Smad3 与Smad4的蛋白表达水平
RIPA 裂解液提取肾组织总蛋白,通过BCA 法测定蛋白浓度。蛋白样品中加入蛋白上样缓冲液,上样蛋白量为20 µg。基于SDS-PAGE 凝胶电泳分离蛋白,再电转至NC 膜上。5%的脱脂奶粉封闭1 h 后,加入Smad3 与Smad4 对应的一抗4℃孵育过夜。洗涤后加入二抗室温孵育1 h,之后再次洗涤。现配ECL 化学发光液进行显影处理,以GAPDH 为内参,采用Image J 软件进行Smad3 与Smad4 目的条带光密度值分析。
1.7 统计学处理
统计分析采用SPSS 26.0 和Prism Graphpad 8.2.1软件,实验数据以均值±标准差()表示。组间差异比较选用独立样本t检验(两组)或单因素ANOVA 分析(两组以上),Kruskal-Wallis检验用于两组以上数据且方差不齐。事后比较中,若方差齐选用LSD 检验,不齐选用Tamhane’sT2 检验。以P<0.05,P<0.01 时认为差异有统计学意义。
2 结果
2.1 肾衰泄浊汤对CRF 大鼠血清Scr、BUN 和β2-MG水平的影响
与正常组相比,模型组大鼠血清中Scr、BUN 和β 2-MG 水平均显著升高(P<0.01),且三者在雄、雌鼠间差异不明显。与模型组相比,Scr 在各浓度中药组中均出现显著下降(P<0.01);BUN 与β2-MG 除中药9.375 g·kg-1组改善不明显以外,中药18.75 g·kg-1与37.5 g·kg-1组均显著下降(P<0.01)。与氯沙坦钾组相比,Scr、BUN 和β2-MG 含量在中药18.75 g·kg-1与37.5 g·kg-1组中均无明显差异(见表2)。

表2 肾衰泄浊汤对CRF大鼠血清中Scr、BUN和β2-MG水平的影响
2.2 肾衰泄浊汤对CRF大鼠肾组织病理的影响
正常组大鼠肾组织肾小球和肾小管排列整齐、形态完整,间质内无明显炎性细胞浸润与纤维病变;造模后肾小管排列无规则,出现不同程度扩张,伴有大量棕褐色代谢产物沉积,肾小球变形萎缩,数量减少,肾间质大量炎性浸润,伴纤维化增生。各浓度中药干预后,较模型组而言,CRF 大鼠肾组织的炎性浸润、纤维化增生以及代谢产物沉积状况均有所改善(见图1)。

图1 肾衰泄浊汤对CRF大鼠肾组织病理的影响(200×)
2.3 肾衰泄浊汤对CRF 大鼠血清TGF-β1 水平的影响
与正常组相比,模型组大鼠血清中TGF-β1 水平均显著升高(P<0.01),雄鼠显著高于雌鼠(P<0.05)。与模型组相比,TGF-β1 在各浓度中药组中均出现不同程度的降低,其中以中药18.75 g·kg-1与37.5 g·kg-1组的改善具有统计学意义(P<0.01)。中药18.75 g·kg-1与37.5 g·kg-1组与氯沙坦钾组相比无明显差异(见表3)。

表3 肾衰泄浊汤对CRF大鼠血清中TGF-β1水平的影响
2.4 肾衰泄浊汤对CRF 大鼠肾组织Smad3 与Smad4的mRNA表达影响
与正常组相比,模型组大鼠肾组织中Smad3 与Smad4 的mRNA 表达均显著升高(P<0.01)。与模型组相比,Smad3 与Smad4 的mRNA 表达在各浓度中药组和氯沙坦钾组中均出现不同程度的降低,Smad3 在各浓度中药组中的改善均具有统计学意义(P<0.01),Smad4在中药组中以18.75 g·kg-1组(P<0.05)与37.5 g·kg-1组(P<0.01)的改善具有统计学意义。中药37.5 g·kg-1组和氯沙坦钾组相比Smad3与Smad4的mRNA表达均无明显差异(见图2)。
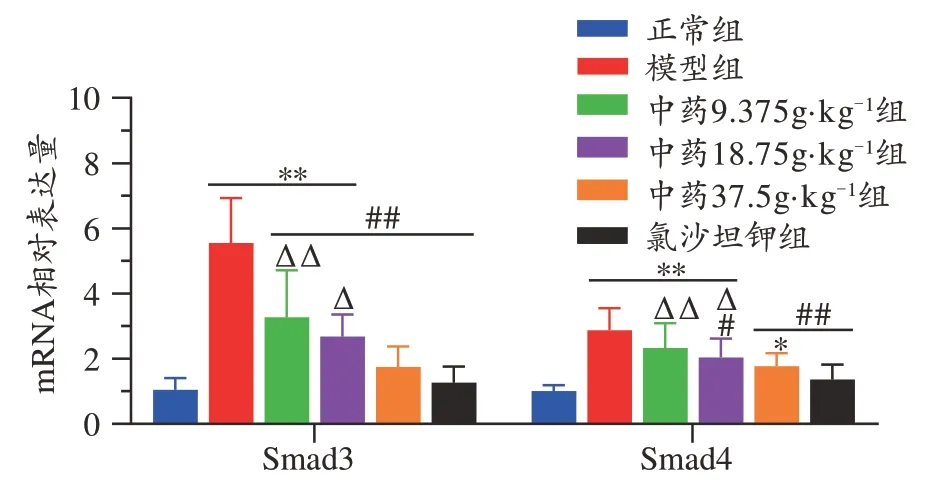
图2 肾衰泄浊汤对CRF大鼠肾组织Smad3与Smad4的基因表达影响(n=36)
2.5 肾衰泄浊汤对CRF 大鼠肾组织Smad3 与Smad4的蛋白表达影响
与正常组相比,模型组大鼠肾组织Smad3 与Smad4的蛋白表达均显著升高(P<0.01)。与模型组相比,各浓度中药组中Smad3 与Smad4 的蛋白表达均出现下调,Smad3 与Smad4 的蛋白表达在中药组中均以18.75 g·kg-1组(P<0.01)与37.5 g·kg-1组(P<0.01)改善具有统计学意义。与氯沙坦钾组相比,中药37.5 g·kg-1组Smad3 的蛋白表达无明显差异,中药18.75 g·kg-1与37.5 g·kg-1组Smad4的蛋白表达无明显差异(见图3)。

图3 肾衰泄浊汤对CRF大鼠肾组织Smad3与Smad4的蛋白表达影响(n=12)
3 讨论与结论
肾衰泄浊汤作为国医大师皮持衡针对CRF 而设立的主方,全方以祛邪为主:方中投川芎以辛温走散,通阳活血使瘀血能祛;予白豆蔻燥湿而走中,大黄、猪苓通浊利尿而走下,分消走泄使得湿毒能化;加蒲公英等苦寒清热,利湿解毒使湿热能去;添牡蛎咸入肾、黄芪甘入脾以益脾肾,以防攻邪伤正之患。前期研究中,肾衰泄浊汤被证实可减缓CRF 大鼠肾脏微血管毁坏,提高免疫保护;减轻受损肾小球内皮细胞炎症反应,抑制TGF-β 和结缔组织生长因子的表达[7-9],这提示肾衰泄浊汤治疗CRF 的机理可能与干预TGF-β 相关通路有关。
3.1 肾衰泄浊汤对CRF 大鼠肾组织病理及肾功能的影响
本研究采用腺嘌呤灌胃复制CRF 大鼠模型,这种造模方式的机理在于高浓度的腺嘌呤可经肝脏转换成2,8-二羟基腺嘌呤,后者难溶于水,易机械性累积于肾小管形成结晶引发持续性梗阻,终而导致CRF。与正常大鼠相比,造模大鼠肾组织HE 染色后表现出明显的肾小球和肾小管结构异常,小管内布满大量的2,8-二羟基腺嘌呤结晶,间质内出现大量炎性浸润以及部分纤维化病变,并伴随着血清中Scr、BUN 表达水平的显著升高,这表明造模后大鼠的肾脏结构受损情况显著。与模型组相比,肾衰泄浊汤能改善肾组织的病理变化,显著降低CRF 大鼠血清中的Scr、BUN 含量,且降低程度与肾衰泄浊汤的浓度成正向关系。
β2-MG 作为一种潜在的内源性滤过标志物被广泛报道[10]。正常情况下,血清中的β2-MG 经过肾小球,在近端小管中以重吸收和分解代谢的方式进行转换。一旦肾小球滤过率出现降低,β2-MG 的不断堆积会使得其在血清中的含量明显增加,检测血清中β2-MG 的含量变化可有效评估肾小球的滤过效率[11]。与Scr、BUN 趋势一致,本研究中CRF 大鼠血清的β2-MG含量均出现了显著增加,而肾衰泄浊汤能较好地降低其在血清中的含量,且18.75 g·kg-1与37.5 g·kg-1浓度的肾衰泄浊汤对CRF 大鼠血清中的β2-MG、CysC 含量改善与氯沙坦钾相比均无显著差异。
3.2 肾衰泄浊汤对CRF大鼠TGF-β1/Smads信号通路的影响
RIF 是肾功能不全的主要决定因素,代表着几乎所有CKD 导致的CRF 共同特征表现,而TGF-β 是肾纤维化驱动的主要因素之一[12]。成熟的TGF-β 通过非共价方式与潜伏相关肽(Latency-associated peptides,LAP)相关联,然后与充当定位作用的TGF-β结合蛋白(Latent TGF-β binding proteins,LTBP)相附着,稳定地存在于细胞外基质(Extracellular matrix,ECM)中。作为哺乳动物的三种TGF-β 亚型之一,TGF-β1 是肌成纤维细胞活化的主要介质[13]。在LAP的抑制作用下,TGF-β1/LAP/LTBP复合物中的TGF-β1处于长期的非活性状态[14]。然而,一旦肾脏持续受损,潜伏的TGF-β1复合物在多种酶的裂解作用下释放出大量活化的TGF-β1。本次研究中,CRF 大鼠模型血清中的TGF-β1 含量出现显著升高,这些活化的TGFβ1 可与TGF-β 受体2 结合,进一步激活TGF-β 受体1以触发细胞内下游的信号通路传导[12]。TGF-β1/Smads 信号通路是目前公认的典型TGF-β1 促纤维化通路。在活化TGF-β 受体1 的作用下,Smad2、Smad3与Smad4 结合形成Smads 复合物,共同调控纤维化前分子的转录,从而触发ECM 积累以及肌成纤维细胞激活的相关生物效应。Smad2、Smad3与Smad4在肾纤维化的调节过程中扮演着不同的角色,三者的显著区别在于Smad3 可直接与基因启动子中的相关元件结合以促进转录,而没有DNA 结合域的Smad2 和Smad4 的效应发挥是建立于其对Smad3的调节基础[15]。本研究结果表明,腺嘌呤灌胃致CRF 大鼠肾组织中的Smad3与Smad4 表达均出现显著上调,这一结果与其他研究的认识基本一致[16-17]。在肾衰泄浊汤的干预下,大鼠血清中的TGF-β1含量、肾组织中Smad3与Smad4的基因和蛋白表达水平均显现出不同程度的改善:TGF-β1含量方面,肾衰泄浊汤中以18.75 g·kg-1和37.5 g·kg-1组改善显著;Smad3 与Smad4 的mRNA 表达方面,Smad3在各浓度肾衰泄浊汤中均改善显著,而Smad4 在肾衰泄浊汤中以18.75 g·kg-1和37.5 g·kg-1组改善显著;蛋白表达方面,Smad3 与Smad4 在肾衰泄浊汤中均以18.75 g·kg-1和37.5 g·kg-1组改善显著。由此可见,肾衰泄浊汤在抗RIF 的机制涉及到TGF-β1/Smads 信号通路的转导,并可能与TGF-β1、Smad3 和Smad4 的抑制有关。
综上所述,肾衰泄浊汤能降低腺嘌呤灌胃造模大鼠血清中的Scr、BUN和β2-MG含量以改善肾脏功能,抑制炎性浸润、纤维化增生和代谢产物沉积以减轻肾组织病理损伤,其对肾脏的保护机制可能与降低血清中的TGF-β1 含量以及下调肾组织中的Smad3、Smad4表达而改善RIF 有关。然而,肾纤维化形成是一个复杂的过程,肾衰泄浊汤对TGF-β1 相关通路的影响还待后续研究以进一步分析。

