肠道菌群及代谢物调控宿主肠道免疫的研究进展
沙珊珊 董世荣 杨玉菊
(哈尔滨学院食品工程学院,哈尔滨 150086)
动物肠道是一个开放的生态系统,与外界环境有着直接的接触,其中栖居着大量的微生物[1]。肠道内微生物群主要分布在肠腔内流动的食糜中,且黏附于肠道黏膜及相关的黏膜。历经长期进化,这些微生物与宿主之间建立了稳定的共生关系,微生物的活动直接影响着宿主的健康。它们不仅在宿主营养物质的消化代谢和机体发育等方面发挥重要作用,而且与宿主的免疫和疾病密切相关[2]。肠道菌群是一个混合器官,与宿主高度互惠共生,是一种共生功能体。肠道不仅是机体营养物质消化吸收的主要场所,同时也是最大的免疫器官,在调节机体免疫稳态中起着核心作用[3]。肠道微生物是刺激“肠黏膜免疫系统”和“全身免疫系统”成熟的重要因子,保证免疫系统功能正常实施。正常生理状态下,肠道微生物可以促进宿主免疫系统的发育,并可通过自身或肠道代谢产物等特定组分调控宿主的免疫反应,形成一道由肠道共生菌、肠道黏液层、肠上皮细胞和固有层内多种免疫细胞共同组成的特殊的生物屏障[4]。目前,肠道微生物群与宿主免疫系统的相互作用受到越来越多的关注,因此,本文在介绍肠道及其在宿主防御中的作用的基础上,就肠道微生物及肠道内代谢产物如何促进宿主免疫系统发育、调节宿主免疫反应等进行了综述。
1 胃肠道及其在宿主防御中的作用
胃肠道(gastrointestinal tract, GI tract)是畜禽机体表面积最大的器官,是机体外部环境与内部环境交汇的生态位之一,由被黏液、免疫球蛋白A和糖萼覆盖的肠上皮细胞组成,不仅负责对日粮的消化吸收,同时为机体共生益生菌群生存和增殖创造适宜的环境,并保护肠道黏膜免受病原体对机体的侵袭。胃肠道遭到来自微生物和外来抗原侵袭时,黏膜免疫系统成为抵御病原体入侵的主要屏障。肠上皮细胞(IECs)作为黏膜免疫系统的屏障之一,广泛表达经典模式识别受体(PRRs),如NOD结构域样受体(NLRs)和Toll样受体(TLRs),它们通过脂多糖(LPS)、鞭毛蛋白、细菌肽聚糖和细胞壁脂蛋白的初始识别与微生物进行通信[5]。肠黏膜提供的物理屏障功能形成了机体对病原体的第一道防线[6],其最重要的组成部分是由紧密连接蛋白和连接黏附分子组成的紧密连接,存在于相邻的肠黏膜上皮细胞(intestinal epithelial cells, IECs)之间。紧密连接蛋白是组成肠黏膜屏障完整性,决定肠道通透性的重要蛋白分子。既能够调节对水、离子和营养的渗透性,同时阻止病原体的入侵。通常情况下,肠黏膜上皮紧密连接处于动态调节状态,然而肠道组织持续的炎症或感染可能导致黏附分子的表达失调,屏障破坏和微生物易位[7]。肠黏膜除提供物理屏障功能外,又是免疫防御的调节中枢,与免疫细胞和基质细胞协同作用以抵抗病原体,并限制其与上皮细胞的直接接触[8]。
胃肠道不仅是消化吸收的重要部位,也是机体最大的免疫器官,在细菌挑战存在的情况下,它拥有宿主60%-80%的一般免疫细胞,以及维持肠道免疫稳态的结构。肠道上皮组织由单层不同的IECs组成,肠道隐窝底部的内分泌细胞和干细胞产生具有特殊功能的IECs(肠细胞、杯状细胞、潘氏细胞和肠内分泌细胞),这些细胞通过被动和主动机制识别和摄取肠道菌群代谢物来影响肠道微环境,直接或间接参与机体先天免疫[9]。在肠黏膜上皮细胞之下为肠道固有层(lamina propria, LP),其中含有树突状细胞、肠系膜淋巴结、派尔集合淋巴结、固有膜和上皮内淋巴细胞[10]。这些免疫细胞之间的互相作用构成了复杂而精密的调控网络,调节宿主的免疫反应以及帮助抵御病原菌的入侵[11]。此外,肠道后天免疫系统主要是通过在肠腔内分泌免疫球蛋白(immunoglobulins, Ig)等效应因子来对抗病原体在肠黏膜上附着及对黏膜组织的侵袭,从而促进肠道屏障的防御效应。
2 肠道菌群对宿主免疫系统发育的影响
哺乳动物的胃肠道中栖息着数量庞大、结构复杂的微生物生态系统,包括真菌、细菌、古生菌、病毒和寄生虫等[12]。其中以细菌为主,肠道中约有100万亿个细菌,是微生物与宿主免疫系统之间相互作用的关键部位。数百万年的进化,肠道与共生菌群形成了稳定的互惠关系,宿主为肠道菌群提供了营养物质和生殖空间,而肠道菌群有助于宿主生理功能的实现。肠道菌群除了参与能量的收集和储存,有助于机体对日粮的消化和发酵外,同时能够促进机体免疫系统发育,并产生抗菌肽等活性物质直接参与机体对病原体的防御和清除。肠道菌群和黏液层的稳定对于防止病原菌感染维持机体健康和疾病之间的平衡至关重要[13]。
一般认为健康动物的胃肠道在出生前是无菌的,Milani等[14]最新研究表明新生动物最初的菌群定植发生在子宫内,是由一些当时环境中最先进入机体的投机型细菌组成,这一过程受到食物等其他环境因素的影响,可能将彻底改变微生物种类,从而影响到黏膜免疫系统的发育、扩张和成熟。微生物群在胃肠道中定植后,可直接参与宿主很多生理过程,包括肠屏障免疫。肠道菌群和宿主免疫系统之间的相互作用从出生时开始,肠道菌群影响免疫系统的发育和成熟;免疫系统反过来塑造肠道菌群的组成。通过无菌动物(即在无菌环境中饲养动物,保持肠道内无菌状态)实验模型研究发现,在没有微生物干涉的情况下,肠黏膜免疫系统发育缓慢,机体肠系膜淋巴结和派尔集合淋巴结相对较小,同时免疫细胞如IgA型浆细胞、固有层CD4+T淋巴细胞等数量偏低,从而弱化了对病原体的抗性[15]。早期相关研究也表明,动物饲养环境能够影响微生物在机体内定殖,进而影响免疫效应,如与正常小鼠相比,无菌小鼠脾脏和淋巴结结构紊乱,血清IgG水平较低[16]。此外,无菌小鼠试验中,肠道菌群的缺失对淋巴器官的形成有负面影响,特别是无菌小鼠的脾脏和肠系膜淋巴结形成缺陷,肠潘氏斑块变小,降低了CD4+、CD25+调节性T细胞功能性,IgA的产生减少。可见,肠道菌群的早期定殖对机体免疫系统的形态和功能的发育至关重要。
幼龄时期肠道菌群的建立会对后期免疫系统的发育产生影响。在幼龄时期,肠道微生物群的多样性和变异性很高,因而该时期内微生物对宿主免疫机能的调节作用还尚未完全发挥[17]。将相同基因型的同胎小鼠分别饲养于不同环境中,其肠道菌群结构即出现显著差异。此外,环境、年龄、日粮、母子效应、疾病和抗生素使用等因素均会对动物肠道菌群结构的形成产生影响,进而影响免疫系统的发育[18-19]。在出生初期,肠黏膜表面特征完全随微生物种类和多样性的波动而改变,直到环境因子达到相对稳恒的状态。与之相关,初生期的微生态演替也是和黏膜免疫系统的发育,扩展和学习呈伴随式发育。动物在成熟以后肠道菌群趋于多样性和稳定性,免疫系统发育完善,持续维护机体健康。在小鼠试验中,肠道微生物群的丰度下降会对IECs产生消极影响,改变微绒毛形成模式并减少了细胞增殖。此外,肠道神经系统的发育也受到微生物群的极大影响,无菌和抗生素处理的小鼠相比于正常小鼠肠道神经元数量减少,神经递质表达改变,胃排空和肠转运出现延迟[20]。
3 肠道菌群对肠黏膜免疫的调控作用
3.1 微生物研究手段的革新促进了宿主-菌群互作的研究
高通量DNA测序技术的出现,最初是基于细菌和古细菌16S核糖体RNA扩增子序列的聚类读数,现在是通过将整个基因组与生命中的所有领域相对应,使样本直接分类而无需培养。这些技术的进步为从各种环境中分析复杂的微生物群落提供了一种可靠的方法,并且可以分析随着时间推移群落结构的变化[21]。通过宏基因组学和转录组学技术能够分析微生物的潜在功能和实时活性,并揭示微生物代谢和宿主发育之间的相互作用[22-23]。组学技术对剖析微生物组的调控、动态变化以及宿主基因表达模式的能力揭示了微生物群落的功能是如何影响宿主。质谱技术和色谱技术已有一个多世纪的历史,近年来也被应用于宿主微生物组的研究,靶向和非靶向代谢组学和蛋白组学技术都可应用于揭示微生物群落与宿主的代谢多样性[24]。新的工具和技术进步极大地促进了我们对复杂微生物群落及其与宿主的相互作用的认识,加快了研究者们对肠道微生物与机体肠道免疫相互作用的研究。
3.2 肠道菌群对机体先天和适应性免疫的调控
在正常情况下,免疫系统和肠道微生物群之间以最合适的方式选择、调整和终止反应,将先天免疫和适应性免疫交织在一起。肠道菌群对免疫的调控作用可能发生在先天反应中,通过影响巨噬细胞和粒细胞,以及树突状细胞的抗原呈递;也可能发生在适应性免疫反应中,通过影响T细胞和B细胞功能。目前仍不明确微生物的组成如何调节机体免疫稳态,但一些研究表明,特定细菌种类的存在可以通过促进某些亚型淋巴细胞的发育来改变免疫反应。例如,分段丝状菌(SFB)能够诱导白细胞介素17(IL-17)和IL-22产生,促进辅助性T细胞(Th)17的生成[25]。Atarashi等[26]从人和小鼠粪便中分离出的梭状芽孢杆菌属(Clostridium)具有独特的Treg诱导能力,重建无菌小鼠微生物群,肠道菌群发生改变并促进了IL-10+辅助性T细胞在结肠中的产生。以上结果表明共生微生物对T细胞的发育与分化具有诱导作用,以此参与调控宿主适应性免疫。与先天免疫反应不同,适应性免疫反应对抗原更具有特异性。例如,来自ApcMin/+小鼠的粪便细菌,特别是脆弱拟杆菌,与黏膜发育不良、息肉数量增加以及Th17(CD4+IL-17+)和Th1(CD4+IFN-γ+)细胞比例增加有关,从而在结直肠癌(CRC)[27]中触发信号传感器和转录激活因子3(STAT3)刺激。产肠毒素脆弱芽孢杆菌(ETBF)也通过其毒素BFT和IL-17在结肠上皮细胞上促进肿瘤的发生。这导致髓样细胞募集并分化为髓样来源的抑制细胞(MDSCs),MDSCs可以上调一氧化氮合酶2(NOS2)和精氨酸酶1(ARG1),产生NO,抑制TME中的T细胞增殖[28]。
同样,微生物对于宿主免疫系统的重要性也体现在先天免疫方面。肠道黏膜或其他消化器官中富集的先天淋巴细胞能够帮助协调免疫平衡和表达细胞因子发挥免疫调节活性。在结肠癌患者中,细菌依赖的转录因子6(ATF6)激活诱导早期肠道生态失调、上皮屏障损伤和促进肿瘤发生的先天免疫信号。在nATF6IEC MyD88/TRIF敲除小鼠中,细菌穿透黏液诱导MyD88先天免疫信号转导适配器(MyD88)/TLR适配器分子1(TRIF)依赖的STAT3激活,促进肿瘤生长[29]。吞噬细胞,如巨噬细胞和中性粒细胞,在维护肠道稳态中也发挥着重要作用[30]。肠道微生物可持续刺激巨噬细胞,释放IL-10从而促进Treg的分化,同时抑制Th17细胞的过度增殖,此过程对维持肠道中免疫耐受状态具有重要意义[31]。肠道菌群对免疫应答的调控主要表现为:激活调节性T细胞增殖和分化;诱导IgA表达;以及抗菌肽表达、微生物代谢、全身炎症调节、细菌易位的影响。
3.3 肠道菌群在机体全身免疫中的作用
宿主免疫调节肠道微生物群以维持稳态,反过来,微生物群也影响宿主免疫。肠道微生物组不仅可以影响肠道免疫,还可以通过循环、全身代谢和免疫调节影响远端黏膜部位的免疫应答。有研究认为微生物组和肠道免疫系统不仅能够维持局部免疫系统功能,同时对全身免疫反应的正常运转也十分关键。肠道免疫系统不断受到来自肠腔内抗原的刺激,肠黏膜上皮的首要功能即区分自身抗原、营养物质、共生微生物、病原体以及毒素等。通过肠黏膜上皮细胞或免疫细胞表面分布的模式识别受体(pattern recognition receptor, PRR)所识别,经一系列信号级联反应启动天然性免疫或获得性免疫应答[32]。肠道菌群的稳定是维持免疫系统平衡的基础,令人担忧的是目前抗生素是畜牧业最为常见的药物,抗生素的使用,抑制了肠道内共生细菌的增殖,破坏了机体肠道脆弱的生态系统,增加了病原体感染的可能性,并增加了后期自身炎症性疾病的风险,同时影响机体对日粮的消化吸收,尤其是对于幼龄动物如犊牛、仔猪等[33]。这一观点已得到实验证实,在幼龄小鼠中使用抗生素会导致肠道菌群改变,引起向促炎性免疫反应的转变,并增加了炎症疾病的风险。在幼龄时期使用低剂量的青霉素引起了微生物群的波动并出现持续的影响机体代谢等[34]。在小鼠中使用阿莫西林处理后,肠道菌群中有害菌和有益菌的比例增加,相反,苦参碱处理显著增加了Ruminiclostridium9、Lachnospiraceae_NK4A136_group和Ruminococcaceae_unclassified等肠道有益菌群的丰度,有利于维持肠道菌群的稳定和肠道健康[35]。因此,目前畜牧养殖中更应注重对畜禽肠道微生态环境的调控,维持肠道菌群及免疫系统稳定。
4 肠道代谢物对肠黏膜免疫的调控作用
尽管宿主和肠道微生物的代谢可以同时发生,但是宿主依赖于其肠道菌群增加代谢物和代谢酶的产生。肠道菌群通过产生能够影响免疫细胞的具有免疫调节和抗炎功能的分子来调节免疫系统。特别是从到达结肠部位的外源未完全消化的日粮发酵物,通过修饰宿主产物和新合成产生的内源性化合物,肠道菌群极大地增加了机体代谢物的多样性。宿主肠道与微生物之间的黏膜界面的单层上皮细胞使微生物代谢产物可以进入宿主细胞,并与宿主细胞相互作用,从而调控免疫反应并抵御疾病风险。肠道菌群代谢物种类繁多,其中最主要代谢物短链脂肪酸(short-chain fatty acids, SCFAs)、芳香烃受体(aryl hydrocarbon receptor, AhR)以及多胺化合物,在调控肠道免疫方面发挥极其重要的作用(图1)[36-37]。
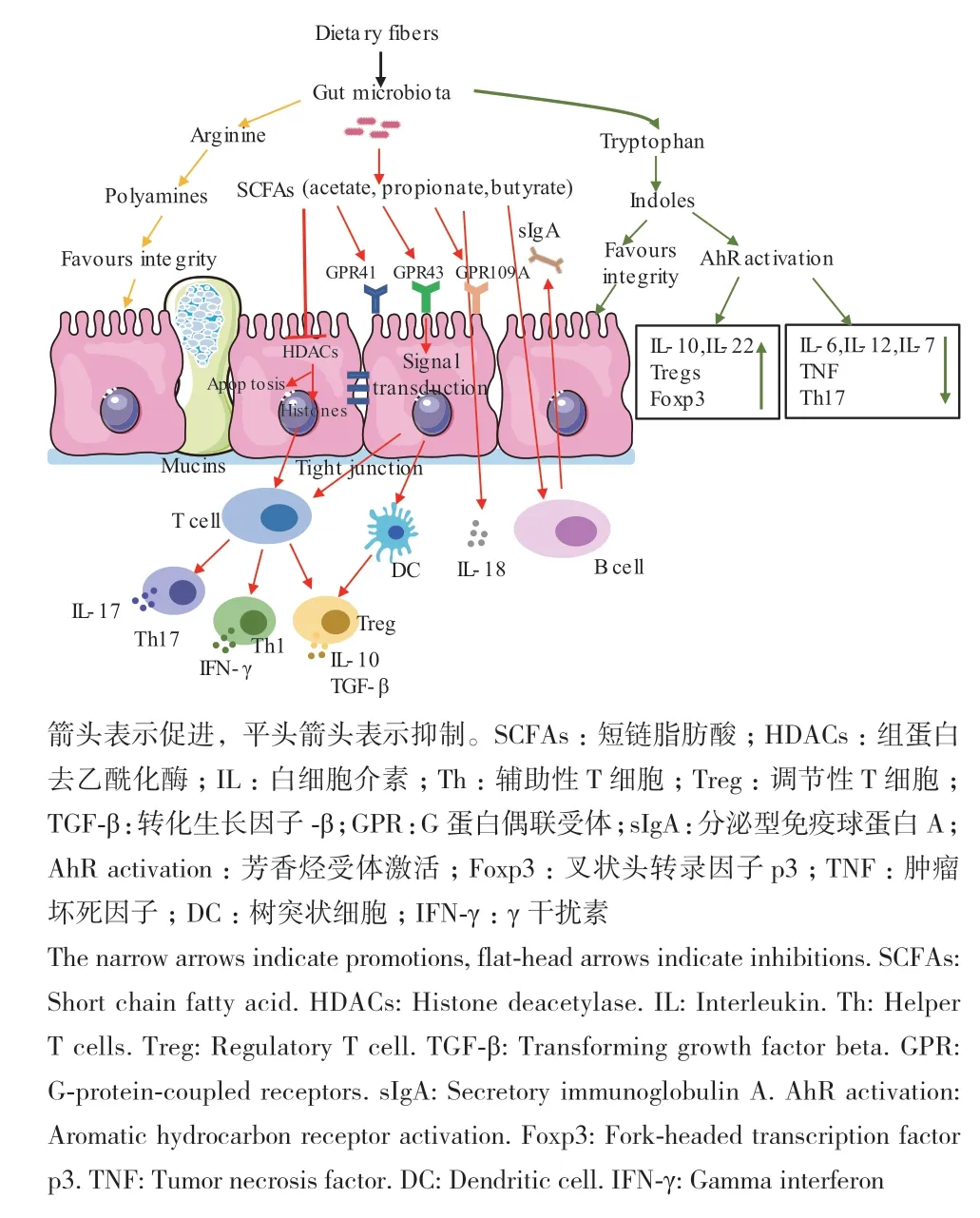
图1 肠道菌群及代谢产物对肠道免疫系统的调控作用Fig. 1 Regulation of gut microbiota and metabolites on intestinal immune system
4.1 SCFAs对肠黏膜免疫的调控
微生物群可介导肠道内产生大量小分子代谢产物在细胞和分子水平上通过直接和间接作用实现对宿主的生理调节。其中最为常见的即未完全消化的碳水化合物在肠道内被厌氧细菌利用,发酵产生的代谢终产物SCFAs,主要由乙酸(C2)、丙酸(C3)和丁酸(C4)组成,且不同种类的细菌和底物通过不同的发酵途径产生不同种类和数量的SCFAs。其中乙酸主要由丙酮酸盐经乙酰辅酶A或Wood-Ljungdahl途径产生,参与作用的细菌主要有拟杆菌、双歧杆菌、普氏菌和瘤胃球菌[38]。丙酸是由琥珀酸途径、丙烯酸途径和丙二醇途径产生的,参与作用的细菌主要包括拟杆菌、厚壁菌、粪球菌、沙门氏菌、罗氏菌和瘤胃球菌等[39]。丁酸作为肠道内主要 SCFAs之一,是由乙酰辅酶A还原为丁酸辅酶A,经转丁酸酶和丁酸激酶转化为丁酸盐的经典路线形成的[40]。产生丁酸的主要细菌是普氏粪杆菌(Faecalibacterium Prausnitzii)和瘦梭菌、瘤胃球菌科成员等。丁酸是能量的来源,影响肠上皮细胞的代谢。而丙酸大部分被肝脏吸收,乙酸以较高浓度进入体循环。其他短链脂肪酸,包括戊酸酯、己酸酯和异戊酸酯也存在于肠道中,但数量较少。动物肠道内的SCFAs浓度可达20-140 mmol/L,这主要取决于微生物组成、肠道转运时间、宿主-微生物代谢通量以及宿主饮食中的纤维含量。它们对肠道稳态至关重要,通过抑制一些细菌在低pH值环境下的增殖来维持微生物群动态平衡。
SCFAs作为肠道微生物代谢的主要产物,能通过对肠道黏膜免疫细胞(如淋巴细胞、树突状细胞、巨噬细胞等)和非免疫细胞(肠上皮细胞等)功能的调节,改变细胞分化、增殖和凋亡,从而调节肠黏膜的免疫应答过程。许多研究表明SCFAs调控免疫应答过程主要通过激活G蛋白偶联受体(G protein-coupled receptors, GPCRs)和抑制组蛋白去乙酰化酶(histone deacetylases, HDACs)活性来实现。
SCFAs激活的GPCRs主要包括GPR43/FFAR2、GPR41/FFAR3和GPR109A/HCAR2,它们由多种细胞类型表达,包括多种免疫细胞和肠上皮细胞。GPCRs 被配体激活后,可以结合4种不同的异源三聚体 G 蛋白(Gs, Gi/o, Gq/11和 G12/13),这些蛋白可以影响单个或多个效应物的活性。GPR41和GPR43可以被乙酸、丙酸、丁酸等SCFAs有效激活,而GPR109A仅可以被丁酸激活。近期有研究表明,在炎症期间,SCFAs(乙酸、丙酸和丁酸)通过激活GPR43[41]刺激中性粒细胞的迁移,并调节其活性氧和吞噬[42]的产生。此外,还能抑制中性粒细胞[43]中促炎细胞因子TNFα的产生。SCFAs调节DCs的功能,DCs调节免疫反应不仅依赖于细胞因子的分泌,还依赖于它们与T细胞相互作用的能力。丁酸和丙酸通过抑制脂多糖诱导的共刺激分子CD40的表达和IL-6和IL-12p40[44]的分泌来抑制BMDC的激活。SCFAs还通过激活T细胞[45]上的GPR43增强结肠T细胞Foxp3的表达。丁酸通过将GPR109a结合在DCs和巨噬细胞上,导致IL-10的表达增加,IL-6的产生减少,从而增加Treg细胞的发育,同时抑制促炎Th17细胞的扩张。这些数据表明SCFAs感知的GPCRs在免疫和炎症调节中发挥着重要作用。
SCFAs调节免疫作用的另一个机制是组蛋白去乙酰化酶(HDACs)抑制,HDACs的过表达导致组蛋白乙酰化降低,从而导致转录过程中的基因沉默[46]。SCFAs可能通过抑制HDACs作用于单核血细胞和中性粒细胞,从而减少促炎细胞坏死因子(TNF)的产生,并导致转录因子-核因子κB(NF-κB)失活[36]。Smith等[47]研究报道,用丙酸处理FFAR2+/+和FFAR2-/-小鼠,其中FFAR2+/+小鼠cTreg HDAC6和HDAC9的表达降低。丙酸处理cTreg增强组蛋白乙酰化,需要依赖于FFAR2的表达。结果表明,SCFAs通过激活FFAR2抑制HDAC进而影响cTreg。Tao等[48]报道HDAC抑制剂(HDACi)增加了Treg细胞中Foxp3的基因表达,增强了FOXP3+Treg细胞在稳态条件下的抑制功能,从而缓解了小鼠结肠炎症状。丙酸盐产生分泌IL-10的Foxp3+Treg,并通过GPR43信号通路通过HDAC抑制增强其抑制活性,从而预防T细胞诱导的结肠炎。在先天免疫系统中,丁酸盐通过抑制巨噬细胞中促炎介质的表达[49]和通过HDACs抑制活性抑制DC成熟[50]来维持对共生细菌的低反应性。丁酸盐也被证明可以调节肠道巨噬细胞的功能。用丁酸盐处理巨噬细胞可抑制LPS诱导的促炎介质,包括NO、IL-6和IL-12,但不影响TNF-α或MCP-1的产生。这一过程依赖于丁酸对HDAC的抑制。
丁酸是结肠上皮细胞的主要能源物质,在肠上皮黏膜内代谢后,通过血液循环到达肝脏中被降解。通过增加紧密连接蛋白的功能增强结肠物理屏障功能,还可以通过MUC2 基因组蛋白选择乙酰化/甲基化来刺激MUC2基因表达,从而调节肠道化学屏障功能[51]。丁酸还可通过介导的GPR109A的激活,通过增加单核细胞抗炎效应分子的表达和诱导Treg细胞和IL-10的T细胞的分化来预防结肠炎和结肠癌的发生[52]。丁酸通过抑制GPR41和HDAC促进CD4+T细胞和先天样淋巴细胞产生IL-22,以维持肠道稳态[53]。
4.2 AhR对肠黏膜免疫的调控
某些肠道菌群或机体产生的代谢产物能够与宿主细胞上的AhR结合,即芳香烃配体。AhR是由配体诱导的转录因子,大量存在于黏膜表面,由免疫细胞,上皮细胞和某些肿瘤细胞表达,激活后可增强肠上皮屏障功能以及调节免疫反应[54]。针对AhR的研究最初集中在其在生物素代谢中的作用,其在调节肠道屏障功能和肠道免疫细胞以及肠道内稳态中的作用[55]。肠道细菌或其代谢产物也可能触发AhR反应。研究表明,给予AhR激动剂或能够产生AhR配体的乳酸菌菌株改善了与代谢综合征相关的改变,这被证明与小鼠和人类[56]中肠道微生物群将色氨酸代谢为AhR激动剂的能力受损有关。AhR的表达影响肠道微生物群落的建立。例如,摄入激活受体信号的2,3,7,8-四氯二苯并呋喃(TCDF)导致小鼠代谢中断,肠道细菌组成和宿主稳态受到影响[57]。通过共生细菌或其代谢产物激活AhR后,肠道炎症的下调,从而恢复正常菌群和黏膜稳态[58]。机体摄入食物或经肠道菌群代谢产生的AhR配体可活化IECs或肠道免疫细胞中的AhR,以促进 IECs自我修复或调控细胞因子IL-10、IL-22等的分泌共同作用于黏膜上皮,从而调节肠道黏膜免疫稳态。小鼠缺乏AhR或配体可导致肠道菌群组成的变化,并降低抗菌肽的产生及肠上皮内淋巴细胞的数量。AhR的激活对于机体后天肠道淋巴细胞和特定的先天性淋巴样细胞特别是产IL-22的视黄酸受体相关的淋巴细胞的扩增也是必要的[59]。
日粮和肠道菌群组成均会影响AhR的激活。只有特定的细菌种属尤其是乳酸杆菌属,才能代谢日粮中的色氨酸,并产生可刺激ILC3s的芳香烃配体[60]。作为AhR的配体,微生物产生的这一代谢产物对于宿主免疫至关重要,尤其是对黏膜层的抗炎起到关键作用[61]。据报道,在一系列内源酶或微生物代谢作用下产生的色氨酸(Trp)代谢产物,如犬尿氨酸和吲哚,能够结合并激活AhR,这一过程被称为Trp-AhR途径[62]。由于不同的AhR配体具有不同的诱导作用和方向,被激活的AhR通过多种机制参与先天和适应性免疫反应[63]。FICZ是Trp光化学产物,是一种重要的高亲和内源性AhR配体。FICZ主要依靠激活AhR来诱导转化生长因子-b(TGF-b1)、IL-6和IL23的产生,促进Th17细胞的分化,增加IL-22的分泌来缓解肠道炎症[64]。因此,内源性微生物来源的色氨酸代谢物可能为宿主提供线索,这对于抵抗定植和保护免受黏膜炎症至关重要。总之,这些研究表明,肠道免疫细胞亚群对AhR具有内在的要求,缺少AhR活性会使宿主易于受到增强的免疫激活和免疫病理学的影响。
4.3 多胺化合物对肠黏膜免疫的调控
多胺,如腐胺、亚精胺和精胺,是一种几乎存在于所有活细胞中的烷基胺类聚合阳离子,并且参与多种生物学功能的发挥,包括基因转录和翻译以及细胞生长和死亡等。动物机体的多胺合成涉及精氨酸酶I(转化精氨酸为鸟氨酸),限速酶鸟氨酸脱羧酶(由鸟氨酸合成腐胺)和依次转化腐胺,亚精胺和精胺的顺序酶。细胞内多胺的浓度受宿主生物合成、分解代谢、摄取和外排机制以及生物合成酶的转录,翻译和降解的紧密调节。与宿主多胺代谢相反,肠道菌群利用氨基酸脱羧酶的组成型或诱导型形式产生多胺。肠道中含有高水平的多胺,主要来源于日粮发酵以及宿主和微生物细胞合成。
多胺能够增强IECs隔离层的完整性,Schipke等[65]体外研究表明,多胺可以通过调节细胞质蛋白和跨膜蛋白影响紧密连接,通过改变E-钙黏附蛋白的依赖性黏着连接来调控物理屏障功能,这对于调节旁细胞通透性和增强上皮屏障功能至关重要。此外,小鼠口服补充亚精胺或者L-精氨酸前体,不仅能下调IL-17的产生,还可以通过自噬相关的方式调节T细胞的发育,增强小鼠和人类幼稚T细胞向Treg细胞的分化[66]。多胺参与免疫细胞的分化和炎症反应的调节。通过对大鼠幼崽进行多胺处理会诱导肠道黏液和分泌型IgA的产生,而大鼠饲喂多胺不足日粮处理则出现肠黏膜发育缓慢[67]。ter Steege等[68]报道新生小鼠补充精胺能够增加表达抗原(如TCRab、CD4、CD5和CD54)的上皮内淋巴细胞的比值。这些究结果表明,宿主-微生物合成多胺是肠道微生物群的重要功能,尤其是在初生时期更为重要,对于肠道的后期发育同样也是必需的。多胺代谢在调节机体免疫反应中起着核心作用,精氨酸酶I和一氧化氮合酶竞争精氨酸分别产生多胺或一氧化氮,两条途径参与机体免疫调节。在涉及受损或死亡细胞的局部炎症反应中,补充精胺可诱导细胞迁移和生长。多胺通过NO代谢与多胺之间复杂的相互作用对巨噬细胞的激活产生负面影响。此外,据报道,多胺可能对肠道免疫过敏反应发挥抑制作用[69]。多胺还可调节全身和肠道黏膜适应性免疫,如接受富含多胺的母乳的幼犬表现出肠道上皮内CD8+T细胞和固有层CD4+T细胞成熟加快,以及脾脏中B细胞的早期产生增多[70]。多胺的复杂调节作用对于宿主和微生物的细胞功能至关重要,值得进一步研究以揭示宿主和微生物多胺代谢的变化如何影响宿主的健康。
5 总结与展望
肠道菌群和机体免疫系统之间的相互作用机制十分复杂,受多种环境因素的影响,至今尚未完全阐明。微生物代谢物及微生物-机体共代谢物对调控免疫功能具有重要作用,近年来研究人员认识到这种共同代谢在人类健康和疾病中的作用。本文主要综述了肠道在宿主防御中的作用,以及肠道微生物及肠道内代谢产物促进宿主免疫系统发育、调节宿主免疫反应的作用机制,通过深入了解微生物代谢物及微生物与机体之间的关系使我们认识“肠道微生物-代谢物-畜禽健康”的相互调控的作用机制。
在哺乳动物胃肠道中,大量的先天和适应性免疫细胞与数万亿的共生微生物共存,机体主要依赖于IECs对共生微生物和致病微生物形成的物理和生化屏障,将微生物区系与宿主免疫细胞隔离开,降低肠道通透性,从而实现宿主-微生物相互作用和稳态调节。此外,IECs可以感知和响应微生物的刺激,以加强其屏障功能,并参与协调适当的免疫反应,从而影响黏膜免疫细胞的发育和稳态[71]。
肠道菌群通过调节淋巴细胞(特别是T淋巴细胞)的发育和分化来调控宿主的适应性免疫,还可以通过刺激吞噬细胞(如巨噬细胞和中性粒细胞)来维持肠道的免疫耐受。肠道内的代谢产物,包括SCFAs、AhR和多胺化合物等,对黏膜免疫的调控发挥重要作用。其中最重要的代谢产物SCFAs主要通过激活GPCRs和HDACs活性来调节肠黏膜免疫细胞和肠上皮细胞的增殖、分化和凋亡等过程,从而调节免疫应答。肠道菌群或肠道内代谢产物与宿主细胞表面的AhR结合,通过影响肠道菌群的组成或调控细胞因子的分泌来调节肠道黏膜的稳态,还可以缓解肠道炎症反应[64]。来自日粮或宿主和微生物细胞合成的多胺化合物主要通过调节IECs的结构或参与免疫细胞的分化等过程[70],来调节全身和肠道黏膜免疫反应。
随着宏基因组学和计算框架技术的不断革新将帮助系统预测和发现更多与免疫系统功能相关的微生物代谢物和成分。尽管如此,仍有许多问题有待进一步探索,如肠道微生物代谢物(SCFAs)以及共代谢物(多胺和芳香烃配体)如何影响免疫细胞亚群及其功能。而肠道菌群与疾病之间的互作,有益菌的功能,改变动物肠道菌群的疗法尚处于起步阶段,还需要进行更多的基础研究。尽管我们对肠道菌群在人类疾病的发生和发展中所起的作用尚不了解,随着新技术手段的更新与发展,肠道菌群多样性及对宿主免疫功能的调控机制将更加深入,肠道菌群及其代谢的改变可能成为自身免疫性疾病的可行治疗和诊断靶点。

