植物中β-紫罗兰酮生物合成及调控研究进展
叶云芳 田清尹 施婷婷 王亮 岳远征 杨秀莲 王良桂
(1. 南京林业大学,南京 210037;2. 南方现代林业协同创业中心,南京 210037;3. 大千生态环境集团股份有限公司,南京 210036)
植物的叶、花、果实、种仁等结构会释放出各种各样的挥发性有机化合物(volatile organic compounds, VOCs)[1-2]。VOCs是亲脂性液体,通常分为苯丙烷类、脂肪酸、氨基酸和萜类化合物[3],β-紫罗兰酮(β-ionone, BI)是植物产生的一种VOCs,属于萜类化合物。“紫罗兰酮”的名字来源于“iona”(希腊语为紫罗兰色)和“酮”,前者指紫罗兰的气味,后者指紫罗兰酮的结构,β-紫罗兰酮作为一类环化异戊二烯,广泛用于化工合成视黄酸、视黄醇、β-胡萝卜素和维生素A等化合物[4-7]。由于β-紫罗兰酮具有极低的气味阈值和宜人的气味,被广泛应用于化妆品和香水行业[8]。此外,β-紫罗兰酮具有抗癌、抗菌抗炎、抗微生物和降血脂等有益人体健康的功效[9-14]。作为植物重要的香气物质之一,β-紫罗兰酮广泛分布于许多植物中,如桂花(Osmanthus fragrans)、矮牵牛(Petunia hybrida)、波邦蔷薇(Rosa bourboniana)、欧洲酸樱桃(Prunus cerasus)、无花果(Ficus carica)等[5,15-21]。综上所述,β-紫罗兰酮作为一类异戊二烯,在提高植物观赏性能、促进人体健康以及生产应用等方面具有重要作用,因此植物β-紫罗兰酮的生物合成与代谢调控研究逐渐成为热点。本文结合β-紫罗兰酮的理化性质、生物活性,综述β-紫罗兰酮生物合成调控途径、途径中相关基因对植物花、果、叶的影响和基因工程技术对植物中β-紫罗兰酮进行改良的研究进展,同时对该领域研究作了合理展望,以期为人工调节植物中β-紫罗兰酮的含量,提高植物的观赏性状及获得高产量的天然β-紫罗兰酮提供参考。
1 β-紫罗兰酮的基本性质
1.1 植物中的β-紫罗兰酮
作为一种常见的天然VOC,β-紫罗兰酮主要存在于一些香味浓郁的植物中,如覆盆子(Rubus idaeus)、甜樱桃(Prunus avium)、葡萄(Vitis vinifera)等果实,或茶叶(Camellia sinensis)、桂花、杜松(Juniperus rigida)、粗糙雾冰藜(Bassia muricata)等植物的花、叶中[22-30]。不同植物中β-紫罗兰酮相对含量的差别很大,例如在变叶木(Codiaeum variegatum)中有相对含量高达29.7%的环氧β-紫罗兰酮[31];树莓(Rubus corchorifolius)中检测出β-紫罗兰酮相对含量为10.46%[32];而β-紫罗兰酮在中国黄茶中的相对含量则极低,其质量分数只有1.10 μg/kg[33]。β-紫罗兰酮在同种植物不同品种中的相对含量也不一样,在浙江省栽培的29个桂花品种中,检测出β-紫罗兰酮相对含量最低和最高的品种间有超过10倍的差距,其范围为4.75%-50.90%[25]。通过分析不同颜色(橙色、紫色、白色和黄色)的胡萝卜(Daucus carota)品种根部的VOCs组成发现,只有橙色和紫色品种的根部会积累大量β-紫罗兰酮,白色和黄色品种的根部则无积累[21]。
1.2 β-紫罗兰酮的理化性质及其衍生物
紫罗兰酮是一种由13个碳组成的酮类化合物,具有一个单环萜类骨架,自然界中存在多种异构紫罗兰酮,包括α-紫罗兰酮、γ-紫罗兰酮等,它们的区别在于双键的位置不同[8,34]。β-紫罗兰酮(C13H20O)全称4-(2,6,6-三甲基-1-环己烯基)-3-丁烯-2-酮,分子量为192.30[6]。其颜色为淡黄色或黄色,常温下以液体形式存在,不溶于水和甘油,可溶于大多数油和醇类物质,具有紫罗兰(Matthiola incana)花香香味[35]。β-紫罗兰酮已经被美国食品药品监督局批准为安全类物质(generally recognized as safe,GRAS),广泛应用于食品工业中[12]。目前有多种已被鉴定的β-紫罗兰酮衍生物,如二氢-β-紫罗兰酮、甲基-β-紫罗兰酮、6-甲基-β-紫罗兰酮、异甲基-β-紫罗兰酮等,和β-紫罗兰酮一样,都具有木香、花香、果香香气,可用作食品添加剂、化妆品和香水的组成部分[8,36-39]。此外,还可以通过一定的技术手段将β-紫罗兰酮转化为β-紫罗兰酮的衍生物,例如β-紫罗兰酮通过使用昂贵的催化剂,如手性铑或膦钌的不对称加氢这一化学生产过程可以合成二氢-β-紫罗兰酮[40-41]。生物技术生产方面,来自青蒿(Artemisia annua)的青蒿醛双键还原酶(double bond reductase,DBR)可以实现将β-紫罗兰酮转化为二氢-β-紫罗兰酮[42]。但在生物体内,β-紫罗兰酮和其衍生物的相互转化的机制仍需进一步探讨(表1)。
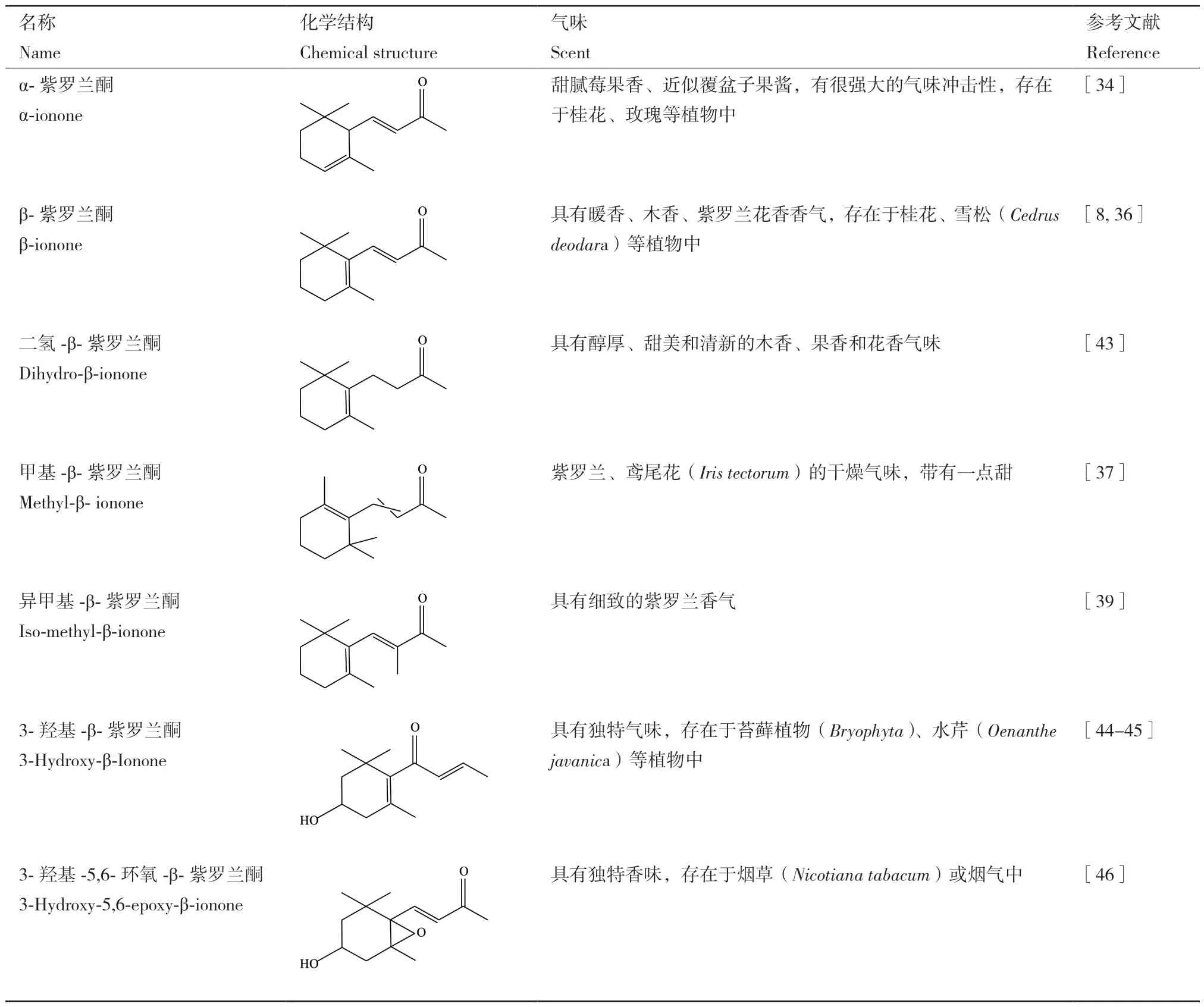
表1 α-紫罗兰酮、β-紫罗兰酮及其衍生物的概况Table 1 General information of α-ionone, β-ionone and their derivatives
1.3 β-紫罗兰酮的生物活性
β-紫罗兰酮在生物体内外均表现出强大的抗癌活性[47]。β-紫罗兰酮可抑制细胞增殖并调节3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl coenzyme A reductase, HMGCoA)还原酶,从而在肝癌发生过程中显示出良好的预防作用[48]。β-紫罗兰酮具有通过自由基清除特性的抗增殖和抗氧化潜力,可以有效改善肺部癌变[49];β-紫罗兰酮还可以抑制大鼠由7,12-二甲基苯并蒽(7,12-dimethylbenz[a]anthracene, DMBA)引发的乳腺癌[47]。此外,β-紫罗兰酮具有很好的抗菌效果,例如龙胆(Adenophora capillaris)、钻果大蒜芥(Sisymbrium officinale)等提取精油后,采用圆盘扩散法或最小抑菌浓度程序评价β-紫罗兰酮的抗菌活性,结果表明,所有精油均表现出潜力巨大的抗菌活性[50-53]。驱避或引诱昆虫研究表明,β-紫罗兰酮对跳蚤甲虫(Phyllotreta cruciferae)和蜘蛛螨(Tetranychus urticae)都有很强的驱虫作用[54];研究推测当β-紫罗兰酮释放出足够的量,可以阻止食草昆虫侵害在露天栽种的作物[55]。β-紫罗兰酮也可用作诱饵来吸引昆虫,在巴西巴拉那州伊瓜苏国家公园的混合亲水森林或这一地貌与山地半落叶森林之间的过渡区,用β-紫罗兰酮作为气味诱捕器的诱饵,可以持续捕获雄性下颌真舌蝴蝶(Euglossa mandibularis)[56]。通过使用其作为信息素来吸引昆虫,可减少农药使用,从而实现环保型生产。
2 β-紫罗兰酮合成途径及其调控机制
2.1 植物中β-紫罗兰酮的合成代谢及其相关酶
现有研究表明,β-紫罗兰酮存在于含有类胡萝卜素(carotenoid)的植物中,从合成途径上看,β-紫罗兰酮主要是由类胡萝卜素裂解产生的一种脱辅基类胡萝卜素(apocarotenoids)[43]。目前合成香气物质β-紫罗兰酮的基本途径和结构基因已经得到鉴定和克隆,然而关于其形成的调控机理仍鲜有报道。
脱辅基类胡萝卜素和类胡萝卜素作为异戊二烯的一个亚类,其生物合成主要来源于番茄红素,番茄红素起始于2-C-甲基-D-赤藓糖醇-4-磷酸(mevalonate pathway, MEP)途径合成的异戊烯基焦磷酸盐(isopentenyl diphosphate, IPP)和二甲基烯丙基焦磷酸盐(dimethyl allyl pyrophosphate,DMAPP)[57]。番茄红素经由番茄红素ε-环化酶(lycopene-Ɛ-cyclase, LCYE)和番茄红素β-环化酶(lycopene-β-cyclase, LCYB)催化转化为δ-胡萝卜素和α-胡萝卜素、γ-胡萝卜素和β-胡萝卜素[58]。然后α-胡萝卜素通过ε-环胡萝卜素羟化酶(carotene-Ɛ-hydroxylase, CHYE)和β-环胡萝卜素羟化酶(carotene-β-hydroxylase, CHYB)催化的过程转化为叶黄素。而β-胡萝卜素的降解一分为二:一方面通过β-胡萝卜素羟化酶(β-carotene hydroxylase,BCH)和玉米黄质环氧化物酶(zeaxanthin epoxidase,ZEP)催化的过程转化为环氧玉米黄质和紫黄质,最后通过新黄质合成酶(neoxanthin synthase, NXS)合成新黄质;另一方面通过类胡萝卜素裂解氧化酶(carotenoid cleavage oxidases, CCOs)裂解成脱辅基类胡萝卜素(图1)[59]。CCOs可以分解类胡萝卜素的多烯链特异性双键,其包括类胡萝卜素切割双加氧酶(arotenoid cleavage dioxygenases, CCDs)和九顺式环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenas, NCEDs)[60-63]。将来自高粱(Sorghum bicolor)、玉米(Zea mays)和水稻(Oryza sativa)等12个物种的90个CCO基因分为6组(即CCD1、CCD4、CCD7、CCD8、NCED和CCD-like),其中来自高粱、玉米和水稻的一些CCD8基因与其他9个物种的CCD8基因没有分为一组,而是聚集在CCDlike组中[62]。已有研究表明,CCD7和CCD8与形成独脚金内脂有关,而形成与β-紫罗兰酮香气成分相关的CCD主要是CCD1、CCD4、CCD10[64-65]。它们具有不同的特异性和切割位点,以不同的类胡萝卜素作为底物,从而有助于植物中脱辅基类胡萝卜素香气成分多样性地形成[57,64,66-68]。而关于β-紫罗兰酮在植物体内的降解途径鲜有报道,目前仅在青蒿和桂花中有所研究,β-紫罗兰酮可由DBR1、DBR2在植物体外生物转化成二氢-β-紫罗兰酮[42]。笔者团队根据桂花中已有功能报道的类DBR氨基酸序列,在日香桂基因组中同源比对,得到与其同源性高达99%的序列(evm.model.Contig48.8),即12-氧代植物二烯酸还原酶(12-oxo-phytodienoic acid reductase, OPR),但其功能是否与DBR一致,还需进一步实验研究(数据未发表)。

图1 植物中β-紫罗兰酮的生物合成途径Fig. 1 Biosynthetic pathways of β-ionone in plants
2.2 β-紫罗兰酮合成途径的基因调控
合成β-紫罗兰酮的前体物质是类胡萝卜素,由其合成途径可知主要由CCD酶基因参与类胡萝卜素裂解(图2-A)。研究表明在拟南芥(Arabidopsis thaliana)中,AtCCD1可以催化线性和环状类胡萝卜素9,10(9',10')位置的裂解,基于类胡萝卜素底物的不同性质产生1-2个紫罗兰酮分子或不同的氧化衍生物[60]。此外,CCD1还可以在5,6(5',6')和7,8(7',8')位置切割番茄红素双键[69-70]。目前,已在桂花和茶叶等多种植物中鉴定出CCD1的同源基因,可催化类胡萝卜素裂解产生β-紫罗兰酮,且研究表明CCD1的启动子和编码序列多样性有助于β-紫罗兰酮的差异积累[43,71]。CCD4在拟南芥、大马士革玫瑰(Rosa damascena)、菊花(Chrysanthemum morifolium)和苹果(Malus domestica)、葡萄中切割β-胡萝卜素以产生β-紫罗兰酮[72-73]。现有研究验证了一种来自烟草的新型类胡萝卜素切割双加氧酶NtCCD10的功能,NtCCD10和CCD1在结构上存在一些差异,NtCCD10可以在9,10(9',10')位置对称地裂解八氢番茄红素和β-胡萝卜素,产生香叶基丙酮和β-紫罗兰酮[65]。
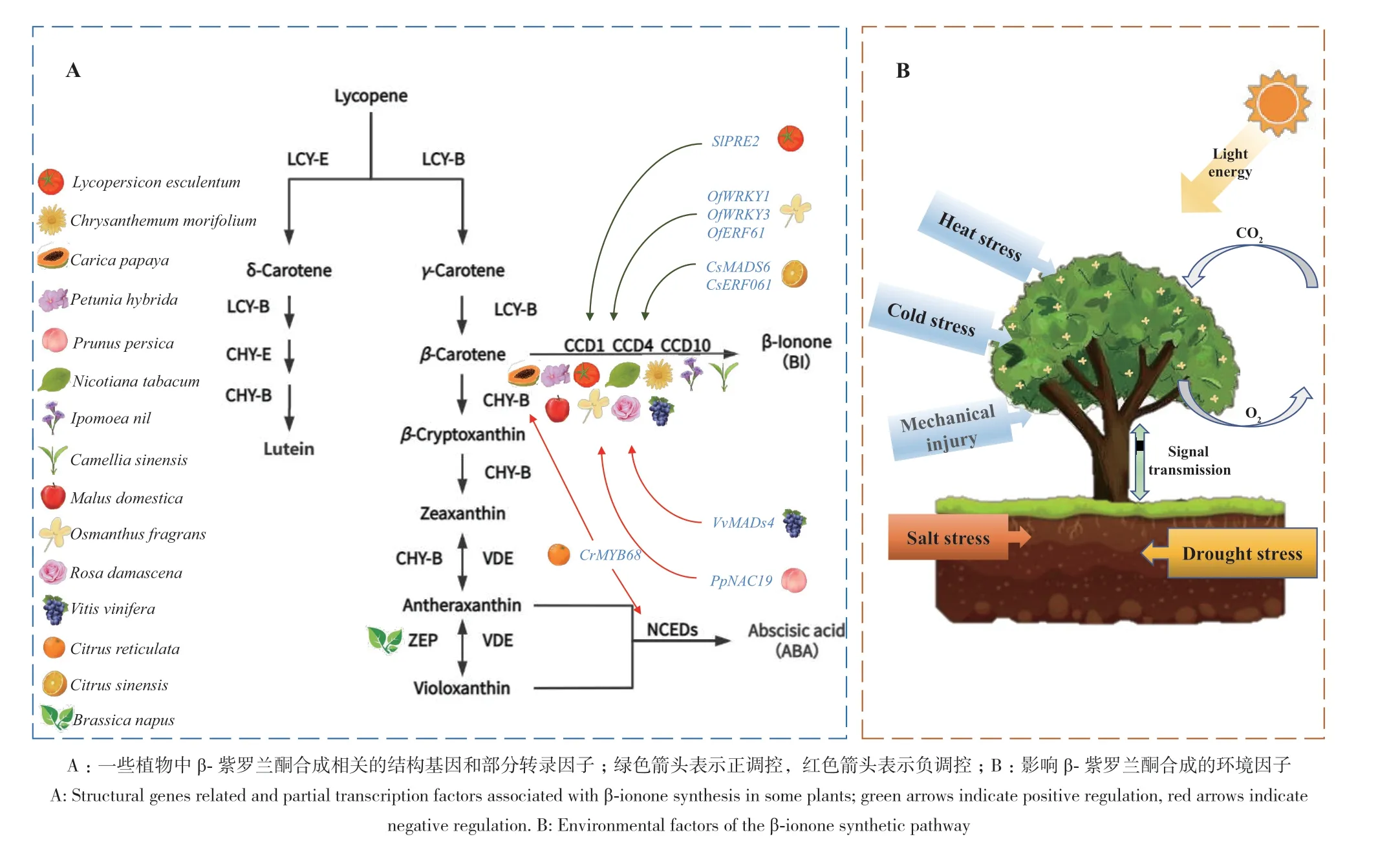
图2 植物中β-紫罗兰酮的合成调控图Fig. 2 Regulation map of β-ionone synthesis in plants
除结构基因参与β-紫罗兰酮生物合成外,还有转录因子参与调控β-紫罗兰酮合成。植物中的主要转录因子家族包括WRKY、MYB、NAC、MADS等,它们参与众多生命活动,如应激反应、新陈代谢和激素诱导等。然而,目前对调节CCD表达的转录因子知之甚少。有研究表明,在‘枣黄’和‘橙红’丹桂两个桂花品种中β-紫罗兰酮含量差异主要受转录因子调控影响[74]。桂花OfWRKY3可以与OfCCD4启动子中存在的W-box回文基序结合,是OfCCD4基因的正调节因子[75]。同时OfWRKY1和OfERF61也被证明上调桂花OfCCD4基因的表达,影响β-紫罗兰酮合成,使花香改变[76]。而桃(Prunus persica)的PpNAC19和葡萄的VvMADS4可抑制各自体内CCD4的启动子活性,负调控β-紫罗兰酮合成[73,77]。部分转录因子通过调节β-类胡萝卜素的转化也能影响到β-紫罗兰酮,比如柑橘(Citrus reticulata)中的CrMYB68可以负调控CrBCH2和CrNCED5两个基因表达,从而控制类胡萝卜素α-分支和β-分支的转化,最终影响β-紫罗兰酮的合成,同属于柑橘属的甜橙(Citrus sinensis)的转录因子CsMADS6、CsERF061通过直接结合CCD1启动子来上调其的表达[78-80]。除此之外,转录因子还可以通过影响相关信号传导蛋白的活性从而控制β-紫罗兰酮合成,如番茄(Solanum lycopersicum)中的SlPRE2通过影响参与光信号传导的bHLH(basic helix-loop-helix)蛋白的活性来控制类胡萝卜素裂解合成β-紫罗兰酮(图2-A)[81]。
2.3 β-紫罗兰酮合成途径的环境因子调控
β-紫罗兰酮除了由β-胡萝卜素通过CCD1、CCD4、CCD10酶促反应裂解产生,也受环境因素的调控。研究表明,β-紫罗兰酮可以由光氧化和热氧化降解合成[82]。对棉花(Gossypium hirsutum)的GhCCDs中启动子区域的顺式作用元件分析表明,大多数元件与光、冷、热、盐和干旱等非生物胁迫的响应有关,这表明β-紫罗兰酮合成途径关键酶基因受环境因子调控[83]。蓝藻(cyanobacteria)在高光诱导下上调NosCCD基因表达,促进β-紫罗兰酮的合成[84]。紫外线B(ultraviolet B, UV-B)辐射通过控制桃中的PpCCD4的转录水平,从而介导β-紫罗兰酮的合成,此外,用乙烯熏蒸处理过的桃中β-紫罗兰酮的含量显著增加[85]。在茶叶枯萎的过程中β-紫罗兰酮会逐渐积累,有两种酶的含量变化可以验证该现象,分别为CsCCD4和CsCCD1a,其中CsCCD4含量变化是由机械损伤和低温引起的,CsCCD1a的含量变化由脱水应激诱导[86]。另外,高盐胁迫会导致杜氏菌中包括β-紫罗兰酮、α-紫罗兰酮和β-环柠檬醛在内的类胡萝卜素裂解产物大量积累[87]。因此,包括β-紫罗兰酮在内的多种类胡萝卜素氧化产物可以作为植物中的胁迫信号(图2-B)[88]。
3 β-紫罗兰酮合成相关基因对植物叶片、花朵、果实的影响
β-紫罗兰酮合成的过程也是类胡萝卜素降解的过程,因此其相关基因对植物的叶片、花朵、果实主要有色泽和香气两部分的影响。
3.1 β-紫罗兰酮合成相关基因对叶片的影响
类胡萝卜素在植物叶片中含量丰富,在叶绿素降解后由其控制叶片色彩,因此类胡萝卜素降解合成β-紫罗兰酮的过程中,叶片的颜色和气味都会发生变化[89-90]。天然香料七叶兰(Pandanus amaryllifolius)中的β-紫罗兰酮、α-紫罗兰酮和β-环柠檬醛等香气化合物,都是在CCD基因的调控下发生酶促反应生成[85,91]。CsCCD1和CsCCD4参与裂解茶叶中的β-胡萝卜素,生成茶叶中的主要香料之一的β-紫罗兰酮,使茶叶更具香韵[71,86]。NtCCD1c可以特异性地裂解β-胡萝卜素和番茄红素,分别产生β-紫罗兰酮和假紫罗兰酮,同时NtCCD1是类胡萝卜素含量的负调节因子,在烟草叶片中活性氧含量的调控中起着至关重要的作用[92]。
3.2 β-紫罗兰酮合成相关基因对花朵的影响
花香是植物最重要的特征之一,可以吸引和引导传粉者完成授粉,这对被子植物的受精至关重要[3]。现有研究已经确认,β-紫罗兰酮是一种重要花香物质,在墨兰(Cymbidium sinense)的6个品种中测得的50种化合物中,β-紫罗兰酮总体占比最高,为0.37%-20.23%,而CCD1和CCD4是调节花朵中β-紫罗兰酮形成的重要基因[60,75,93]。CCD1基因在大马士革玫瑰、桂花中被证实负责C13-正异戊二烯(如β-紫罗兰酮、β-大马士革酮和α-紫罗兰酮)的积累,以及在体外试验中可以裂解多种类胡萝卜素[94]。OfCCD4可以调控桂花花瓣中类胡萝卜素的裂解,从而控制花瓣颜色的深浅,同时影响β-紫罗兰酮、二氢-β-紫罗兰酮等花香物质的积累[74]。CmCCD4a可以抑制类胡萝卜素的积累从而使菊花呈现白色,其表达严格限于花瓣,在其他器官(如根、茎或叶)中未检测到[95]。
3.3 β-紫罗兰酮合成相关基因对果实的影响
β-紫罗兰酮是水果中重要的香气化合物,迄今为止,在番茄、桃、李子(Prunus salicina)、草莓(Fragaria×ananassa)、枸杞(Lycium chinense)、甜橙(Citrus sinensis)和葡萄中广泛研究[96-105]。研究表明桃的果实成熟过程中,β-紫罗兰酮的合成在很大程度上是由酶促作用主导的,PpCCD1和PpNCED1的转录水平下降会导致类胡萝卜素积累增加,且PpCCD4也被证实可以决定桃子的果肉颜色[106-108]。在番茄果实中SlNCED的较低表达会导致类胡萝卜素积累增加,从而显示出深红色[109]。抑制柑橘CCD1基因的表达后,其外观色泽轻微变黄,同时紫黄质和9-顺式-紫黄质含量显著上升[110]。随着消费市场对水果品质要求的不断提升,作为果实的一种特色风味,怡人的香气是果品吸引消费者和增强市场竞争力的重要因素之一,通过基因工程技术改良果香将极大提高果实的经济价值[111-112]。
4 基因工程技术在改良植物中β-紫罗兰酮的应用
作为β-胡萝卜素的代谢产物,β-紫罗兰酮的合成和积累依赖于合成途径中关键酶基因的转录水平,因此对天然β-紫罗兰酮进行改良的最有效的基因工程技术手段,是关键酶基因的过表达或沉默以及异源表达。
4.1 关键酶基因的过表达或沉默
八氢番茄红素合酶(phytoene synthase, PSY)基因、八氢番茄红素去饱和酶(phytoene desaturase,PDS)基因、ζ-胡萝卜素去饱和酶(ζ-carotene desaturase, ZDS)基因、番茄红素β-环化酶(lycopene-β-cyclase, LCYB)基因和紫黄质去环氧化酶(violaxanthin de-epoxidase, VDE)基因等都不是调节β-紫罗兰酮合成的关键酶基因,其合成的关键酶基因为ZEP、NCED1、CCD1和CCD4[74]。在植物体内可以利用过表达关键酶基因或基因敲除、RNA干扰(RNA interference, RNAi)等手段沉默酶基因,从而改良植物中β-紫罗兰酮的合成。‘穗红’木瓜(Carica papaya cv. ‘Sui hong’)中CpCCD1的过表达可能刺激β-胡萝卜素和番茄红素的降解,进而形成6-甲基-5-庚烯-2-酮和β-紫罗兰酮等特异性挥发物[113]。OfCCD4在桂花中的高基因表达,促进类胡萝卜素在花瓣中裂解,使花色变浅(浅黄色),β-紫罗兰酮含量升高,改变桂花花香和花色[74]。敲除欧洲油菜(Brassica napus)花瓣中BnaC09.ZEP和BnaA09.ZEP,可以引起其β-胡萝卜素含量改变,影响β-紫罗兰酮合成[114]。在番茄(Lycopersicon esculentum)果实中,沉默LeCCD1A和LeCCD1B可导致成熟果实中β-紫罗兰酮的含量显著降低[15]。在牵牛花AK77栽培种(Ipomoea nil cv. AK77)以及菊花(Chrysanthemum morifolium)中,利用RNAi技术或CRISPR/Cas9的基因敲除技术沉默CCD4基因,都可以使花瓣从白色变成淡黄色,说明类胡萝卜素裂解效率变低,从而导致β-紫罗兰酮含量下降[95,115]。利用RNAi技术,降低靶基因SlNCED8的表达,使转基因果实的SlNCED1转录水平下调,共同作用导致类胡萝卜素积累,β-紫罗兰酮含量下降[109]。
4.2 关键酶基因的异源表达
β-紫罗兰酮的异源合成依赖于其前体β-胡萝卜素的降解,利用源于植物的CCDs在大肠杆菌(Escherichia coli)和酵母菌(Saccharomyces cerevisiae)中已经成功地进行了β-紫罗兰酮的异源合成[20,70]。当在工程大肠杆菌(生产八氢番茄红素、番茄红素、β-胡萝卜素和玉米黄质)和酵母菌(生产β-胡萝卜素)中异源表达NtCCD10时,NtCCD10可以对称切割八氢番茄红素和β-胡萝卜素分别产生香叶基丙酮和β-紫罗兰酮[65]。向大肠杆菌中转入了CsCCD1基因和OfCCD4基因,可以产生β-紫罗兰酮[116]。迄今为止,使用大肠杆菌菌株获得的β-紫罗兰酮最高滴度为32.4 mg/L[57]。由于酵母细胞工厂具有公认的GRAS标签,因此是合成应用于食品行业的β-紫罗兰酮的首选平台[117]。在最早的研究中,CCD1在酵母菌中异源表达,β-紫罗兰酮的滴度仅为5 mg/L[118-119]。经过改造解脂耶氏酵母(Yarrowia lipolytica)菌株后,通过异源表达可以产生68 mg/L滴度的β-紫罗兰酮[120]。有研究测试了来自不同植物的各种CCD酶在异源宿主中β-紫罗兰酮合成的区别,比较了拟南芥、葡萄、矮牵牛和桂花的CCD1基因在大肠杆菌中的异源表达,其中效率最高的是PhCCD1[57]。在工程酵母菌株SCIGS22中转入矮牵牛的PhCCD1,可以产生(0.073 ± 0.01)mg/g干重的β-紫罗兰酮,将红发夫酵母(Xanthophyllomyces dendrorhous)的crtYB、crtI基因和PhCCD1异源转入SCIGS22共同表达导致β-紫罗兰酮浓度增加8.5倍[(0.63 ± 0.02)mg/g干重],使用该菌株进行批量发酵,在1 h后最终为50 mg/g干重,增加了15倍[119]。在此基础上进一步优化,将PhCCD1转入酵母菌中异源表达,生成了184 mg/L滴度和高达32 mg/g干重的β-紫罗兰酮,这是迄今为止CCD1在酵母菌中异源表达的最高水平[121]。尽管在微生物细胞工厂中过量生产β-紫罗兰酮的代谢工程策略已经相当成功,但仍需要提高生产效率以使该技术具有竞争力(表2)。

表2 基因工程技术改良植物中β-紫罗兰酮的应用Table 2 Application of β-ionone in plants improvement by genetic engineering technology
5 展望
β-紫罗兰酮是一种重要香气物质,广泛存在于植物的根、茎、叶、花、果等器官中,是植物中具有多种生物活性的类胡萝卜素代谢产物,在提高植物观赏商用价值、促进人体健康以及生产应用等方面具有重要作用。植物中β-紫罗兰酮的释放与类胡萝卜素生物合成和降解基因的表达量高低有明显的相关关系,但有关β-紫罗兰酮合成和降解的分子调控机制却少有报道,近年来随着染色质可及性测序(assay for transposase-accessible chromatin with high-throughput sequencing, ATAC-seq)等高通量测序技术和以CRISPR/Cas9为代表的基因组编辑技术的不断改进发展,以及在不同植物中的广泛应用,利用现代生物学手段发现并鉴定植物中β-紫罗兰酮生物合成的特异性调控因子及分子调控网络将变成可能[122-123]。许多关于植物香气物质的研究是在模式植物或微生物上进行的,常用顶空固相微萃取气相色谱质谱法(headspace solid-phase microextraction gas-chromatographic mass-spectrometric method, HSSPME-GC/MS)对挥发性类胡萝卜素裂解产物进行检测和定量,对该方法进行了优化,已在拟南芥体外、体内进行了验证[124]。优化后的测量方法有利于在植物中找到更多的香气物质,开发了基于大肠杆菌的模块化途径优化和酶工程的策略,用以大量生产天然的β-紫罗兰酮,显示出了利用微生物或植物生产天然β-紫罗兰酮的巨大潜力[57,125]。
人们对于植物β-紫罗兰酮的认识日新月异,但目前植物中β-紫罗兰酮的研究仍缺乏系统性,以下几个方面还需要进一步探索和完善:(1)β-紫罗兰酮合成的更多调控机制,包括酶基因调控、转录因子调控、转录后调控等;(2)提升β-紫罗兰酮的分离纯化技术;(3)β-紫罗兰酮对植物、动物和人类的其他未探明生物活性;(4)植物生长过程中β-紫罗兰酮的动态变化;(5)果实或花器官中β-紫罗兰酮香气浓度与类胡萝卜素含量的关系;(6)开发β-紫罗兰酮的新产品;(7)生产具有较高β-紫罗兰酮香气的水果和花卉;(8)通过转基因工程生产天然的β-紫罗兰酮香精香料。相信随着科学技术的发展以及研究的日渐深入,对β-紫罗兰酮的合成调控的认识也会更加深刻,从而更好地改良和利用植物中的β-紫罗兰酮资源。

