聚多巴胺涂覆Cu-MBG的生物活性及抗菌性能研究
贺蓉 刘涛 丁新波 仇巧华 朱灵奇

摘 要: 为了获得适用于治疗骨髓炎骨组织缺损及修复的生物材料,受贻贝蛋白的强黏附性能的启发,以掺铜的生物玻璃(Cu-MBG)纳米颗粒为基底,在Cu-MBG表面涂覆聚多巴胺(PDA),得到Cu-MBG@PDA;对PDA涂覆前后的Cu-MBG纳米颗粒的形貌和结构进行表征,分析其亲水性、体外生物活性及抗菌性能。结果表明:经过PDA涂覆的Cu-MBG@PDA的水接触角减小到44.31°,亲水性能明显提高;在体外模拟体液(SBF)中浸泡之后,Cu-MBG@PDA样品比Cu-MBG有着更快的羟基磷灰石形成能力;经过PDA涂覆的Cu-MBG@PDA具有优异的抗菌性能,对金黄色葡萄球菌(Staphylococcus aureus, S. aureus)和大肠杆菌(Escherichia coli, E.coli)的抑制率都提高到99.90%以上。经过PDA涂覆的Cu-MBG@PDA具有更优异的亲水性、体外生物活性及抗菌性能,有望应用于慢性骨髓炎导致的骨组织缺损及修复方面的治疗。
关键词: 生物活性玻璃;铜;聚多巴胺;生物活性;抗菌性能
中图分类号: TB381
文献标志码: A
文章编号: 1673-3851 (2023) 07-0508-08
引文格式:贺蓉,刘涛,丁新波,等. 聚多巴胺涂覆Cu-MBG的生物活性及抗菌性能研究[J]. 浙江理工大学学报(自然科学),2023,49(4):508-515.
Reference Format: HE Rong, LIU Tao, DING Xinbo, et al. Study on the biological activity and antibacterial properties of polydopamine-modified Cu-MBG[J]. Journal of Zhejiang Sci-Tech University,2023,49(4):508-515.
Study on the biological activity and antibacterial properties of polydopamine-modified Cu-MBG
HE Rong, LIU Tao, DING Xinbo, QIU Qiaohua, ZHU Lingqi
(College of Textile Science and Engineering (International Institute of Silk), Zhejiang Sci-Tech University, Hangzhou 310018, China )
Abstract: To obtain biomaterials suitable for the treatment of bone tissue defects and repair in osteomyelitis, we, inspired by the strong adhesive properties of mussel proteins, obtained Cu-MBG@PDA by coating polydopamine (PDA) on the surface of Cu-MBG using copper-doped bioglass (Cu-MBG) nanoparticles as the substrate. We characterized the morphology and structure of Cu-MBG nanoparticles before and after PDA coating to analyze their hydrophilicity, in vitro bioactivity and antibacterial properties. The results show that the water contact angle of Cu-MBG@PDA coated with PDA is reduced to 44.31°, and the hydrophilic performance is significantly improved. The ability of Cu-MBG@PDA samples to form hydroxyapatite is faster than Cu-MBG after immersion in in vitro simulated body fluids (SBF). The inhibitory rates of PDA-coated Cu-MBG@PDA against Staphylococcus aureus and Escherichia coli both increase to over 99.90%, with excellent antibacterial properties. PDA-coated Cu-MBG@PDA has superior hydrophily, in vitro bioactive and antibacterial properties, and is expected to be used in the treatment of bone tissue defects and repair caused by chronic osteomyelitis.
Key words: bioactive glass; copper; polydopamine; biological activity; antibacterial properties
0 引 言
骨髓炎是由至少一種细菌感染引起的骨和骨髓的炎症,能导致人体局部骨破坏和坏死[1],每年超过数百万人因其发病或者死亡[2]。目前,骨缺损治疗是骨科医师的棘手问题;治疗骨髓炎通常需要手术切除感染或坏死的骨组织,导致大段骨缺损[3],给患者带来了巨大痛苦。因此寻找有效的治疗方案是当下亟须解决的问题。
骨髓炎引起的骨缺损患者需要接受的骨移植,骨移植的主要来源有人体骨(自体骨、同种异体骨、异种骨)和各种人工骨材料[4]。自体骨是理想的治疗骨缺损的材料,但是自体骨来源有限,甚至会增加供给区损伤的风险[5];同种异体骨移植会增加感染其他细菌的风险;异体骨则会增加免疫排斥的发生。因此,人体骨并不能实现自身修复,例如骨组织坏死、骨关节创伤,这时就需要人工骨的帮助。理想人工骨材料的研制是医学和生物材料科学领域的一个重要课题。近年来,为了解决骨髓炎引发的一系列问题,预防细菌感染的抗菌生物活性材料引起了越来越多的关注。
介孔生物活性玻璃(Mesoporous bioactive glass, MBG)具有高成骨生物活性,可作为骨再生材料,因而得到了广泛的研究[6]。为了进一步提高MBG的生物活性和抗菌作用,常将锌、铜和银等金属离子掺杂在其中;掺杂了Cu的MBG暴露于生理环境后,释放的铜离子可以增强其在骨生成中的生物活性和抗菌性能[7]。由于Cu-MBG与宿主骨组织的界面黏附性较差,可能导致界面松动问题,极大地限制了它的应用[8]。骨修复材料表面特性及其与细胞和组织的相互作用,是影响骨修复有效性的关键因素[9]。骨修复材料的表面改性可以增加与宿主骨组织的表面相互作用,提高其亲水性,增强表面细胞黏附性和抗菌性,从而有效地提高其生物活性和生物相容性[10]。
贻贝是一种海洋生物,它通过贻贝蛋白对各种表面具有突出的黏附性能。受贻贝的启发,Lee等[11]在2007年发现多巴胺是海洋贝类生物分泌的黏附蛋白的模拟小分子物质,在典型的海洋环境条件下能够发生自聚合反应,可以覆盖到几乎所有基质上,形成聚多巴胺(Polydopamine, PDA)涂层。PDA涂层的官能团(邻苯二酚、胺和亚胺)可以与有机或无机底物形成共价或强的非共价相互作用(氢键或堆叠相互作用),从而改善材料之间的界面相互作用[12]。近年来,构造PDA涂层已成为一种表面功能化的方法[13]。Wu等[14]利用PDA对多孔SiO2支架孔壁进行表面改性,显著提高了羟基磷灰石形成的能力。由于PDA有大量的亲水基团,PDA也能使得底物有良好亲水性[15]。Yang等[16]和Jo等[17]发现,利用PDA对PLLA和PCL纳米支架材料进行改性,可以有效改善了其表面的润湿性,改性后的PLLA和PCL纳米纤维支架由疏水性转变为亲水性。除此之外,PDA本身也具有一定的抗菌性能。例如,Su等[18]通过摇动辅助方法制备了牢固的PDA涂层,显著增强了各种基材的抗菌活性,并证实PDA表面带正电荷的胺基可通过与细菌的细胞膜接触而引起细菌裂解;Zhong等[19]在二氧化钛纳米管表面进行PDA涂覆改性,發现在改性后的二氧化钛纳米管表面,内皮细胞和平滑肌细胞的生长和繁殖显著优于改性之前,表明PDA对表面内皮细胞和平滑肌细胞具有较好的生物相容性,细胞毒性较小。
本文选择掺铜生物玻璃Cu-MBG的骨修复材料作为基底物,通过在Cu-MBG表面进行PDA涂层,制备Cu-MBG@PDA纳米颗粒;分析了PDA涂覆前后的Cu-MBG纳米颗粒的形貌、结构和光谱性能,并且对其亲水性、生物活性和抗菌性能进行测定,以期为骨髓炎骨组织缺损及修复治疗提供更多理论依据。
1 实验部分
1.1 实验材料
十六烷基三甲基溴化铵(CTAB)、氨水(NH3·H2O)、正硅酸乙酯((C2H5O)4Si)、磷酸三乙酯(C6H15O4P)、乙酸乙酯(C4H8O2)和Tris三(羟甲基)氨基甲烷(C4H11NO3),购于上海麦克林生化科技有限公司;无水乙醇(C2H5OH)、氯化钠(NaCl)、碳酸氢钠(NaHCO4)、氯化钾(KCl)、无水氯化钙(CaCl2)和无水硫酸钠(Na2SO4),购于杭州高晶精细化工有限公司;磷酸氢二钾(KH2PO4·3H2O)、氯化镁(MgC12·6H2O)和磷酸氢二钠(NaH2PO4),购于天津科密欧化学试剂有限公司;氯化铜(CuCl·H2O),购于国药集团化学试剂有限公司;四水硝酸钙(Ca(NO3)2·4H2O),购于成都科龙化工试剂厂;浓盐酸(HCl),购于杭州双林化工试剂有限公司;以上试剂均为分析纯。去离子水(实验室自制)。
金黄色葡萄球菌(Staphylococcus aureus, S.aureus)和大肠杆菌(Escherichia coli, E.coli)菌种,均购于上海士锋生物科技有限公司。
1.2 Cu-MBG和Cu-MBG@PDA的制备
采用微乳液-溶胶凝胶法合成Cu-MBG,具体方法如下:将0.56 g CTAB溶解在26.00 mL的去离子水中,当完全溶解后,分别加入8.00 mL C4H8O2、5.6 mL N H3·H2O、3.00 mL正硅酸乙酯、0.29 mL磷酸三乙酯、0.40 g Ca(NO3)2·4H2O和0.14 g CuCl2·H2O,充分搅拌之后,进一步反应4 h。用乙醇、去离子水离心洗涤3次,60 ℃下恒温干燥12 h,所得粉末以2 ℃/min的升温速率在马弗炉中煅烧,升温至700 ℃,并保温4 h,获得Cu-MBG粉末,用于后期测试。
将0.20 g的盐酸多巴胺加入100.00 mL的10 mmol/L Tris-HCl缓冲溶液中,搅拌至溶解;随后加入0.20 g的Cu-MBG纳米颗粒,在室温下搅拌12 h。静置1 h时间后,将溶液上部清液取出,用去离子水反复清洗所得沉淀3次,将得到的纳米颗粒置于烘箱中,在40 ℃下烘至过夜,获得完全干燥的Cu-MBG@PDA。
1.3 测试方法与表征
1.3.1 理化特性
用场发射扫描电子显微镜(Ultra55,德国Carl Zeiss半导体公司)观察和记录样品的形,用X射线衍射仪(美国Thermo Fisher Scientific公司)分析样品结晶情况,用X射线光电子能谱仪(K-Alpha美国Thermo Fisher Scientific公司)分析样品的化学元素,用傅里叶变换红外光谱仪(Nicolet 5700型,赛默飞世尔科技有限公司)检测样品的化学组成,用CA500S水接触角测量仪(昆山北斗精密仪器有限公司)进行静态接触角测量,通过MindVision软件分析样品的接触角和研究其亲水性。
1.3.2 体外生物活性研究
采用Barrère等[20]报道的方法配备10×模拟体液(SBF),取15 mg的样品加入10 mL的模拟体液中,设置恒温摇床温度37 ℃,速度90 r/min,将样品置于恒温摇床上。每隔1 d换一次模拟体液,分别在1、7 d和28 d后取出,取出的样品用去离子水洗净之后,进行烘干备用。
1.3.3 抗菌性能研究
选取稀释涂板法来评价不同纳米材料抗菌性能。取单克隆菌落置于20 mL营养肉汤中,在恒温摇床中以200 r/min转速、37 ℃条件下培养18 h。用0.9% NaCI溶液将菌液浓度按比例稀释到105 个/mL,各取稀释后的1 mL菌液分别与200 mg的PDA、Cu-MBG和Cu-MBG@PDA纳米颗粒置于试管中,将试管移入恒温培养箱中37 ℃条件下培养24 h。取出试管,用移液枪吸取100 μL菌液至LB固体培养基平板中,使用无菌的涂布棒进行涂布,之后将平板置于恒温培养箱中37 ℃条件下再培育24 h。取出平板,计算样品对S.aureus和E.coli抑菌率,计算公式为:
R/%=(B-A)B×100(1)
其中:R为PDA涂覆Cu-MBG前后对S.aureus和E.coli的抑菌率,%;A为各样品表面的活细菌数,个;B为生理盐水对照组表面的活细菌数,个。
2 结果与讨论
2.1 Cu-MBG和Cu-MBG@PDA理化性能
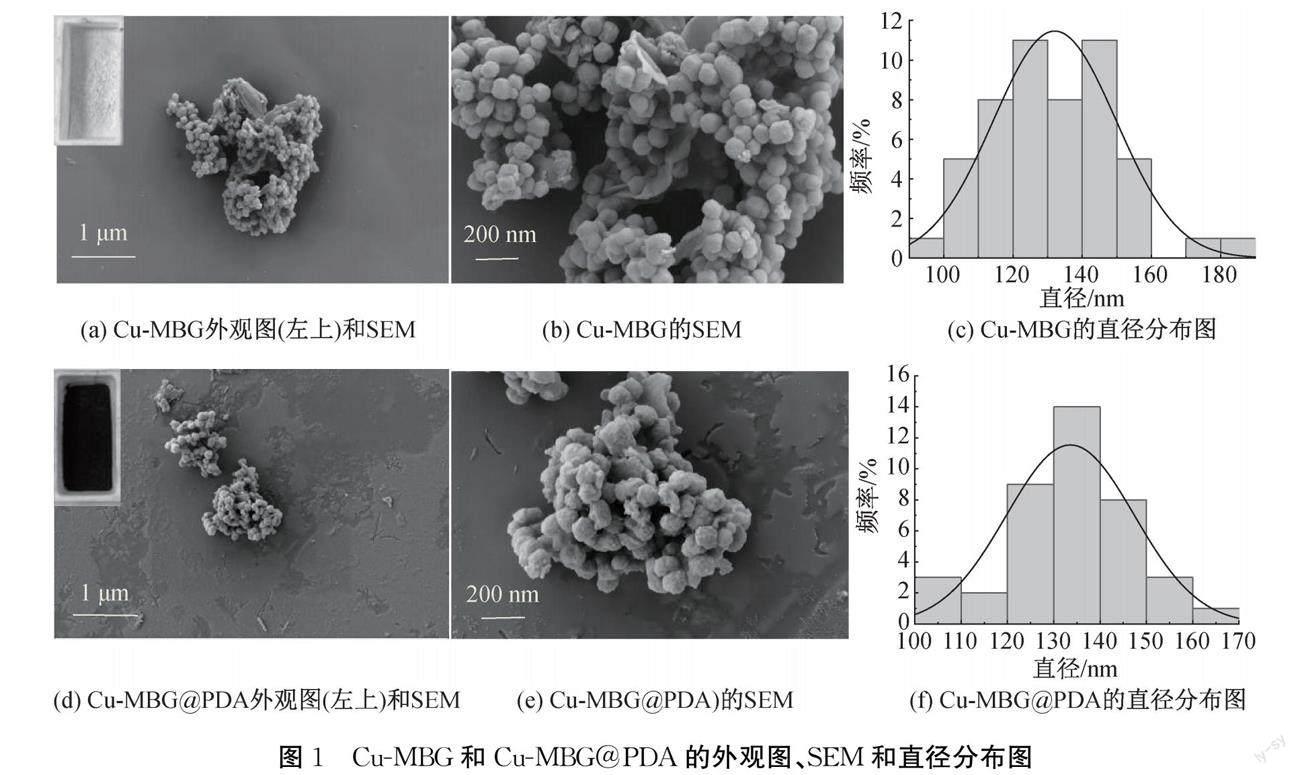
对所制备的Cu-MBG和Cu-MBG@PDA的理化性能进行表征,Cu-MBG和Cu-MBG@PDA的外观图、SEM图和直径分布如图1所示。由图1(a)和图1(d)的左上角的外观图可见,经过PDA涂覆之后的Cu-MBG,其外观颜色从白色变成黑色;由于多巴胺在聚合的过程中溶液的颜色会随着时间的推移逐渐发生变化,颜色由无色变为棕色最后变为黑色,表明在Cu-MBG表面上形成PDA膜。Cu-MBG和Cu-MBG@PDA的SEM如图1(b)和图1(e)可知,Cu-MBG颗粒表面光滑,经过PDA涂覆后,Cu-MBG@PDA颗粒表面粗糙度增加。Cu-MBG和Cu-MBG@PDA的直径分布图如图1(c)和图1(f),可见,Cu-MBG和Cu-MBG@PDA的纳米颗粒的粒径分别为(132.05±0.33) nm和(134.51±0.03) nm,Cu-MBG@PDA粒径略有增加,表明PDA成功涂覆到Cu-MBG的表面。与Cu-MBG相比,Cu-MBG@PDA的表面被PDA涂层包裹,PDA涂层显著增加了Cu-MBG的表面粗糙度,在表面形成完整、均匀的涂层。
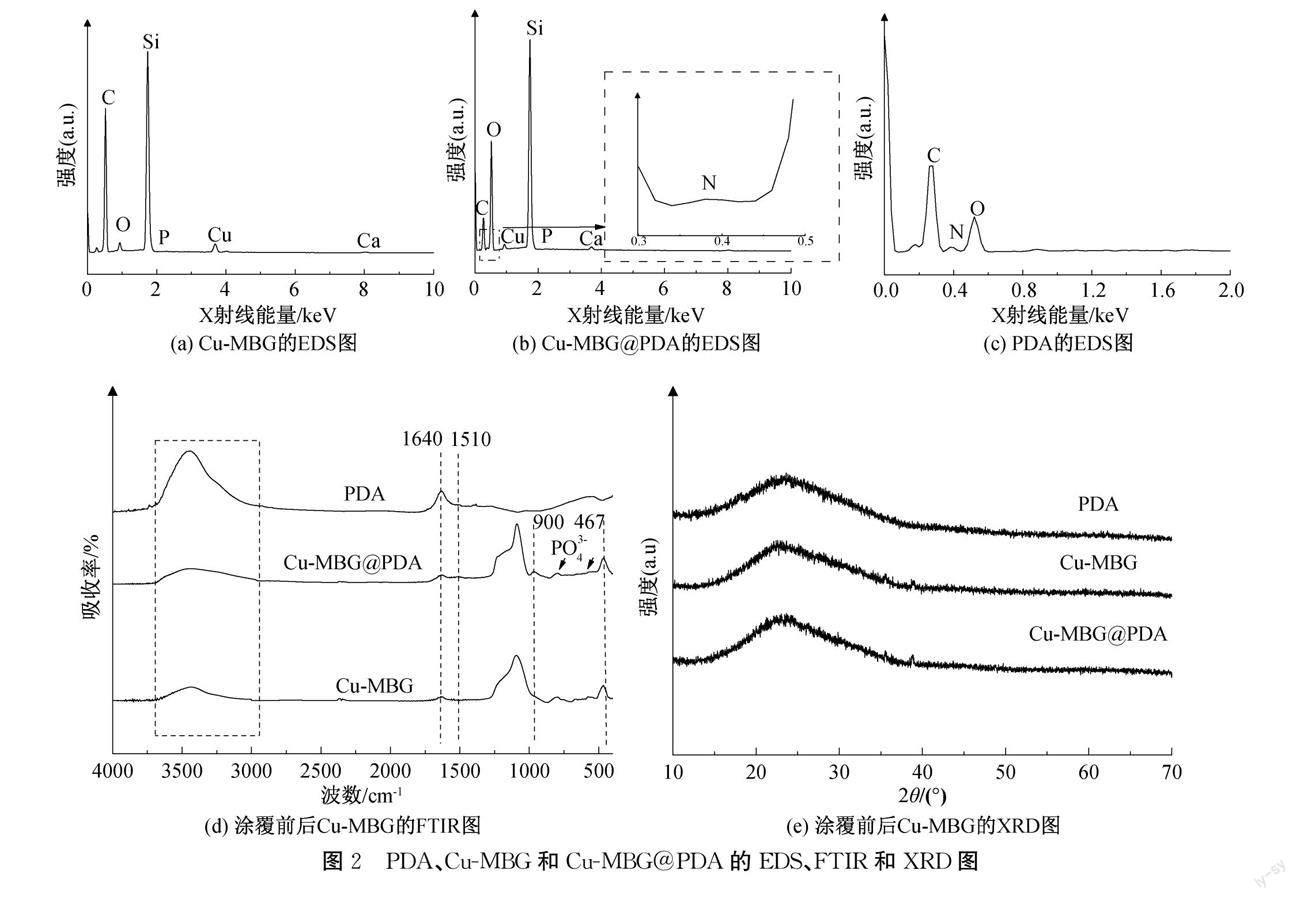
Cu-MBG、Cu-MBG@PDA和PDA的EDS如圖2(a)所示。从图2(a)—(c)可知,Cu-MBG在0.28、0.53、0.93、1.76、1.98 keV和3.72 keV处的峰分别为C、O、Cu、Si、P和Ca元素特征峰;相比Cu-MBG,Cu-MBG@PDA在0.39 keV位置上出现了对应于N元素的新特征峰。PDA、Cu-MBG和Cu-MBG@PDA的FTIR图谱如图2(d)所示。由图2(d)中可知,在1090、800、680~790 cm-1和467 cm-1处为硅基纳米材料的特征峰,1615 cm-1和1510 cm-1处为PDA的特征峰;Cu-MBG@PDA样品在680~790 cm-1附近仍有P—O的伸缩振动峰,Cu-MBG@PDA在1615 cm-1和1510 cm-1附近出现了的新特征峰,这是PDA化学结构式中苯环的CC共振和N—H弯曲振动,以及苯环中的N-H剪切振动引起的特征峰的变化,DA成功涂覆在Cu-MBG的表面上,与SEM结果一致。PDA、Cu-MBG和Cu-MBG@PDA的XRD图如图2(e)所示,PDA、Cu-MBG和Cu-MBG@PDA仅在2θ=23°处出现一个大宽峰,说明Cu-MBG经过PDA涂覆后,Cu-MBG@PDA未出现新的物相,主要衍射峰也没有出现增加和减少或峰位的改变。
Cu-MBG和Cu-MBG@PDA的水接触角如图3所示。从图3(a)和图3(b)可知,Cu-MBG和Cu-MBG@PDA的水接触角分别为74.63°、44.31°,表明Cu-MBG涂覆PDA之后亲水性大幅提高,是由于PDA含有酚羟基(—OH)、氨基(N—H)等亲水基团,提高了Cu-MBG的亲水性。Cu-MBG@PDA的亲水表面能够促进细胞外基质蛋白的黏附,对细胞的黏附、增殖和分化等方面有重要影响。
2.2 体外生物活性
Cu-MBG和Cu-MBG@PDA在SBF中浸泡不同天数的SEM图如图4所示。从图4(a)和图4(d)可以看出,当矿化时间为1 d时,Cu-MBG表面有很 少的矿化物,而Cu-MBG@PDA纳米颗粒表面出现较多的矿化物沉积。Cu-MBG@PDA在矿化的初期,SBF溶液中富含Ca2+和PO43-,在纳米颗粒的羟基或羧基作用下沉积在相应位点形成微小晶核,并促成矿化物的进一步沉积。在Cu-MBG@PDA纳米颗粒相互靠近的部位有更多的成核位点,可以进一步沉积为较大的矿化物,与Olszta等[21]提出的理论吻合。从图4(b)和图4(e)看出,当矿化时间延长到7 d时,Cu-MBG@PDA表面形成了片状或者针状羟基磷灰石矿化物,羟基磷灰石和Cu-MBG@PDA并没有相互分离,形成了一个理想的界面,对保持机械完整性至关重要。图4(c)和图4(f)表明,当矿化时间延长到28 d时,Cu-MBG纳米颗粒表面才基本被矿化物包裹,而Cu-MBG@PDA纳米颗粒表面的矿化物已经团聚成簇分布。因此Cu-MBG纳米颗粒表面涂覆PDA之后,能极大提高其生物活性,为其在骨组织工程中的应用提供新思路。
Cu-MBG和Cu-MBG@PDA在SBF中浸泡不同天数的EDS图如图5所示。由图5可知,与Cu-MBG相比之下,Cu-MBG@PDA的Ca和P的衍射峰随着浸泡天数的增加的速度较快,与Cu-MBG相比,Cu-MBG@PDA具有较好的矿化能力。通过EDS测试,将所得钙磷元素的原子含量相除,得到矿化物的钙磷比(Ca/P)。根据Cu-MBG@PDA的EDS分析,在SBF浸泡28 d后,矿化物的钙磷比(Ca/P为1.67,与羟基磷灰石的Ca/P比相一致[22],可以判断矿化物为羟基磷灰石。因此,Cu-MBG表面涂覆PDA之后,可以增加在其表面的Ca2+和PO43-积累,提高Cu-MBG@PDA生成羟基磷灰石的能力。
浸泡SBF后Cu-MBG@D的XRD图谱如图6所示。从图6可以看出,Cu-MBG@PDA样品在基底物Cu-MBG的基础上出现了羟基磷灰石晶体的特征衍射峰,2θ为25.5°、32.80°、40.27°和49.58°的特征衍射峰分别对应羟基磷灰石(002)、(300)、(200)和(213)晶面;Cu-MBG和Cu-MBG@PDA在SBF中浸泡1 d后,都在(002)、(300)晶面上出現羟基磷灰石晶体特征峰,依然能检测出来。Cu-MBG和Cu-MBG@PDA在SBF中浸泡7 d后,在(002)、(300)晶面的基础上出现(200)和(213)晶面的特征衍射峰,样品中羟基磷灰石晶体峰强变高;Cu-MBG和Cu-MBG@PDA在SBF中浸泡28 d后,样品中羟基磷灰石特征衍射峰强度最高,并且峰型尖锐。这是因为随着样品在SBF中浸泡时间变长,羟基磷灰石晶体在样品表面形成量增多,结晶性提高;羟基磷灰石晶体的特征衍射峰强度随着浸泡时间的变化,羟基磷灰石晶体的特征衍射峰越尖锐,呈现明显的规律性。Cu-MBG@PDA样品的羟基磷灰石晶体的特征衍射峰微高于Cu-MBG的特征衍射峰,表明样品Cu-MBG@PDA表面沉积的羟基磷灰石晶体含量相对较高。以上结果说明:经PDA涂覆后,Cu-MBG@PDA的羟基磷灰石的形成能力显著增强。
2.3 抗菌性能
采用平板涂布法探究PDA涂覆Cu-MBG前后的抗菌性能。将不同样品与S.aureus和E.coli孵育24 h,平板涂布照片如图7和图8所示。从图7和图8的中可以看出:同空白组对照,PDA、Cu-MBG和Cu-MBG@PDA平板上的细菌数量逐渐减少;说明PDA、Cu-MBG和Cu-MBG@PDA三者都有一定程度的抗菌性能,且抗菌能力由弱到强分别为PDA、Cu-MBG、Cu-MBG@PDA。以上结果表明Cu-MBG@PDA纳米颗粒更能有效地抑制S.aureus和E.coli生长。
不同样品所对S.aureus和E.coli生长抑制率如图9所示。由图9可知,与空白组对比,PDA对S.aureus和E.coli抑菌率分别为70.64%和62.52%,说明PDA具有抗菌性能;通过研究发现,PDA的抗菌机理有两方面:一方面,由于PDA的高黏附性能使得PDA容易黏附在细菌表面,形成一种屏障作用,降低了细菌的渗透性,限制了细菌的生长空间;随着时间的增长,细菌无法生长和增殖,从而达到抑制细菌生长甚至杀死细菌的作用[23];另一方面,PDA的抗菌性能归因于PDA中的胺基和羟基基团,它们能降低细菌细胞膜的渗透性,同时会使细胞膜丧失完整性,从而导致细菌死亡[24-25]。Cu-MBG纳米颗粒对S.aureus和E.coli抑菌率分别为85.13%和78.96%,说明Cu-MBG也有良好的抗菌效果;这是因为是Cu-MBG纳米颗粒中的铜离子释放产生毒性杀死细菌,导致S.aureus和E.coli死亡。当Cu-MBG纳米颗粒表面涂覆PDA之后,Cu-MBG@PDA纳米颗粒对S.aureus和E.coli抑制率都能达到99%,说明Cu-MBG@PDA可以基本杀死细菌。
3 结 论
本文以Cu-MBG为基底,在Cu-MBG表面进行PDA涂层,成功制备了Cu-MBG@PDA生物材料;考察了经过PDA涂覆前后的Cu-MBG纳米颗粒的形貌、结构、光谱性能、亲水性能、生物活性及抗菌效果,主要结论如下:
a)PDA涂覆后Cu-MBG@PDA纳米颗粒的亲水性明显提高,PDA含有(—OH)、氨基(N—H)等亲水基团,PDA涂层改性显著提高Cu-MBG@PDA表面的亲水性。
b)PDA涂覆后Cu-MBG@PDA纳米颗粒具有更好的生物活性,Cu-MBG表面涂覆PDA之后,可以增加在其表面积累Ca2+和PO43-,促进羟基磷灰石的形成。
c)Cu-MBG纳米颗粒表面涂覆PDA之后,Cu-MBG@PDA纳米颗粒对S. aureus和E. coli抑制率高达99%以上,证明Cu-MBG@PDA具有更优异的抗菌性能。
本文制备的Cu-MBG@PDA纳米颗粒表现出较好亲水性、生物活性和抗菌性能,在骨组织缺损及修复治疗方面具有潜在应用价值。
参考文献:
[1]Birt M C, Anderson D W, Bruce T E, et al. Osteomyelitis: Recent advances in pathophysiology and therapeutic strategies[J]. Journal of Orthopaedics, 2016, 14(1): 45-52.
[2]Kremers H M, Nwojo M E, Ransom J E, et al. Trends in the epidemiology of osteomyelitis: A population-based study, 1969 to 2009[J]. The Journal of Bone and Joint Surgery: American Volume, 2015, 97(10):837-845.
[3]Fritz J M, McDonald J R. Osteomyelitis: Approach to diagnosis and treatment[J]. Physician and Sportsmedicine, 2008, 36(1):50-54.
[4]Koons G L, Diba M N, Mikos A G. Materials design for bone-tissue engineering[J]. Nature Reviews Materials, 2020, 5(8): 584-603.
[5]Ghanaati S, Barbeck M, Orth C, et al. Influence of β-tricalcium phosphate granule size and morphology on tissue reaction in vivo[J]. Acta Biomaterialia, 2010, 6(12): 4476-4487.
[6]Zhu H, Zheng K, Boccaccini A R. Multi-functional silica-based mesoporous materials for simultaneous delivery of biologically active ions and therapeutic biomolecules[J]. Acta Biomaterialia, 2021, 129: 1-17.
[7]Hoppe A, Güldal N S, Boccaccini A R. A review of the biological response to ionic dissolution products from bioactive glasses and glass-ceramics[J]. Biomaterials, 2011, 32(11): 2757-2774.
[8]Madhurakkat P S K, Lee J K, Lee Y B, et al. Materials from mussel-inspired chemistry for cell and tissue engineering applications[J]. Biomacromolecules, 2015, 16(9): 2541-2555.
[9]Taskin M B, Xu R D, Gregersen H, et al. Three-dimensional polydopamine functionalized coiled microfibrous scaffolds enhance human mesenchymal stem cells colonization and mild myofibroblastic differentiation[J]. ACS Applied Materials & Interfaces, 2016, 8(25): 15864-15873.
[10]Jia L L, Han F X, Wang H, et al. Polydopamine-assisted surface modification for orthopaedic implants[J]. Journal of Orthopaedic Translation, 2019, 17(7): 82-95.
[11]Lee H, Dellatore S M, Miller W M, et al. Mussel-inspired surface chemistry for multifunctional coatings[J]. Science, 2007 , 318(5849): 426-430.
[12]Liu Y L, Ai K L, Lu L H. Polydopamine and its derivative materials: synthesis and promising applications in energy, environmental, and biomedical fields[J]. Chemical Reviews, 2014, 114(9): 5057-5115.
[13]Ryu J H, Messersmith P B, Lee H. Polydopamine surface chemistry: A decade of discovery[J]. ACS Applied Materials & Interfaces, 2018, 10(9): 7523-7540.
[14]Wu C, Zhou Y, Xu M, et al. Copper-containing mesoporous bioactive glass scaffolds with multifunctional properties of angiogenesis capacity, osteostimulation and antibacterial activity[J]. Biomaterials, 2013, 34(2): 422-433.
[15]Wardani A K, Ariono D, Wenten I G, et al. Hydrophilic modification of polypropylene ultrafiltration membrane by air-assisted polydopamine coating[J]. Polymers for Advanced Technologies, 2019, 30(4): 1148-1155.
[16]Yang W F, Zhang X Z, Wu K K, et al. Improving cytoactive of endothelial cell by introducing fibronectin to the surface of poly L-Lactic acid fiber mats via dopamine[J]. Materials Science and Engineering: C, 2016, 69: 373-379.
[17]Jo S, Kang S M, Park S A, et al. Enhanced adhesion of preosteoblasts inside 3D PCL scaffolds by polydopamine coating and mineralization[J]. Macromolecular Bioscience, 2013, 13(10): 1389-1395.
[18]Su L, Yu Y, Zhao Y S, et al. Strong antibacterial polydopamine coatings prepared by a shaking-assisted method[J]. Scientific Reports, 2016, 6: 24420.
[19]Zhong S, Luo R F, Wang X, et al. Effects of polydopamine functionalized titanium dioxide nanotubes on endothelial cell and smooth muscle cell[J]. Colloids and Surfaces B: Biointerfaces, 2014, 116: 553-560.
[20]Barrère F, Van der Valk C M, Meijer G, et al. Osteointegration of biomimetic apatite coating applied onto dense and porous metal implants in femurs of goats[J]. Journal of Biomedical Materials Research: Part B: Applied Biomaterials, 2003, 67B(1): 655-665.
[21]Olszta M J, Cheng X, Jee S S, et al. Bone structure and formation: A new perspective[J]. Materials Science and Engineering: R: Reports, 2007, 58(3/4/5): 77-116.
[22]Zhao J, Zhao Y P, Zhang W, et al. Preparation and mineralization of PLGA/Gt electrospun fiber mats[J]. Chinese Science Bulletin, 2009, 54(8): 1328-1333.
[23]Zafar I, Edward P C L, Tyler J A, et al. Antimicrobial effect of polydopamine coating on Escherichia coli[J]. Journal of Materials Chemistry, 2012, 22(40): 21608-21612.
[24]Karkhanechi H, Takagi R, Matsuyama H. Biofouling resistance of reverse osmosis membrane modified with polydopamine[J]. Desalination, 2014, 336: 87-96.
[25]Patel K, Singh N, Yadav J, et al. Polydopamine films change their physicochemical and antimicrobial properties with a change in reaction conditions[J]. Physical Chemistry Chemical Physics: PCCP, 2018, 20(8): 5744-5755.
(責任编辑:廖乾生)
收稿日期: 2022-12-13 网络出版日期:2023-03-01网络出版日期
基金项目: 国家自然科学基金项目(31900964)
作者简介: 贺 蓉(1997- ),女,山西临汾人,硕士研究生,主要从事生物纳米材料方面的研究。
通信作者: 刘 涛,E-mail:39851007@qq.com

