陆地棉MGDG基因家族低磷胁迫下的表达分析
孟超敏,卿桂霞,耿翡翡,张富厚,李雪林
(河南科技大学农学院/河南省旱地作物种质资源利用工程研究中心,河南洛阳 471000)
单半乳糖甘油二酯(monogalactosyl diacylglycerol,MGDG)和双半乳糖甘油二酯(digalactosyt diacylglycerol,DGDG)是高等植物光合膜中最主要的半乳糖脂,分别约占叶绿体脂质的50%和20%,在叶绿体的类囊体膜中形成必不可少的基质,参与光合作用的光化学反应和电子传递反应[1-2]。此外,MGDG和DGDG在质体外膜上被发现,包括质膜、液泡膜、内质网和高尔基体,说明其在高等植物中不具有光合作用[3-4]。单乳糖基二酰基甘油(monolactosyl diacylglycerol,MGDG)是造粉体膜的主要糖脂,约占总糖脂的50%。MGDG生物合成的最后一步发生在包膜内,其中MGDG合酶催化二酰基甘油脂(DAG)汞IUDP一半乳糖(UDP—Gal)生成MGDG和UDP[5-6]。根据MGDG合成酶的酶学和生理特性,MGDG合成酶可分为A型(MGDl)和B型(MGD2和MGD3)。A型(MGDl)位于质体内膜,B型(MGD2和MGD3)位于外膜。MGDl在所有植物组织中均有表达,特别是在光合组织中。而MGD2和MGD3主要在非光合组织中表达[7-8]。
MGDG不仅是光合膜的重要组分,而且对逆境胁迫具有调节作用。当植物遭到逆境胁迫时,会通过MGDG含量和脂肪酸组成的变化来适应环境,而这些变化有助于维持和恢复膜的稳定性和完整性,从而增加植物的胁迫耐受性[9]。在低磷胁迫下,膜中的磷脂含量降低,为了维持膜的完整性,会促进MGDG向DGGD的转化,增加膜中的DGDG来替代缺失的磷脂[10]。低磷条件下,拟南芥中AtMGD1的表达量并未发生显著显著变化,而AtMGD2和AtMGD3的表达量显著上升,这表明低磷条件可以诱导激活type B型MGD的表达[8]。当膜脂成分中的磷脂含量降低时,会引起叶绿体中DGDG合成量增加,并转移至线粒体膜[11]、质膜[12]和液泡膜[13]。在低磷胁迫下,type B型MGD2-3通过真核型途径合成了更多的MGDG,而这些MGDG又被用于DGGD的合成,并运往非质体膜上,进一步改变植物体的膜脂组分,以此适应低磷环境[14]。以上研究结果表明,MGDG基因在低磷胁迫中起着重要的作用。
棉花是全球重要的经济作物之一,而缺磷是作物生产力损失的主要原因之一。本研究基于前期棉花根部低磷胁迫基因表达谱分析结果,对候选陆地棉耐磷相关GhMGD基因家族进行生物信息分析,同时利用qRT-PCR技术对GhMGD基因在低磷胁迫下的表达模式进行分析,以解析MGDG家族基因在棉花中的进化及响应低磷胁迫应答的能力。
1 材料和方法
1.1 试验材料及处理
选取自交留种中籽粒饱满的‘新陆早19’种子,用70%酒精杀菌30 min,冲洗干净后泡种24 h至棉花露白,分别播种于室内培养箱沙土中和河南科技大学农学院试验田。在试验田棉花花铃期取根、茎、叶、花等4个组织迅速放入液氮中备用。将棉花种子播种于含干净湿润细沙的塑料盆内,28 ℃恒温培养箱(光照14 h、黑暗10 h)培养至棉苗三叶期,选择长势良好且一致的幼苗移至水培盆中,用1/2 Hoagland 营养液培养1周后分为2个处理水平,即适磷处理(SP,1.0 mmol/L)和低磷处理(LP,0.01 mmol/L),磷源采用KH2PO4,为保证K+浓度一致,以1.0 mmol/L为标准,低磷营养液中以KCl补齐K+,其他营养成分含有2 mmol/L Ca(NO3)2·4H2O、2.5 mmol/L KNO3、0.5 mmol/L NH4NO3、1.4 mmol/L MgSO4·7H2O、1×10-3mmol/L ZnSO4·7H2O、1×10-3mmol/L MnSO4·H2O、0.1×10-3mmol/L CuSO4·5H2O、0.01 mmol/L H3BO3、0.05×10-4mmol/L (NH4)6Mo7O24·4H2O、0.1 mmol/L EDTA-FeNa[15]。分别处理0,4,12,24,72 h后,选取3株生长一致的棉花植株,并混合取其根部组织,然后迅速置于液氮中,-80 ℃保存备用。每日调节营养液pH,使其保持在6.5左右,每3 d更换1次营养液。
1.2 方 法
1.2.1 陆地棉MGDG基因家族成员鉴定及序列分析从棉花数据库(http://www.cottongen.org)和生物学数据库NCBI(http://www.ncbi.nlm. nih.gov/Blast)中检索提取出所有基因的CDS序列文件。使用Pfam数据库下载MGDG保守结构域的隐马尔可夫模型文件(PF06925)。通过HMM model在基因组文件中搜寻候选基因家族成员蛋白序列。从Swiss-Prot数据资源库中分别下载拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)MGDG的基因家族成员,双向Blast比对获取的陆地棉MGDG基因家族成员进一步确认,查看基本特征。
将预测的蛋白序列在Pfam数据库、CD-Search、InterPro数据库中进行MGDG蛋白保守结构域的检查。使用ExPASy对基因序列进行理化性质的分析,等电点的确定对于纯化方面有较大的帮助。通过CELLO v.2.5对蛋白进行亚细胞定位预测。利用TBtools从陆地棉的基因组注释文件中提取MGDG家族基因的基因结构进行可视化分析。
1.2.2 基因家族成员的进化分析使用MEGA5.0对家族成员蛋白进行多序列比对后在Jalview进行可视化。用MEGA5.0筛选出最优的模型,采用ML(最大似然法)构建系统进化树。使用MEME-Submission form基于Motif分析成员序列保守特性。利用NCBI数据库中的Batch CD-Search基于domain分析成员结构域的保守性。
1.2.3 染色体定位利用TBtools从陆地棉的基因组注释文件中提取MGDG家族基因的染色体位置信息并绘制染色体图谱。
1.2.4 蛋白质结构预测分析在SOPMA网站预测该基因家族成员的蛋白质二级结构。
1.2.5 总RNA提取及cDNA合成按照天根RNAprep Pure多糖多酚植物总RNA提取试剂盒说明书提取棉株总RNA,然后利用超微量分光光度计测定RNA浓度,并用1%琼脂糖凝胶电泳检测其
完整性。若RNA的质量符合要求,则根据HiScript®Ⅱ 1st Strand cDNA Synthesis Kit cDNA第一链合成试剂盒说明书将所提取的总RNA反转录合成cDNA第一链,用于后续实验。
1.2.6 实时荧光定量PCR使用Primer 5.0软件,根据基因的CDS序列设计特异引物,GhActin作为内参基因(表1),由生工生物工程股份有限公司

表1 陆地棉MGDG基因家族实时荧光定量引物
(上海)合成。反应体系按照SYBR®Green Premix Pro Taq HS qPCR Kit试剂盒说明配制,使用荧光定量PCR仪型号为CFX96,采用2-ΔΔCT计算目的基因相对表达量,利用Origin 9.0对数据进行统计分析并作图。
2 结果与分析
2.1 陆地棉MGDG基因家族鉴定及其序列特征分析
通过hmmsearch搜素和数据验证,在陆地棉基因组中共鉴定出17个MGDG基因家族成员GhMGD1~GhMGD17(表2),17个MGDG基因家族成员编码的氨基酸数量在435~888之间,其中GhMGD15所编码的蛋白序列最短,GhMGD16所编码的蛋白序列最长。等电点分布在6.00~9.67之间,仅有GhMGD12与GhMGD15的等电点小于7,其中绝大多数均为碱性蛋白。相对分子质量介于48 612.78~99 187.20 Da之间,变化相对较大。亚细胞定位预测结果表明,陆地棉基因编码蛋白位于线粒体、细胞质、叶绿体和细胞膜等细胞结构。MGDG基因序列基因结构分析结果如图1,各家族成员均含有多个内含子与外显子。该基因家族的各家族成员的外显子数目分布在7~9之间,内含子的数目分布在6~8之间,其中仅GhMGD9含有7个外显子,其次有GhMGD14和GhMGD16含有9个外显子,其余的14个MGDG成员均含有8个外显子。

图1 陆地棉MGDG基因家族结构分析Fig. 1 Structure analysis of MGDG gene family in G.hirsutum L.
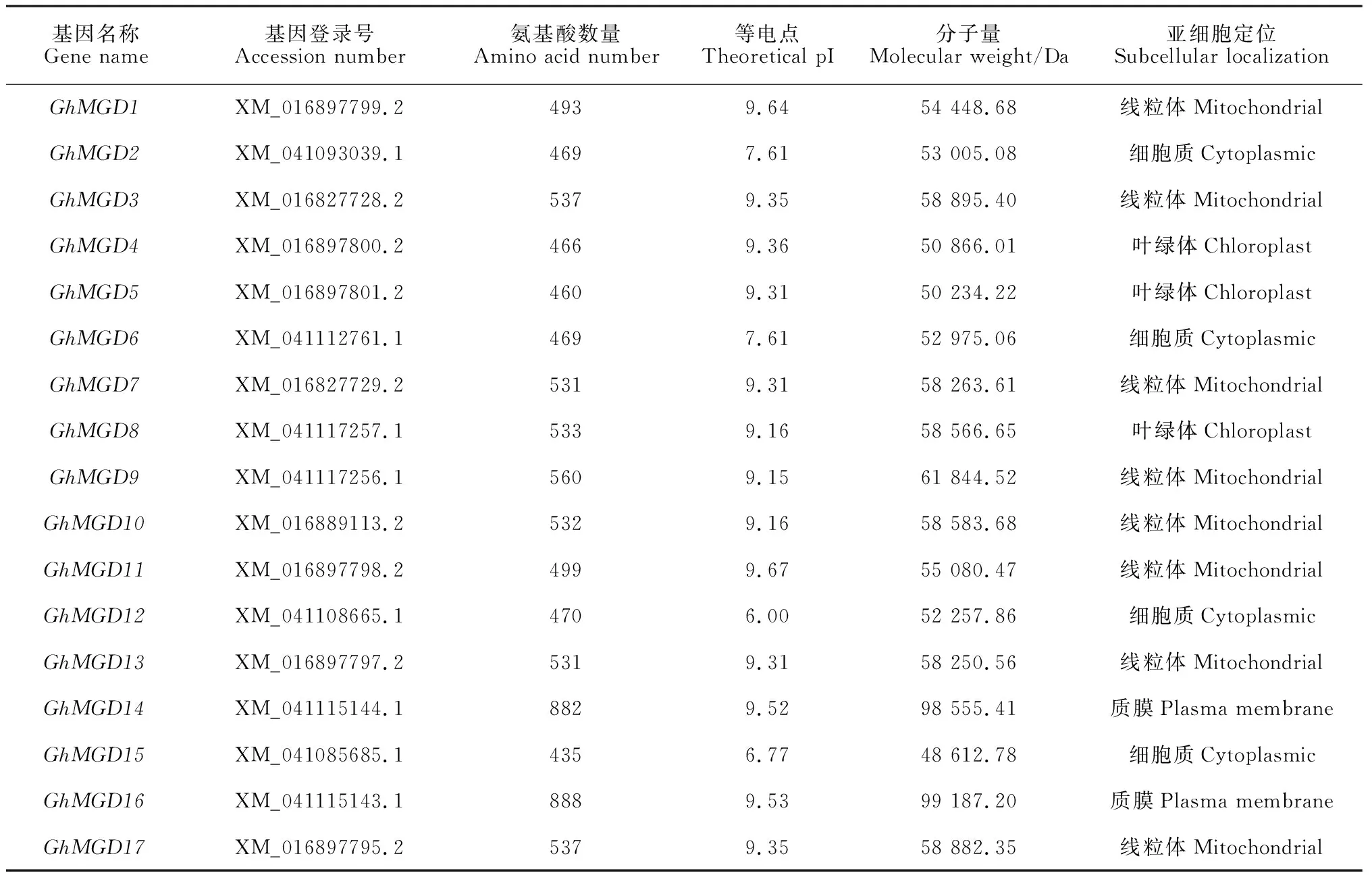
表2 陆地棉MGDG基因家族信息
2.2 陆地棉MGDG基因家族系统进化分析
由图2可知,陆地棉MGDG基因家族的17个成员被划分为两大分支。
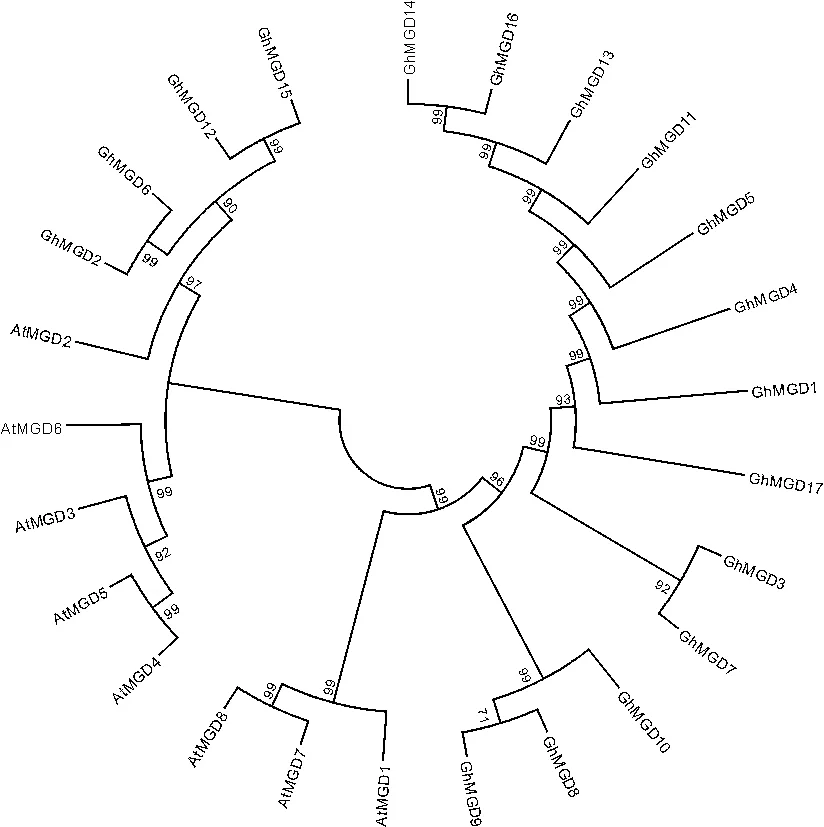
At.拟南芥;Gh.陆地棉。图2 陆地棉MGDG基因家族的系统进化树At. Arabidopsis thaliana; Gh. Gossypium hirsutum.Fig.2 Phylogenetic analysis of MGDG gene family in G. hirsutum L.
其中GhMGD2、GhMGD6、GhMGD12、GhMGD15 4个陆地棉MGDG蛋白成员与拟南芥AtMGD2、AtMGD3、AtMGD4、AtMGD5、AtMGD6同属于B型MGDG合成酶。
另一个分支中GhMGD8、GhMGD9、GhMGD10、GhMGD3、GhMGD7、GhMGD1、GhMGD4、GhMGD5、GhMGD11、GhMGD13、GhMGD14、GhMGD16、GhMGD17和拟南芥AtMGD1、AtMGD7、AtMGD8亲缘关系较近,属于A型MGDG合成酶。
对陆地棉MGDG基因家族成员进行蛋白的保守基序分析和蛋白保守结构域的分析可知(图3),大部分家族成员都具有相似的motif。

图3 陆地棉MGDG基因家族的保守基序和保守结构域的分析Fig.3 Conserved motif and domain analysis of MGDG gene family in G. hirsutum L.
在陆地棉MGDG基因家族中一共鉴定出了10个motif(motif代表一段特定的氨基酸序列,即表示氨基酸位置),各亚族之间的motif的数量和分布基本一致。
蛋白保守结构域的分析表明17个家族成员均包含MGDG保守结构域,除GhMGD14和GhMGD16含有2个其他类型的保守结构域之外的15个成员都仅含有一个MGDG保守结构域。
2.3 陆地棉MGDG基因家族染色体定位
对陆地棉MGDG基因家族成员进行染色体定位(图4),陆地棉MGDG基因家族17个成员分布于A05、A06、A07、A13、D05、D06、D07、D13共7条染色体上,其中A亚组共有12个GhMGD基因,D亚组共有5个基因。
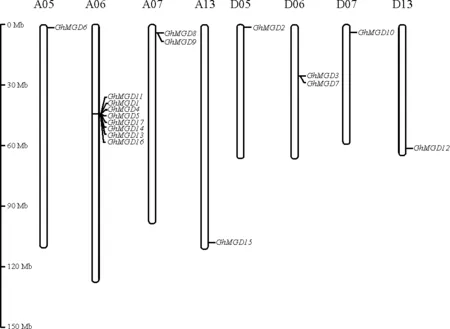
图4 陆地棉MGDG基因家族的染色体定位Fig.4 Chromosomal localization of MGDG gene family in G.hirsutum L.
染色体A05、A13、D05、D07和D13分别含有GhMGD6、GhMGD15、GhMGD2、GhMGD10、GhMGD12,而GhMGD8和GhMGD9主要分布于A07染色体上,GhMGD3和GhMGD7主要分布于D06染色体上,A06染色体上共有8个成员,这8个成员表现为成簇分布,较为集中。
2.4 陆地棉MGDG基因家族蛋白质结构预测
陆地棉MGDG基因家族成员的蛋白质二级结构呈现出基本相似的结果(表3),MGDG基因家族17个家族成员全部都表现出α-螺旋和无规则卷曲所占比例最大,其次是延伸链,β-转角所占比例最少。

表3 陆地棉MGDG家族蛋白质二级结构预测结果
每个亚族的表现也更为相似,如GhMGD2、GhMGD6、GhMGD12、GhMGD15同属一个亚族,均表现出α-螺旋所占比例大于无规则卷曲。
2.5 陆地棉MGDG基因家族表达特性分析
以棉花的GhActin为内参基因,利用qRT-PCR技术检测陆地棉MGDG基因家族中6个代表性的基因在根、茎、叶和花等4个组织中的表达情况。6个MGDG基因家族成员在不同组织中均有表达,但相对表达量各不相同(图5)。
其中GhMGD9和GhMGD10在叶片中的表达量最高,其次是根。
GhMGD2和GhMGD12在根中的表达量最高,而在叶中几乎不表达。GhMGD7基因在根中的表达量略低于叶,在花中表达量最低。和GhMGD16在根和叶中的表达量最高,在茎和花中的表达量最低。
对陆地棉幼苗进行低磷胁迫,以处理不同时间的陆地棉根部组织为材料进行qRT-PCR分析MGDG基因表达情况。
如图6所示,GhMGD2和GhMGD7基因在受到低磷胁迫的刺激下,能够持续性响应低磷胁迫,GhMGD2基因在低磷胁迫4~72 h其表达量均比适磷条件下高,且在72 h表达量约是对照组的72倍;GhMGD7基因在低磷胁迫4~72 h其表达量均比适磷条件下高,且在72 h表达量约是对照组的67.2倍。GhMGD9基因在低磷处理4~24 h时其趋势为逐渐下降,但表达量均比正常情况下高,在72 h时其表达量又上升,仅比4 h时表达量略低;GhMGD10基因在低磷处理4~24 h时其趋势为逐渐下降,但表达量均比正常情况下高,在72 h时其表达量又上升,达到最高表达量。从GhMGD9和GhMGD10基因的表达趋势看,该基因在受到低磷胁迫的刺激后,立即会对低磷胁迫做出应答,且具有持续性。GhMGD12基因在低磷胁迫0~4 h的表达量均比适磷条件下低,在12 h虽比适磷条件下略高,但在24 h时表达量下调,低于适磷条件下的表达量,然而,在低磷胁迫72 h时表达量达到最高值,是适磷条件下表达量的1.9倍,说明该基因低磷胁迫下虽不稳定表达,但对低磷刺激有应答反应。GhMGD16基因在低磷处理4 h时达到最大值,在4~24 h这个时间段该基因呈现表达量逐渐下调的趋势,且低磷胁迫下的表达量在12,24 h时都比适磷条件下低,但在72 h该基因表达上调,且在低磷胁迫下的表达量高于适磷处理的表达量,说明该基因能够响应低磷胁迫。
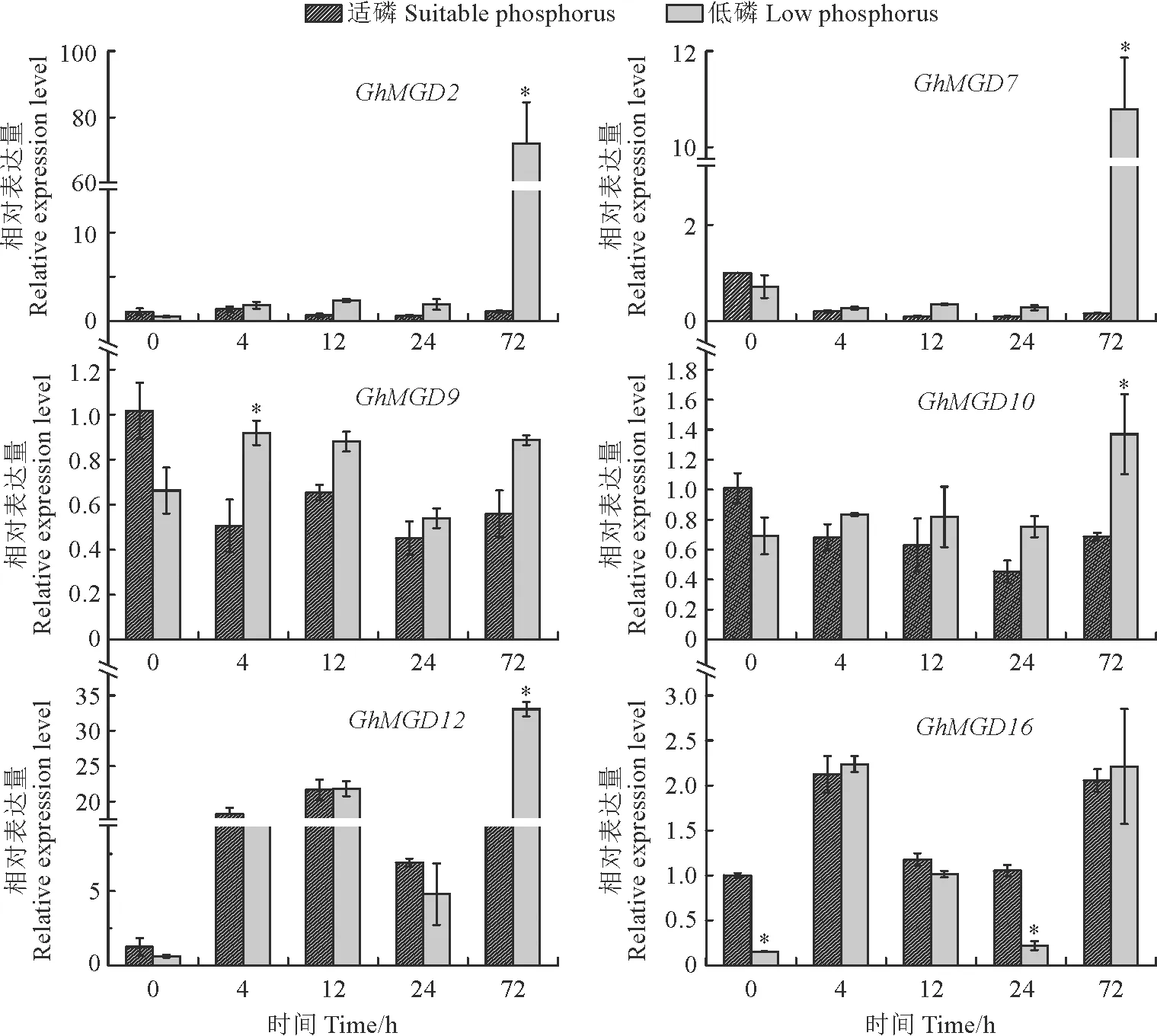
*表示与对照相比存在显著差异(P<0.05)。图6 陆地棉MGDG基因在根部低磷胁迫不同时间的表达模式* are significant difference in different tissues and low phosphorus stress at 0.05 level.Fig.6 The relative expression analysis of MGDG gene in roots of G. hirsutum L. different time points with low phosphorus treatment
3 讨 论
磷素是核酸的重要组成成分之一,在植物体内的新陈代谢中起着关键性的作用,低磷胁迫不利于作物生长发育[16]。大部分脂质由MGDG和DGDG组成,它们占总脂质的80%。单半乳糖基二酰基甘油是生物活动以及光合活性所需的主要和必需的植物脂质,这需要富含半乳糖脂的环境。MGDG也是二半乳糖基二酰基甘油(DGDG)的关键前体,它在磷酸盐胁迫下转移到质体膜外。大部分MGDG是由位于质体膜上的MGDG合酶合成的[17]。因此,MGDG的合成对植物至关重要。而在植物体内合成的磷脂的含量会受到磷素利用率的影响发生改变,在低磷胁迫下,磷脂含量会产生明显地下降,进而影响细胞膜的稳定性[18]。
虽然MGDG是高等植物中最多的糖脂,但因为细胞中MGD的含量却非常低,因此想要分离并得到MGD的序列是较为困难的。目前对棉花中MGDG基因在全基因组水平的鉴定和分析仍未见报道。棉花属于异源多倍体,基因组庞大而复杂,高质量版本的基因组成为提升基因家族分析准确性的必要条件。本研究利用最新的棉花基因组数据库,通过生物信息学的方法在陆地棉中鉴定了17个具有MGDG结构域的GhMGD基因。与拟南芥[8]和水稻[19]等植物相比,陆地棉MGDG基因数目明显较多,推测陆地棉单半乳糖甘油二酯家族成员分化可能早于拟南芥、水稻的物种分化。MGDG家族分成了两种不同的MGD类型:Type A MGD家族(AtMGD1)和type B MGD家族(AtMGD2和AtMGD3)[8]。由图2系统进化树分析可知陆地棉MGDG基因家族的17个成员同样被划分为两大亚族,但每个亚族中的单半乳糖甘油二酯蛋白数量多于拟南芥,由此推测陆地棉中单半乳糖甘油二酯蛋白家族基因可能发生了物种特异性扩增[20]。
蛋白质处于特定的亚细胞位置上才能有效发挥其功能,因此了解亚细胞定位对研究蛋白质功能具有一定的帮助,本研究亚细胞定位分布位置较多,包括线粒体、细胞质、叶绿体和细胞膜等细胞结构,这可能与基因功能分化的多样性有关。通过保守基序和功能结构域分析发现,陆地棉GhMGD基因结构相似且都包含MGDG保守结构域,亚族中的motif的数量和分布几乎相同,亚族间有一定差异,这可能和功能的发挥有至关重要的联系。染色体定位发现17个基因中,12个基因分布于A基因组,5个基因分布于D基因组,其中有8个基因成簇分布于A基因组的一条染色体上,基因数量的不同以及成簇的分布可能于植物在进化过程中发生的基因复制、基因组重排、基因丢失等有关系,对此有待进一步研究[21]。
用实时荧光定量PCR技术分析陆地棉MGDG基因组织表达特异性和低磷胁迫下的抗性,各个MGDG基因在陆地棉根、茎、叶和花4个不同组织中表达量的差异,表明MGDG基因家族在棉花中可能功能分化有所不同。分析的6个GhMGD基因在根部具有不同程度的表达,其中GhMGD2、GhMGD12和GhMGD16在根部的表达量均最高。根部低磷胁迫相对表达量分析表明,这6个GhMGD基因均能响应低磷胁迫,其中GhMGD2基因在低磷胁迫72 h表达量约是适磷处理的72倍。在低磷环境胁迫下,植物会在分子机制、生理生化和形态结构等多环节的调整来增加自身的适应性,而根系作为植物吸收矿质元素的主要器官对植物适应磷饥饿具有重要作用[22-23]。GhMGD基因会持续性地对低磷胁迫作出应答,表明其在棉花磷素信号调控中起到一定的作用。
综上所述,本研究从陆地棉基因组数据库中共获得17个GhMGD基因,首先进行生物学分析,然后利用实时荧光定量技术进行分析,陆地棉MGDG家族GhMGD2、GhMGD7、GhMGD9、GhMGD10、GhMGD12和GhMGD16基因对低磷胁迫均有不同程度的响应。本试验为进一步研究陆地棉MGDG基因家族在低磷胁迫下的功能鉴定提供了一定理论依据。

