酸性矿山废水S(-II)对含铬和钼施氏矿物溶解与相转变的影响
郑妍婷,谢莹莹,赖鹤鋆,陈柔君,唐柳玲
(韩山师范学院 化学与环境工程学院,广东 潮州 521041)
施氏矿物是指在酸性矿山废水(Acid Mine Drainage,AMD)环境下,黄铁矿(FeS2)和磁黄铁矿(Fe1-xS)[1]风化、氧化产生的Fe2+、Fe3+和SO42-[2]通过Acidithiobacillus ferrooxidans细胞作用反应生成的不定型沉积矿物[3]。施氏矿物属于羟基硫酸盐铁矿物[3],典型的化学式为Fe8O8(OH)8-2x(SO4)x(1≤x≤1.75)[4],结晶度较差[5],且具有较大的比表面积和大量的表面羟基。因此,具有通过吸附或共沉淀作用富集重金属的能力[6],能使AMD 中有毒有害金属元素产生自然钝化现象,从而影响矿区重金属的迁移转化。对此,学者们开展了关于施氏矿物作为吸附材料处理重金属等污染水体的诸多研究[2,7]。但施氏矿物的稳定性容易受环境pH 值、重金属初始浓度、环境温度和共存离子等因素影响[8-9]。比如,当环境酸碱度发生变化时,施氏矿物会随之发生一定的相转变[10]。高美娟等[11]研究发现,不同酸碱环境条件下,含砷施氏矿物在反应一段时间后向更稳定的针铁矿产生相转化,尤其是在酸性条件下(pH 值为2~6)。但是,金属离子的存在会延迟施氏矿物的溶解相转变,如李君菲等[12]发现,Cu(II)均能有效抑制施氏矿物的老化。因此,施氏矿物成为学者们研究酸性矿山废水中有毒有害重金属钝化的重要媒介。
铬和钼是AMD 环境中常见的重金属,其中铬是美国超级基金中优先控制的前20 种有毒物质之一[13]。铬在环境中的主要存在形式有三价铬和六价铬,其中六价铬主要以CrO42-、HCrO4-等形态存在[14],在溶液中溶解度大,活性及迁移性较强。六价铬对生物体具有高毒性,在人和动物中具有诱变和致癌作用,若大剂量摄入六价铬可致动物和人死亡,大鼠口服毒性的LD50为50~100 mg/kg[15-16]。Chen 等[17]研究发现,在广东省大宝山AMD 沉积物中Cr 含量高达147.86 mg/kg。而在钼矿及综合性矿山的开采和冶炼过程中,金属Mo 也会产生污染。文献[18]所报道的矿山周围河流水体中Mo 浓度高达13 900 μg/L,且钼对人与动物具有吸入毒性,易导致生殖细胞及性机能损失,甚至癌变[19-20]。已有研究表明,施氏矿物形成过程中能够吸附或共沉淀铬和钼[2,12],但环境条件改变时吸附及共沉淀后的铬和钼存在被再次释放的风险。
在金属硫化物矿区中存在大量的氧化还原物质,如溶解性有机质(Dissolved Organic Matter,DOM)、Fe(II)和S(-II)等,目前已有很多学者研究了DOM 和Fe(II)对施氏矿物稳定性的影响及对重金属迁移转化的制约作用[3,21-22]。AMD 环境中的S(-II)来源于金属硫化物在O2和Fe3+的化学作用或者硫氧化细菌等的生物作用中产生的中间产物,而施氏矿物形成于高铁、高硫酸根浓度的极端酸性环境下。S2-通过化学还原铁矿物结构中的Fe3+而发生溶解,产生相转变。已有研究报道了S(-II)会引起铁矿物的溶解,如Zhang 等[22]研究发现,所加入的S(-II)加速了含As 施氏矿物的溶解,导致了As 的释放,而释放的As 会再次吸附到产物针铁矿和磁铁矿表面;其次,S(-II)与Fe(III)的氧化还原产物Fe(II)会再次催化矿物的溶解。但是,目前未见采用流动柱法探究S(-II)作用下负载铬和钼的施氏矿物溶解和相转变的相关研究报道。
笔者以负载不同含量铬、钼的施氏矿物为研究对象,采用流动柱法探究S(-II)作用下施氏矿物的溶解和相转变。根据淋滤液中重金属和硫离子浓度的变化,模拟研究酸性矿山废水中负载重金属施氏矿物的环境稳定性,为利用施氏矿物解决环境污染问题的研究提供相关数据,同时,进一步了解施氏矿物作为吸附材料的可行性,并为金属硫化物矿区重金属的修复提供理论依据。
1 试验
1.1 试验试剂与仪器
主要试剂或药品:七水硫酸亚铁(FeSO4·7H2O)、钼酸钠(Na2MoO4)、硝酸(HNO3)均为分析纯,由天津大茂化学试剂厂提供。过氧化氢(H2O2,纯度≥30%)、铬酸钾(K2CrO4,纯度为99.5%)、硫化钠(Na2S,纯度为95%)分别由西陇科学股份有限公司、麦克林、阿拉丁提供。试验用水为去离子水。
主要仪器:摇床(BSD-WX3200,上海博迅)、离心机(TDZ5-WS,湖南湘仪)、电感耦合等离子体发射光谱仪(ICP,ICPE-9820,日本岛津)、X 射线衍射仪(XRD,Ultima VI,日本理学)、扫描电子显微镜(SEM,TESCAN MIRA4,捷克泰斯肯)、X 射线光电子能谱仪(XPS,Thermo Scientific K-Alpha,美国赛默飞)。
1.2 施氏矿物的合成
施氏矿物的合成采用双氧水氧化硫酸亚铁的方法[23-24],具体为:在3 个10 L 去离子水体系中各加入166 g 的FeSO4·7H2O 后,分 别滴加100 mL 30%的双氧水,并快速搅拌至溶解均匀,再分别加入一定量的重金属,使其在反应器中最后的浓度分别为0、1.5 mmol/L CrO42-和0.5 mmol/L MoO42-、2.25 mmol/L CrO42-和1.0 mmol/L MoO42-(Cr 和Mo 的添加量既要维持施氏矿物的原有结构特征[19,25-26],也要依据实际金属硫化物矿区河流或沉积物底泥中的含量[27-28]来确定),快速搅拌后静置24 h;之后,每隔一段时间将每个容器中的上清液弃掉,再重新加入蒸馏水,搅拌、静置,重复该步骤8 次及以上,至脱盐[29];最后,通过离心保留下层悬浮沉淀物质,做好标记并烘干,以备后续使用。最终得到纯施氏矿物(Sch)和两种负载不同含量铬和钼的施氏矿物0.1Mo0.06Cr-Sch和0.2Mo0.09Cr-Sch。
1.3 流动柱淋滤试验
如图1 所示,流动淋滤柱由内径为15 mm、高为100 mm 的有机玻璃树脂构成,并在淋滤柱最底部放置圆形纱布,再平铺一层粒径为2 mm 的石英砂,防止堵塞并起承载作用,再分别填入一定量的上述3 种施氏矿物,做好标记。同样地,再依次平铺放上纱布和石英砂,填充完成后将吊瓶、流动柱和接收瓶用橡胶管按顺序从上到下连接起来,同时确保流动柱在淋洗过程中处于垂直状态。根据Huang 等[30]和Zhang 等[22]关于S(-II)初始浓度对铁矿物稳定性影响的研究,采用20 mg/L 的Na2S 溶液从上往下进行淋滤,连续淋滤30 d(30 d 的试验周期有利于检测施氏矿物的相转变产物),每天的淋滤液量为30 mL;每天取样,采用0.45 μm 针式滤膜将淋滤液过滤后进行酸化预处理,置于4 ℃的冰箱中冷藏保存。
图1 流动柱填充示意图Fig.1 Schematic diagram of flow column filling
1.4 分析测定方法
离子的测定:液体样品中Fe、Mo、Cr 和S 离子的浓度使用电感耦合等离子体发射光谱仪测定,测定完毕后,使用Origin 绘图软件对数据进行整合,并绘制成相应的关系图。
固体样品的测定:对反应后的矿物样品进行烘干收集后,采用X 射线衍射法对其进行晶型结构分析,其中X 射线为Cu 靶Kα 射线(λ=0.154 18 nm),管电压为40 V,管电流为40 mA,扫描区域为10°~80°,扫描速度为2 (°)/min。另外,利用场发射扫描电镜分析反应后该固体的形态。利用X 射线光电子能谱对反应前后元素的价态进行测定,激发源为Al Kα 射线(hv=1 486.6 eV),工作电压为12 kV,灯丝电流为6 mA,全谱扫描通能为100 eV,步长为1 eV。
2 结果与讨论
2.1 合成矿物的化学组成
合成的3种矿物元素组成及化学式如表1所示,不含重金属的纯施氏矿物化学式为Fe8O8(OH)5.12(SO4)1.44,与文献[31]报道的铁硫比范围一致。两种负载铬和钼的施氏矿物化学式分别为Fe8O8(OH)5.22(SO4)1.39Mo0.1Cr0.06和Fe8O8(OH)5.26(SO4)1.37Mo0.2Cr0.09,可见,铬和钼的掺入使得SO42-含量减少,这是因为含氧阴离子与施氏矿物结构中的硫酸根产生类质同象而发生取代,因此,合成矿物负载的含氧阴离子与硫酸根含量成反比[32-34],且相比于钼酸根,铬酸根对施氏矿物更具亲和力,这与以往文献报道的研究结果一致[35-36]。
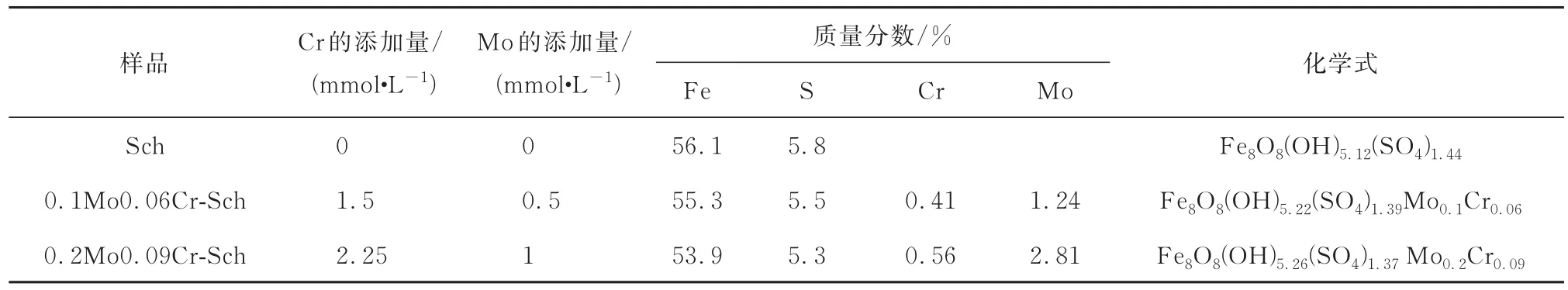
表1 合成矿物的化学组成Table 1 Chemical composition of the synthetic minerals
2.2 淋滤液中离子的浓度变化
2.2.1 淋滤液中总铁和总硫离子的浓度变化 3 种样品淋滤液中铁和硫离子浓度随淋洗天数的变化如图2(a)~(c)所示。从整体上看,在所有反应组中,在硫化钠溶液的淋洗作用下,施氏矿物释放的铁和硫离子浓度总体上都呈递减趋势。对于Sch,其淋滤液中铁和硫离子浓度变化趋势一致,溶液中Fe/S 摩尔比(约为0.08~0.05)远小于矿物最初合成时的Fe/S 摩尔比5.52(见表1),说明反应过程中施氏矿物硫酸根在释放。正如文献[37]所报道,施氏矿物还原溶解过程中伴随着针铁矿的生成而释放一定量的硫酸根,这部分内容在下文XRD 表征中得到了验证。此外,据研究报道[30,38],S(-II)与铁矿物先在矿物表面形成络合物FeIIIS-II,并发生氧化还原反应,产生Fe(II)和S0,与溶液中S(-II)形成了中间体FeIIS,在此过程中Fe(III)和S0又会发生氧化还原反应。相比于纯的施氏矿物,负载了铬和钼的施氏矿物滤液中总铁和总硫离子的浓度明显降低。从不同样品同一元素来看,Sch、0.1Mo0.06Cr-Sch和0.2Mo0.09Cr-Sch 3 种样品淋滤液中第1 天铁离子浓度分别为11.12、1.77、0.76 mg/L,硫离子浓度分别为78.4、26.33、23.55 mg/L,总铁和总硫离子浓度大小顺序整体上为Sch>0.1Mo0.06Cr-Sch>0.2Mo0.09Cr-Sch。表明重金属的掺入一定程度上提高了施氏矿物的结晶度,且施氏矿物的稳定性与合成时重金属的添加量成正比[24]。而随着反应时间的延长,反应的产物覆盖于母体矿物表面,阻碍了离子的进一步释放。
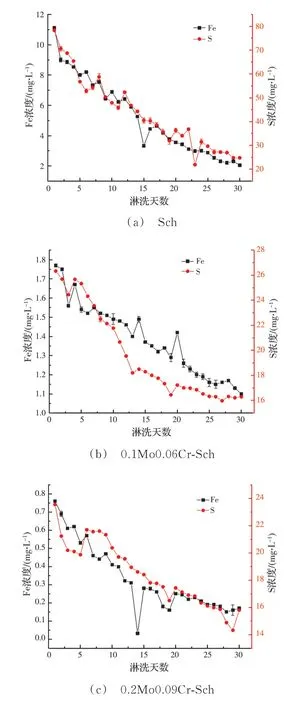
图2 样品淋滤液中铁和硫离子浓度随淋洗天数变化的关系Fig.2 The relationship between the concentrations of iron and sulfur ions in the leachate from samples with the leach⁃ing days
2.2.2 0.2Mo0.09Cr-Sch 样品淋滤液中铬和钼离子的浓度变化及表观动力学分析 图3 反映了0.2Mo0.09Cr-Sch 淋滤液中铬和钼离子浓度随淋洗天数的变化。随着淋滤天数的增加,滤液中铬和钼离子浓度都随之减小,且分别从第15 天和第14天开始检测不到铬和钼的浓度数值(未检出)。滤液中铬的浓度最高为0.069 mg/L,最低为0.039 mg/L,累积的释放浓度为0.717 mg/L;而钼的最高释放浓度为0.078 mg/L,最低为0.032 mg/L,累积释放浓度为0.754 mg/L。试验中铬和钼通过吸附共沉淀的方式附着于施氏矿物表面或矿物晶格内部[24],下层矿物在淋滤液中呈现释放和共沉淀的动态平衡状态,因此,水溶液中存在CrO42-和MoO42-。在淋滤试验过程中,S(-II)具有还原性,最先与上层矿物接触,和矿物中具有氧化性的离子发生氧化还原反应,并产生沉淀作用。反应后期,施氏矿物被产物附着覆盖,阻碍了离子的再次释放,所以金属离子释放量降低。相比于Cr,Mo 的释放量在后期下降得更为明显,但0.2Mo0.09Cr-Sch 淋滤液中钼离子浓度总体高于铬离子浓度,与在合成的0.2Mo0.09Cr-Sch 中所含钼质量高于铬质量的情况相符。
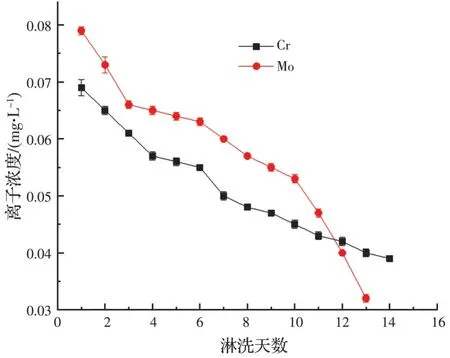
图3 0.2Mo0.09Cr-Sch 淋滤液中铬和钼离子浓度随淋洗天数变化的关系Fig.3 The relationship between the concentrations of chromium and molybdenum ions in the leachate from 0.2Mo0.09Cr-Sch with the leaching days
结合关于不同环境介质中重金属释放表观动力学的研究,模拟酸雨作用下六价铬的释放规律符合Elovich 方程[39];Neupane 等[40]通过多种数学模型拟合发现,钼的渗滤液浸出规律符合Elovich 方程。因此,采用常见的描述重金属释放规律的反应动力学数学模型,如零级动力学方程、双常数方程和Elovich 方程等进行表观动力学拟合,其数学模型中的物理量如表2 所示,重金属铬和钼的动力学拟合结果如表3 所示。

表3 重金属铬和钼的动力学拟合情况Table 3 Kinetic fitting of heavy metals chromium and molybdenum
由表3 可知,在零级动力学方程中,矿物中重金属铬和钼的释放规律拟合度最好,R2分别达到0.968 98 和0.933 76,说明重金属铬和钼的释放速率不受初始浓度的影响,释放过程在一定程度上是逐层解吸的过程[41]。其次是Elovich 方程,铬和钼在该数学模型中的拟合度分别为0.958 36和0.807 83;而在双常数方程中拟合度最差,分别为0.921 33 和0.755 80。Elovich 和双常数模型适合于描述复杂非均相的扩散过程,表明重金属在矿物中的吸附和解吸过程是一非均相扩散过程[42],受到多种因素的制约和影响。此外,铬的释放规律均较为符合这3类方程,而钼的释放规律只有在零级动力学方程中的拟合度达到0.9 以上。综上所述,对于负载重金属铬和钼的施氏矿物来说,零级动力学方程是最合适的表观动力学模型,其表观动力学方程分别为:C=C0-0.0023t,C=C0-0.0032t。
式(1)~式(4)中的物理量如表2 所示。
2.3 矿物的表征
2.3.1 XRD 表征 3 种合成矿物的XRD 结果如图4(a)所示,在衍射峰位18.24°、26.27°、35.17°、39.49°、46.53°、55.29°、61.34°和63.69°处均出现不同强度的施氏矿物特征峰,且铬酸根和钼酸根的添加对矿物的晶型影响不大,在35.2°和61.3°处的特征峰强度略高于纯施氏矿物,说明CrO42-和MoO42-的掺入一定程度上增强了施氏矿物的结晶度,但矿物主体仍然是施氏矿物。反应后矿物的XRD 表征结果如图4(b)所示。空白样品Sch 反应后XRD 谱图出现多个明显的衍射峰,分别在2θ为22°、27°、33.5°、35°、37.5°、53.5°、59°、62°和65°的位置,与PDF 卡和相关文献对比可知,反应后的产物主要为针铁矿,且经过Jade 软件分析可知,产物中还存在少量的FeS等。0.1Mo0.06Cr-Sch和0.2Mo0.09Cr-Sch 反应前后的XRD 谱图基本保持不变,与PDF 卡和文献报道[23]的合成施氏矿物对比一致,仍然为施氏矿物。由此可见,经过S(-II)溶液的淋滤,Sch 结构发生了改变,正如文献所报道的,当环境中pH值、共存金属离子和氧化还原物质等因子变化时,施氏矿物通常会转化成其他更稳定的矿物,如针铁矿等,如式(5)所示[43]。但负载的重金属铬和钼能够使施氏矿物结构更稳定,通过文献[23,44]可知,施氏矿物共沉淀大量MoO42-和CrO42-后,促进了矿物结构的稳定性。这是因为MoO42-和CrO42-与矿物中Fe 的络合作用比SO42-更强。另外,结合滤液中离子的浓度变化可知,负载重金属的施氏矿物结晶度随着重金属量的增加而提高[45]。
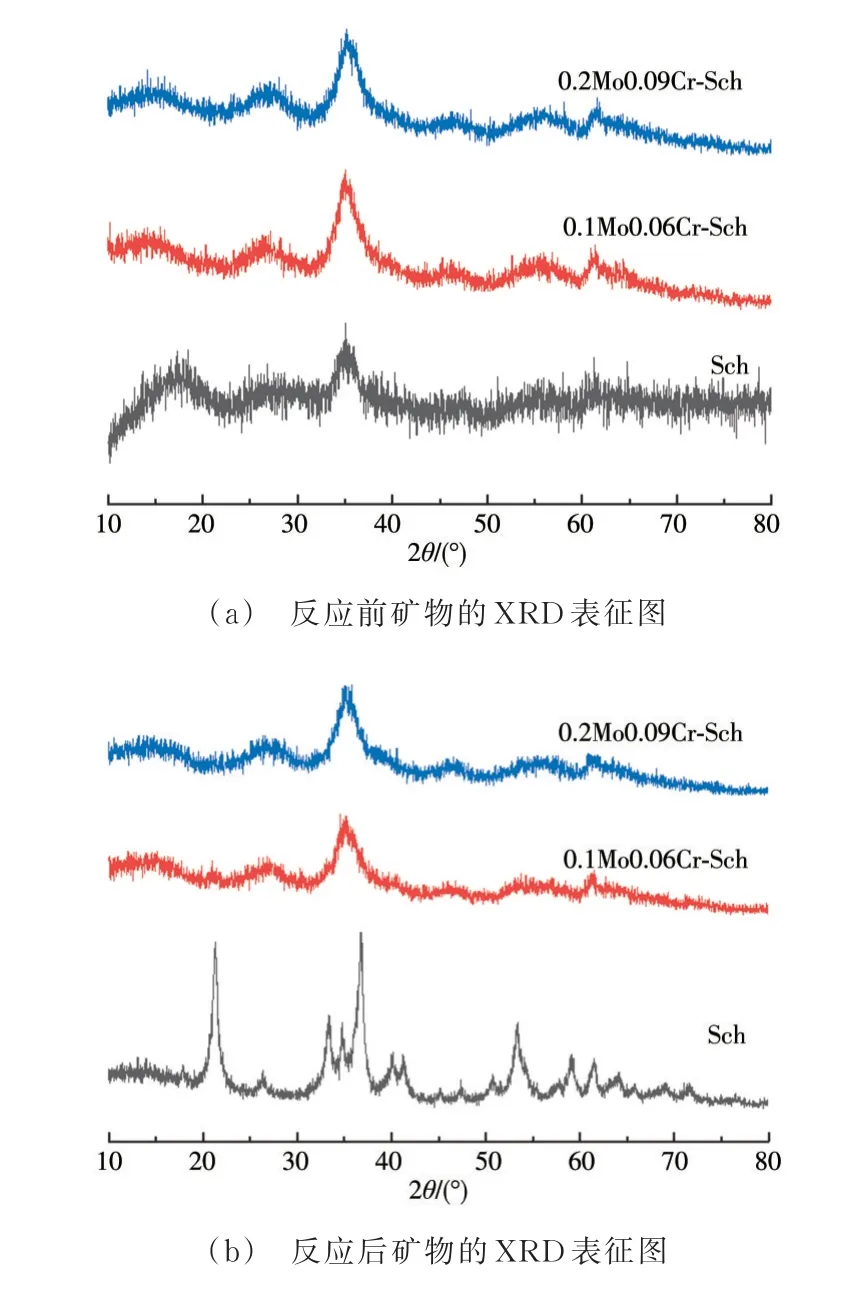
图4 矿物的XRD 谱图Fig.4 The XRD images of minerals
2.3.2 SEM 表征 通过快速法合成的施氏矿物呈现球状颗粒并出现聚集现象,如图5(a)~(c)所示,与自然形成的海胆状不一样。铬和钼的掺入对矿物形貌影响较小,都呈团聚颗粒状,Sch 粒径约为200 nm,但 是0.1Mo0.06Cr-Sch 和0.2Mo0.09Cr-Sch 的颗粒相对较小,粒径约为150 nm,且颗粒依旧呈聚集状态,表面较为粗糙,其表面形貌与Jönsson等[36]的研究结果相似。反应后矿物的SEM 表征如图5(d)~(f)所示,从图中可以看到,空白样品Sch呈片状团簇体(图5(d)),表面粗糙,成片聚集且附着一些小颗粒,轮廓模糊,这与XRD 的结果相对应,施氏矿物相转变后产物主要为针铁矿;图5(e)中0.1Mo0.06Cr-Sch 呈重叠的球状颗粒,相比反应前,颗粒大小不一,直径约为150~500 nm。且表面有小颗粒,轮廓明显;图5(f)中0.2Mo0.09Cr-Sch呈较小的颗粒状,且有的团聚成块状,表面同样有明显附着的小颗粒,不同大小的团聚体直径普遍在100~300 nm 之间,与文献[23]报道的形貌基本一致。SEM 结果与XRD 图谱结果相对应,总体来说,球状颗粒表面反应后更为粗糙,颗粒感更为明显,可能是反应后的次生矿物。

图5 矿物的SEM 图Fig.5 The SEM images of minerals
2.3.3 XPS 表征 为进一步探讨S(-II)介导下矿物的反应特征以及重金属Cr 和Mo 的价态变化和存在形态,采用X 射线光电子能谱(XPS)对反应前后0.2Mo0.09Cr-Sch 固体样品 中Fe、Cr 和Mo 三种元素进行测定,并采用XPS PEAK 41 软件进行分峰拟合,结果如图6 所示。反应前(图6(a))Fe 2p3/2和Fe 2p1/2 的结合能分别为712.4、710.18、724.0 eV,对应Fe(III)和Fe-O,表明在施氏矿物中铁主要以Fe(III)形式存在[46]。对反应后Fe 2p3/2 进行分峰可知(图6(d)),电子结合能711.5、712.4、710.3 eV分别对应特征峰FeOOH、Fe(III)和Fe-S,谱图中电子结合能在724.3 eV 处对应的也是FeOOH 特征峰。可见,反应后新增了FeOOH 和Fe-S 特征峰,表明固相产物中含有针铁矿组分,对应XRD 结果可知,还可能存在FeS。将反应前后Cr 2p的XPS谱图进行比较,反应前(图6(b)),Cr 2p结合能576.6、578.5 eV 分别对应Cr-O 和Cr(VI)特征峰;反应后(图6(e)),Cr 2p 的电子结合能为586.8、577.75、576.4、574.8 eV,分别对 应Cr(OH)3、Cr(III)、Cr2O3和Cr-S 特征峰[47],表明反应过程中Cr(VI)被还原,毒性降低。图6(c)、(f)显示了反应前后Mo 赋存形态的变化,可见反应前后最大区别是在Mo 3d 5/2 处新增了Mo(IV)和Mo-S特征峰,对应结合能分别为232.3、232.1 eV。结合氧化还原电位Cr(VI)/Cr(III)=1.33 V,Mo(VI)/Mo(IV)=0.65 V,Fe3+/Fe2+=0.771 V,S2-/S=-0.48 V 可知,淋洗过程中ADM 系统存在氧化还原反应[48]。
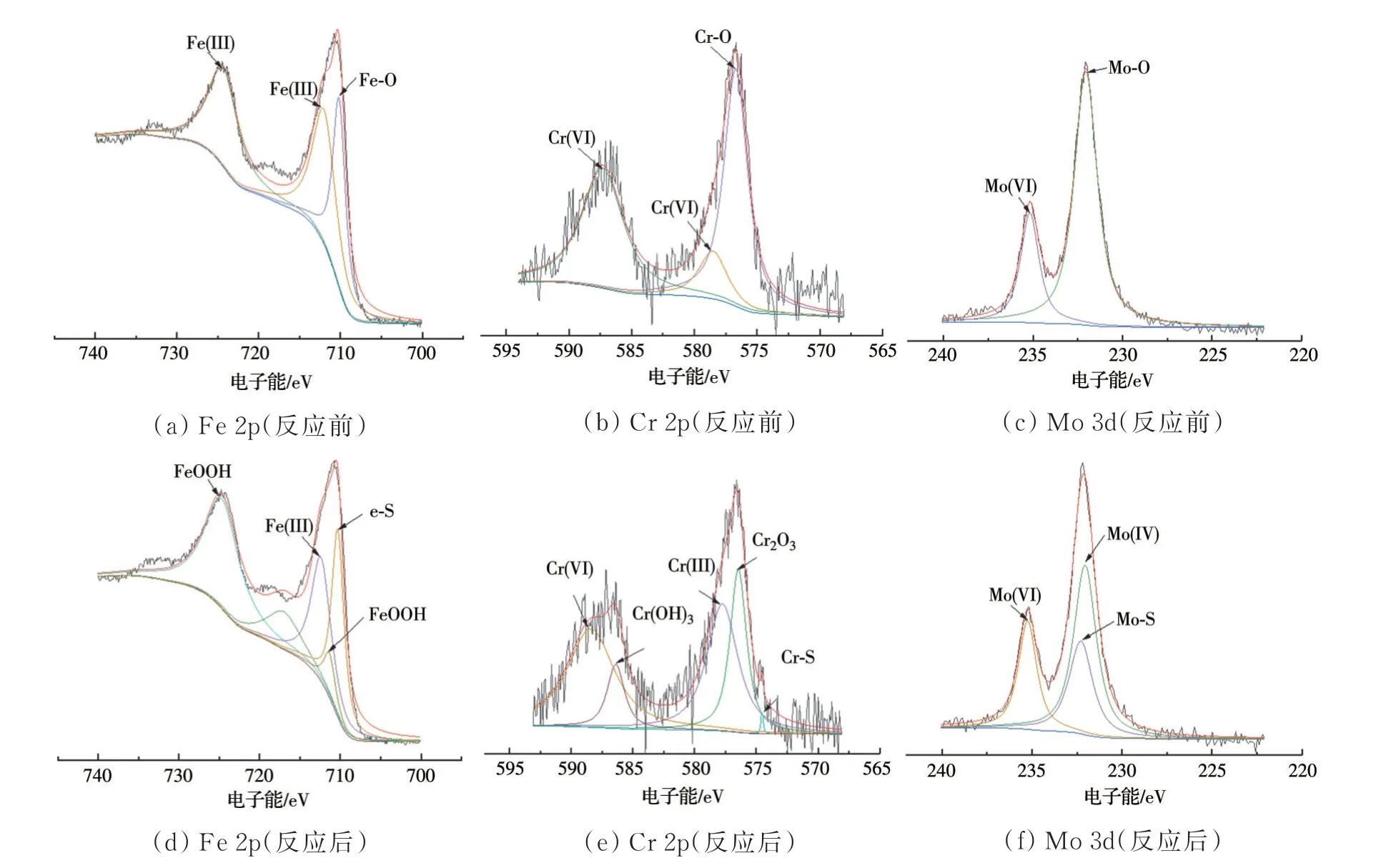
图6 矿物的XPS 图Fig.6 The XPS images of minerals
2.4 环境工程意义
探讨了在酸性矿山废水环境中S(-II)对含Cr(VI)和Mo(VI)施氏矿物溶解和相转变的影响,结果表明,在酸性矿山废水环境中,重金属的污染控制修复应注意体系中的还原性物质,如S(-II)或Fe2+等对施氏矿物稳定性的影响,保持AMD 系统的稳定性,有利于其在低pH 值和高硫酸根环境下生成含铁羟基硫酸盐次生矿物。其次,当施氏矿物作为吸附剂用于重金属污染物的吸附治理时,由于未负载重金属的施氏矿物稳定性较差,在环境工程水体修复中可先将施氏矿物进行微量重金属的负载,以提高其稳定性,但应注意,长时间内仍存在再次释放的环境风险。
3 结论
利用流动柱淋滤方法探究了不同铬、钼含量的负载型施氏矿物的环境稳定性。通过XRD 和SEM证实了所合成的矿物为施氏矿物,且铬和钼的添加对施氏矿物结构影响较小,在还原性S(-II)的介导下,纯施氏矿物发生了明显的相转变,产物主要为针铁矿,而负载了铬和钼的施氏矿物反应前后晶型变化不明显,铬和钼的释放规律符合零级动力学方程。而总铁和硫离子的释放量大小顺序为Sch>0.1Mo0.06Cr-Sch >0.2Mo0.09Cr-Sch,表明施氏矿物的稳定性与合成时重金属的添加量成正比。

