慢滤对污水厂二级出水中条件致病菌的去除
孙丽华,王春芳,朱珺瑶,邓 斯
慢滤对污水厂二级出水中条件致病菌的去除
孙丽华1*,王春芳2,朱珺瑶3,邓 斯2
(1.北京建筑大学城市雨水系统与水环境教育部重点实验室,北京 100044;2.北京建筑大学环境与能源工程学院,北京 100044;3.北京市东城区住房与城市建设委员会,北京 100027)
以高效去除污水厂二级出水中的铜绿假单胞菌为目的,探究慢滤工艺在不同条件下(滤速、碳氮比、离子浓度、pH值)对铜绿假单胞菌的去除效果,在最佳运行条件下监测污染物在慢滤生物膜表面的沉积过程,分析慢滤表面生物膜的种群结构特征及其对铜绿假单胞菌的去除机制.结果表明,在最佳运行条件下(滤速5cm/h、碳氮比为10、Ca2+浓度为60mg/L、pH7),有生物膜慢滤对二级出水中铜绿假单胞菌的去除效果最好,去除率能够达到87.0%;在最佳运行条件下,滤料表面生物膜的多样性最高,物种组成最均匀,变形菌属和硝化螺旋菌属等对铜绿假单胞菌有去除效果的微生物相对丰度占比最大;在滤速为5cm/h、碳氮比为10条件下,二级出水中污染物在慢滤生物膜表面的沉积主要为胞外聚合物的粘附作用;而在水中Ca2+浓度为60mg/L、pH值为7时,污染物在慢滤表面的沉积主要为微生物的粘附作用.
慢滤;铜绿假单胞菌;二级出水;运行条件;沉积过程
条件致病菌、病毒等病原微生物是城市污水再生利用过程中需高度关注的风险因子,有效控制病原微生物风险,是再生水深度净化与水质安全保障的重要内容和挑战.其中,条件致病菌(OPs)是一种在正常情况下不会引起疾病,但在特殊的条件下会引起疾病的病原微生物[1].铜绿假单胞菌(PA)作为一种常见的OPs,广泛存在于水体环境中,人体经过与水的接触,会将其摄入或吸入体内而引发疾病,对人类健康造成严重的威胁[2].由于具有耐氯性和抗药性[3],常规的污水处理工艺对于水中的去除倍显乏力,使得污水处理厂的二级出水中仍含有数量较多的,因此,为保证污水厂二级出水的微生物安全性,需要对其做进一步的深度处理.
传统的污水深度处理技术包括:混凝-沉淀-砂滤、膜过滤、生物处理、臭氧氧化等[4-5].常规的深度处理工艺对二级出水中的胶体、大分子有机物、悬浮物和细菌等有较好的去除效果,但水中的OPs、有毒害微量污染物和生态毒性物质等很难被完全去除[6].地表渗流补充地下水、慢滤等介质过滤方式以其性能优异、成本低廉、运行简便等优势,在污水深度处理领域得到国内外关注[7].近年来,大量的研究结果显示,慢滤在二级出水深度处理中能有效去除水中的病原微生物[8].慢砂滤池中的原生动物和细菌对OPs的去除起到非常重要的作用[9-10];水体中的氨氮、有机物以及致病菌等能够由慢滤表面生物膜上的多糖与蛋白的混合物所捕获,被生物膜上的微生物所利用,进而将其清除[11].经过大量试验和工程应用,进一步证实了慢滤滤膜的生物降解能力,对水中的病原微生物有较好的去除效果[12].
因此,本文以城市污水厂二级出水为处理对象,采用慢滤工艺对其进行深度处理,探究不同运行条件下(进水碳氮比、离子浓度等)该工艺对水中的去除效果;采用耗散型石英晶体微天平技术(QCM-D),在最佳运行条件下监测二级出水中污染物在生物膜表面的沉积去除过程;利用Illumina高通量测序技术分析慢滤表面生物膜的种群结构,揭示最佳运行条件下慢滤表面生物膜种群结构的特征及其对去除的机制.
1 材料与方法
1.1 试验材料与装置
1.1.1 试验水样 试验原水采用模拟污水处理厂二级出水.取学校生活污水,依次使用1mm、70µm、40µm孔径的滤筛过滤,加入经72h曝晒除氯后的自来水稀释10倍.模拟二级出水水质参数为:温度22.8℃, pH值7.9,浊度6.85NTU, CODCr13.1mg/L, DOC5.2mg/L,NH4+-N6.5mg/L,Ca2+51.5mg/L.
1.1.2 试验试剂 CODCr、NH4+-N检测所需试剂购自北京科力华源科技有限公司;培养生物膜以及常规水质指标检测所用试剂:葡萄糖、NH4Cl、CaCl2、HCl、H2SO4、NaCl、酒石酸钾钠、EDTA、钙羧酸指示剂,均为分析纯,均购自北京福康顺昌商贸有限公司;PA检测所需试剂:DNA快速提取试剂盒(FastDNA® Spin Kit for soil,擎科生物)、pMD® 18-T Vector(TAKARA)、琼脂糖B(BBI)、GeneRuler DNA Ladder Mix(Thermo Scientific)、50xTAEBuffer (捷瑞生物)、DL5000DNA Marker(擎科生物)、TS-GeIRed核酸凝胶染料(Nucleic acid gel dye,擎科生物)、UItaSYBR Mixture(康为世纪),均由北京博云辉生物科技有限公司提供并检测.
1.1.3 试验装置 试验所用慢滤滤料为石英砂和粗砂,有效粒径分别为0.6mm、2.0mm,均购自佰圣泰科商贸有限公司.慢滤装置由5根滤柱组成,每根直径均为8cm,高65cm;每根滤柱的填充高度一致,砾石高度为5cm,石英砂高度为45cm.其中,柱1为无生物膜的滤柱,柱2、3、4和5为不同运行条件下具有生物膜的滤柱.试验装置如图1所示.
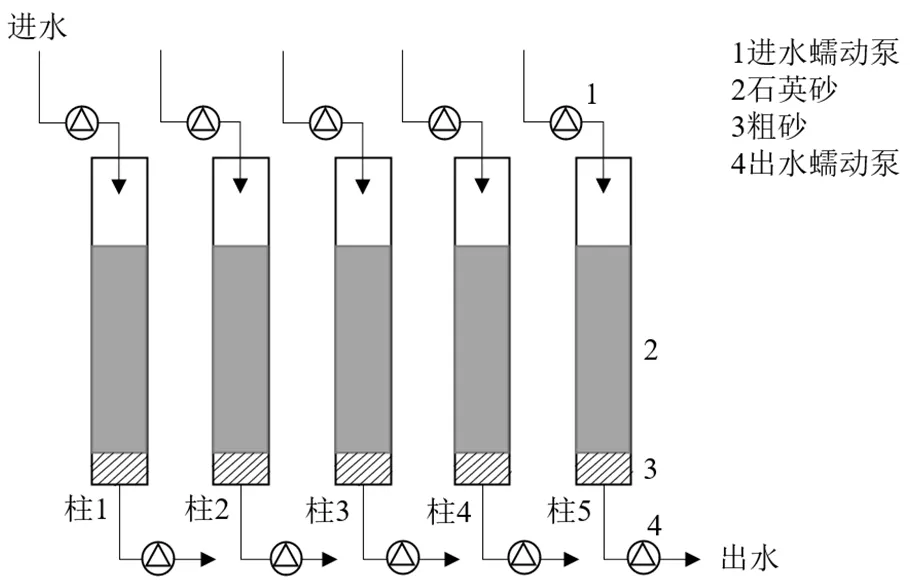
图1 慢滤试验装置
1.2 试验方法
1.2.1 不同运行条件下生物膜的培养 试验运行期间,水温控制在20~25℃之间,对慢滤柱中的生物膜培养采用连续流自然生长挂膜[13],并以慢滤对CODCr的去除率(>60%)稳定作为生物膜成熟的标准[14].通过蠕动泵控制滤速分别为5, 10, 20, 30cm/h.通过向模拟二级出水中加入一定量的营养物质,得到培养不同水质条件生物膜时所用水样,并根据生物膜对CODCr的降解效果确定该阶段最佳运行条件.选择慢滤最佳滤速,通过投加葡萄糖和NH4Cl来改变进水碳氮比(CODCr与NH4+-N之比),分别为5,10,15和20,相应的CODCr依次为33, 60, 90和114mg/L,NH4+-N浓度均为6.5mg/L;选择慢滤最佳滤速、最佳进水碳氮比,通过投加CaCl2改变进水Ca2+浓度,分别为60,120,180和240mg/L;选择慢滤最佳滤速、最佳进水碳氮比、最佳水质进水Ca2+浓度,通过滴加HCl改变进水pH值为5,滴加NaOH改变进水pH值为9.
1.2.2 仪器及分析方法 化学需氧量(CODcr)使用哈希水质检测仪(DR-6000,美国)检测;Ca2+浓度采用国标《水质钙的测定EDTA滴定》(GB 7476-87)方法测定;浊度采用便携式浊度仪(SGZ-200BS型,中国)测定;溶解性有机碳(DOC)采用总有机碳分析仪(TOC-VCPH,德国)检测.
采用q-PCR法定量检测水中PA浓度,样品均送至北京博云辉生物科技有限公司,使用PCR仪(CFX Manager biorad,美国)进行DNA提取、扩增并定量检测.的引物F: GACGTACACGCGAAAGACCT, R: GCCCAGAGCCATGTTGTACT.
采用高通量测序平台(Illumina MiSeq,美国)进行测序,样品均送往生工生物工程(上海)有限公司,在Illumina MiSeq高通量测序平台上分析扩增基因,并与DNA数据库进行比对,确定样品中的微生物种群结构.
1.2.3 PA动态沉积过程检测 采用耗散型石英晶体微天平分析仪(QSense Explorer,瑞典)监测PA在生物膜表面的动态沉积过程.石英晶片(QSX 301,Biolin Scientific AB)频率为5MHz,直径为14mm,采用AT切割.采用高压灭菌前从慢滤生物膜表面提取生物膜样品,涂抹于石英晶片上备用.使用蠕动泵向QCM-D的样品室中通入超纯水3~5min,建立稳定基线,记录此时的芯片频率(∆)和耗散因子(∆);再引入试验溶液持续30min.监测倍频段=5的∆和∆的变化,计算耗散因子与频率偏移的比值∆/-∆(∆/-∆数值可拟合计算出芯片表面薄层的质量和厚度变化),采用Sauerbrey模型拟合质量变化∆和质量沉积速率[15];
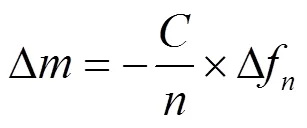
质量沉积速率(MDR)=质量最大值/实验时间(2)
式中:为恒定常数,为17.7ng/cm2;为芯片倍频数;“实验时间”指自样品进入流室起至质量最大值出现时的两个时间节点之差,h.
2 结果与讨论
2.1 慢滤在不同运行条件下对PA的去除效能
通过改变慢滤的滤速、进水碳氮比,进水Ca2+浓度和pH值,探究慢滤在不同运行条件下对的去除效能,结果如图2所示.
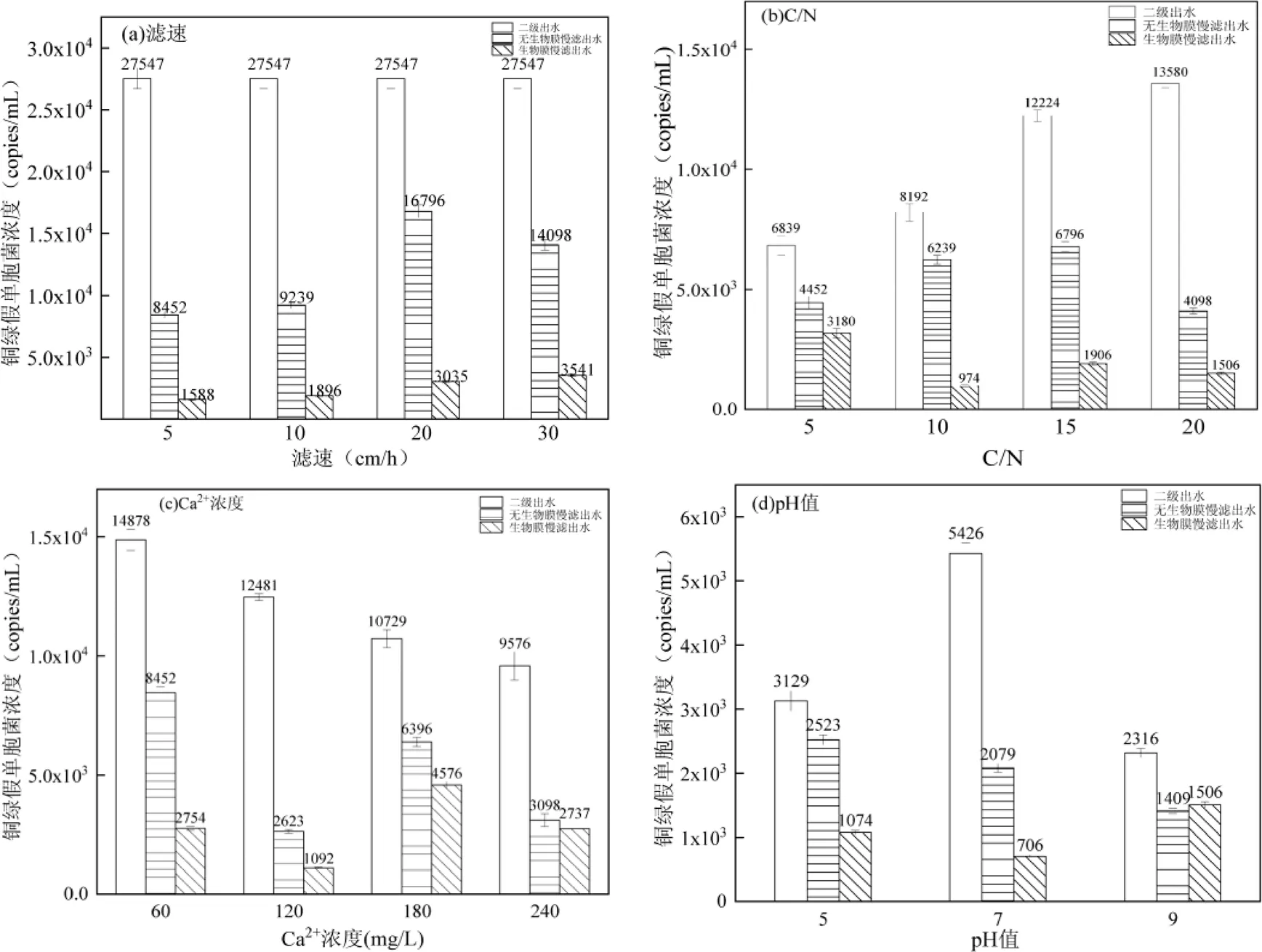
图2 不同运行条件下慢滤对铜绿假单胞菌的去除效能
2.1.1 不同滤速 本试验向慢滤装置通入模拟二级出水,通过蠕动泵在慢滤柱出水端控制滤速为5,10,20和30cm/h.在各滤速条件下培养生物膜,滤速为5cm/h时,生物膜在第67d左右成熟,滤速为10cm/h的滤柱在63d左右成熟,滤速为20 和30cm/h的滤柱表面生物膜均在59d左右成熟.在慢滤运行稳定后,分别检测不同慢滤柱进出水中的浓度,并计算其去除率,结果如图2(a)所示.
结果表明,在相同滤速条件下,生物膜慢滤对二级出水中的去除效果均优于无生物膜慢滤.不同滤速条件下,滤速为5cm/h时对的去除效果最好,去除率为84.2%;当滤速增大为10、20、和30cm/h时,慢滤出水中PA的去除率有所下降,分别为77.9%、63.8%和62.2%.这是因为的大小比滤料之间的孔隙小得多[16],仅靠石英砂滤料的物理截留无法有效去除;而生物膜慢滤表面维持着大量的微生物,可分泌多糖和蛋白质混合物,使得吸附于滤料上,进而被去除[11].同时,生物膜上的一些微生物能够摄取生长的必要物质,因此也可以有效削减水中的数量[17].由于滤速变化,使生物膜上的微生物种群和生物量发生了不同程度的改变;滤速越小,水力停留时间越久,使得更有机会被吸附在滤料及生物膜上,进而被去除.这与曹相生等[18]的研究结果一致.因此,滤速为5cm/h时慢滤对的去除效果最佳.
2.1.2 不同碳氮比 本试验在最佳滤速(5cm/h)条件下,通过向水中投加葡萄糖和氯化铵,控制慢滤进水的C/N分别为5、10、15和20.在各C/N条件下培养生物膜,慢滤表面生物膜均在第17d左右成熟.在慢滤运行稳定后,滤后水中CODCr依次为13,10,37和64mg/L,对CODCr的去除率分别为64.4%、83.3%、58.9%和43.9%;分别检测不同慢滤柱进出水中的浓度,并计算其去除率,结果如图2(b)所示.
结果表明,相同的C/N条件下,生物膜慢滤对水中的去除效果均优于无生物膜慢滤.随着进水C/N的增大,无生物膜慢滤对的去除效果区别不大,去除率均低于50%;生物膜慢滤对于水中的去除效果呈先增强后减弱的趋势,C/N为10时,去除效果最好,其去除率为91.2%;C/N为5,15和20时,其去除率分别为76.7%、54.5%和66.7%.这是因为无生物膜慢滤对水中的去除仅靠物理截留作用,进水C/N对无生物膜慢滤影响不大;由于二级出水中有机物含量低,并且大多数处于难以降解的状态,不容易被微生物利用[19],因此,对于生物膜慢滤,当进水C/N从5增大到10时,通过增加有机碳源,增强生物膜表面活性,提高生物量,微生物的新陈代谢速率加快,能有效提升生物膜对水中的捕食能力[20],这与仇雁翎等[21]的研究结果一致.但随着碳源浓度增大,超过滤料表面微生物膜中异养菌的分解能力,导致水中的有机物不能被慢滤表面微生物充分利用[22],从而使得的去除率随之下降.由此可见,慢滤进水C/N为10时对的去除效果最佳.
2.1.3 不同Ca2+浓度 本试验在最佳滤速条件(5cm/h)、最佳进水碳氮比(C:N=10)条件下,调整不同进水Ca2+浓度(60,120,180和240mg/L)培养生物膜, Ca2+浓度为60mg/L时,生物膜在第22d左右成熟, Ca2+浓度在120,180和240mg/L时,对水中CODCr的去除率均在第25d左右趋于稳定.在慢滤运行稳定后,分别检测不同慢滤柱进出水中的浓度,并计算其去除率,结果如图2(c)所示.
结果表明,不同Ca2+浓度条件下,随着Ca2+浓度逐渐增大,生物膜慢滤对二级出水中的去除率逐渐降低,但均优于无生物膜慢滤.无生物膜慢滤对水中的去除率均低于60%;Ca2+浓度为60mg/L时,生物膜慢滤对的去除率最高,为87.5%;当增大进水Ca2+浓度为120,180,240mg/L时,去除效果均显著下降,其去除率分别为76.1%、63.3%和50.6%.这是因为,随着进水Ca2+浓度的上升,无生物膜慢滤表面产生CaCO3的堆积,堵塞滤料孔隙,导致其对的截留效果降低.对于生物膜慢滤,Ca2+浓度对生物膜表面微生物和生物膜胞外聚合物(EPS)有不同程度的影响,且EPS受Ca2+浓度影响较大,能够提供更多的蛋白质粘附位点,提高的去除效果[23].在生长过程中会产生多种粘附素,可以使菌体粘附在宿主细胞上[24].Ca2+浓度过高,反而起到筛选静电结合作用的功能,使EPS蛋白质的结合位点饱和,降低微生物的聚集能力[25],从而削弱的去除效果.因此,慢滤进水Ca2+浓度控制在60mg/L左右时,对水中的去除效果最佳.
2.1.4 不同pH值 本试验在最佳滤速条件(5cm/h)、最佳进水碳氮比(C:N=10)和最佳进水Ca2+浓度(60mg/L)条件下,通过向二级出水中滴加HCl和NaOH来控制进水pH值为5, 7和9,并在此条件下培养生物膜,pH值为5和9时,慢滤生物膜对水中CODCr的去除率均第20d左右趋于稳定,pH值为7时,生物膜在第15d左右成熟.在慢滤运行稳定后,分别检测不同慢滤柱进出水中的浓度,并计算其去除率,结果如图2(d)所示.
结果表明,在不同进水pH值条件下,随着pH值的升高,生物膜慢滤对的去除效果先增强后减弱,并且均优于相同条件下的无生物膜慢滤.无生物膜慢滤对的去除率均低于60%;进水pH值为5、7和9时,生物膜慢滤对的去除率分别为79.1%, 87.0%和35.0%.可见,pH值为7时生物膜慢滤效果最佳.这是因为,慢滤表面生物膜中,多数细菌生长繁殖的最适pH值为6.5~7.5,而属于耐酸细菌,在恶劣的环境下仍可生存[26].研究表明,的最适生长pH值在5.0~9.0范围内,并且极易生成生物被膜,可以在酸性条件下生存,但在碱性环境下生存力较低[27].在强酸和强碱性条件下,慢滤表面生物膜呈现不可逆性破坏,使得微生物对于水中的去除效果大大减弱.因此,尽管由于调节pH值使得进水中的含量有所下降,但基于生物膜的生物净化作用,应当控制慢滤进水pH值在7左右为宜.
2.2 慢滤表面生物膜及其对PA的去除机制
2.2.1 最佳运行条件下生物膜微生物种群结构分析 为确定在最佳运行条件下(滤速5cm/h、进水C/N为10、Ca2+浓度60mg/L、pH值为7)对微生物种群结构的影响,采用样品的多样性(Alpha多样性)分析微生物群落的丰度和多样性[28],包括OTUs、Shannon、Chao、Ace及Simpson等统计学分析指数.OTUs、Shannon指数、Chao指数、Ace指数越大,Simpson指数越小,说明种群物种多样性越高;Coverage指数越高,说明样本的可靠性越高.结果如表1所示.
结果表明,4种运行条件下的Coverage值均为1,说明样本的可靠性非常高.对比每种水质条件不同指数之间的情况可知,在最佳滤速为5cm/h基础上,C/N为10、Ca2+为60mg/L和pH值为7水质条件下培养的生物膜微生物群落多样性均有不同程度的下降.其中,Ca2+浓度为60mg/L时,物种的多样性下降最明显;调节进水pH值为7时,物种的多样性有一定提升.
当C/N为10时,慢滤表面微生物群落多样性下降可能与碳源葡萄糖的降解途径有关,微生物在利用葡萄糖代谢和发酵的过程中,会造成系统中pH值的改变,从而导致污泥中微生物多样性的下降[30];调整Ca2+浓度为60mg/L时,由于微生物对Ca2+的竞争关系,导致生物膜内优势菌种的产生,且有CaCO3存在,从而导致多样性下降;调节pH值为7,向水中滴加HCl可以溶解部分CaCO3,使得生物膜表面微生物多样性增大.
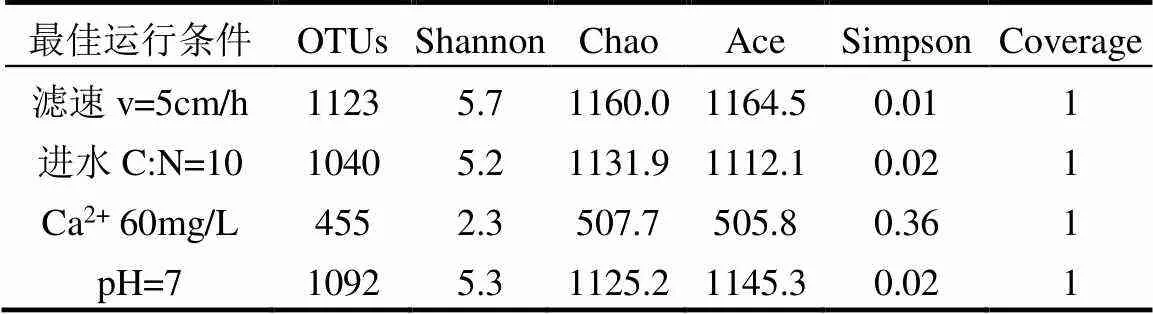
表1 最佳运行条件下微生物种多样性指数
2.2.2 最佳运行条件下微生物类型对的去除影响 试验对慢滤生物膜进行高通量测序,采用RDP classifier方式[30]对微生物群落分类.选取最佳运行条件下,各生物膜表面微生物中总OTUs前10的优势菌属进行分析,结果如图3所示.
结果表明,滤速为5cm/h条件下,变形菌属、酸杆菌属和硝化螺旋菌属等占比较大;进水C/N为10时,拟杆菌属占比最大,其次是变形菌属和浮霉菌属.研究表明,变形菌和拟杆菌表面的脂多糖有利于细菌粘附至填料表面,进而将其去除[31].Ca2+浓度为60mg/L时,生物膜上出现了厌氧氨氧化菌属,相对丰度达到59.1%,同时拟杆菌属和浮霉菌属相对丰度降低,根瘤菌属、放线菌属的相对丰度升高.这是因为Ca2+浓度增高导致CaCO3的积累,生物膜中出现部分厌氧的区域,使得厌氧氨氧化菌出现;通过去除水中的氨氮,导致生长所需营养物质减少,从而使得出水中的含量减少.此外,在进水C/N为10和Ca2+浓度为60mg/L条件下,生物膜中生丝微菌属、放线菌属和根瘤菌等一类细菌较多,可利用多糖类作为底物,增强其代谢活性,分泌更多的EPS和蛋白质,通过EPS表面蛋白质与表面分泌的蛋白质特异性结合而去除.pH值为7时,变形菌属、酸杆菌属和硝化螺旋菌属的相对丰度升高,成为优势菌属.硝酸螺旋菌作为污水处理中常见的细菌,对氨氮类化合物有较好的去除效果,而氨氮是生长的必要物质,因此可以有效削减水中的数量[17].并且,由于大部分微生物最适pH值为中性,强酸或者强碱环境使得大部分微生物死亡,从而降低了生物膜活性[32],因此在pH值为7条件下培养的生物膜活性最高,对水中的去除效果最佳.总之,与其他运行条件相比,在最佳运行条件下,对有去除效果的微生物相对丰度最大.
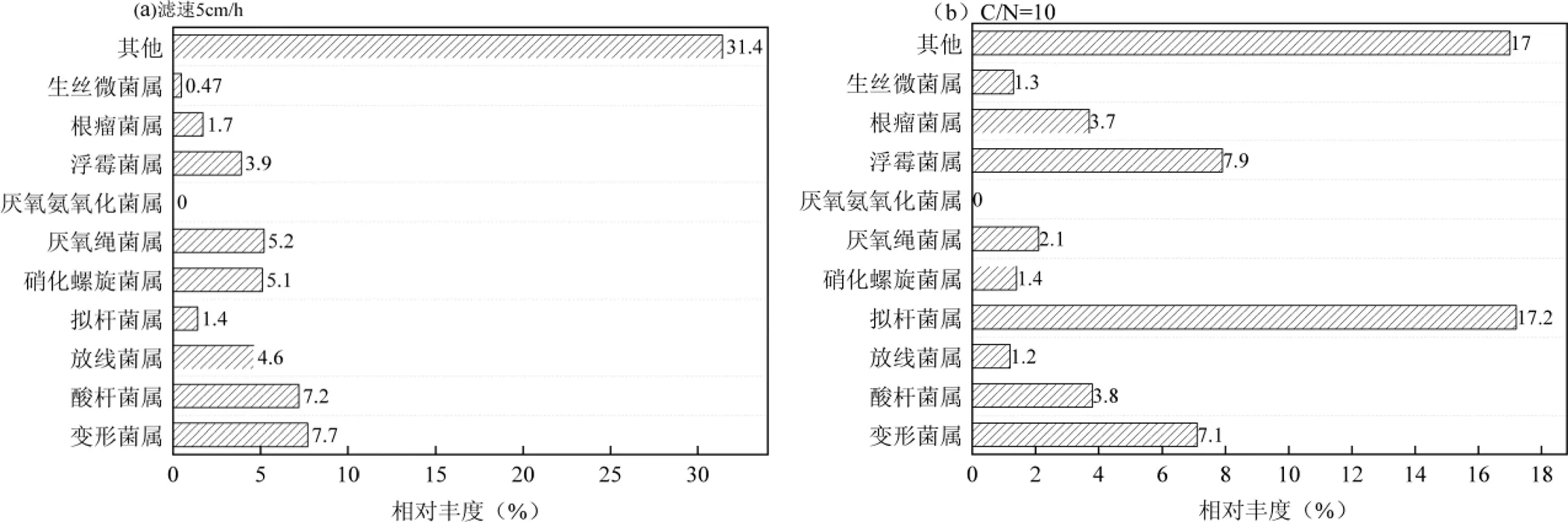
图中“0”代表在此条件下未检出
2.3 污染物在不同慢滤表面的动态沉积过程分析
2.3.1 污染物在不同生物膜表面的动态沉积过程 选取慢滤对水中污染物去除效果最佳时的运行条件,即慢滤滤速为5cm/h,进水C/N为10,进水Ca2+浓度为60mg/L,进水pH值为7条件下培养的慢滤生物膜,利用QCM-D技术,以第5个倍频段(=5)为基础,监测二级出水中的污染物在生物膜表面的沉积过程,结果如图4和表2所示.
由图4(a)可知,通入超纯水稳定基线7min左右后,向QCM-D流室中注入实验水样,不同生物膜表面的频率∆持续降低;并且依次改变慢滤进水碳氮比、Ca2+浓度和pH值水质条件,生物膜表面的频率∆呈降低的趋势.由图4(b)可知,通入试验水样后,石英晶片的耗散因子∆均上升,且进水C/N为10的条件下∆最大,说明3种水质条件下培养的生物膜的结构粘弹性质均逐渐增强,但在进水C/N为10时生物膜的粘弹性最好.由图4(c)可知,∆和生物膜表面质量∆成反比,因此通入二级出水后,生物膜表面微生物摄取有机物进行生长繁殖,在成膜过程中导致∆不断下降,∆上升,4种条件下慢滤生物膜表面的吸附量均有不同程度的增加,并且在整个监测过程中,生物膜一直未达到吸附饱和.
由图4(d),在进水C/N为10条件下,污染物在生物膜表面的沉积速率先增大后逐渐趋于稳定,并且相较于滤速为5cm/h条件下,生物膜表面的吸附量有所提升.当进水Ca2+浓度为60mg/L时生物膜表面的质量变化最大,沉积速率先增大后减小,且平均质量沉积速率最大;随着Ca2+在生物膜形成少量的CaCO3沉淀,对污染物的去除速率降低.研究表明[33],低浓度Ca2+条件下会增加污染物与生物膜界面之间的范德华引力和极性引力.与C/N为10时水质条件相比,此时∆/-∆显著减小,说明Ca2+使慢滤生物膜变得更加致密,静电吸引和H键有利于Ca2+在这些表面形成致密、刚性的生物膜[34].调节进水pH值为7时,生物膜对污染物的吸附增量不大,质量沉积速率先增大后略有降低,并趋于稳定.说明调节pH值可以缓解部分生物膜表面CaCO3沉淀,此时∆/-∆基本不变,对生物膜质地影响不大.在沉积表面上,降低pH值可以降低静电斥力[35],因此有助于沉积速率增加,提升生物膜吸附量;同时,吸附后期,生物膜表面的吸附位点减少,污染物的沉积速度减慢.在一般环境条件下微生物表面带负电荷,更容易吸附在带正电的载体表面[36].pH值为7条件下,表面电位的变化并未受较大的影响,即吸附量受pH值影响并不明显[37].
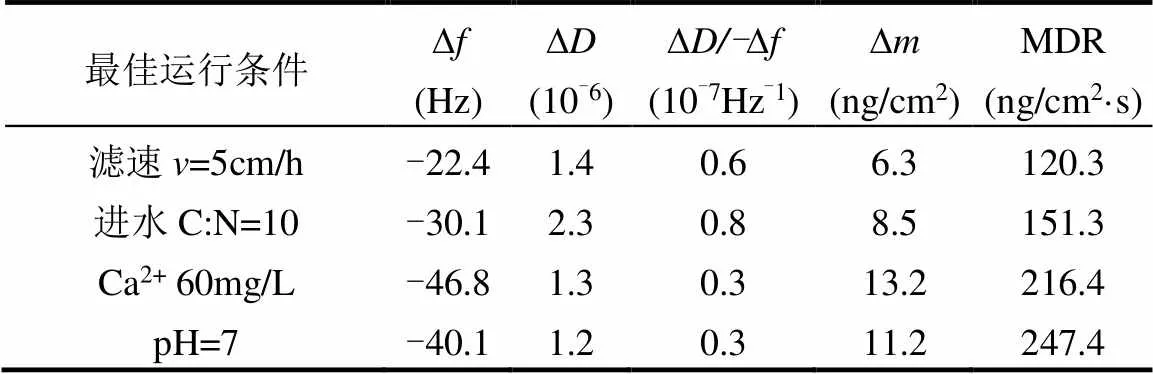
表2 不同生物膜表面污染物沉积因子变化值
2.3.2 污染物在不同EPS表面的动态沉积过程 在同样的试验条件下,将不同水质条件下的二级出水对应通入表面附着不同条件生物膜EPS的石英晶片,监测二级出水中的污染物在生物膜EPS表面的沉积过程,结果如图5和表3所示.
由图5(a)可见,QCM-D的基线稳定后,向流室中注入水样,4种生物膜EPS的∆均逐渐减小,其中滤速为5cm/h时频率降低的最大.由图5(b)可知,石英晶片的耗散因子∆均上升,且进水C/N为10时,耗散因子∆显著提升,而其他条件下∆变化相差不大,表明C/N为10时,由于多糖含量的增加,EPS结构的粘弹性较好,Ca2+和pH值对EPS的粘弹性质影响不大.由图5(c)和(d)可知,通入二级出水, EPS表面∆持续增加,EPS表面污染物的MDR先增大后下降,说明EPS对水中污染物的吸附初期较快,而随着水中污染物的沉淀,EPS上吸附的污染物较多,因此速率变慢.
通入C/N为10的二级出水,EPS表面质量持续上升,污染物在EPS表面的沉积速率先增大后下降并趋于平缓,并且相较滤速5cm/h条件下生物膜表面的吸附量有所下降.当Ca2+浓度为60mg/L时,EPS表面质量持续上升,污染物在EPS表面的MDR先增大后减小,并且趋于平缓.研究表明[38],投加Ca2+不会刺激微生物产生更多EPS,因此去除过程与进水C/N为10类似;但∆有所增加,这是因为随着吸附的进行,少量CaCO3附着在生物膜表面,导致生物膜EPS质量有所增加.此外,Ca2+能够改变EPS的zeta电位来影响其附着能力,桥接生物大分子链和改变分子构象的能力[39],使得EPS表面产生更强的疏水作用性.因此,EPS表面污染物沉积行为的增强又与EPS表面负电减小而导致的疏水性增强有关.在进水pH值为7时,/-与Ca2+浓度为60mg/L时相比变化不大,因此pH值对EPS结构变化影响不大;EPS表面的质量缓速提升,吸附一定时间后趋于稳定;污染物在EPS表面的MDR先增大后持续降低,最后达到饱和.这是由于pH值降低会导致EPS的相对疏水性提高,在前期沉积速率增大,而后EPS中的氨基R-NH2通过吸附H+形成R-NH3+,导致H+减少,使得pH值上升,从而对污染物的吸附速率降低[40].
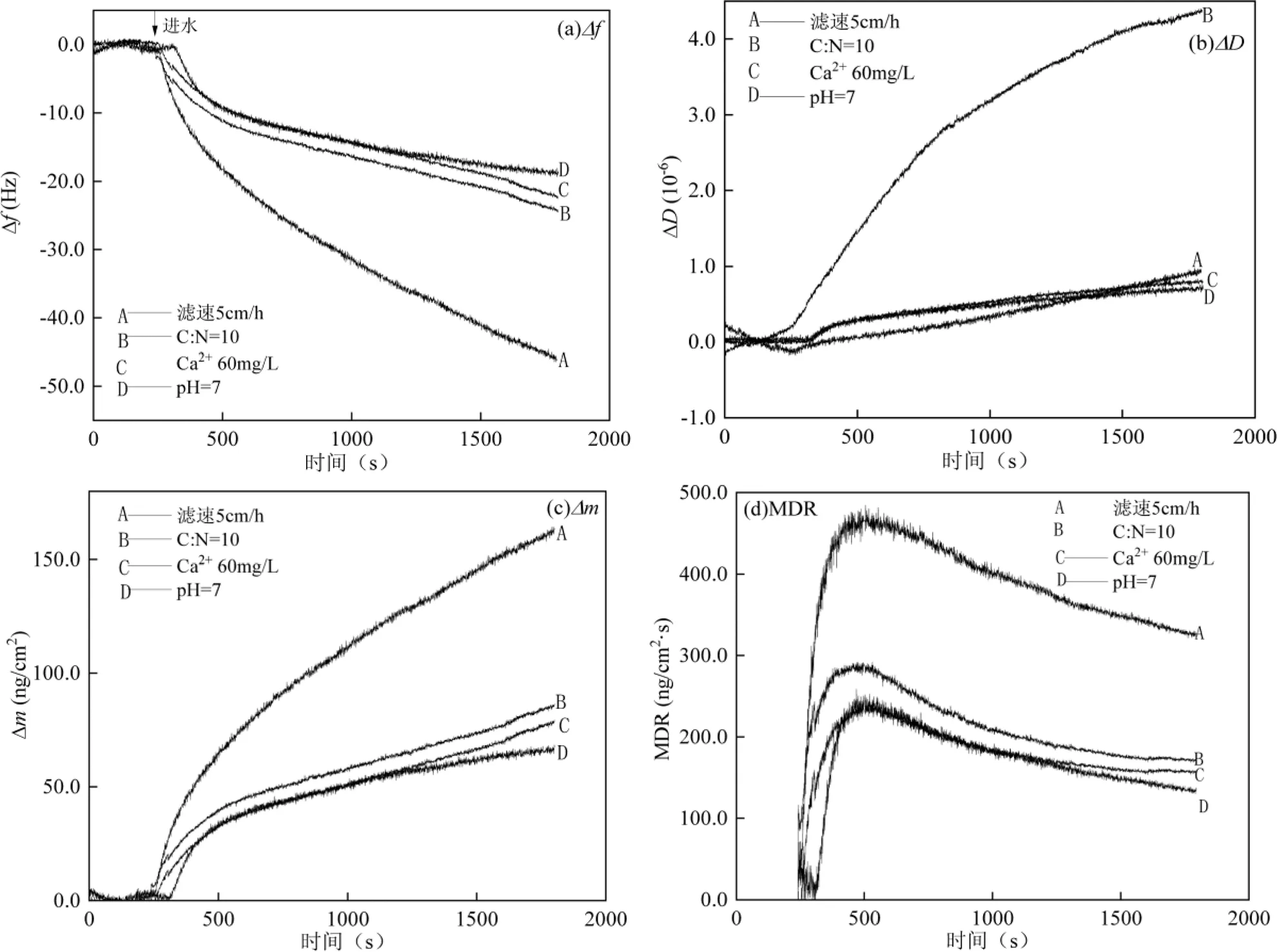
图5 污染物在慢滤生物膜EPS表面沉积因子的变化
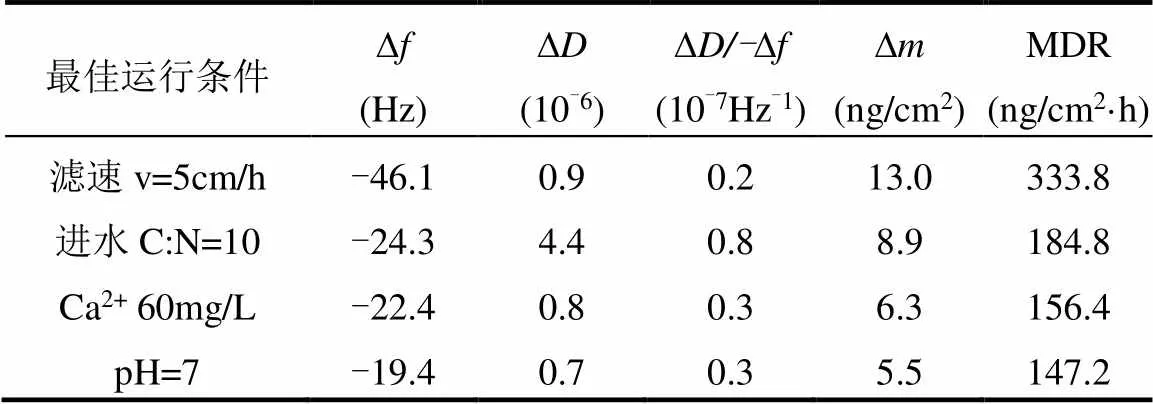
表3 不同生物膜EPS表面污染物沉积因子变化值
3 结论
3.1 相同条件下,生物膜慢滤较无生物膜慢滤对的去除效果更好;改变运行条件,慢滤进水的滤速、C/N、Ca2+浓度和pH值均存在一个最佳值;当滤速为5cm/h、C/N为10、Ca2+浓度为60mg/L、pH值为7时,生物膜慢滤的去除效果最佳.
3.2 滤速为5cm/h时,慢滤表面生物膜中变形菌属和酸杆菌属占主导地位;C/N为10时,拟杆菌属占比最大;Ca2+浓度为60mg/L时,厌氧氨氧化菌、变形菌属和拟杆菌属等占比更大;pH值为7时,滤料表面生物膜中硝化螺旋菌属、变形菌属和酸杆菌属占比更大;不同运行条件下滤料表面生物膜中的厌氧氨氧化菌、硝化螺旋菌、变形菌、拟杆菌和酸杆菌等均有利于的去除.
3.3 在滤速为5cm/h、C/N为10条件下,污染物在慢滤生物膜表面的沉积主要为EPS的粘附作用;在水中Ca2+浓度为60mg/L、pH值为7时,污染物在生物膜表面的沉积过程主要为微生物的粘附作用;随着粘附的进行,污染物在生物膜和EPS表面的质量沉积速率均逐渐趋于稳定.
[1] 宋红梅,金玉怀,李丽婕,等.石家庄市水体环境病原菌分布的研究[J]. 环境与健康杂志, 2015,32(2):140-142. Song H M, Jin Y H, Li L J, et al. Study on the distribution of environmental pathogenic bacteria in Shijiazhuang city water bodies [J]. Journal of Environment and Health, 2015,32(2):140-142.
[2] Campodónico V L, Gadjeva M, Paradis-Bleau C, et al.Airway epithelial control of Pseudomonas aeruginosa infection in cystic fibrosis [J]. Trends in molecular medicine, 2008,14(3):120-133.
[3] 周丽萍,郭明秋,陈华波,等.不同来源的铜绿假单胞菌的耐药性分析[J]. 中国实验诊断学, 2020,24(3):471-472. Zhou L P, Guo M Q, Chen H B, et al. Analysis of drug resistance of Pseudomonas aeruginosa from different sources [J]. Chinese Experimental Diagnostics, 2020,24(3):471-472.
[4] 康芳芳.不同组合工艺深度处理污水厂二级出水的试验研究[D]. 哈尔滨:哈尔滨工业大学, 2016. Kang F F. Experimental study on the deep treatment of secondary effluent from wastewater plants by different combination processes [D]. Harbin: Harbin Institute of Technology, 2016.
[5] 黄韵清,孙 傅,曾思育,等.污水深度处理中超滤工艺对有机物的截留模型[J]. 中国环境科学, 2015,35(2):420-426. Huang Y Q, Sun F, Zeng S Y, et al. Retention model of organic matter by ultrafiltration process in deep wastewater treatment [J]. China Environmental Science, 2015,35(2):420-426.
[6] Pandey S R, Jegatheesan V, Baskaran K, et al. Fouling in reverse osmosis (RO) membrane in water recovery from secondary effluent: a review [J]. Reviews in Environmental Science and Bio/Technology, 2012,11(2):125-145.
[7] 刘来胜.生物慢滤技术研究及其在集雨水饮用安全保障中的应用[D]. 北京:中国水利水电科学研究院, 2013. Liu L S. Research on biological slow filtration technology and its application in the security of drinking water from water harvesting [D]. Beijing: China Institute of Water Resources and Hydropower Research, 2013.
[8] Randtke S J, Horsley M B. Water treatment plant design [M]. McGraw-Hill, 2012.
[9] Bomo A M, Stevik T K, Hovi I, et al. Bacterial removal and protozoan grazing in biological sand filter [J]. Journal of Enrironmental Quality, 2004,33(3):1041-1047.
[10] 齐 鹏,胡 春,邢学辞,等.铁改性石英砂过滤协同控制饮用水含氮消毒副产物和条件致病菌[J]. 环境科学, 2022,43(2):887-895. Qi P, Hu C, Xing X C, et al. Synergistic control of nitrogenous disinfection by-products and conditioned pathogens in drinking water by iron-modified quartz sand filtration [J]. Environmental Science, 2022,43(2):887-895.
[11] Dorea C C, Clarke B A. Chemically enhanced gravel pre-filtration for slow sand filters: advantages and pitfalls [J]. Water Science and Technology: Water Supply, 2006,6(1):121-128.
[12] 董 军.慢滤池去除原水中微量有机物及氨氮的应用研究[D]. 昆明:昆明理工大学, 2008. Dong J. Application study on the removal of trace organic matter and ammonia nitrogen from raw water by slow filtration tank [D]. Kunming: Kunming University of Science and Technology, 2008.
[13] 李继民.不同滤料的生物慢滤柱处理微污染窖水研究[D]. 兰州:兰州交通大学, 2018. Li J M. Study of biological slow filtration columns with different filter media for treating micro-polluted cellar water [D]. Lanzhou: Lanzhou Jiaotong University, 2018.
[14] 张文妍.曝气生物滤池预处理黄浦江上游水的生产性试验研究[D]. 南京:河海大学, 2003. Zhang W Y. Productive experimental study of aeration biofilter pretreatment of upper Huangpu River water [D]. Nanjing: Hohai University, 2003.
[15] Wang T, Wang X, Long Y, et al. Ion-specific conformational behavior of polyzwitterionic brushes: exploiting it for protein adsorption/ desorption control [J]. Langmuir, 2013,29(22):6588-6596.
[16] Cotar A I, Chifiriuc M C, Dinu S, et al. Quantitative real-time PCR study of the influence of probiotic culture soluble fraction on the expression of Pseudomonas aeruginosa quorum sensing genes [J]. Roumanian Archives of Microbiology & Immunology, 2010,69(4): 213-223.
[17] 魏 萍.污水中好氧环境下细菌的凝聚机理及影响研究[D]. 西安:西安建筑科技大学, 2020. Wei P. Study on the mechanism and influence of bacterial coagulation in aerobic environment in wastewater [D]. Xi'an: Xi'an University of Architecture and Technology, 2020.
[18] 曹相生,刘 杰,孟雪征,等.滤速对慢滤池深度处理生活污水的影响[J]. 生态环境学报, 2010,19(8):1947-1950. Cao X S, Liu J, Meng X Z, et al. Influence of filtration rate on the deep treatment of domestic wastewater in slow filtration ponds [J]. Journal of Ecology and Environment, 2010,19(8):1947-1950.
[19] 李思敏,张 胜,孙广垠,等.生物砂滤池除氨氮效果及影响因素分析[J]. 中国给水排水, 2006,22(1):74-76. Li S M, Zhang S, Sun G Y, et al. Analysis of the effect and influencing factors of ammonia nitrogen removal in biological sand filter tank [J]. China Water Supply and Drainage, 2006,22(1):74-76.
[20] 王亚军,曹相生,孟雪征.不同C/N DEHP对反硝化生物滤池的影响及其去除[J]. 水利天地, 2015,(2):7-10. Wang Y J, Cao X S, Meng X Z. Effect of different C/N DEHP on denitrification biofilter and its removal [J]. Water World, 2015, (2):7-10.
[21] 仇雁翎,赵建夫,李咏梅,等.A1-A2-O生物膜系统处理焦化废水试验中好氧段影响因素的研究[J]. 重庆环境科学, 2001,23(6):16-19. Qiu Y L, Zhao J F, Li Y M, et al. Study on the influencing factors of aerobic section in the experiment of A1-A2-O biofilm system for treating coking wastewater [J]. Chongqing Environmental Science, 2001,23(6):16-19.
[22] 张若琳,冯东向,张发旺.进水碳氮比对悬浮载体生物膜反应器运行特性影响的研究[J]. 勘察科学技术, 2006,(4):24-27. Zhang R L, Feng D X, Zhang F W. Study on the effect of feedwater carbon to nitrogen ratio on the operating characteristics of suspended carrier biofilm reactor [J]. Survey Science and Technology, 2006,(4): 24-27.
[23] 朱 哲,李 涛,王东升,等.Ca2+在活性污泥生物絮凝中的作用研究[J]. 环境工程学报, 2009,3(4):612-616. Zhu Z, Li T, Wang D S, et al. Study on the role of Ca2+in activated sludge bioflocculation [J]. Journal of Environmental Engineering, 2009,3(4):612-616.
[24] 于柏峰,张慧云,刘 冰,等.铜绿假单胞菌致病力和致病机理研究进展[J]. 微生物学杂志, 2004,24(1):52-53. Yu B F, Zhang H Y, Liu B, et al. Progress in the study of pathogenicity and pathogenesis of[J]. Journal of Microbiology, 2004,24(1):52-53.
[25] 张 颖.Ca2+、Mg2+强化Pesudomonoas stutzeri XL-2生物膜形成的机理研究[D]. 重庆:重庆大学, 2019. Zhang Y. Mechanisms of Ca2+and Mg2+-enhanced biofilm formation in Pesudomonoas stutzeri XL-2 [D]. Chongqing: Chongqing University, 2019.
[26] 李明远.微生物学与免疫学[M]. 北京:高等教育出版社, 2010:290. Li M Y, Microbiology and Immunology [M]. Beijing: Higher Education Press, 2010:290.
[27] Hasan H A, Muhammad M H, Ismail N. A review of biological drinking water treatment technologies for contaminants removal from polluted water resources [J]. Journal of Water Process Engineering, 2020,33:101035.
[28] 董庆利,姚 远,赵 勇,等.铜绿假单胞菌的温度、pH值和乳酸钠主参数模型构建[J]. 农业机械学报, 2014,45(1):197-202. Dong Q L, Yao Y, Zhao Y, et al. Model construction of the main parameters of temperature, pH and sodium lactate for[J]. Journal of Agricultural Machinery, 2014,45(1):197- 202.
[29] Wang F, Devine C L, Edwards M A. Effect of corrosion inhibitors on in situ leak repair by precipitation of calcium carbonate in potable water pipelines [J]. Environmental Science & Technology, 2017, 51(15):8561-8568.
[30] Cui Q, Fang T, Huang Y, et al. Evaluation of bacterial pathogen diversity, abundance and health risks in urban recreational water by amplicon next-generation sequencing and quantitative PCR [J]. Journal of Environmental Science, 2017,57:137-149.
[31] Sun J, Guo L, Li Q. et al. Structural and functional properties of organic matters in extracellular polymeric substances (EPS) and dissolved organic matters (DOM) after heat pretreatment with waste sludge [J]. Bioresource Technology, 2016,219:614-623.
[32] Ferguson A S, Layton A C, Mailloux B J, et al. Comparison of fecal indicators with pathogenic bacteria and rotavirus in groundwater [J]. Science of the Total Environment, 2012,431(5):314-322.
[33] 金舒敏.NOM超滤膜污染的界面作用解析及高级氧化预处理研究[D]. 哈尔滨:哈尔滨工业大学, 2018. Jin S M. Analysis of interfacial effects of NOM ultrafiltration membrane contamination and advanced oxidation pretreatment study [D]. Harbin: Harbin Institute of Technology, 2018.
[34] Chen X, Stewart P S. Biofilm removal caused by chemical treatments [J]. Water Research, 2000,34(17):4229-4233.
[35] 熊雪君.二沉池出水有机物混凝机制与膜污染控制研究[D]. 武汉:华中科技大学, 2019. Xiong X J. Study on coagulation mechanism and membrane pollution control of organic matter in secondary sedimentation tank effluent [D]. Wuhan: Huazhong University of Science and Technology, 2019.
[36] Osunmakinde C O, Selvarajan R, Mamba B B, et al. Profiling bacterial diversity and potential pathogens in wastewater treatment plants using high-throughput sequencing analysis [J]. Microorganisms, 2019,7(11): 506.
[37] 李 默.氧化-超滤工艺对污水厂二级出水有机物及生物毒性削减效能的研究[D]. 哈尔滨:哈尔滨工业大学, 2019. Li M. Study on the efficacy of oxidation-ultrafiltration process on the reduction of organic matter and biotoxicity in secondary effluent of wastewater plants [D]. Harbin: Harbin Institute of Technology, 2019.
[38] More T T, Yadav J S S, Yan S, et al. Extracellular polymeric substances of bacteria and their potential environmental applications [J]. Journal of Environmental Management, 2014,144:1-25.
[39] van der Wielen P W J J, Van der kooij D. Nontuberculous mycobacteria, fungi, and opportunistic pathogens in unchlorinated drinking water in the Netherlands [J]. Applied & Environmental Microbiology, 2013,79(3):825-834.
[40] Huang J G, Chen S S, Ma X, et al. Opportunistic pathogens and their health risk in four full-scale drinking water treatment and distribution systems [J]. Ecological Engineering, 2021,160:106-134.
Removal ofin secondary effluent from sewage plants by slow filtration.
SUN Li-hua1*, WANG Chun-fang2, ZHU Jun-yao3, DENG Si2
(1.Key Laboratory of Urban Rainwater System and Water Environment, Ministry of Education, Beijing University of Civil Engineering and Architecture, Beijing 100044, China;2.School of Environmental and Energy Engineering, Beijing University of Civil Engineering and Architecture, Beijing 100044, China;3.Beijing Dongcheng District Housing and Urban Construction Committee, Beijing 100027, China)., 2023,43(8):3946~3955
This study investigated the removal ofin secondary effluent from sewage plants, as well as the related mechanism. Different slow filtration parameters influence onremoval such as filtration velocity, carbon nitrogen ratio, ion concentration and pH were examined. The results showed that 87.0% removal ofcould be obtained under the optimizing condition with 5cm/h of filtration velocity, 10: 1of C/N , 60mg/L of Ca2+at pH7. And the biofilm on the filter surface had the highest diversity and the most uniform of the species composition under this condition,spp. andspp. accounted for the largest proportion of the relative abundance of microorganisms with removal effect on. Mechanism study revealed that the deposition of pollutants on the biofilm surface of the filter was mainly attributed to the adhesion of extracellular polymers under 5cm/h of filtration velocity, 10: 1of C/N, while the adhesion of microorganisms contributed for the deposition of pollutants under 60mg/L of Ca2+at pH 7.
slow filtration;;secondary effluent;operating conditions;deposition process
X703
A
1000-6923(2023)08-3946-10
孙丽华(1978-),女,山东烟台人,教授,博士,主要从事再生水处理及膜法水处理技术方面的研究.发表论文40余篇. sunlihuashd@163. com.
孙丽华,王春芳,朱珺瑶,等.慢滤对污水厂二级出水中条件致病菌的去除 [J]. 中国环境科学, 2023,43(8):3946-3955.
Sun L H, Wang C F, Zhu J Y, et al. Removal ofin secondary effluent from sewage plants by slow filtration [J]. China Environmental Science, 2023,43(8):3946-3955.
2022-12-31
国家自然科学基金资助项目(52070011)
* 责任作者, 教授, sunlihuashd@163.com

