红肉苹果MdMKK9互作蛋白的筛选与鉴定
孙晓红 李欣欣 王彦博 陈奕州 张玉刚


摘要:MKK9是丝裂原活化蛋白激酶(MAPK)家族重要成员之一,是在植物细胞响应外界胁迫信号转导中发挥重要作用的酶。为深入研究苹果MKK9的相关功能,以红肉苹果‘黛红为材料,克隆到MdMKK9基因CDS序列,利用酵母双杂交试验筛选苹果cDNA文库,并通过酵母双杂交筛选、体内双分子荧光互补(BiFC)和体外Pull-down试验进行MdMKK9互作蛋白验证。结果表明,通过对苹果cDNA文库的筛选,共获得11个参与调控植物生长发育及应答逆境胁迫的候选互作蛋白;选取花青苷合成相关蛋白MdCHS及氮胁迫调控相关蛋白MdSPX3进行酵母双杂交、体内BiFC及体外Pull-down试验,结果证明MdMKK9可与MdSPX3互作。
关键词:红肉苹果,MdMKK9,酵母双杂交;双分子荧光互补;互作蛋白
中图分类号:S661.I:Q78 文献标识号:A 文章编号:1001-4942(2023)02-0020-10
丝裂原活化蛋白激酶(mitogen-activated protem kmase,MAPK)级联信号系统是广泛存在于真核生物的信号传递系统,尤其在植物响应外界环境胁迫信号转导过程中发挥重要作用。MAPK模块包括3种激酶,分别为MKKK、MKK和MAPK,其中MAPKKs成员数量最少(拟南芥10个,番茄5个,黄瓜6个),可分为A、B、C、D4个亚族,另外,部分植物中也发现了MAP-KKKKs的存在。当植物受到辐射、病原体、干旱等外界信号刺激时,MKKK、MKK和MAPK会改变静止状态,发生顺序的磷酸化反应,激活下游靶标基因,从而对植物生长发育、基因表达和环境适应等方面进行调控。如拟南芥中4-甲氧基吲哚基-3-甲基硫代葡萄糖苷的生物合成和积累,为其硫代葡萄糖苷响应非生物胁迫提供了MAPK介导的信号通路:MKK9是MAPK级联信号途径MKKs中D亚族的重要成员,在拟南芥中响应低氮、低磷胁迫从而调控花青苷的合成:棉花中GhMKK9与GhRaf19存在互作关系,参与棉花抗枯萎病的生物过程;拟南芥的MKK9-MPK6级联系统通过调控RCA、Ftsz2-2,TOR2和PRPSJ的磷酸化在响应盐胁迫中发挥作用,轻度盐渗透胁迫能够激活MKK9 -MAPK3/6级联信号系统;MKK9作为盐处理拟南芥愈伤组织积累H2O2的正因子,与MAPK3/6形成信号通路增强细胞的呼吸作用;MKK9 -MAPK3/6级联反应能够促进拟南芥幼苗对磷的吸收;RAF22-MKK7/MKK9-MPK3/MPK6形成一个完整的级联过程,通过参与蔗糖分解代谢来调控拟南芥的生长;磷脂酸(phosphatidic acid,PA)能够同时结合MPK6和MKK9,增强MKK9对MPK6的磷酸化活性;MKK9的组成型和诱导型过表达导致拟南芥叶片过早衰老,敲除MKK9后叶片则延迟衰老;拟南芥MKK9通过调节花青素积累和氮状态来调节植物对低氮胁迫的适应。但苹果中MdMKK9生物学功能研究尚少,MdMKK9互作蛋白的研究未见报道。本研究通过对红肉苹果cDNA文库的筛选得到MdMKK9互作蛋白,选取与花青苷合成和氮调控相关蛋白,利用酵母双杂交、体内双分子荧光互补(BiFC)和体外Pull-down试验进行互作蛋白验证,以期为今后预测MdMKK9在花青苷积累和氮胁迫响应方面的功能提供参考。
1材料与方法
1.1试验材料与试剂、仪器
供试材料为红肉苹果‘黛红,种植于青岛农业大学胶州现代农业示范园。
大肠杆菌(E.coli)DH5a感受态、大肠杆菌BL21(DE3)感受态、酵母(Saccharomyces cerevisiae)Y2H Gold感受态,购于上海唯地生物技术有限公司;pGADT7文库质粒及pGBKT7、pGADT7、pGBKT7-53(对照载体)、pGADT7-T、pGBKT7-Lam、pCAMBIA1300-nLUC、pCAMBIA1300-cLUC、pET-32a、pGEX-4T-l载体均为实验室保存。
SD缺陷培养基、YPDA培养基、X-a-gal、AbA购于TaKaRa。
PCR仪(TaKaRa TP-600)、植物活体荧光仪、电泳仪(Bio-Rad PowerPac-3000)、凝胶成像系统、恒温培养箱及摇床等。
1.2试验方法
1.2.1pGBKT7-MdMKK9诱饵表达栽体构建把本实验室前期扩增得到的MdMKK9基因的CDS区域(GenBank登录号为ON427820)重组到pGBKT7载体的EcoRI和BamHI之间,构建诱饵表达载体,命名为pGBKT7-MdMKK9。
1.2.2诱饵质粒细胞转化效率和毒性檢测及AbA(金担子素)浓度筛选 参照YestmakerYeast Transformation System 2 User Manual中菌落数要求,根据公式计算转化效率。通过比对pGBKT7空载和pGBKT7-MdMKK9在SD-Trp板上酵母菌落生长状况检测诱饵质粒毒性。通过对pGBKT7-MdMKK9自激活检测筛选适宜的AbA浓度。
1.2.3酵母文库双杂交 按照Matchmaker Gold Yeast Two-Hybrid System操作说明进行酵母文库双杂交。将转化好的杂交菌液涂布于直径150mm的SD-Trp-Leu/AbA培养基平板上,30℃倒置培养3-4 d。将SD-Trp-Leu/AbA培养基上有明显生长优势的单克隆菌落,用灭菌枪头划线于SD-Trp-Leu-His-Ade/AbA/X-a-gal培养基上,30℃倒置培养2-3 d,得到蓝色菌斑。挑取蓝色明显单菌落,加入10uL ddH2O均匀稀释进行阳性克隆筛选,利用引物pGADT7-F/pGADT7-R进行PCR扩增,将只扩增出一条带的菌液进行测序,测序结果利用NCBI数据库及苹果基因组数据库对可能互作的相关蛋白编码基因进行注释分析。
1.2.4pGADT7-MdCHS、pGADT7-MdSPX3载体构建 根据pGADT7载体图谱及MdCHS、MdSPX3基因序列设计分别含Nde I和BamH I及EcoR I和BamH I酶切位点的引物。将双酶切的载体与基因产物16℃连接并过夜。连接产物转化大肠杆菌DH5a感受态,挑取Kan抗性板上的单克隆摇菌,菌液经交叉引物PCR筛选后进行测序。将构建的载体分别命名为pGADT7-MdCHS和pGADT7-MdSPX3。
1.2.5酵母双杂交验证MdMKK9与MdCHS、Md-SPX3互作情况 将Bait质粒pGBKT7-MdMKK9与Prey质粒pGADT7-MdCHS、pGADT7-MdSPX3共转Y2H Gold感受态细胞,并涂布在SD-Trp-Leu培养基上,30℃培养3-5 d:分别设置阳性(pGBKT7-53+pGADT7-T)与阴性(pGBKT7-Lam+pGADT7-T)对照,分别挑取对照组与试验组培养基上的单菌落,用灭菌ddH2O稀释10倍,取8uL点于SD-Trp-Leu-His-Ade/X-a-gal/AbA培养基上,观察菌落颜色变化。
1.2.6BiFC栽体构建及体内蛋白互作验证 将无MdMKK9终止密码子的ORF区域克隆到pCAMBIA1300-nLUC载体中,并将MdSPX3克隆到pCAMBIA1300-cLUC载体上,将两种重组质粒转化大肠杆菌DH5a,送公司测序成功后,转化根癌农杆菌GV3101。菌液于28℃摇至OD600为0.5-0.8,离心后用重悬液重悬,将nLUC-Md-MKK9+cLUC-MdSPX3作为试验组、nLUC-Md-MKK9+eLUC作为对照组,注射本生烟,培养2-3d,使用活体荧光仪检测LUC表达情况。
1.2.7Pull-down载体构建及体外蛋白互作验证
(1)原核表达载体构建及重组蛋白诱导表达:将MdMKK9克隆到pGEX-4T-1载体、MdSPX3克隆到pET-32a载体上,构建pGEX-4T-l-GST-MdMKK9(GST-MdMKK9)和pET-32a-HIS-Md-SPX3(HIS-MdSPX3)载体。将重组质粒转人大肠杆菌BL21,测序成功后提取质粒,转化DE3大肠杆菌。
菌液在37℃培养至OD。00为0.5~0.8时,加入200 mmol/L IPTG(异丙基-B-D-硫代半乳糖苷)进行诱导,30℃继续摇菌6h。分别于摇菌2、4、6h各取1 mL菌液作为阳性对照,取诱导前菌液1mL作为阴性对照(O h)。在离心管中加入0.2mol/L PMSF(苯甲基磺酰氟)80 uL,用超声波破碎菌液。超声波破碎条件:工作时间5s,间歇10s,功率35%,60-70 min,4℃。破碎后的菌液于4℃、5 000 r/min离心15 min,分离上清和沉淀,用PBS缓冲液(pH=7.4)重悬沉淀,用SDS -PAGE对上清和沉淀分别进行检测。
(2)重组蛋白纯化:分别对诱导的pGEX-4T-1-GST-MdMKK9(GST-MdMKK9)/pET-32a-HIS-MdSPX3(HIS-MdSPX3)蛋白使用Pierce试剂盒纯化,过柱子后洗脱蛋白。加上GST/HIS标签的纯化蛋白用于SDS-PAGE检测。
(3)Pull-down验证互作:Pull-down试验步骤同上,将诱导的HIS-MdSPX3融合蛋白与GST-MdMKK9融合蛋白按照1:1比例混合,过带有HIS活化柱料的蛋白过滤柱,洗脱蛋白用于West-ern blot检测。
SDS-PAGE跑胶后转PVDF膜,将转后的PVDF膜分别放入封闭液封闭2-3 h、放人含GST抗体的一抗抗体反应液孵育过夜及放入二抗抗体反应液孵育2-3 h,最后加入超敏化学发光试剂盒显色液进行蛋白显影。
1.2.8本研究所用引物名称及序列 研究中进行克隆基因、构建载体等工作所需的引物及其序列见表1。
2结果与分析
2.1pGBKT7-MdMKK9载体构建及诱饵质粒细胞毒性检测
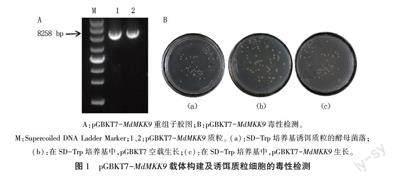
将红肉苹果‘黛红的MdMKK9基因产物连接到酵母双杂交诱饵载体pGBKT7中,得到pGBKT7-MdMKK9重组质粒。将pGBKT7和pG-BKT7-MdMKK9转化大肠杆菌DH5a,鉴定结果证明pGBKT7-MdMKK9成功转化(图1A)。
参照YeastmakerTM Yeast Transformation Sys-tem 2 User Manual中菌落数要求,选择菌落数在30-300个范围的SD-Trp平板来计算诱饵质粒细胞转化效率,根据转化效率计算公式得到最終转化效率为6x10个转化子。通过比对pGBKT7空载和pGBKT7-MdMKK9在SD-Trp板上酵母菌落生长状况证实pGBKT7-MdMKK9并无毒性(图1B)。
2.2诱饵质粒细胞自激活检测及AbA抗性浓度筛选
通过对pGBKT7-MdMKK9自激活检测发现转化pGBKT7-MdMKK9诱饵质粒的Y2H Gold酵母细胞能够在SD-Trp-Leu/AbA(200 ng/uL)上正常生长(图2A),证明诱饵质粒具有自激活能力。通过pGBKT7-MdMKK9质粒在不同浓度AbA上的生长筛选结果显示,pGBKT7-MdMKK9在300 ng/uL和400 ng/uL AbA上均没有酵母单菌落生长(图2B),所以后续试验选择300 ng/uLAbA进行文库筛选。
制作pGBKT7-MdMKK9酵母感受态,共转文库质粒,涂布在SD-Trp-Leu/AbA培养基上。2-3d后选取生长明显的单菌落(图2C)作为阳性克隆,划线于SD-Trp-Leu-His-Ade/X-a-gal/AbA培养基上,融合蛋白表达激活半乳糖苷酶活性,使得酵母菌落在含有X-a-gal的培养基上显蓝色(图2D)。
2.3互作蛋白的功能注释
将SD-Trp-Leu-His-Ade/X-a-gal/AbA培养基上筛选的蓝色菌斑进行PCR分析,选取单片段插入菌斑进行测序,获得11条读码框完整的cDNA序列,通过与NCBI数据库进行比对,获取每条序列登录号、蛋白名称及功能(表2),并根据实验目的选择花青苷合成相关蛋白CHS及氮素调控相关蛋白SPX3进行蛋白互作验证。
2.4互作蛋白验证
2.4.1酵母双杂交验证MdMKK9与MdCHS和MdSPX3的互作 以‘黛红组织cDNA为模板克隆得到MdCHS和MdSPX3。构建pGBKT7-Md-MKK9、pGADT7-MdCHS及pGADT7-MdSPX3载体(图3)。将pGBKT7-MdMKK9+pGADT7-MdCHS(标注为MdMKK9+MdCHS)、pGBKT7-MdMKK9+pGADT7-MdSPX3(标注为MdMKK9+MdSPX3)分别共转Y2H Gold酵母感受态,涂于SD-Trp-Leu-His-Ade/X-a-gal/AbA及SD-Trp-Leu-His/AbA培养基上。分别以pGBKT7-Md-MKK9+pGADT7(标注为MdMKK9+AD)、pGBK17+pGADT7-MdCHS(标注为MdCHS+BD)、pGBKT7+pGADT7-MdSPX3(标注为MdSPX3+BD)作为阴性对照,pGBKT7-53(标注为53对照)作为阳性对照。
由图4A发现,在SD-Trp-Leu-His-Ade/X-a-gal/AbA培养基上,MdMKK9+MdSPX3共转菌斑生长并变蓝,而MdMKK9+MdCHS共转菌斑未生长未变蓝,三组对照(MdMKK9+AD,MdCHS+BD,MdSPX3+BD)菌斑均未生长未变蓝。图4B结果显示,在SD-Trp-Leu-His/AbA培养基上,MdMKK9+MdSPX3共转菌斑长势与53对照相似,长势良好,MdMKK9+MdCHS共转菌斑及阴性对照均未生长。因此,初步判断MdMKK9与MdSPX3互作,与MdCHS不互作或互作较弱。
2.4.2BiFC验证互作 为进一步验证MdMKK9与MdSPX3互作,构建了pCAMBIA1300-nLUC-MdMKK9和pCAMBIA1300-cLUC-MdSPX3载体,进行本生烟注射,观察LUC表达情况得知,Md-MKK9与MdSPX3在体内互作(图5)。
2.4.3Pull-down验证互作 (1)为了进一步验证MdMKK9与MdSPX3互作,构建pET-32a-HIS-MdSPX3、pGEX-4T-l-GST-MdMKK9原核蛋白表達载体,转化大肠杆菌DH5a,测序成功后提取质粒,转化DE3大肠杆菌(图6A、B)。利用诱导剂IPTG诱导蛋白表达,从变性聚丙烯酰胺凝胶电泳图中可以发现,30℃诱导6h后MdSPX3(48.6 kD)和MdMKK9(63.1 kD)蛋白条带比诱导前(0h)明显变粗(图6C、D),说明这两个蛋白已经被成功诱导。
(2)诱导蛋白经亲和层析方法纯化后,通过SDS-PAGE检测发现,在48.6、63.1 kD处有明显的目的条带(图7A)。利用纯化后的蛋白进行Pull-down蛋白下拉试验及Westem blot蛋白印迹试验进一步验证MdSPX3与MdMKK9的互作关系,结果(图7B)显示,MdMKK9-GST可以通过与MdSPX3-HIS结合被下拉,证明MdMKK9与Md-SPX3可以在体外相互结合,即MdMKK9与Md—SPX3蛋白互作。
3讨论与结论
蛋白质之间互作是蛋白质发挥调节作用的重要方式。在细胞接收内源和外源信号、通过信号途径调节基因表达、保持物种生物学特性过程中,蛋白质都占有重要地位,且大部分蛋白质是通过与伴侣分子或其他蛋白质复合物一起发挥作用,因此蛋白质互作研究具有十分重要的生物学意义。
研究蛋白互作的工具和手段有多种,酵母双杂交可为蛋白提供接近活细胞体内环境的状态,能够直接鉴定蛋白互作情况,在筛选和鉴定MAPK级联途径研究中起着重要作用。双分子荧光互补与亚细胞定位原理相似,属植物体内试验,常用试验植物为烟草(Nicotuma tabacumL.);BiFC利用荧光蛋白作为报告基因,将荧光蛋白分割成两个不具有荧光活性的分子片段N端和C端,再分别与目标蛋白连接。体外PuU-down试验是在蛋白提取并纯化的基础上进行的。本试验用MdMKK9作为诱饵蛋白,通过酵母双杂交技术从苹果cDNA文库中筛选出MdMKK9逆境相关互作蛋白11个,挑选与花青苷合成相关的MdCHS及参与氮素调控途径的MdSPX3进行互作验证,经酵母点对点初步验证了MdMKK9与MdSPX3互作,而与MdCHS不互作或者互作信号弱:构建双分子荧光互补载体pCAMBIA1300 -nLUC-MdMKK9、pCAMBIA1300-cLUC-MdMKK9、pCAMBLA1300-cLUC-MdSPX3,对MdMKK9与MdSPX3的互作关系加以验证,在荧光显微镜下观察到MdMKK9与MdSPX3互作:体外Pull-down下拉试验进一步验证了MdMKK9与Md-SPX3互作。
SPX蛋白家族普遍存在于维管植物,在植物磷胁迫反应、缺铁反应、抗病性、低氧反应和光敏色素介导的光信号传导等代谢过程中起着重要作用。如小麦TaSPX基因在磷酸盐(Pi)饥饿条件下被显著诱导,TaSPX积极响应小麦根部低Pi胁迫过程;ZmSPX3与ZmPHR1互作,参与了玉米对低Pi的应激反应;GmSPX3参与大豆的磷酸盐稳态;SPX结构域与PP-InsP具有强亲和力,可调节植物Pi平衡,维持在减少磷肥投入的情况下获得高产;杜红园研究了甘蓝型油菜SPX3基因响应低磷胁迫的工作模式。另据报道,硝酸盐诱导的NIGTl-SPX-PHR级联信号途径亦介导了氮饥饿信号下的氮响应调节。但是SPX3对MdMKK9在响应低氮胁迫花青苷合成途径中的功能尚待继续研究。
综上,本研究通过酵母双杂交、BiFC、Pulldown等试验筛选并验证了红肉苹果MdMKK9的互作蛋白MdSPX3。

