解毒护肝方防治APAP致药物性肝损伤作用与肠道微生态的相关性探讨*
石家庄医学高等专科学校
胡巍巍 彪雅宁△ 彭小园△△ 巨 晓△△△ 刘晨旭△ 路 帅 张一昕△(石家庄 050599)
提要 目的:探讨解毒护肝方防治药物性肝损伤(DILI)的作用与肠道微生态的相关性。方法:60只C57BL/6N小鼠随机分为正常组、模型组、水飞蓟宾组及解毒护肝方低、中、高剂量组。采用对乙酰氨基酚(APAP)药液灌胃复制DILI模型,造模同时给予相应药物治疗,连续14 d。半自动生化仪检测血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)和直接胆红素(DBIL)的含量或活性,苏木素-伊红(HE)染色法观察肝脏病理形态,16SrRNA测序法分析粪便中肠道菌群组成结构。结果:与正常组比,模型组小鼠血清中ALT、AST、DBIL、TBIL的含量或活性均显著升高(P<0.01),肝细胞内可见大量的嗜酸性变和炎性细胞浸润,Chao1、Observed species、Simpson和Shannon指数均显著降低(P<0.01或P<0.05),厚壁菌门、变形菌门相对丰度以及厚壁菌门/拟杆菌门(F/B)值均明显升高(P<0.01或P<0.05),拟杆菌门相对丰度明显降低(P<0.05)。与模型组比,解毒护肝方能显著改善肝组织病理损伤,显著降低血清中ALT、AST、DBIL、TBIL的含量或活性(P<0.01或P<0.05),显著升高Chao1、Observed species、Simpson、Shannon指数以及拟杆菌门相对丰度(P<0.01或P<0.05),显著降低厚壁菌门、变形菌门相对丰度以及F/B值(P<0.01)。相关性分析结果表明,厚壁菌门、变形菌门相对丰度与肝损伤标志物成正相关,而拟杆菌门相对丰度与肝损伤标志物成负相关。结论:解毒护肝方防治DILI的机制可能与改善肠道菌群失衡有关。
药物性肝损伤(DILI)是最常见的药物不良反应之一,我国大陆住院患者的DILI年发病率约为23.80/(10万)人,占临床急性肝损伤的50%以上,已成为严重威胁人们身体健康的公共卫生问题[1]。对乙酰氨基酚(APAP)是临床上常用的解热镇痛药,在多种感冒药中均存在,正常剂量下安全有效,一旦重复用药或错误用药导致APAP在肌体含量过高,就会损伤肝脏。在西方国家,APAP已成为临床上造成的急性DILI患者比例较大的药物之一,但其发病较急,就医时常常错过最佳救治时间。因此,积极开发防治APAP致DILI的药物为当前DILI治疗领域的研究重点。
DILI发病是一个多因素、多机制的复杂过程,新近研究表明DILI发病过程中伴随肠道菌群失调现象,肠道菌群失调后可通过内毒素血症、胆汁酸代谢、脂质代谢等参与DILI的发生[2-3]。课题组以茵陈蒿汤、小柴胡汤和逍遥丸为基础,加减化裁自拟解毒护肝方。茵陈蒿汤、小柴胡汤和逍遥散均可改善肝损伤[4-6],且前期研究已证实该方对APAP诱导的肝损伤大鼠有一定的保肝效果[7]。本实验选用APAP诱导DILI模型,从肠道微生态的角度探讨解毒护肝方防治DILI的机制,进一步明确其作用机制。
1 材料与方法
1.1 实验动物 60只SPF级C57BL/6N小鼠,雄性,体质量20~24 g,购自北京维通利华实验动物技术有限公司,合格证号:110011210101691148,许可证号:SCXK(京)2016-0006。
1.2 实验药物 解毒护肝方组成:柴胡、五味子、生甘草各10 g,炒白芍、炒白术、丹参、生黄芪、楮实子、茵陈各15 g,田基黄30 g。方中所用药物均为广东一方制药有限公司生产的中药配方颗粒,批号分别为1030913、1010233、17120058、0122303、1030293、1012143、18010046、11080711、1016583、0075913。水飞蓟宾胶囊(天津天士力圣特制药有限公司,35 mg/粒,批号:750709172);对乙酰氨基酚片(石药集团欧意药业有限公司,0.5 g/片,批号:016171002)。
1.3 实验试剂 丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)试剂盒(批号分别为201001、201201、201002、210101)购自深圳市库贝尔生物科技股份有限公司;QIAampDNA提取试剂盒购于上海恒斐生物科技有限公司;琼脂糖凝胶试剂、琼脂糖凝胶电泳缓冲液(批号分别为AM9870、75510-019)均购于赛默飞世尔科技公司。
1.4 实验仪器 Humalyzer2000型半自动生化仪(德国Millimeter Mike公司);1-15K型高速冷冻离心机(美国Sigma公司);RM2016型切片机(上海徕卡仪器有限公司);DP73型数码显微镜(日本OlymPus公司);Illumina MiSeq型测序仪(美国Illumina公司)。
1.5 动物分组、造模与给药 60只小鼠随机分为正常组、模型(APAP)组、水飞蓟宾组(0.144 g/kg)、解毒护肝方低、中和高剂量组(1.11、2.22、4.44 g/kg),每组10只。上午各给药组给予相应药物灌胃,正常组和模型组给予等量蒸馏水灌胃;下午除正常组外,其余组均给予APAP(600 mg/kg)灌胃,建立DILI模型,正常组给予等量蒸馏水,给药体积10 mL/kg,给药14 d。
1.6 标本采集 实验结束后,摘眼球取血,离心以收集血清;取血后,迅速剖取肝组织用4%多聚甲醛固定;收集结肠内容物于无菌冻存管中,-80 ℃保存。
1.7 指标检测及方法
1.7.1 血清和肝组织生化指标检测:半自动生化分析仪检测小鼠血清中ALT、AST、TBIL、DBIL的活性或含量。
1.7.2 HE染色法观察肝组织的病理形态学变化:固定好的肝组织进行常规脱水,石蜡包埋,切片,HE染色,光镜下观察结果。
1.7.3 粪便DNA提取与16SrRNA测序分析:根据治疗效果,选用正常组、模型组和治疗效果较好的高剂量组的小鼠粪便进行肠道菌群分析。按照说明使用OMEGA Soil DNA试剂盒提取肠道内容物中DNA样本,1.2%琼脂糖凝胶电泳检测DNA提取质量,用338F和806R对所提取DNA中V3-V4区进行PCR扩增。扩增完成后使用Vazyme VAHTSTM DNA 清洁珠纯化,并用Quant-it PicoGreen dsDNA检测试剂盒进行定量。根据定量结果,对各样本进行等量混样,采用Illumina MiSeq测序平台进行测序。
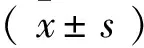
2 结果
2.1 各组小鼠血清ALT、AST活性和TBIL、DBIL含量变化 与正常组比,模型组小鼠血清中AST、ALT、TBIL、DBIL含量或活性明显升高(P<0.01);与模型组比,各用药组小鼠血清中AST、ALT、TBIL、DBIL含量或活性明显下降(P<0.01或P<0.05),详见表1。
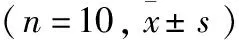
表1 各组小鼠血清ALT、AST、TBIL和DBIL活性或含量的比较
2.2 各组大鼠肝脏病理形态学变化 正常组小鼠肝小叶结构清晰,肝细胞呈放射状排列,肝细胞未见病变。模型组小鼠肝细胞排列紊乱,可见嗜酸性变和炎性细胞浸润,偶见点状坏死;各用药组小鼠肝细胞排列趋于整齐,嗜酸性变和炎性细胞浸润现象均减轻,见图1。
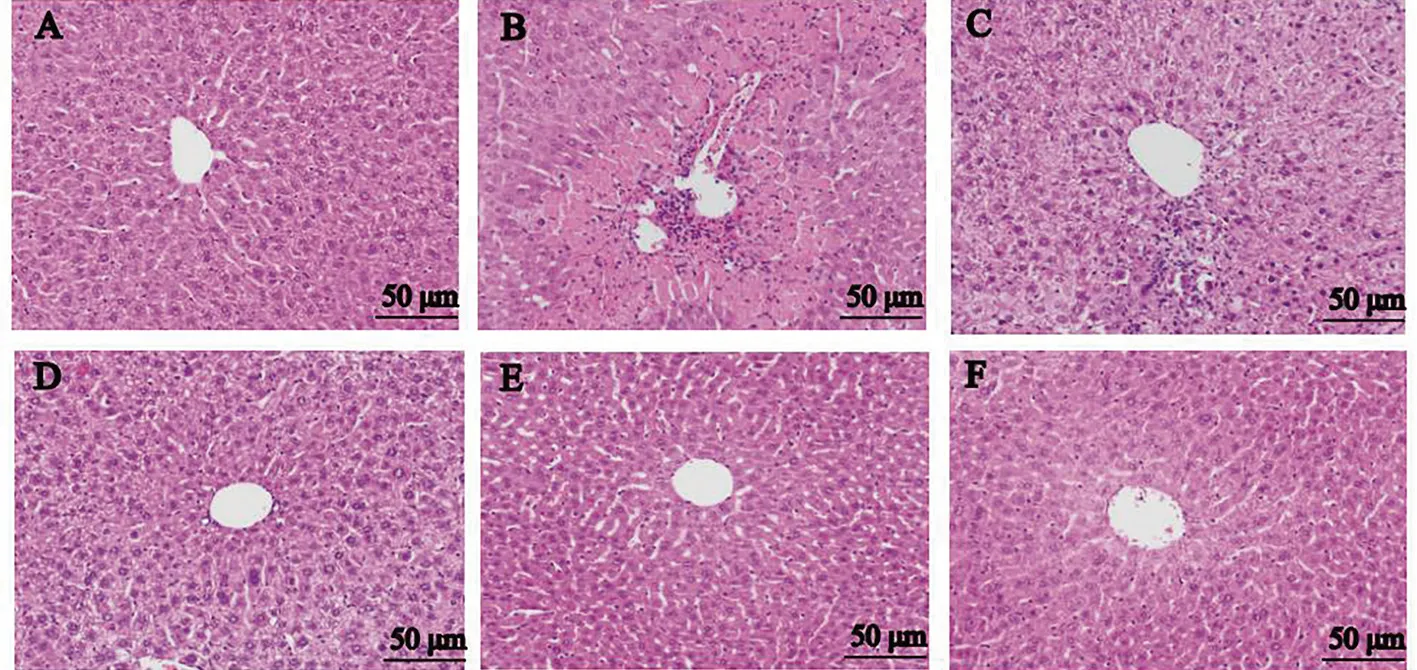
注:A.正常组;B.模型组;C.水飞蓟宾组;D.低剂量组;E.中剂量组;F.高剂量组。图1 各组小鼠肝组织病理形态变化(HE×200)
2.3 Alpha多样性分析 Alpha多样性指数中,Chao1、Observed species、Simpson和Shannon指数数值越大,说明物种丰富度和多样性越高。结果显示,与正常组比,模型组小鼠Chao1、Observed species、Simpson和Shannon指数均明显降低(P<0.01或P<0.05),与模型组比,解毒护肝方组小鼠Chao1、Observed species、Simpson和Shannon指数均明显升高(P<0.01或P<0.05),详见表2。
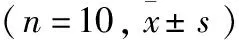
表2 各组小鼠Alpha多样性指数比较
2.4 OTU水平上的Venn图分析 由图2可知,正常组OTU数量为14 780个,模型组OTU数量为5 906个,解毒护肝方组OTU数量为10 857个,表明解毒护肝方可提高肠道菌群物种的多样性,这一结果与Alpha多样性分析结果相一致。
2.5 各组大鼠肠道菌群组成结构分析和相关性分析 在门分类学水平上,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为相对丰度较高的菌群。与正常组比,模型组小鼠粪便内厚壁菌门、变形菌门相对丰度以及厚壁菌门/拟杆菌门(F/B)值均显著升高(P<0.01或P<0.05),拟杆菌门相对丰度明显降低(P<0.05);与模型组比,解毒护肝方组小鼠厚壁菌门、变形菌门相对丰度以及F/B值均显著降低(P<0.01),拟杆菌门相对丰度明显升高(P<0.01),详见表3。
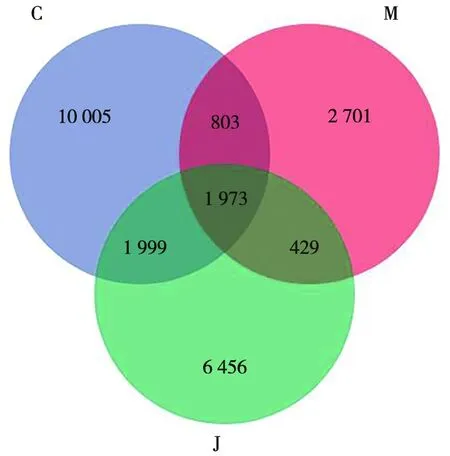
注:C.正常组;M.模型组;J.解毒护肝方组。图2 各组小鼠肠道菌群在OTU水平的Venn图
表3 各组小鼠粪便主要菌群相对丰度和F/B值比较
相关性分析结果表明,厚壁菌门、变形菌门相对丰度与肝损伤标志物成正相关并有统计学差异(P<0.01或P<0.05),拟杆菌门相对丰度与肝损伤标志物成负相关,其中与ALT活性以及TBIL、DBIL含量有统计学差异(P<0.01或P<0.05),见图3。
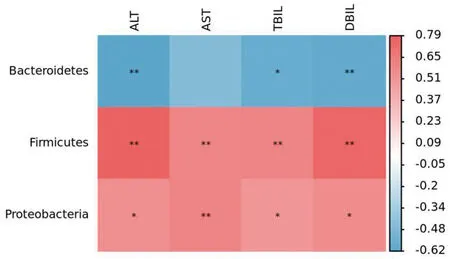
注:r<0为负相关,r>0为正相关;*P<0.05,**P<0.01。图3 Spearman's 相关性分析热图
3 讨论
中医学中并没有DILI这一病名,根据其致病特点及临床症状,将其归为“胁痛”“黄疸”“药毒”等范畴。DILI的发生多是由于药毒经口,戕伐脾胃,土壅木郁,传病到肝,肝失疏泄,致气滞血瘀,水液代谢异常,脏腑功能失司;或药毒侵袭,经表入体,直中于肝,木遏土壅,脾失健运,湿浊内生,蕴久化热,瘀毒内结所致。因此DILI主要病位在肝,并与脾密切相关,肝郁脾虚、湿热毒瘀为其主要病机,治宜疏肝健脾、清热祛湿、解毒化瘀。解毒护肝方中柴胡疏肝行气,为君药。炒白芍、五味子养血柔肝以滋肝阴,防柴胡疏泄之力过强而耗伤肝阴,生黄芪、炒白术健脾益气,4药合用,柔肝养血、健脾益气,共为臣药。茵陈、田基黄清热祛湿、调肝化浊,绝湿浊之源,楮实子清肝热、泻肝火,丹参活血祛瘀,共为佐药。生甘草清热解毒、调和诸药,为使药。全方调肝和脾、清热除湿,疏泄同时又兼有收敛之性,疏泄合宜,开阖有度,共奏疏肝解郁、健脾祛湿之效。现代药理研究表明,解毒护肝方中多种药物均能改善APAP致肝损伤,如柴胡水煎液可减少APAP毒性产物产生,以缓解APAP致肝损伤[8];五味子丙素、楮实子和黄芪甲苷可通过抗炎或抗氧化作用治疗APAP致肝损伤[9-11]。因此,本实验选用解毒护肝方为该病的治疗方剂。
ALT和AST为诊断肝损伤的敏感指标,肝细胞受损时,肝细胞膜完整性破坏,二者释放入血,ALT和AST活性升高[12]。肝脏有清除血中胆红素的作用,当肝细胞受损,肝脏对胆汁酸代谢不足时,血中胆红素含量升高,其中TBIL和DBIL可反映肝脏代谢胆红素的能力以及肝细胞损伤情况[13]。本实验结果表明,模型组小鼠血清中ALT、AST、DBIL和TBIL活性或含量均明显升高,肝细胞内出现嗜酸性变和炎性细胞浸润,提示DILI模型建立成功;解毒护肝方可明显降低小鼠血清中ALT、AST、DBIL和TBIL活性或含量,改善肝脏病理损伤,揭示解毒护肝方有较好的护肝效果。
1998年Marshal提出了“肠-肝轴”理论,这代表了肝脏与肠道的双相通信:肠道菌群失调后可影响肝功能,肝脏疾病也可诱发或加重菌群失调[14]。肠道菌群失调后,可通过脂多糖外漏和肠道代谢物失衡直接影响药物代谢,促进炎症反应和氧化应激,加重肝损伤[15]。在APAP诱导大鼠肝损伤中,肠道菌群失调可增加甲酚的产生来降低APAP的磺化作用,导致APAP在肝脏中堆积,加重肝损伤[16];已有研究证实,纠正肠道菌群失衡,可能成为防治DILI的潜在靶点,补充益生菌可降低伊立替康所致的肝脏毒性[17];APAP致肝损伤小鼠经过粪菌移植后肝损伤程度得到改善[18]。在肠道菌群中,厚壁菌门和拟杆菌门为优势菌门,约占肠道菌群总数的90%以上,二者的比值可用于评估肌体是否存在肠道菌群失调[19-20]。同时,肝病的恶化程度与拟杆菌门相对丰度降低成反比[21]。也有学者提出以变形菌门相对丰度增加作为衡量肠道菌群失调的生物性标志,变形菌门以革兰阴性杆菌居多,能够产生脂多糖,增加肠源性内毒素的含量,引发肠源性内毒素血症,加重肝脏损伤[22]。本研究结果显示,模型组小鼠肠道菌群的丰富度和多样性均降低,同时厚壁菌门和变形菌门相对丰度以及F/B值均明显升高,而拟杆菌门相对丰度明显降低,表明APAP诱导的DILI小鼠确实存在肠道菌群失调现象。解毒护肝方给药治疗后,Alpha多样性指数和拟杆菌门相对丰度均明显升高,厚壁菌门和变形菌门相对丰度以及F/B值均明显降低,提示解毒护肝方可改善肠道菌群紊乱。肠道菌群与肝功能相关性分析结果表明,厚壁菌门和变形菌门相对丰度与肝损伤标志物成正相关,拟杆菌门相对丰度与肝损伤标志物成负相关,可见解毒护肝方的保肝作用与肠道菌群密切相关。综上可知,解毒护肝方可能通过调节肠道菌群结构,从而发挥保肝的作用。

