内皮钙黏蛋白、血管生成素2 对老年脓毒症并发急性肾损伤患者的预后评估价值
林胜芬,林永强,王超超,蔡小巧
脓毒症是临床较常见的一种危重症,发病率及死亡率均较高,主要是指感染因素导致的全身炎症反应综合征[1]。脓毒症患者并发症较多,其中急性肾损伤(AKI)较为常见,40%~50%的脓毒症患者并发AKI[2]。AKI 可加重脓毒症患者病情,使其生活质量下降,导致预后较差,同时也是造成老年脓毒症患者死亡的独立危险因素。因此,积极寻找可以预测老年脓毒症并发AKI 患者的预后指标,对于及时调整诊疗方案具有重要作用。相关研究发现,内皮钙黏蛋白(VE-Cad)、血管生成素2(Ang-2)与脓毒症的发生发展密切相关[3]。本研究探讨VE-Cad、Ang-2 对老年脓毒症并发AKI患者的预后评估价值,报道如下。
1 资料与方法
1.1 一般资料 选择2017 年5 月至2022 年4 月在温州市中西医结合医院接受治疗的98 例老年脓毒症并发AKI患者作为研究对象,其中男57 例,女41例;年龄61 ~87 岁,平均(72.1±5.4)岁;AKI 分期:1 期48 例,2 期30 例,3 期20 例。根据患者28 d 治疗结果分为生存组(n=30)和死亡组(n=68)。本研究经温州市中西医结合医院医学伦理委员会审批通过。
纳入标准:符合脓毒症[4]及AKI[5]诊断标准,临床资料完整,年龄>60 岁,对研究内容知情,签署同意书,且依从性良好者;排除标准:合并恶性中或自身免疫性疾病者,既往接受过肾脏手术或有肾脏疾病使者,入组前1 周内使用过对肾毒性药物者,脓毒症合并急性呼吸窘迫综合征(ARDS)患者。
1.2 方法
1.2.1 临床资料收集 采用本院自制调查表收集患者性别,年龄,体质量,是否合并冠心病、糖尿病、高血压,舒张压,收缩压,并采用血气分析仪检测动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)。
1.2.2 血清指标检测 采集患者入院次日清晨空腹静脉外周血4ml,以转速为3000r/min,离心半径10cm离心机离心15 min,收集血清,采用酶联免疫吸附试验检测VE-Cad、Ang-2 水平,试剂盒均够自上海韵泰信息科技有限公司,收集好血清样本后寄回上海韵泰信息科技有限公司进行检测。
1.3 观察指标(1)生存组和死亡组的临床资料及血清VE-Cad、Ang-2 水平;(2)不同AKI分组患者血清VE-Cad、Ang-2 水平;(3)评估VE-Cad、Ang-2 水平对老年脓毒症并发AKI 患者预后的预测价值。
1.4 统计方法 应用SPSS 23.0统计软件进行处理,计数资料用百分率表示,采用2检验;计量资料用均数±标准差表示,采用t 检验,重复计量资料采用方差检验;预测价值分析采用受试者工作特征(ROC)曲线。P <0.05 表示差异有统计学意义。
2 结果
2.1 死亡组与生存组临床资料比较 生存组和死亡组在性别,年龄,体质量,是否合并冠心病、糖尿病、高血压,舒张压,收缩压,PaO2,PaCO2方面差异均无统计学意义(均P >0.05),见表1。

表1 两组临床资料比较
2.2 死亡组与生存组血清VE-Cad、Ang-2 水平比较死亡组血清VE-Cad、Ang-2 水平均较生存组高,差异均有统计学意义(均P <0.05),见表2。
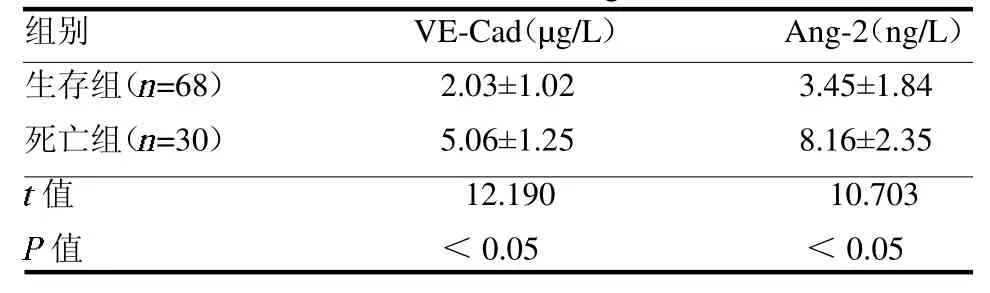
表2 两组血清VE-Cad、Ang-2 水平比较
2.3 不同AKI 分期患者血清VE-Cad、Ang-2 水平比较 不同AKI分期患者血清VE-Cad、Ang-2 水平相比,3 期>2 期>1 期,差异均有统计学意义(均P<0.05),见表3。

表3 不同AKI 分期患者血清VE-Cad、Ang-2 水平比较
2.4 预测价值分析 血清VE-Cad、Ang-2 联合预测老年脓毒症并发AKI 患者预后的AUC 值为0.837(95%CI:0.751 ~0.923),高于VE-Cad、Ang-2 单独预测的0.788(95%CI:0.697 ~0.879)、0.696(95%CI:0.572 ~0.819),见图1。
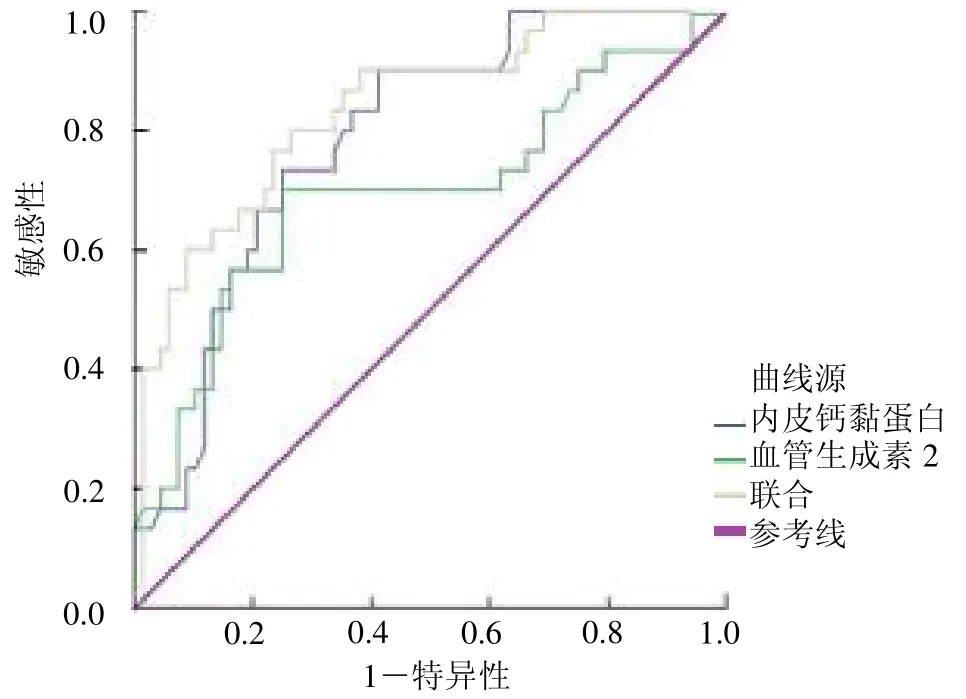
图1 VE-Cad、Ang-2 及联合预测老年脓毒症并发AKI 预后的ROC曲线图
3 讨论
脓毒症的发病机制较为复杂,主要受到创伤、感染、手术等因素刺激,导致患者体内趋化因子及炎性因子过度表达,诱发机体过度炎症反应,造成凝血、免疫系统异常及代谢微循环障碍等[6]。脓毒症患者病情凶险,进展快,临床表现以低血压、心动过速、呼吸急促、发热、多器官功能衰竭等为主,患者病死率高达30%~70%。老年脓毒症患者常并发AKI,增加治疗难度,降低患者生活质量,增加其死亡风险[7]。因此,准确评估老年脓毒症并发AKI 患者的预后,是提高救治成功率的关键。目前临床常采用尿量及血肌酐等指标对脓毒症并发AKI 患者的预后进行预测,但尿量容易受到多种因素感染,血肌酐敏感度不高,二者均无法准确反映患者预后情况[8]。
近年来研究发现,脓毒症患者体内过度炎症反应导致血管内皮细胞的损伤,造成微血管障碍,是脓毒症并发AKI 的机制之一[9]。正常情况,血管内皮细胞可维持血管内外缓解的稳定;当发生脓毒症时,血管内皮细胞过度活化,导致血小板和白细胞黏附,损伤内皮细胞,造成微血管功能障碍[10]。本研究结果显示,死亡组血清VE-Cad、Ang-2 水平均较生存组高,不同AKI 分期患者血清VE-Cad、Ang-2 水平相比,3 期>2 期>1 期(P <0.05)。这提示血清VE-Cad、Ang-2 水平在老年脓毒症并发AKI 死亡患者中显升高,且与患者病情严重程度密切相关。分析原因为:VE-Cad 是一种内皮细胞特异性钙黏蛋白,在维持血管内皮细胞屏障功能中发挥着重要作用[11]。VE-Cad 可激活Toll-样受体4,刺激增强细胞内信号传导,产生炎症反应,增加血管通透性。当VE-Cad 水平上升,导致与连环蛋白的连接状态受损,损害内皮屏障功能,增加血管通透性,造成微血管功能障碍,进而损伤肾脏功能。Ang-2 属于由血管内皮细胞合成一种血管形成因子,在脓毒症患者中呈高表达状态,Ang-2 的释放,导致血管炎症反应及渗漏的发生,造成血管通透性增高,参与肾损伤过程[12]。另外,本研究采用ROC 曲线分析VE-Cad、Ang-2 及联合预测老年脓毒症并发AKI 预后的价值,结果显示,血清VE-Cad、Ang-2 联合预测老年脓毒症并发AKI 患者预后的AUC 值明显高于二者单独检测。这进一步说明血清VE-Cad、Ang-2 水平联合检测对老年脓毒症并发AKI 患者预后具有较高的预测价值。

