基于SEER 数据库的肾嫌色细胞癌Nomogram生存预测模型的构建与验证
张继方,唐佳雯,陈芳,任莹
肾细胞癌是世界前十大常见恶性肿瘤之一,2022 年全球发病率3%~5%[1]。肾嫌色细胞癌(ChRCC)是仅次于透明细胞肾细胞癌和乳头状肾细胞癌的第三大肾细胞癌的病理类型,发病率占肾细胞癌的4%~10%[2],其是来源于集合小管上皮细胞的恶性肿瘤。2004 年起WHO 将其确定为一个独立的肾细胞癌病理分型[3]。
ChRCC生物学行为较为惰性,虽然现有研究表明,相对于透明细胞肾细胞癌和乳头状肾细胞癌,ChRCC 患者的预后较好[4]。但同样有研究指出,出现肿瘤转移及腔静脉侵及等进展表现的ChRCC 患者预后较差[5-6]。因此,对ChRCC 患者生存预后的预测、临床治疗中手术方式的选择仍然是一个非常有价值的研究方向。本研究借助SEER 数据库,利用其大规模人群数据完善的临床病理和长期的生存预后资料,通过分析ChRCC 的独立预后影响因素,构建临床预测模型,为临床治疗和患者的个体化管理提供依据,现报道如下。
1 资料与方法
1.1 数据来源 本研究数据来源于美国国家癌症研究所监测,流行病学和最终结果数据库,简称SEER数据库。纳入标准:(1)在2004—2019 年病理组织学诊断为ChRCC,且原发肿瘤位置为肾脏;(2)具有完整的基本信息、临床病理资料及明确生存时间的患者;(3)具有患者完整的治疗信息,包括有无手术治疗、有无行化学治疗和放射治疗。排除标准:(1)联合其他脏器原发癌症的患者;(2)在治疗后肾细胞癌在同侧肾脏或另一侧肾脏复发的患者;(3)仅记录了临床分级,如cT、cN、cM,而未记录病理分级的患者。
1.2 方法 最终纳入的患者以随机数字分组法按照7∶3 分为训练人群和验证人群。提取研究变量,包括基本信息、临床病理资料、治疗以及生存信息。基本信息包括患者ID编码、性别、年龄、人种及居住地类别等,临床病理资料包括肿瘤侧别、肿瘤大小、病理分期,治疗信息包括有无手术治疗、手术方式以及有无行化学治疗和放射治疗等,生存信息包括患者的生存时间和结局。
1.3 统计方法 采用SPSS 22.6 统计软件进行分析,计量资料以M(范围)表示,采用秩和检验;计数资料采用2检验;单因素和多因素Cox 分析评估OS 的独立预后影响因素;采用R 4.2.2 构建3、5 年OS 的Nomogram 预测模型,并计算c-指数(c-index),绘制校准曲线。P <0.05 表示差异有统计学意义。
2 结果
2.1 基本筛选数据结果 经过筛选,共纳入7 771例ChRCC 患者,随访时间为0 ~191 个月,3 年生存率为72.58%,5 年生存率为59.64%;按7∶3 比例随机分为训练人群和验证人群,训练人群为5 439例,验证人群为2 332 例,两组各变量差异均无统计学意义(均P >0.05),见表1。
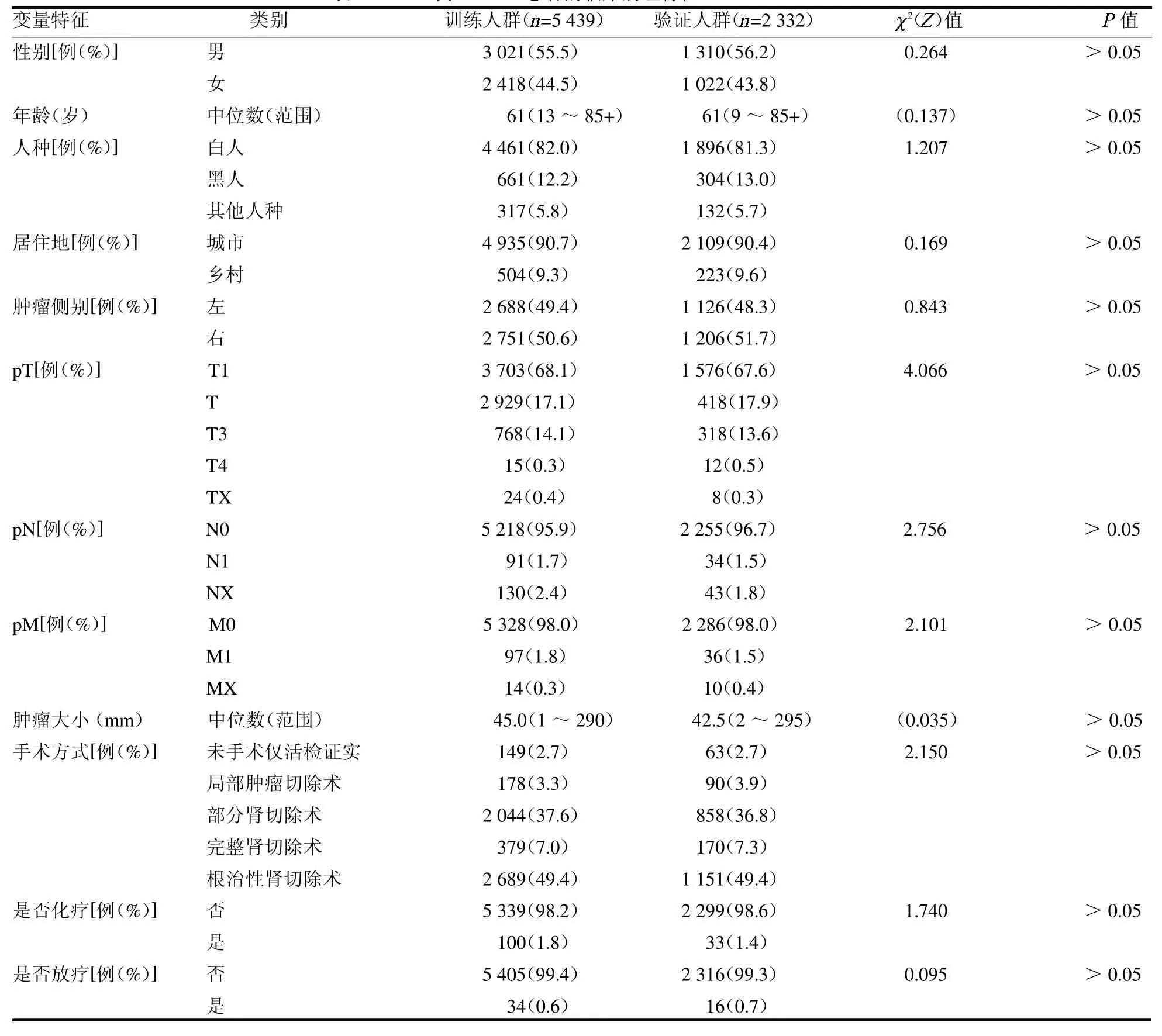
表1 7 771 例ChRCC 患者的临床病理特征
2.2 单因素与多因素Cox 分析 性别、年龄、人种、居住地、pT、pN、pM、肿瘤大小、手术方式、是否化疗和是否放疗是患者预后的独立影响因素(均P <0.05),见表2。
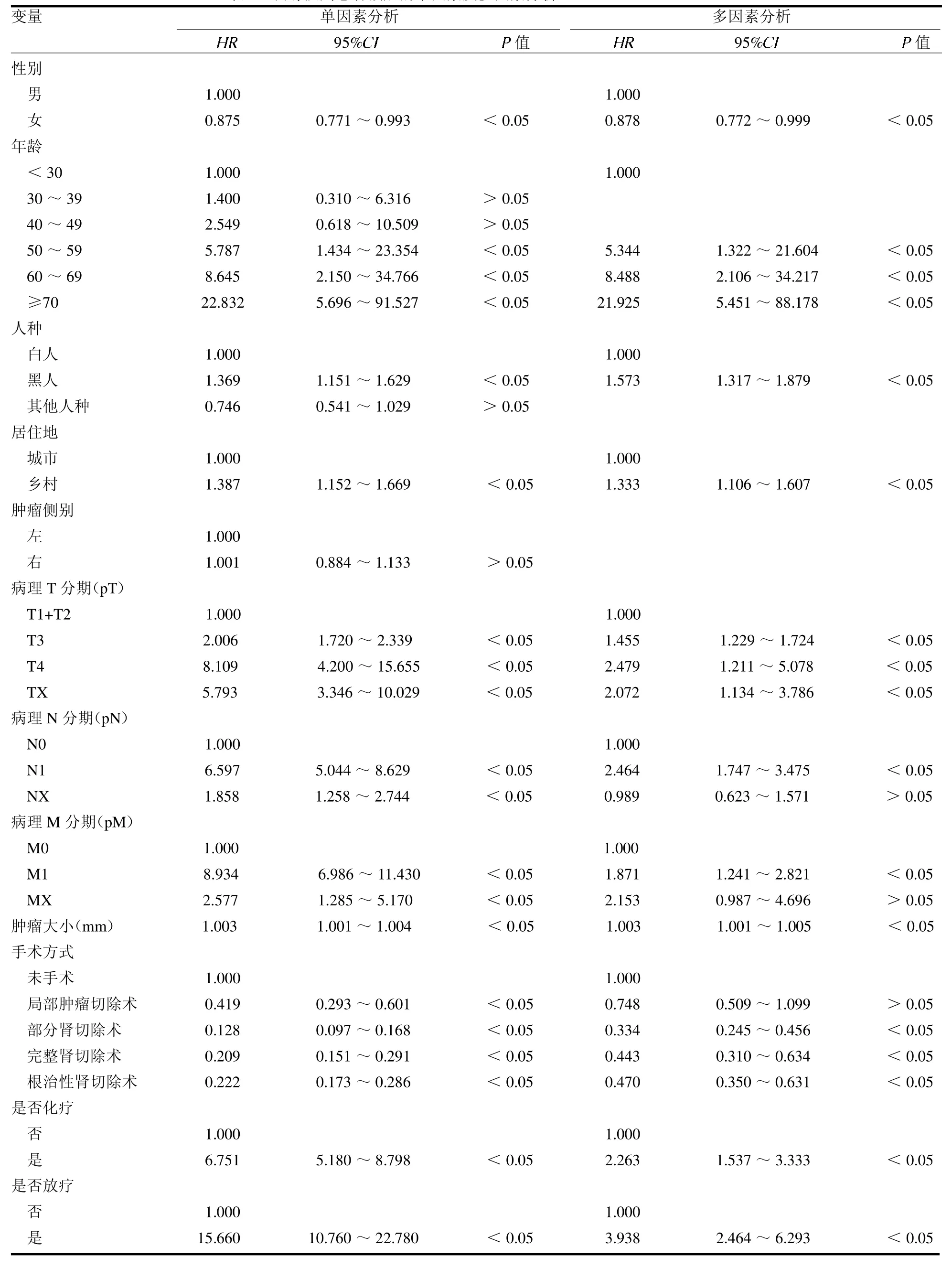
表2 训练队列患者预后的单因素及多因素分析
2.3 Nomogram 预测模型的构建 在训练人群中将Cox多因素分析为预后独立影响因素的变量用于构建Nomogram 临床预测模型,预测患者3 和5 年的生存率,见图1。该临床预测模型的c-index 为0.772(95%CI:0.756 ~0.788),生存率的校准图表明预测值和实际观测值一致性较好。

图1 预测ChRCC 患者3、5 年OS 的Nomogram 列线图
2.4 Nomogram 预测模型的验证 将用于上述已建立的Nomogram 临床预测模型在验证人群中计算对应的c 指数为0.782(95%CI:0.758 ~0.806),同时在验证人群生存率的校准图中,预测值和实际观测值有着更好的一致性。
3 讨论
ChRCC 为肾细胞癌的一个少见亚型[2],在临床中偶尔会碰到,其诊疗方法和预后情况与常见肾癌亚型有一定差异。有30%~50%缺乏早期的临床症状和体征,大多数患者在健康体检或其他疾病检查时发现,少数患者可出现“肉眼血尿、腰痛及腹部肿块”的三联征[7]。CT 检查是目前诊断肾细胞癌最可靠的影像学方法,ChRCC 的CT 多表现为肾区实性占位性肿块,ChRCC 若无确切的影像学表现,则需依赖病理学检查,借助特异的免疫组化标记物,即高表达CK7、CD117,极少表达Vimentin来进一步明确诊断[8]。
相比肾透明细胞癌,ChRCC 侵袭性较低,但仍有5%~10%的患者发生肿瘤进展或转移[6],导致患者的不良预后。众所周知,TNM 分期系统是临床评价各种恶性肿瘤的常用方法。然而,有研究提出在评估患者预后时仅依赖肿瘤的大小或侵及深度、淋巴结转移情况和有无远处转移,会忽视临床中其他可能对预后有一定影响的因素[9]。Nomogram 预测模型则可筛选并纳入更多有意义的影响因素,与TNM分期体系相比在预后预测方面更具有优势[10]。本研究利用SEER数据库纳入7771 例ChRCC,通过多因素分析筛选出ChRCC患者11 个独立预后因素,即性别、年龄、人种、居住地、pT、pN、pM、肿瘤大小、手术方式、是否行化疗及放疗,构建Nomogram 生存预测风险模型并验证效能,利用该模型预测患者的生存率,结果显示其具有较好的准确性和可靠性,能够为进一步指导患者的临床治疗提供有价值的参考依据。
本研究结果显示男性、中高龄、黑色人种及居住在农村的患者生存预后情况较差,在临床病理资料方面,pT3、pT4、pN1、pM1 期以及肿瘤直径较大者的生存预后情况较差,这与肿瘤发生进展及转移有关[11]。在治疗方面,临床中对ChRCC 患者手术范围的选择也有一定的讨论。针对于局部肿瘤切除包括经皮射频、冷冻消融、微波治疗和高强度聚焦超声消融被一些研究认为是RCC 手术治疗的可行替代方案,适用于肿瘤体积小、具有多发性肿瘤遗传倾向、孤立肾、双侧肾肿瘤、一般健康状况不佳而不适合常规手术的高风险患者[12]。然而也有研究表明,局部肿瘤切除的复发率远高于手术切除。对于T1a 期肿瘤体积较小(<4 cm)且肿瘤局限于肾内的患者,保留肾单位的部分肾切除手术具有更好的治疗效果[13]。而且这些接受肾部分切除的患者的长期生存率与接受根治性肾切除术的患者相似,这可能与对患者肾脏功能的损伤较少,进而降低了慢性肾脏疾病及心血管疾病的发病率有关[14]。在保证最终手术标本切缘阴性的前提下,对于T1b、T2 期甚至部分T3 期肿瘤,也可考虑行保留肾单位的部分肾切除手术。而对于肿瘤体积较大且恶性度高的患者首选完整性或根治性手术切除方式[13]。本研究结果表明接受部分肾切除的患者整体预后更好,其次为完整肾切除或根治性切除治疗,而未手术或局部肿瘤切除术的患者的预后较差。对患者个体化临床手术治疗方案提供一定的参考价值。
对于临床辅助治疗方面,ChRCC是一种对常规化疗与放疗耐受的肿瘤,辅助放化疗主要用于晚期肾细胞癌患者的姑息治疗,如对局部瘤床复发、区域或远处淋巴结转移、骨骼、脑或肺转移患者做姑息放疗,以提高患者的生存质量[15]。本研究结果表明,术前或术后接受化疗和放疗对ChRCC 并未有较好的预后,甚至预后更差。关于放化疗的数据记录较少,还需更多的数据进一步研究相关内容。另外,ChRCC存在一些分子遗传学改变,如Y1、2、6、10、13、17、21号染色体的丢失,以及TP53、PTEN、TERT基因的改变。关于ChRCC 术后的靶向治疗还需要更多大样本的研究,这也是一个临床治疗工作中值得深入探讨的方向。

