大黄素对胰腺癌细胞5-甲基胞嘧啶表达的影响及对抑癌基因ppENK 去甲基化的作用
陈亮,唐坚,褚永权,叶剑宏,沈超,钱晓宇,姚旭枫
胰腺癌临床表现隐匿、早期诊断困难、容易发 生远处转移,是预后很差的消化系统恶性肿瘤之一,总体五年生存率约10%[1]。尽管手术切除是唯一可能的治愈手段,但由于早期症状不典型、易发生转移等特点,大部分胰腺癌患者就诊时已无法行根治性切除[2-3]。而且接受了手术治疗,其预后仍然不是十分理想。
大黄素具有抗菌、抗炎、免疫调节、抗肿瘤等作用,Liu 等[4]报道大黄素可通过多种途径抑制胰腺癌细胞的生长,起到抗癌作用,但其具体作用机制尚不清楚。DNA 甲基化是指在 DNA 甲基转移酶(DNMTs)的催化下,对CG 二核苷酸的胞嘧啶进行化学修饰,使其成为5-甲基胞嘧啶(5mc),DNMTs在肿瘤中的表达增强,引起高甲基化抑癌基因失活,最终促进肿瘤发生[5]。目前最常用的去甲基化药物主要包括核苷类似物地西他滨和5AzA-cdR,在低浓度下通过抑制DNMT 活性发挥去甲基化作用[6]。本文主要研究大黄素对胰腺癌细胞基因组5mc 的影响,及对抑癌基因ppENK启动子区CpG岛的去甲基化作用,探讨大黄素是否可以通过降低5mc 的表达来逆转ppENK 的甲基化状态,从而使其重新表达生物活性。
1 资料与方法
1.1 材料与试剂 大黄素、5AzA-cdR 购自sigma,CCK-8 试剂盒购自Gibco,细胞/组织基因组DNA提取试剂盒(离心菌株型)购自上海杰瑞生物工程有限公司,EpiTect®MSP 套件购自QIAGEN。
1.2 方法
1.2.1 细胞系和培养 本课题组引进并保存胰腺癌细胞系Panc1 细胞株,培养于胎牛血清、链霉素和青霉素的DMEM培养基中,37 ℃,饱和水分和5%CO2条件下生长,每2 ~4 d 换一次培养基,当生长到70%~80%时传代进行实验。
1.2.2 细胞增殖实验(CCK-8) 取对数生长期的Panc1 细胞,每孔接种5×103/100l 细胞于96 孔板中,分别使用浓度为0、10、20、40 及80l 的大黄素处理细胞24、48、72 h。用酶标仪测定各孔在450 nm波长下的吸光度值(OD 值),实验重复3 次。根据以下公式计算细胞抑制率:细胞抑制率(%)=(1-实验组OD 值/对照组OD 值)×100%。
1.2.3 Dot-blot 各组作用于Panc1 细胞72 h后,用细胞/组织基因组DNA 提取试剂盒按照说明提取各组DNA,使用HS dsDNA Kit和Qubit Fluormete(rInvitrogen)通过荧光测定术来测定DNA 的浓度。Dotblot 过程参考文献[7]的方法。
1.2.4 mRNA-Seq Panc1 细胞用0、10、20及40mol/L大黄素和1mol/L 5AzA-cdR 处理72 h,然后用TRIzol®试剂提取每组总RNA,从5g 真核总RNA 开始。磁珠法分离mRNA,离子裂解mRNA,用TruseqTMRNA 样品制备试剂盒合成双链cDNA,连接index linker,经PCP 富集后,用2%的琼脂糖胶回收目的条带,TBS380(Picogreen)定量,按数据比例混合上机,cBot 上桥式扩增,用Truseq SR Cluster Kit v3-cBot-HS 生成clusters,Hiseq2000 测序平台,进行1*50 bp 测序实验[Hiseq2000 Truseq SBS Kit v3-HS(50cycles)]。
1.2.5 DNA的提取与亚硫酸盐修饰 使用Cell/Tissue Genomic DNA Extraction Kit 按照说明书分别提取DNA,检查DNA 的纯度和浓度后,取1g DNA进行亚硫酸盐修饰,修饰过程按照EpiTect的说明书进行,最后修饰的DNA 溶于30l 的Buffer EB 溶液中,立即用于PCR 反应或保存于-20℃冰箱备用。
1.2.6 甲基化特异性PCR(MSP) 根据EpiTect®MSP Kit 试剂盒说明要求,PCR 反应体系结束后,取10l PCR产物,经含GoldViewI型核酸染色剂的2%琼脂糖凝胶电泳45min,电泳结束后紫外拍照分析。1.3 统计方法 采用SPSS17.0 统计软件进行分析,计量资料以均数±标准差表示,采用单因素方差分析和t 检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 大黄素对胰腺癌细胞的生长抑制作用 大黄素可以抑制Panc1 细胞的生长,表现为时间和浓度梯度形式。40mol/L 处理72h 后,生长抑制率为49.4%,80mol/L处理72h后,其抑制率达到了64.4%,见图1。鉴于药物的去甲基化作用通常在相应较低的药物浓度下,不会对细胞产生毒副作用,因此大黄素的浓度选择为0、10、20 和40mol/L,用于后续研究。

图1 不同浓度大黄素对Panc1 的抑制作用

图2 不同浓度大黄素对5mc、5hmc 表达的影响
2.3 不同浓度大黄素对ppENK 甲基化的影响 0、10、20 及40mol/L的大黄素作用于胰腺癌细胞48、72 h 后,ppENK 基因甲基化条带表达有不同程度的减弱,非甲基化条带由几乎不表达到有不同程度的表达,且有随着药物浓度增加表达逐渐增多的趋势,对照组5AzA-cd 作用明显强于大黄素组。同一浓度的大黄素分别作用于胰腺癌细胞48、72 h,其甲基化条带随着时间有递减的趋势,非甲基化条带具有增加的趋势,见图4。
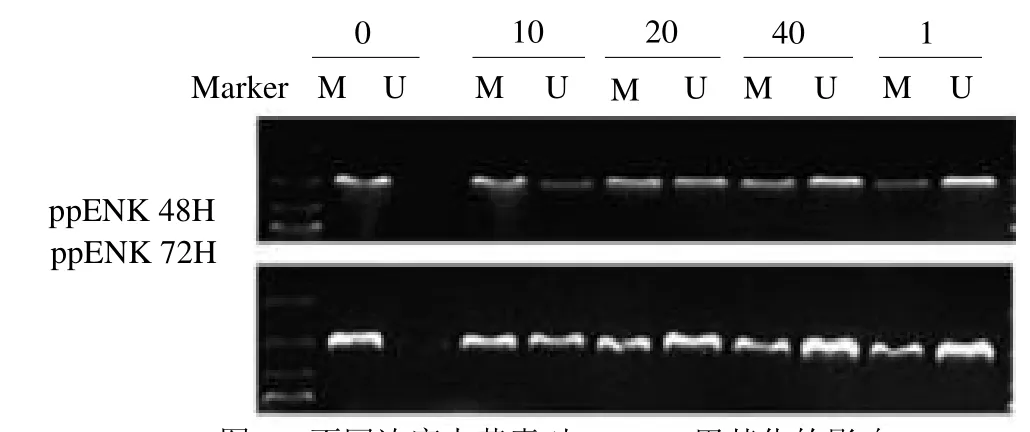
图4 不同浓度大黄素对ppENK 甲基化的影响
3 讨论
胰腺癌是恶性程度最高的消化系统肿瘤之一,是目前美国癌症相关死亡的第三大原因,其全球负担在过去几十年间增加了一倍以上[8-10]。大黄素可诱导胰腺癌细胞凋亡[11]、抑制新生血管形成[12],与吉西他滨合用可提高胰腺癌细胞对吉西他滨的耐药性,但具体机制尚不十分清楚。本研究结果表明,大黄素可以通过去甲基化作用进而影响全基因组的表达,尤其是通过降低ppENK的甲基化水平发挥抗癌作用,阐明了大黄素抗肿瘤的表观遗传调控机制。
胰腺癌抑癌基因的启动子区CpG 岛甲基化被认为是表达失活的主要原因之一[13]。ppENK 基因与肿瘤细胞生长迟缓有关,ppENK 基因位于8q23-24,由4 个外显子和3 个内含子组成。ppENK 基因编码的产物是阿片类生长因子[14]。对包括胰腺癌在内的多种肿瘤都具有生长抑制功能,在胰腺癌细胞中检测到ppENK 的高甲基化。Ueki 等[15]报道了11 种胰腺癌细胞系ppENK全甲基化,胰腺癌病理标本中ppENK 甲基化水平显着高于正常胰腺组织,表明CpG 岛的甲基化与ppENK 表达的失活有关。本研究结果显示,大黄素、5-AzA-cdR 可以显著地降低Panc1 细胞ppENK 的甲基化水平,但是大黄素作用强度要稍微弱于5-AzA-cdR。
本研究结果显示大黄素可以随着时间和浓度梯度抑制胰腺癌细胞的生长。当80mol/L 大黄素作用于Panc1 细胞72 h 后,生长抑制率为64.4%,细胞形态发生明显改变,这与以往相关文献报道一致[8],但40mol/L时其抑制率为49.4%,细胞学形态学无明显变化,故选择0、10、20 及40mol/L的大黄素药物浓度实验。
DNA CpG 岛甲基化(5mc)对基因转录沉默,基因组印迹和X染色体的失活等发挥了不可或缺的作用,但是最新研究热点主要集中在5hmc 上。5hmc由Ten-eleven translocation 酶(TET 酶)催化5mc 氧化而来,TET 酶主要有TET1、TET2、TET3[16],5hmc的具体功能不是很清楚,被认为可能是完成由5mc到C 去甲基化过程中的一个中间体,许多肿瘤组织中5hmc 的表达较正常组织相比明显减少。本实验Dot-blot 结果示40mol/L 的大黄素和1mol/L 的5AzA-cdR 可显著减少5mc 的表达,但是各浓度用药组对5hmc的表达均无明显差异,说明大黄素可以通过抑减少5mc 的生成、降低5mc 的表达来逆转ppENK的甲基化状态,从而使其重新表达生物活性。

