IGSF9在上皮性卵巢癌中的表达及对卵巢癌细胞转移能力的影响
丁佰娟 张立伟 杨慧 崔秀娟 李南
1徐州医科大学附属滕州市中心人民医院妇科,滕州 277500;2上海复旦大学附属妇产科医院妇科,上海 200011
卵巢癌是最致命的妇科恶性肿瘤,5年生存率为48.6%[1-2]。卵巢癌中最常见的病理类型是上皮性卵巢癌(epithelial ovarian cancer,EOC),占卵巢恶性肿瘤的85%~90%,其中高级别浆液性卵巢癌(HGSOC)是卵巢癌中最常见和具有侵袭性的亚型,占卵巢癌亚型的67.5%[3]。由于其发病早期无明显症状且易转移,多数患者诊断时已为晚期,预后不良[4]。标准化治疗是肿瘤细胞减灭术联合铂类加紫杉醇的化学治疗,然而,超过30%的EOC患者对铂或其他化疗药物耐药,导致疾病持续或复发[5]。免疫球蛋白超家族成员9(IGSF9)最早被克隆并被鉴定为免疫球蛋白超家族的一员,在人类和小鼠的多种组织中表达[6-8]。在多种肿瘤中,IGSF9出现表达变化:在黑色素瘤全基因组表达谱中,IGSF9在晚期黑色素瘤中表达约下调7倍[9];但是,在胆囊癌中,IGSF9表达明显升高,大约是正常胆囊组织的18倍[10]。本研究拟结合数据库及EOC临床样本分析IGSF9在EOC患者中的表达及其临床意义,细胞实验分析IGSF9对卵巢癌细胞转移能力的影响,以期为EOC的诊治提供新思路。
资料与方法
1.临床资料
选取2010年6月至2020年6月于滕州市中心人民医院妇科就诊的EOC患者原发病灶石蜡样本76例。纳入标准:⑴EOC患者术前未接受任何化疗或其他抗肿瘤治疗;⑵无其他身体部位肿瘤、盆腔炎症及卵巢相关疾病。收集同期具有完整上皮的正常卵巢组织石蜡标本30例(因子宫肌瘤等良性疾病行卵巢切除患者)作为对照组。EOC样本组患者年龄(59.62±1.58)岁,对照组患者年龄(58.34±2.76)岁,差异无统计学意义。组织样本的病理诊断均由滕州市中心人民医院的2位主治病理医生独立确认。患者相关的临床病例信息从滕州市中心人民医院病案室获得,组织样本收集告知患者并签署知情同意书。
本研究经滕州市中心人民医院、上海复旦大学附属妇产科医院医学伦理委员会审核批准(kyy2021-126)。
2.数据库资料
使用基因表达谱数据动态分析(GEPIA)网站综合分析IGSF9 mRNA表达情况,该网站是由国人开发用于分析癌组织和正常组织基因表达谱差异的公共数据库,数据来源于TCGA和GTEx的RNA测序表达数据[11]。采用Kaplan-Meier Plotter数据库(网址:http: //kmplot.com)分析IGSF9对卵巢癌患者生存期的影响。
3.免疫组化石蜡切片
免疫组织化学染色过程交由武汉谷歌生物科技有限公司代为完成,兔抗人IGSF9多克隆抗体购买于英国Abcam公司,货号ab121324,稀释比1∶100,HRP-山羊抗兔/鼠通用二抗购买于丹麦DAKO公司,货号K5007,稀释比1∶1。免疫组化染色结果分析由2位研究者独立完成,评分标准如下。染色强度评分(a):无着色0分,淡黄色1分,深黄色2分,黄褐色3分;根据阳性细胞占该视野面积评分(b):1分<25%,2分≥25%~50%,3分≥50%~75%,4分≥75%~100%;免疫组化综合得分=a×b。每张组化切片随机观察5个独立的高倍镜视野,5个观察区域的得分平均值为该组织样本的最终得分,得分≤6分为低表达,得分>6分为高表达。
4.细胞培养与转染
卵巢癌细胞株SKOV3购自中国科学院典型培养物保藏委员会细胞库,培养于McCoy 5A(Gibico,USA)培养基,根据ATCC细胞培养说明添加10%的胎牛血清(Gibico,USA)和10%的青霉素、链霉素。将细胞置于培养箱(37 ℃,含5% CO2)培养。细胞转染:IGSF9干扰质粒慢病毒浓缩液购买于山东维真生物科技公司,质粒载体为hRNA pAV-U6-GFP载体克隆,干扰载体序列如下;shRNA1:GGTCGAGGGAAGCCT GAGGTGGT;shRNA2:AATGCCTCCCAGGATGTTTCATT;shRNA3:CCTGCGACCAT TGACCAAGGAGG;shRNA4:GGCAGCTTCGTCAGCGACCCCAG。待细胞密度达70%后,将细胞用胰酶消化传代,取处于对数生长状态的细胞进行实验。将细胞消化后均匀接种至6孔板,控制细胞密度为50%左右。待细胞过夜贴壁,更换培养基,加入shRNA慢病毒颗粒浓缩液进行细胞转染。培养48 h后培养基中加入嘌呤霉素清除未转染细胞,荧光显微镜下观察绿色荧光表达情况,待阳性细胞占比达90%以上,收集一部分细胞用于抽提总RNA,qRT-PCR检测IGSF9 mRNA表达情况,挑选干扰效果最佳的IGSF9-shRNA2和IGSF9-shRNA3及shRNA NC阴性对照细胞进行后续实验。
5.qRT-PCR检测IGSF9的表达
TRIzol-酚-氯仿法从新鲜收集的细胞中提取总RNA。使用TaKaRa公司的mRNA逆转录试剂盒(货号:RR036A)配制逆转录体系,将mRNA反转录为cDNA。反应条件:37 ℃ 15 min(反转录反应),85 ℃ 5 s(反转录酶的失活反应)。得到的RT反应液加入到下一步的qRT-PCR反应体系中,选择TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)(Code No.RR820A)进行qRT-PCR,根据操作手册配制反应体系,在Applied Biosystems 7500 Real-Time PCR System仪器上进行PCR。反应步骤一:预变性95 ℃ 30 s;步骤二:PCR 95 ℃ 5 s,60 ℃ 30 s,循环40次。以GAPDH为内参,2-ΔΔCT计算IGSF9的相对表达量,其中CT值为循环阈值,实验重复3次。引物序列如下:IGSF9正向引物5'-GAAGCCTGAGGTGGTATCGG-3',反向引物5'-CAGCCACTCGATGACATGC-3';GAPDH正向引物5'-TGTGGGCATCAATGGATTTGG-3',反向引物5'-ACACCA TGTATTCCGGGTCAAT-3'。
6.Transwell小室检测干扰IGSF9后卵巢癌细胞转移能力变化
使用无血清培养基制备IGSF 9-shRNA2和IGSF9-shRNA3及shRNA NC对照3组细胞的细胞悬液,使细胞浓度为2×105个/ml,取0.2 ml细胞悬液加入Transwell小室的上室,下室加入0.5 ml含10%胎牛血清的培养基,置于培养箱中孵育48 h,取出Transwell小室上室,棉签擦上室内的细胞,固定后结晶紫染色,显微镜下拍照计数,结果取平均值。
7.统计学方法
采用GraphPad 6.0软件进行统计学处理。计量资料经正态性检验符合正态分布,以()表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,计数资料采用χ2检验。P<0.05为差异有统计学意义。
结果
1.数据库分析IGSF9基因在卵巢癌和正常卵巢组织中的表达差异
在GEPIA数据库中检索IGSF9在33种肿瘤中的表达水平,结果显示,IGSF9在卵巢癌等12种肿瘤中的表达明显高于正常组织,而在肝细胞癌、睾丸生殖细胞瘤中的表达明显低于正常组织,其中在卵巢癌中表达水平最高,且与正常组织相比差异最大,是正常组织的21.8倍(图1A)。匹配GTEx数据分析显示,IGSF9在卵巢癌组织中的表达高于正常对照,差异有统计学意义(P<0.05)(图1B)。
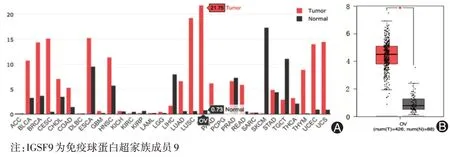
图1 基因表达谱数据动态分析数据库分析IGSF9基因的表达差异。A:IGSF9在人体正常组织和癌组织中表达差异;B:IGSF9在卵巢癌组织和正常对照组织中的表达情况
2.IGSF9表达与EOC患者预后的相关性
使用Kaplan-Meier Plotter网站分析IGSF9(Affy ID:229276_at)表达与EOC患者无进展生存期(PFS)和整体生存期(OS)的关系。PFS分析中满足条件的病例数有614例,其中高表达患者461例,低表达患者153例;Kaplan-Meier Plotter结果显示,高表达患者死亡风险比HR=1.90(1.49~2.43),logrankP=1.6e-07(图2A)。OS分析中满足条件的病例数为655例,其中高表达患者459例,低表达患者196例;Kaplan-Meier Plotter结果显示,高表达患者死亡风险比HR=1.30(1.04~1.64),log-rankP=0.023(图2B)。PFS与OS分析均提示高表达IGSF9为EOC患者预后不良的预测因子。

图2 IGSF9表达与EOC患者预后的相关性。A:IGSF9与EOC患者PFS之间的关系;B:IGSF9与EOC患者OS之间的关系
3.免疫组化分析IGSF9在EOC组织样本中的表达
免疫组化SP法显示,IGSF9的蛋白表达主要位于细胞膜及胞浆,在EOC组织中高表达,在正常卵巢组织上皮几乎不表达(图3A)。IGSF9在EOC组织和正常对照卵巢组织的高表达率分别是69.7%(53/76)和16.7%(5/30),差异有统计学意义(P<0.01)(图3B)。

图3 免疫组化SP法分析IGSF9在EOC组织和正常组织中的表达。A:IGSF9在正常卵巢组织呈阴性表达,在EOC组织中呈阳性表达(×200);B:IGSF9在EOC组织和正常对照卵巢组织的高表达率
4.IGSF9表达水平与EOC患者临床病例特征的关系
EOC患者组织样本中IGSF9的蛋白表达与EOC患者的FIGO分期、腹腔转移及血清CA-125水平有相关性(均P<0.05),与患者的年龄、腹水量、组织类型及肿瘤长径无相关性(均P>0.05),见表1。
5.IGSF9-shRNA对SKOV3细胞中IGSF9表达的抑制作用
qRT-PCR结果显示,在SKOV3细胞中转染IGSF9-shRNA后,将shRNA-NC组的IGSF9 mRNA表达水平设为1.000,shRNA1~4组的IGSF9 mRNA表达水平分别为(0.320±0.086)、(0.250±0.045)、(0.190±0.075)、(0.350±0.056),均明显低于对照组,差异均有统计学意义(均P<0.05),选取shRNA-NC组、IGSF9-shRNA2组和IGSF9-shRNA3组细胞用于后续实验。
6.IGSF9对卵巢癌SKOV3细胞转移能力的影响
Transwell小室实验提示,IGSF9-shRNA-2组、IGSF9-shRNA-3组和shRNA-NC组卵巢癌细胞的每高倍镜视野的平均穿膜细胞数分别为(64.600±2.993)、(202.200±8.919)和(69.600±6.369);IGSF9干扰组细胞的转移能力明显降低,差异有统计学意义(P<0.05),而IGSF9-shRNA2组和IGSF9-shRNA3组间的穿膜细胞数差异无统计学意义(P>0.05)。见图4。
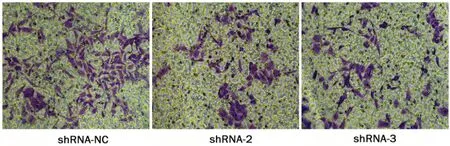
图4 IGSF9对卵巢癌SKOV3细胞株转移能力的影响
讨论
卵巢癌是发生于卵巢的恶性肿瘤,其发病率仅次于子宫内膜癌和宫颈癌,病死率却居女性生殖恶性肿瘤首位[12]。卵巢上皮性肿瘤是一种常见的卵巢肿瘤,发病隐匿,多数患者确诊时已为中晚期,严重影响患者的生存质量[13]。早期患者通过手术联合以铂类为基础的化疗可以治愈,但大多数晚期患者会出现复发、对化疗耐药、疾病无进展间隔期逐渐缩短,但是对于铂类药物具有较好反应的患者,可以通过化疗控制病情,使卵巢癌成为一种慢性疾病,改善预后[14]。因此,寻找更好的卵巢癌治疗相关的基因靶点对于改善卵巢癌患者的治疗和预后具有重要的意义。
IGSF9属于免疫球蛋白超家族成员之一,隶属于细胞黏附分子(cell adhesion molecules,CAMs)大家族。CAMs介导细胞间的相互作用和细胞与细胞外基质之间的相互作用,也可通过与其他细胞表面受体或细胞内信号分子的相互作用来调节细胞内信号转导[15]。因此,CAMs参与各种生物学和病理过程,包括细胞的存活、增殖、分化、迁移、器官发生、血管生成和炎症等[16-18]。研究表明,IGSF9在癫痫易感性中起作用,是引起癫痫易感性变化的候选基因之一。根据IGSF9的表达谱和外显子单核苷酸多态性可导致氨基酸替换,相对不易患癫痫的B6小鼠和对癫痫易感的D2小鼠的IGSF9之间的差异在于IgIV中第411位的谷氨酰胺替换为精氨酸和细胞质尾部871位的脯氨酸替换为丝氨酸[19]。在不同的肿瘤中,IGSF9有表达差异。Shi等[20]研究表明,在子宫内膜癌中,IGSF9的表达水平显著高于正常腺细胞,且高表达与患者预后不良有关,但是在黑色素瘤中表达降低[8]。不同类型癌症中IGSF9家族蛋白的上调和下调对癌症的进展是否有抑制或促进作用仍有待确定。
本研究通过数据库分析发现,IGSF9在EOC组织中的表达高于正常对照组织;进一步EOC组织样本免疫组化数据表明,IGSF9蛋白在EOC组织中高表达,在正常卵巢组织上皮几乎不表达,并且高表达与EOC患者较差FIGO分期、腹腔转移及血清CA-125水平升高有相关性;Kaplan-Meier Plotter网站关于PFS与OS的分析提示,高表达IGSF9为卵巢癌患者预后不良的预测因子;干扰IGSF9后细胞转移能力明显减弱。以上数据均表明,IGSF9可能为EOC患者的促癌因素。
综上所述,在EOC患者的组织样本中IGSF9表达升高,高表达的IGSF9提示EOC患者倾向于具有较差的临床病理特征及较差的预后,并且可能促进EOC患者的肿瘤转移。本研究结果提示,IGSF9在卵巢癌的发生发展中具有促进作用,能否成为卵巢癌相关的治疗靶点,仍有待进一步研究。利益冲突 所有作者均声明不存在利益冲突

