儿童幽门螺杆菌胃炎临床表现及镜下特点分析
郑炳升 王欢 李文文 白大明 张大莉 代东伶
1汕头大学医学院,汕头 515000;2深圳市儿童医院内镜中心,深圳 518034
幽门螺杆菌(Helicobacter pylori,Hp)作为世界上感染最为广泛的病原体,其感染人群约占世界人口总数的一半,在一些发展中国家,感染的比例高达70%以上。成人感染的Hp大部分为儿童时期治疗不及时或者不彻底获得的,这类感染可能持续终身。Hp感染是慢性胃炎、消化性溃疡最主要的病因,还与胃黏膜相关组织淋巴瘤、胃癌、缺铁性贫血、特发性血小板减少性紫癜等疾病相关[1-2]。预防和根除儿童Hp感染,既可保障儿童的生长健康,又可降低消化道溃疡和消化道恶性肿瘤在成人时期的发病率。儿童Hp感染与成人感染相比,有诸多不同之处,患儿感染症状不典型,更容易受到忽视,况且我国仍是Hp感染率较高的国家,所以提高对儿童Hp胃炎的认识非常重要[3]。
资料与方法
1.研究对象
选取2020至2022年在深圳市儿童医院行胃镜检查及黏膜活检行Hp免疫组化的慢性胃炎患儿1 028例,年龄范围1~18岁,性别不限。按照胃黏膜Hp免疫组化结果分Hp阳性和Hp阴性两组。(1)纳入标准:完善胃镜明确诊断为慢性胃炎,伴或不伴随腹痛、腹胀、恶心呃逆/嗳气、呕吐、食欲减退等不适症状的患儿。其中胃镜诊断参照中华医学会儿科学分会小儿慢性胃炎、消化性溃疡胃镜诊断标准方案进行[4]。(2)排除标准:①检查前4周曾服用抗菌药物(如阿莫西林、克林霉素、甲硝唑/替硝唑、四环素、利福平等)及铋剂,检查前2周内曾服用质子泵抑制剂或H2受体阻制剂等影响Hp诊断者;②不适宜胃镜检查者,如先天性消化道发育异常、近期有上消化道及临近部位手术、严重腹部外伤等;③临床资料不完全者。
本研究经深圳市儿童医院伦理委员会批准(202300401)。
2.检查方法
研究选用富士电子胃镜(EG-600WR型),根据患儿年龄选择不同直径的内镜,术中在胃窦和胃体、病变明显处取2~3块标本行Hp免疫组化检测及胃黏膜病理组织学检查。
3.关于Hp感染的判断
Hp感染的确诊根据胃黏膜病理组织学,胃黏膜组织Hp免疫组化试验为本次研究的金标准,取一块胃黏膜组织加入即用型抗体(中杉Hp抗体)100 μl,用另一块阳性胃黏膜组织做对照,使用全自动免疫组化染色仪(BenchMark ULTRA/XT,Ventana),DAB显色,褐色为阳性,阳性部位为细菌Hp的菌体。
4.临床数据收集
收集患儿的一般资料,包括姓名、性别、年龄、临床症状、镜下表现、胃黏膜组织病理活检内容(即Hp、活动性、慢性炎性反应、萎缩、肠化生,分别以无、轻度、中度和重度4个级别记录,简易记录为0、+、++、+++)以及其他病理组织特征[如常见的淋巴小结(又称淋巴滤泡)、胰腺化生、肉芽肿等],上述标准参考我国慢性胃炎的病理诊断标准[5]和新悉尼系统的直观模拟评分法[6]。
5.统计学分析
应用SPSSPRO统计平台进行统计分析,其中计数资料用频数或构成比表示,组间比较采用χ2检验或Fisher确切概率(T<1时),符合正态分布的计量资料以()表示。P<0.05时表示差异有统计学意义。
结果
1.研究对象一般情况
1 028例慢性胃炎患儿中,Hp阳性组216例,Hp阴性组812例,Hp阳性患儿比例为21.01%。Hp阳性组儿童216例,男124例,女92例,男女比例1.34∶1,年龄(9.31±2.72)岁,其中年龄最小为3岁,最大17岁。Hp阴性组儿童812例,男434例,女378例,男女比例1.14∶1,年龄(8.52±3.38)岁,年龄最小为1岁,最大为16岁。
2.临床表现
1 028例慢性胃炎患儿中,腹痛症状875例(87.12%),腹胀131例(12.74%),恶心/呃逆367例(35.70%),呕吐326例(31.71%),食欲减退169例(16.44%),餐后饱胀、早饱、腹泻、便秘、便血/黑便、胸口疼痛/胸闷不适、口腔异味等为少数表达症状,各占比不足1%,近2/3患儿有上述两个或两个以上的症状共存,见图1。
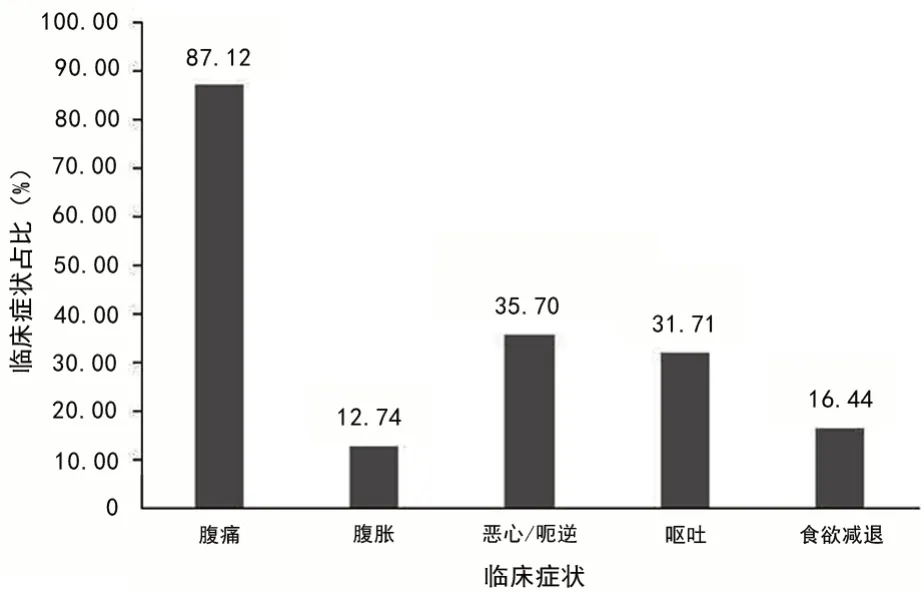
图1 1 028例儿童慢性胃炎的临床症状
进一步比较Hp阳性组与Hp阴性组患儿临床表现,结果发现腹痛、腹胀、恶心/呃逆、呕吐、食欲减退等症状,两组差异均无统计学意义(均P>0.05)。见表1。
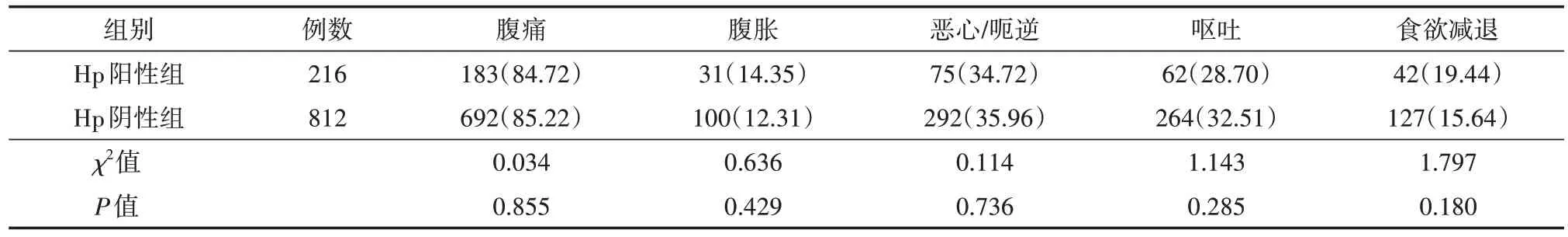
表1 两组慢性胃炎患儿的临床症状比较[例(%)]
3.胃镜下表现
本研究所有患儿胃镜下均未发现萎缩表现,Hp阳性组儿童黏膜水肿、微小结节、幽门收缩不良发生率均明显高于Hp阴性组患儿(均P<0.05);糜烂、出血点、胆汁返流等两组比较差异均无统计学意义(均P>0.05)。见表2。
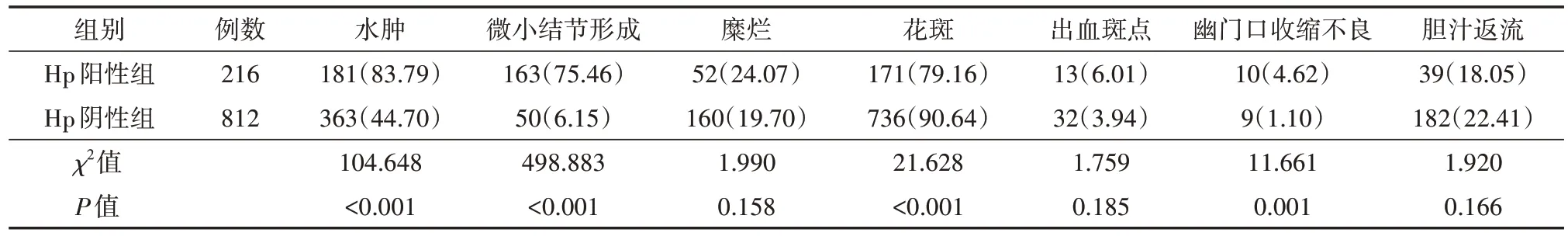
表2 两组慢性胃炎患儿镜下表现 [例(%)]
4.病理病理学检查
本研究组织病理学检查未发现黏膜萎缩表现,两组患儿均存在慢性炎性反应+,Hp阳性组患儿活动性+、慢性炎性反应++、淋巴小结检出率明显高于Hp阴性组患儿,差异均有统计学意义(均P<0.05);而Hp阳性组患儿肠化生则显著低于HP阴性组患儿。见表3。
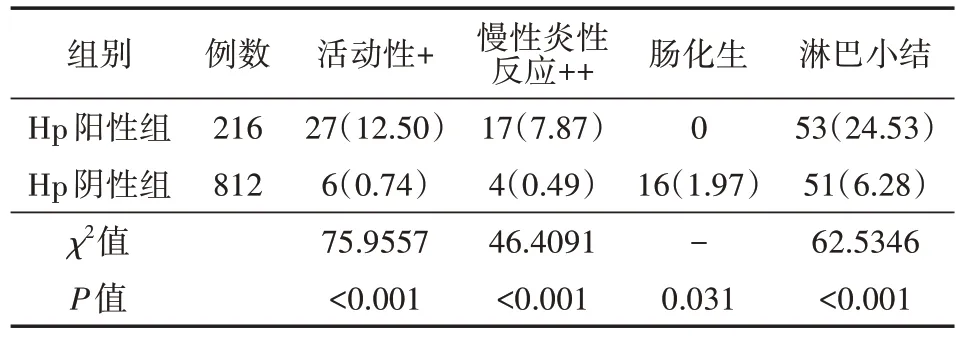
表3 两组慢性胃炎患儿病理组织活检分析[例(%)]
讨论
Hp人群普遍易感,地域、人群感染差异率大,与社会经济、卫生状况、教育程度相关[7]。本研究病例主要来自深圳市儿童医院消化内科,覆盖范围为深圳及周边地区,研究得出该区域儿童Hp感染率为21.01%,比我国目前儿童Hp平均感染率30.31%低[7]。可能与深圳及周边地区在经济上、教育、卫生方面明显优于落后地区有关,该感染率接近高收入国家的平均水平21.7%[8]。除上述因素影响外,检测方法同样会影响最终的结果,在相同的检测方法下,青岛地区儿童Hp总体感染率近期为21.8%[9],与本研究的结果相近。目前,流行病学调查多采用是血清学Hp-IgG检测、尿素呼气试验(UBT)或者甚至粪便抗原检测(SAT),其灵敏度、特异度不一。本研究为胃黏膜Hp免疫组化试验,通常被认为是“金标准”,其灵敏度、特异度最高[10],资料可靠,但是作为侵入性检查,难以广泛开展,不作为流行病学调查的常用方法,有一定的局限性。
本研究结果显示,慢性胃炎患儿腹痛是最常见的症状,占87.12%,其次为恶心/呃逆35.70%,呕吐31.71%,食欲减退16.44%,腹胀12.74%,并且2/3患儿有两个或者两个以上症状并存。Hp阳性组与Hp阴性组患儿临床症状差异无统计学意义。儿童Hp感染引起的胃炎无特异性临床表现多不典型症状[11]。Hp感染患儿内镜下则表现为黏膜发红、黏膜肿胀、皱襞肿大等表现[12]。本研究中,儿童Hp阳性组患儿黏膜微小结节发生率为75.46%,黏膜水肿发生率为83.79%,幽门收缩不良发生率4.62%,均显著高于Hp阴性组,因此,可以认为微小结节形成、胃黏膜水肿、幽门收缩不良等表现为儿童Hp胃炎的内镜特征。胃黏膜水肿、幽门收缩不良与Hp感染后诱发的炎症相关,微小结节形成考虑为Hp抗原长期刺激引起的特殊免疫反应所致[13],其镜下表现以胃窦为中心的颗粒样改变,病理改变一般为淋巴小结的形成。本研究同样得以证实,Hp阳性组与Hp阴性组在病理组织活检中检出淋巴小结数据差异有统计学意义,Hp阳性组检出率明显高于Hp阴性组,故可以认为淋巴小结为儿童Hp胃炎的组织病理学特征改变[14-15]。除了结节样表现,其他Hp胃炎特征难以得到充分的描述及体现,仍需未来进一步的统一命名及研究探讨。
Hp通过激活环氧合酶-前列腺素通路等机制导致胃黏膜萎缩及肠化生的发生发展[16],胃黏膜萎缩及肠化生在成人Hp胃炎常见[17]。但儿童与成人有所区别,日本有学者曾进行相关研究,通过与成年组(超过20岁)的对比,发现随着年龄的增加,结节表现逐渐减少,萎缩逐渐增多,超过25岁的成年患者胃黏膜萎缩的比例甚至高达65%[18],儿童胃黏膜萎缩及肠化生十分少见,或者程度较轻,可能与儿童期胃黏膜损伤后易于修复有关。本研究内镜下及病理组织活检均未发现胃黏膜萎缩表现,与相关儿童Hp胃炎的研究结论相符[19-20]。
其他组织病理学结果显示,两组患儿均存在慢性炎性反应,但是Hp阳性组患儿活动性+、慢性炎性反应++明显高于Hp阴性组患儿,提示儿童Hp感染与与胃黏膜病理变化密切相关。Hp感染会加剧其炎症程度,与既往大部分学者的研究结论相符[17,19],可能与Hp感染后吸附并释放毒素刺激产生炎症因子及趋化因子,如白细胞介素(IL)-1β、IL-6、IL-8、肿瘤坏死因子(TNF)-α,引起中性粒细胞、淋巴细胞、巨噬细胞等浸润,从而诱发炎症反应相关[21]。
综上,儿童Hp感染导致的胃炎无特异性临床表现,内镜特征为黏膜水肿、微小结节形成、幽门口收缩不良,Hp感染导致淋巴小结增生为其组织病理学特征,主要反映胃黏膜的活动性及慢性炎症程度,儿童时期胃黏膜萎缩及肠化生罕见,与成人Hp胃炎相比,有诸多方面不同。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明郑炳升、王欢、李文文、白大明、张大莉:酝酿和设计试验,实施研究,采集数据,分析/解释数据,起草文章,统计分析;代东伶:酝酿和设计试验,实施研究,采集数据,分析/解释数据,起草文章,对文章的知识性内容作批评性审阅,统计分析,行政、技术或材料支持,指导,支持性贡献

