T1-mapping评估慢性肾病肾功能损伤的价值
索朗尼玛, 冒炜, 曾蒙苏, 周建军, 丁玉芹, 曹波红, 丁小强, 傅彩霞
慢性肾脏病(chronic kidney disease,CKD)是全球性的公共健康问题,其定义为肾脏功能或结构异常持续3个月以上[1]。每年全球CKD的患病率估计为13.4%,而需要接受肾脏替代治疗的终末期肾病(end-stage renal disease,ESRD)患者大约在490~708万之间[2]。早期CKD的临床治疗相对容易、花费较低,而晚期CKD的临床治疗方案复杂、花费高昂。因此,CKD的早期诊断及肾功能损伤的精准评估对于延缓CKD进展为ESRD具有重要意义。目前临床评估CKD患者肾功能的方法主要是通过检测血清肌酐值来计算估算肾小球滤过率(estimated glomerular filtration rate,eGFR)。但是,eGFR评估的是双侧肾脏的整体功能,对于左、右单侧肾脏功能的评估价值有限,并且其受年龄、性别和体重等个体因素的影响。我们认为,如果能够准确评估左、右单侧肾脏的功能,再与eGFR相结合,对于CKD治疗效果的评价及长期随访具有重要意义。T1-mapping是定量测量组织T1值的无创性MRI技术,目前已广泛应用于评估心肌纤维化、肝功能和肝纤维化[3-6]。既往的研究已证实健康成年人肾脏T1-mapping成像的可行性[7],而此技术在评估CKD方面的应用尚处于探索阶段。因此,本研究中,笔者通过对比分析CKD患者和健康志愿者的T1-mapping检查结果,旨在探讨这项技术在评估CKD患者肾功能损伤中的价值。
材料与方法
1.研究对象
本研究经本院伦理委员会批准,所有受试者在MRI检查前签署了知情同意书。
健康对照组:前瞻性招募20例健康志愿者,包括男9例和女11例,年龄24~56岁,平均(41±10)岁。纳入标准:①近期无肾毒性药物服用史;②临床实验室检查肾功能指标未发现异常;③无肾脏疾病史;④无高血压、糖尿病等影响肾功能的疾病史。
CKD组:前瞻性纳入2021年3月-2022年2月在本院就诊的CKD患者。纳入标准:①符合CKD的诊断标准[8];②超声检查未发现肾脏有明显萎缩;③能配合完成MRI检查,无相关禁忌证。排除标准:①存在影响肾脏T1-mapping图像分析的疾病,如肾肿瘤、多囊肾等;②磁共振图像质量较差,无法进行后续的图像分析。最终,本研究共招募了60例CKD患者,包括37例男性和23例女性,年龄26~76岁,平均(48±11)岁。在MRI检查前所有患者进行血清肌酐(SCr)的检测,然后采用简化的肾脏病膳食改良公式来计算eGFR[9]:
(男性)eGFR=186×SCr-1.154×年龄-0.203
(1)
(女性)eGFR=186×SCr-1.154×年龄-0.203×0.742
(2)
根据肾脏病患者生存质量指导(kidney disease outcomes quality initiative,K-DOQI)中对CKD的分期标准[10],将CKD患者分成两组:轻度肾损伤组(eGFR≥60 mL/min/1.73 m2)31例,包括1期16例、2期15例;中重度肾损伤组(eGFR<60 mL/min/1.73 m2)29例,包括3期17例、4期9例、5期3例。
2.MRI检查方法
使用Siemens Magnetom Prisma 3.0T磁共振扫描仪、18通道相控阵体部线圈和32通道集成脊柱线圈。在T1-mapping检查前要求每例受试者禁水、禁食至少6 h,对其进行呼吸训练,检查过程中取仰卧位。T1-mapping采用冠状面Look-Locker反转恢复序列屏气扫描,扫描中心线定于肾门水平,主要扫描参数:TE 1.32 ms,TR 3.00 ms,体素大小2.0 mm×2.0 mm×8.0 mm,视野380 mm×308 mm,层厚5.0 mm,层间距1.0 mm,矩阵192×153,加速因子2,层数3,扫描时间17.0 s。扫描结束后系统自动后处理并生成T1-mapping伪彩图。
3.图像分析和评估
由2位泌尿生殖亚专业方向的放射科医师采用盲法在肾脏T1-mapping冠状面图像上进行分析和数据测量,评估2位医师测量结果的一致性,后续的统计学分析中采用两者测量结果的平均值。本研究中,我们仅测量了右肾的数据,这是为了保证数据测量的准确性和稳定性,因为心脏大血管搏动和呼吸运动对左侧肾脏的影响更显著[11]。在靠近肾门平面的冠状面T1-mapping图像上,避开肾盂、肾盏及肾周组织,分别于肾脏上、中、下极区域内的肾皮质和肾髓质内各勾画1个ROI,共6个ROI(皮质和髓质各3个),每个ROI的面积为15~18像素,肾皮质和肾髓质均取3个ROI测量值的平均值作为最终结果,用于进一步的统计学分析。
4.统计学分析
使用MedCalc 15.8和SPSS 22.0软件进行统计学分析。测量数据以均值±标准差来表示。采用组内相关系数(intraclass correlation coefficient,ICC)来评估2位医师测量的肾实质T1值的一致性,ICC≥ 0.75为一致性好,0.40≤ICC<0.75为一致性中等,ICC<0.40为一致性差。采用配对样本t检验比较每组中肾皮质与肾髓质之间T1值的差异。肾皮质和肾髓质T1值在3组之间的比较均采用单因素方差分析,进一步组间两两比较采用LSD法。采用Spearman相关性分析评估CKD患者肾皮、髓质T1值与eGFR之间的相关性,|r|<0.3为低度相关,0.3≤|r|<0.7为中度相关,0.7≤|r|<1.0为高度相关。采用ROC曲线分析评估肾皮质和肾髓质T1值鉴别CKD肾功能损伤程度的效能。以P<0.05为差异有统计学意义。
结 果
本研究中所有受试者均获得了高质量的T1-mapping图像,肾皮质和肾髓质结构显示清晰,分界清楚(图1)。
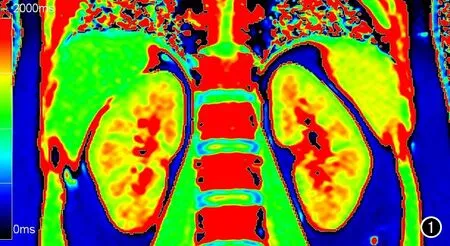
图1 T1-mapping伪彩图,肾脏的皮、髓质显示清晰,分界清楚。
1.两位医师测量值的一致性分析
两位医师测量的肾皮质和肾髓质T1值的ICC值分别为0.971(95%CI:0.956~0.981)和0.985(95%CI:0.977~0.991),一致性均非常好。
2.三组受试者肾实质T1值的比较
健康对照组、轻度肾损伤组和中重度肾损伤组肾皮质和肾髓质T1值的测量结果见表1。三组中肾髓质的T1值均大于肾皮质,差异均有统计学意义(P<0.05)。

表1 三组受试者间肾皮质和髓质T1值的比较
三组之间肾皮质和肾髓质T1值的差异均具有统计学意义(F=46.09,P<0.01;F=37.06,P<0.01)。进一步进行组间两两比较,轻度组与对照组之间、中重度组与对照组之间、以及中重度组与轻度组之间,肾皮质和肾髓质T1值的差异均有统计学意义(P<0.05)。
3.CKD患者肾实质T1值与eGFR的相关性
CKD患者eGFR与肾皮质T1值呈高度负相关(r=-0.773,P<0.01),eGFR与肾髓质T1值呈中度负相关(r=-0.689,P<0.01)。
4.肾实质T1值鉴别肾功能损伤程度的效能
肾实质T1值对肾功能损伤程度的诊断效能指标详见表2。鉴别正常肾功能(健康对照组)与轻度肾损伤:肾髓质T1值的ROC曲线下面积大于肾皮质T1值(0.866 vs.0.821)。鉴别中重度与轻度肾损伤组时,肾皮质T1值的ROC曲线下面积大于肾髓质T1值(0.874 vs.0.820)。
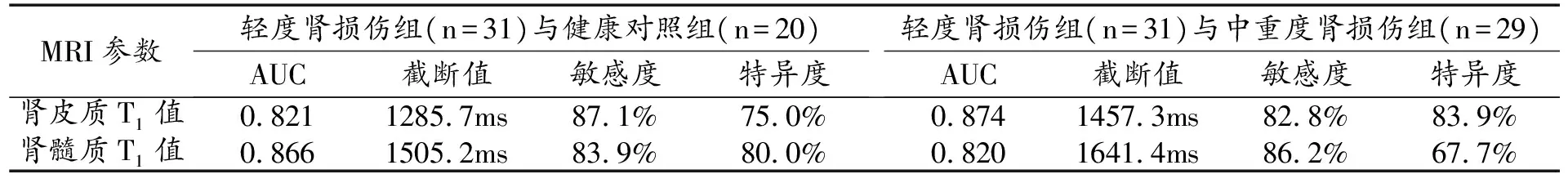
表2 肾实质T1值对肾功能损伤程度的诊断效能
讨 论
组织中氢质子受到激发跃迁至高能级状态后,关闭射频脉冲,宏观纵向磁化矢量会逐渐恢复至激发前的平衡状态,这个过程称为T1弛豫(纵向弛豫),在此过程中,自旋系统的能量会转移到周围晶格[12],它的定量参数就是T1弛豫时间。T1弛豫时间是组织的一个特征物理量,T1-mapping技术可以测量组织的T1值,组织的T1值受多种生物因素影响,如组织的水含量、水结合状态和大分子浓度等[12]。CKD中肾脏的病理学改变主要是间质纤维化、肾小管萎缩和肾小球硬化等,这些病理学改变不但会使得肾组织的微观结构发生变化,而且会影响肾脏的含水量,从而使肾脏T1值发生相应的变化。早期的研究结果表明,T1-mapping技术不仅可以评估小鼠急性肾损伤的严重程度,还可以通过评估慢性肾纤维化的严重程度来预测转归,证实了T1-mapping技术评估慢性肾脏病的可行性[13]。此外,T1-mapping技术可以用于评估移植肾的肾功能、新型冠状病毒肺炎患者肾功能损伤、糖尿病肾病患者肾病理损害、慢性乙型肝炎患者早期亚临床肾实质病变以及慢性肾小球肾炎患者的肾脏纤维化[14-18]。T1-mapping技术在评估CKD肾功能损伤方面的相关报道较少。本研究结果显示T1-mapping对CKD的肾功能损伤有一定的评估价值。
1.肾脏皮质和髓质T1值的差异
本研究中对照组、轻度肾损伤组和中重度肾损伤组受试者肾髓质T1值均明显大于肾皮质T1值,差异有统计学意义(P<0.05),这与之前的研究结果类似[7,19]。分析其原因可能为肾皮质和髓质的含水量和组织学结构不同,肾髓质主要由集合管和肾小管构成,肾皮质主要由部分肾小管和肾小球构成,并且肾髓质的含水量大于肾皮质。
2.CKD患者肾皮质和髓质T1值的变化
Hueper等[13]通过研究发现,缺血诱导的急性肾损伤小鼠肾实质的T1值会随着肾损伤程度的加深而不断升高。陈丽华等[19]采用T1-mapping评估肾移植术后移植肾功能时发现,移植肾功能受损组肾皮质和肾髓质T1值较对照组均升高。与既往的研究结果相似,本研究中肾实质T1值在3组之间的比较结果显示中重度肾损伤组、轻度肾损伤组的肾皮质和肾髓质的T1值明显高于健康对照组,差异均有统计学意义(P<0.05)。我们认为出现这种结果的原因可能为CKD患者的肾脏所发生的病理变化,如肾间质内炎性细胞浸润、水肿等,使得细胞间质内和细胞内含水量增加[20],从而使得肾组织T1值升高。不仅如此,肾间质纤维化或许也是导致肾组织T1值增加的原因之一。de Miguel等[21]采用T1-mapping技术评估抗肾小球基底膜病兔后发现,肾实质T1值与肾纤维化之间存在相关性(P<0.05)。除此之外,本研究结果还显示,中重度肾损伤组的肾皮质和肾髓质T1值均明显高于轻度肾损伤组(P<0.05)。Graham-Brown等[22]采用T1-mapping评估IgA肾病患者肾纤维化,结果显示IgA肾病患者肾皮质的T1值明显大于健康志愿者,差异有统计学意义(P<0.05);而且在IgA肾病患者中,肾纤维化评分大于0组的肾皮质T1值要高于肾纤维化评分等于0组,但差异无统计学意义(P>0.05)。此外,Wu等[23]利用T1-mapping评估慢性肾小球肾炎患者肾纤维化程度,研究发现,慢性肾小球肾炎患者的肾皮质T1值要明显高于健康志愿者,差异有统计学意义(P<0.05);而且,不同分期的慢性肾小球肾炎患者之间肾皮质T1值的差异有统计学意义(P<0.05)。上述两项研究的结果与我们的研究结果类似,但是与上述研究相比,我们的研究具有一定的优势。这是因为,上述研究中仅测量了肾皮质的T1值,而本研究中同时测量了肾皮质和肾髓质的T1值,并将两者进行了比较。所以,相比于上述的研究,我们的研究结果更加具有代表性,研究结论更加具有适用性。除此之外,Hu等[24]利用T1-mapping评估单侧输尿管结扎大鼠的肾纤维化程度,发现随着输尿管结扎时间的延长,肾纤维化程度加重,肾实质T1值会不断升高。Schmidbauer等[25]采用T1-mapping评估肾移植小鼠的慢性肾排斥反应,他们发现,与正常小鼠的肾脏和不伴有慢性排斥反应的移植肾相比,伴有慢性排斥反应的移植肾的T1值明显升高。这两项研究的结果与我们的研究结果相似,均表明随着肾纤维化的不断进展及肾功能的逐渐恶化,肾组织的T1值会逐渐升高。
3.CKD患者肾实质T1值与eGFR的相关性
Peperhove等[26]对接受器官移植的患者进行T1-mapping检查,评估其肾功能损伤情况。他们发现,器官移植患者的肾皮质和髓质的T1值均较健康志愿者升高,并且与eGFR之间存在负相关关系。Graham-Brown等[22]的研究结果亦显示,IgA肾病患者的肾皮质T1值与eGFR呈负相关。与上述研究相似,我们的研究结果显示CKD患者的eGFR与肾皮质T1值之间呈高度负相关,eGFR与肾髓质T1值之间呈中度负相关。上述结果表明T1-mapping用于评估CKD患者的肾功能是可行的。
4.肾实质T1值对肾功能损伤程度的诊断效能
本研究结果显示,鉴别健康对照组与轻度肾损伤组时,肾髓质T1值的AUC大于肾皮质;而鉴别中重度与轻度肾损伤组时,肾皮质T1值的AUC大于肾髓质。Wu等[23]的研究中肾皮质T1值鉴别慢性肾小球肾炎患者有无肾纤维化的AUC为0.762,低于本研究中肾皮质和髓质T1值鉴别肾功能损伤程度的AUC(均大于0.80)。造成差异的原因,笔者认为可能是因为Wu等的研究中是将慢性肾小球肾炎患者按照肾间质纤维化的程度进行分组,而本研究中是将CKD患者按照肾功能损伤程度进行分组。我们认为肾间质纤维化只是CKD病理学改变的一个方面,它并不能全面和准确地反映肾功能损伤的严重程度,所以本研究中对CKD的分组标准更加科学,所得的结果应该更加准确。
5.本研究的局限性
本研究的局限性主要有以下2点。第一,本研究为单中心研究,样本量相对不足,未来需要扩大样本量来验证现有的研究结果和结论;第二,本研究为横断面研究,未来还需要进行纵向研究来探索T1-mapping评估CKD预后和进展的价值。
综上所述,T1-mapping技术对于评估CKD肾功能损伤具有一定的价值,有望为临床无创性评估CKD的肾功能损伤提供新的影像学手段。