MDCT窗技术联合MPR在T1和T2期胃癌中的鉴别诊断价值
崔芷萌,任刚,蔡嵘,汪心韵
近年来,随着胃癌个体化精准治疗的发展,T1期胃癌的早期检测和T1期与T2期胃癌的准确术前分期对临床医师选择最佳治疗方案具有重要价值[1]。T1期胃癌主要采用内镜下黏膜切除术(endoscopic mucosal resection,EMR)或内镜下黏膜剥离术(endoscopic submucosal dissection,ESD),两者具有创伤小、恢复快以及与根治性外科切除术治疗效果相当等优点[2-3]。此外,准确的术前分期包括对病灶大小和浸润深度的准确评估,对ESD切除病变黏膜范围及深度的选择、以及减少术后复发也具有重要意义[4]。由于现有的影像学手段难以满意地显示胃壁的分层[5-10],因而影像学区分T1期与T2期胃癌存在较大困难。窗技术可通过改变CT图像的窗宽、窗位来显示具有密度差异的正常结构与病变区域,使观察对象的组织结构细节处于最佳显示条件下,从而影响图像质量[11-12]。近期有文献报道,与传统的腹窗图像相比,窄窗宽技术对判断T1与T2期胃癌具有更高的准确性[13]。通过设置合适的窗宽和窗位,可优化胃壁各分层之间天然的对比度差异,从而增加对胃癌T分期的诊断准确性。此外,MPR技术可提供多个方位的图像,有利于胃癌的术前分期,使诊断更加全面和准确[14-17]。本研究旨在探讨CT窗技术联合MPR技术对T1与T2期胃癌的鉴别诊断价值。
材料与方法
1.临床资料
搜集2012年1月-2020年12月在本院经病理证实且符合研究要求的232例胃癌患者的临床、病理和影像资料。所有患者行根治性手术治疗,并在术前2周内接受CT增强检查。
纳入标准:①均经手术病理证实,且T分期为T1期或T2期;②影像资料完整;③首次诊断为胃癌,既往未接受抗肿瘤等相关治疗。排除标准:①存在MDCT检查禁忌证;②合并有其它系统恶性肿瘤;③CT图像质量差,无法明确显示病灶。
2.CT检查方法
使用Siemens Somatom Definition 64层双源CT、Philips Brillance 256层iCT机和Philips Brillance64层CT机。患者于检查日的前一晚禁食,检查前1 h口服清水800~1000 mL。采取仰卧位,扫描时嘱患者屏气,扫描范围自膈顶至髂嵴水平。扫描参数:层厚5 mm,间距5 mm,120 kV,管电流平扫为80 mA、增强为100 mA。对比剂采用碘海醇(350 mg I/mL)、优维显(300 mg I/mL)或碘普胺(300 mg I/mL),剂量均为2.0 mL/kg,使用高压注射器以3.5 mL/s的流率经肘前静脉注射,分别于注射对比剂后28、60和120 s采集动脉期、静脉期和平衡期图像。对静脉期的原始数据在图像后处理工作站上进行1 mm层厚的薄层重建及图像后处理。
3.图像后处理
观察者已知患者患有被组织学证实的胃癌及术前内窥镜检查显示的肿瘤位置,但不知道胃癌的分期。腹窗的定义为窗宽350 HU、窗位50 HU;窄窗宽组采用窗宽180 HU、窗位90 HU。由两位影像科医师分别对三组图像(静脉期腹窗图像、窄窗宽的原始横轴面薄层图像及窄窗宽结合MPR图像)独立阅片观察,作出T分期判断;随后,在各组图像中对意见不一致的病例,通过讨论作出一致判定。
4.统计学分析
统计分析采用SPSS 25.0软件及R3.4.1软件(http://www.Rproject.org),以P<0.05为差异有统计学意义。使用行×列χ2检验评估年龄、性别等临床病理因素与胃癌分期(单变量)的相关性。评估腹窗组、窄窗宽组、窄窗宽结合MPR组对T分期的诊断价值,计算敏感度、特异度、PPV和 NPV。将PPV和特异度作为主要评估指标,敏感度和NPV为次要研究终点。采用Z检验(Z-test)分别比较窄窗宽组与腹窗组、窄窗宽+MPR组与腹窗组诊断T1期胃癌(与T2期鉴别)的敏感度、特异度、PPV和NPV。采用Kappa检验评估两位阅片者对胃癌T分期的诊断一致性。Kappa<0.40为一致性差,0.41~0.80为中度-高度一致性,>0.80为一致性极高。
结 果
1.临床病理特征
232例中经临床病理检查确定为T1期154例和T2期78例,两组患者的临床病理资料及统计学分析结果详见表1。两组胃癌患者在肿瘤位置及最大径、手术类型、病理分型、病理(pathological,p)N分期、pTNM分期、淋巴管浸润及神经浸润等指标间的差异均有统计学意义(P<0.05),两组之间年龄、性别构成和静脉浸润出现率的差异无统计学意义(P>0.05)。

表1 T1及T2期胃癌患者临床病理特征的比较 /例
2.三组图像对T分期的诊断价值
两位医师分别基于3组CT图像对所有患者进行术前T分期(记为cT),结果详见表2,典型病例的图像见图1。计算2位观察者诊断T1期胃癌的诊断效能指标,结果见表3。与腹窗组比较,2位医师基于窄窗宽组图像诊断T1期胃癌具有更高的敏感度(86% vs.59%,86% vs.53%)和NPV(71% vs.47%,72%vs.45%),基于窄窗宽结合MPR组具有更高的敏感度(91% vs.59%,92% vs.53%)、NPV(83% vs.47%,85% vs.45%)和PPV(93% vs.81%,93% vs.82%),且差异均具有统计学意义(P<0.025)。

表2 三组图像对pT1和pT2期胃癌的分期结果 /例

表3 两位医师基于三组图像对T1期胃癌的诊断效能
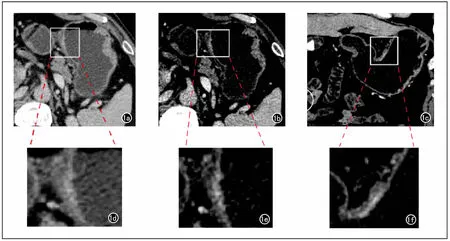
图1 患者,男,62岁,T1b期胃体前壁近小弯侧腺癌。a)横轴面腹窗CT增强图像,示胃体小弯侧胃壁增厚,有明显强化,局部胃壁强化欠均匀,胃壁浆膜面稍毛糙,观察者将其误分为cT3期;b)横轴面窄窗宽CT增强图像,示病灶与胃壁外层之间可见条状低密度影,依此征象正确分期为cT1期;c)CT增强窄窗宽冠状面重组图像,示病灶与胃壁外层之间低密度影显示更清晰,正确分为cT1期;图d、e、f分别为图a、b、c上取样框内病变区域的对应放大像。
3.观察者间的一致性分析
Kappa检验结果显示,使用腹窗组(Kappa=0.831>0.80)、窄窗组(Kappa=0.836>0.80)和窄窗宽结合MPR组(Kappa=0.868>0.80)进行胃癌T分期评估时,两位医师之间均具有极高的一致性。
讨 论
在实际工作中,我们发现胃壁的分层、低密度带显示、癌肿的浸润范围在腹窗(窗宽350 HU,窗位50 HU)下很难清楚显示,导致T1、T2期胃癌分期困难[18-19],但使用较窄的CT窗宽可能会有助于观察。在胃癌原发灶的检出和分期判断中可以运用窄窗显示胃壁分层;利用宽窗更好显示浆膜面的浸润、胃周脂肪间隙及小淋巴结的变化[20-22]中,我们采用一种比腹窗窗宽窄的窄窗宽组(窗宽180 HU,窗位90 HU)来突出显示胃癌的分层对比及胃粘膜病变。本研究中,以Observer 1为例,采用腹窗T1分期胃癌中63例为过高分期,窄窗宽组T1分期胃癌中22例为过高分期(表2)。两位观察者使用窄窗宽技术诊断T1期胃癌的灵敏度、阴性预测值均高于腹窗(P<0.025),与既往文献报道相仿[13]。可能与窄窗对比度较高,分界锐利有关,可以更加清晰地显示胃壁分层、癌肿侵犯范围及病灶周边情况,减少由于病灶周围炎症反应导致的过度分期。
胃癌常表现为环周生长,位于胃角或幽门区的病灶,由于层厚间距宽,切层平行于癌肿平面的原因,仅观察CT横轴图像可能导致判断不足,可结合多平面重建图像进行判断[23]。MPR技术可全面观察病灶,直观显示肿瘤临近结构及淋巴结转移的情况[24-26]。文献[28-30]报道MDCT横轴位图像结合MPR技术较单纯MDCT横轴位影像,对胃癌术前T分期的诊断性明显提高,与我们研究结果一致。本研究中,Obse-rver1使用窄窗宽技术结合MPR图像检出14例T1期胃癌过高分期,11例T2期胃癌过低分期。与单纯依靠腹窗横轴位图像相比,两位观察者使用窄窗技术结合MPR对胃癌T1分期的敏感度、阳性预测值、阴性预测值均增高,差异具有统计学意义(P<0.025)。因此,使用窄窗宽技术结合MPR在T1期胃癌筛查、确诊中都具有良好的效果。
本研究存在一定的局限性:①本研究为单中心回顾性研究,研究结果需要在大规模的多中心研究中进一步验证,特别是与基层医院合作。②根据临床经验选择窄窗宽组的窗宽、窗位。③考虑到窄窗宽技术对浆膜及瘤周脂肪间隙显示欠清,研究中没有包括T3、T4期胃癌,未能比较验证窄窗宽技术的局限性。
综上所述,窗技术对区分T1、T2期胃癌具有重要的应用价值,结合MPR具有较高灵敏度,阳性预测值和阴性预测值,可用于T1期胃癌的常规诊断中。