基于高通量测序分析土层与间伐强度对辽东山区红松人工林真菌群落的影响
刘 晴,徐 阳,张 妍,李虹谕,潘丕克
(1.辽宁省森林经营研究所,辽宁 丹东 118002;2.辽宁辽东半岛森林生态系统国家定位观测研究站,辽宁 丹东 118002)
【研究意义】我国人工林位居世界首位,其中红松(Pinuskoraiensis)是我国东北部东部林区主要的人工造林树种之一,具有较高的经济和生态价值。辽宁省森林经营研究所实验林场拥有自1949年营造的新中国第一处红松人工林,迄今林龄达73年,具有代表性的红松人工林[1]。间伐是人工林的主要抚育措施和提高生态系统生产力的重要手段[2],对人工林的结构影响较大。而相对于天然林,人工林结构单一,抵抗力稳定性差,因此分析人工林抚育间伐措施效益,对人工林森林培育有着重要意义。土壤是森林的重要组成成分,土壤微生物以其作为活动场所完成全部或部分生活史。其中,土壤真菌可以作为评价土壤生态状况的重要生物指标,植物物种及其根系分泌物均可影响真菌群落结构[3-5]。部分土壤真菌在维持植物生长方面发挥作用,同时也可提高植物的抗逆性[6-8]。了解土壤真菌群落结构对评价人工林生态系统功能、探寻植物繁育机制、防治病害和维护生态系统多样性及稳定性等尤为重要[9]。在土壤微生物多样性研究中,传统分离鉴定土壤微生物的方法只能区分微生物种类中的0.1%~10.0%[10],而高通量测序技术具有准确性高、灵敏度好、样本量大等优点,被认为是研究土壤微生物多样性较好的方法[11-12],广泛运用于土壤微生物多样性研究。【前人研究进展】众多学者将高通量测序运用在林地微生物研究中,周玉杰等[13]运用高通量测序方法全面分析了海南大丰农场橡胶林土壤真菌群落状况,浦滇等[14]通过探究不同树龄茶树土壤细菌多样性,得出高通量绝对定量能够研究不同样本微生物群落的结论。许姗姗[15]分析云南昭通不同栽培模式苹果园根际土壤微生物种群的特征发现,不同栽培模式影响根际土壤微生物种群,汪其同等[16]运用高通量测序方法分析了杨树人工林根际土壤真菌群落结构。庄静静等[17]分析发现,刺槐-栓皮栎混交林的土壤微生物量优于刺槐纯林,建议人工林种植过程中加大混交林的种植面积,陈艳芳等[18]采用高通量测序发现,随着连栽代数的增加,杉木林土壤AMF的丰富度逐渐增大,韩冬雪[19]运用高通量测序分析了长白山红松林土壤微生物群落结构和功能多样性,赵爱花等[20]运用该方法测定了宝天曼落叶阔叶林土壤细菌多样性,刘晓华等[21]分析了黄土高原退耕还林区土壤细菌群落特征,乔沙沙等[22]探究了关帝山针叶林土壤细菌群落结构特征。【本研究切入点】通过对不同间伐强度的辽东山区红松人工林林下土壤真菌进行Illumina-Miseq高通量测序,分析表层和亚表层及5种间伐强度对大径材培育目标下红松人工林土壤真菌的短期影响。【拟解决的关键问题】旨在了解不同土层和间伐强度土壤真菌的结构特征,进而对营林措施加以评价,以期为辽东山区红松人工林土壤肥力维护、大径材人工林经营和森林多功能效益提供理论依据。
1 材料与方法
1.1 研究区概况
研究地点位于辽宁省本溪市本溪满族自治县草河口镇的实验林场(40°53′ N,123°51′ E),属于大陆性季风气候,年均降水量926.3 mm,土壤为山地棕色森林土,pH 5.3~6.3,保水性差,平均海拔645 m,年均气温6.5 ℃。植被以红松人工林为主,其下植物稀疏,仅有少量铁线莲(ClematisfloridaThunb)、大叶樟[Cinnamomumparthenoxylon(Jack) Nees]、天南星[Arisaemaerubescens(Wall) Schott]等[23]。
抚育间伐强度以保留株数为指标划分弱度区1、中度区2、强度区3、极强度区4及对照0(不间伐)5个处理,各处理面积均为0.1 hm2,分别在1959年、1967年、1987年、1994年、2005年、2012年进行6次抚育间伐。2019年调查平均胸径。采样地基本特征如表1所示[1]。

表1 样地基本特征
1.2 样品采集
土壤样品采集时间为2021年10月。选择间伐强度为不间伐(对照组)、弱度区、中度区、强度区和极强度区的土壤进行不同间伐强度土壤真菌群落分析,选用中度间伐的表层(0~10 cm)及亚表层(10~20 cm)进行不同土层真菌群落分析。在标准地内随机选择靠近红松根系、具有稳定土壤发育条件的空地,利用五点取样法选取土样混合均匀,用灭菌锡纸将新鲜土样保存于液氮中,送回实验室去除腐殖质、植物根系等杂质,放置-80 ℃冰箱中,用于微生物多样性高通量测序。
1.3 DNA提取及高通量测序分析
利用OMEGA试剂盒提取土壤真菌基因组DNA(E.Z.N.ATMMag-Bind Soil DNA Kit),通过琼脂糖凝胶电泳检测DNA完整性,Qubit定量检测DNA样本浓度。利用Qubit3.0 DNA检测试剂盒对基因组DNA精确定量后进行PCR扩增,扩增引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)[24],ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)[25]扩增片段长度为300 bp。通过2%琼脂糖凝胶电泳检测文库大小,使用Qubit3.0荧光定量仪(Invitrogen公司)进行文库浓度测定。土壤样品委托生工生物工程(上海)股份有限公司进行DNA提取和高通量测序。
1.4 数据处理与分析
进行Miseq文库构建、拼接质控、OTU聚类、数据分析与信息挖掘[26]。真菌群落多样性均采用SPSS 17.0进行分析。
2 结果与分析
2.1 土壤真菌群落稀释曲线分析
由图1可知,样品稀释曲线呈现平稳趋势,说明结果存在较高的客观土壤环境真菌群落构成置信度,能科学体现样品各自真菌群落。虽存在少量部分未发现微生物的可能性,但测序结果仍可反应样品绝大多数真菌信息。

图1 土壤真菌群落稀释曲线Fig.1 Dilution curve of fungi under different plantation forests
2.2 不同间伐强度土层土壤真菌多样性分析
通过Illumina-Miseq高通量测序共获得572 932条高质量ITS序列,在97%序列相似性基础上可划分为9329个OTUs。各土壤样品真菌覆盖度指数介于99.60%~99.92%,说明测序数据量合理,测序基本覆盖了红松人工林土壤中所有真菌类群,能够体现真实的红松人工林真菌特征。
从表2可知,不同土层土壤真菌群落Ace指数变化范围为770.16~1213.04,Chao指数变化范围为775.38~1207.68,Shannon指数变化范围为3.29~4.82,Simpson指数变化范围为0.03~0.11。不同土层ITS序列数、OTUs、Ace、Chao和Shannnon指数均表现为表层>亚表层;Simpson指数表现为表层<亚表层。表明,与亚表层土壤相比,表层土壤真菌更丰富。但方差结果显示,二者各指数间的差异不显著(P>0.05,下同),即二者真菌多样性相近。

表2 表层与亚表层土壤真菌序列统计及多样性指数
从表3可知,不同间伐强度土壤真菌群落Ace指数变化范围为907.68~1087.78,Chao指数变化范围为910.53~1087.74,Shannon指数变化范围为3.75~4.50,Simpson指数变化范围为0.04~0.10。不同间伐强度ITS序列数表现为0>4>2>1>3;OTUs、Ace指数、Chao指数和Shannnon指数表现为4>1>0>3>2;Simpson指数表现为2>3>0>1>4。表明在不同间伐强度的土壤中,极强度区真菌种群最丰富,而中度区土壤真菌丰富度最低。方差结果显示,不同间伐强度间各指数差异不显著。
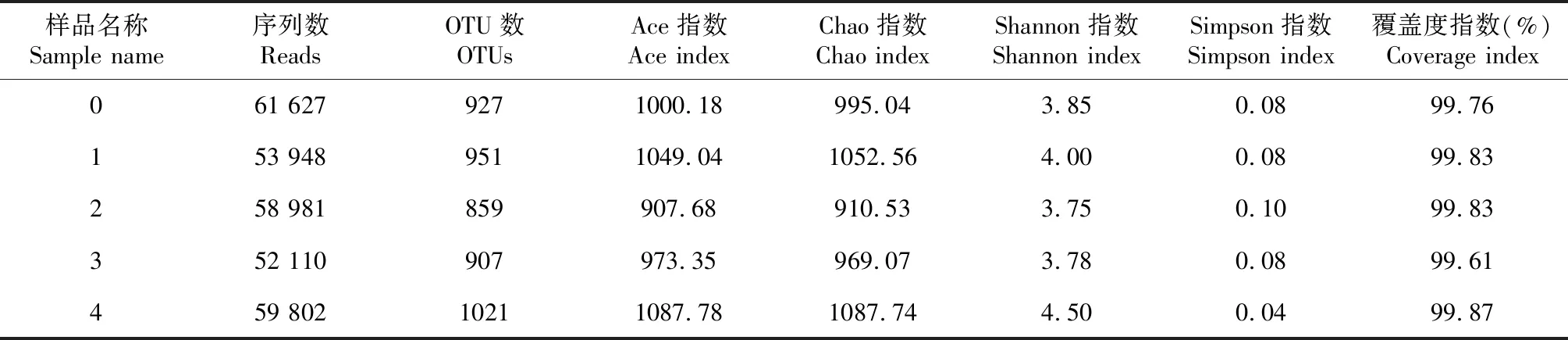
表3 不同间伐强度土壤真菌序列统计及多样性指数
2.3 不同土层土壤优势真菌群落结构组成特征
2.3.1 不同土层土壤优势真菌群落在门水平上的丰富度分析 选第2组中度间伐强度的表层(0~10 cm)、亚表层(10~20 cm)土层进行差异分析。利用统计学分析方法,得到样本在不同分类水平上的群落结构特征,主要以门和属分类水平进行分析,样本中丰度占比均大于一定比例(1%)的物种作为优势物种。
从图2可知,在表层和亚表层2个土层中优势真菌群落在门水平上包括:担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、罗茨菌门(Rozellomycota)、毛霉门(Mucoromycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)和分类不明确门,在表层占比分别为48.26%、26.51%、10.78%、1.15%、0.93%、0.79%、0.58%和10.57%,在亚表层占比分别为57.18%、24.88%、9.17%、0.79%、0.69%、0.36%、0.20%和6.34%。方差分析显示,门水平上的表层和亚表层2个土层不同菌门相对丰度均无显著差异,说明表层和亚表层2个土层的土壤真菌群落在门水平上的相对丰度无明显区别。
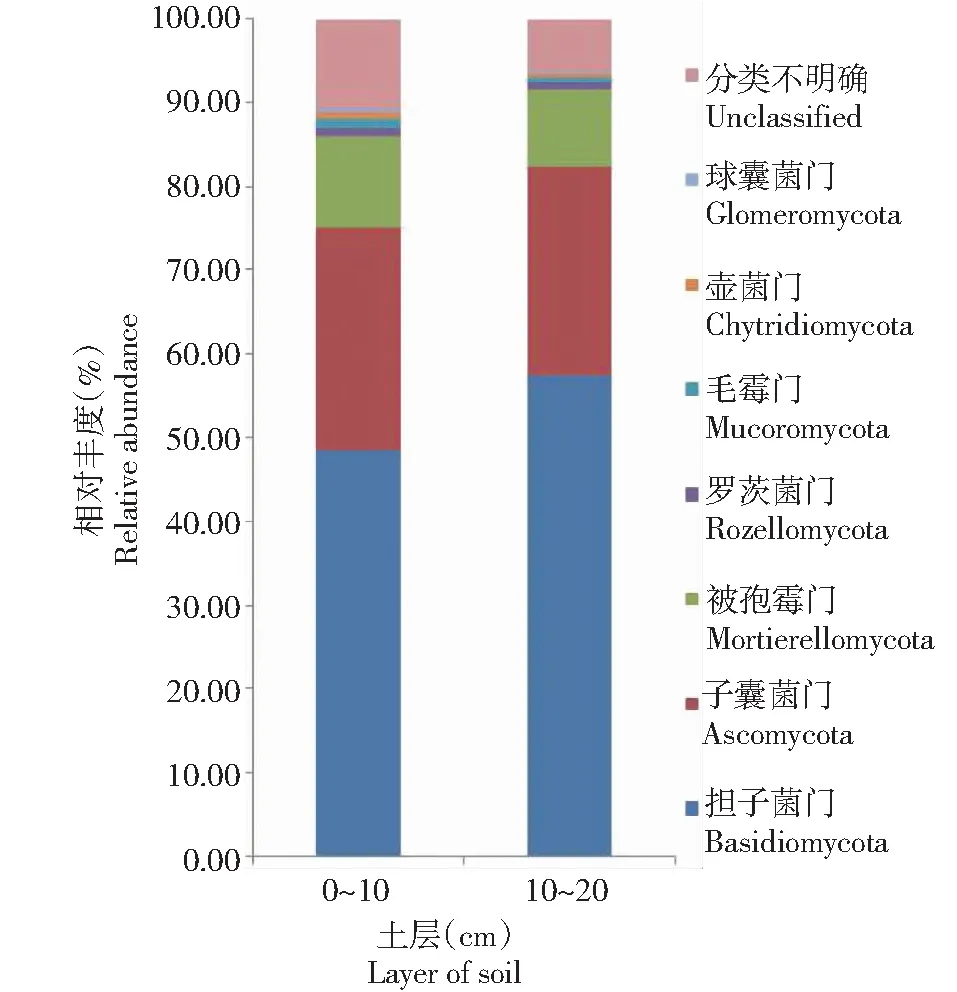
图2 不同土层土壤真菌群落门水平相对丰度Fig.2 Relative abundance of fungi community in different soil layers at phylum level
2.3.2 不同土层土壤优势真菌群落在属水平上的丰富度分析 从图3可知,在表层和亚表层2个土层中属水平上排名前10的优势真菌群落包括:蜡壳耳属(Sebacina)、被孢霉菌属(Mortierella)、红菇属(Russula)、乳牛肝菌属(Suillus)、Geminibasidium、白环蘑属(Leucoagaricus)、角孢革菌属(Tylospora)、鹅膏菌属(Amanita)、Delastria和口蘑属(Tricholoma),在表层占比分别为14.90%、10.77%、5.96%、4.55%、5.83%、0.30%、0.89%、1.93%、2.71%和0.28%,在亚表层占比分别为13.04%、9.15%、6.53%、4.81%、2.49%、7.22%、4.90%、3.84%、2.88%和0.64%。方差分析结果显示,属水平上,表层和亚表层2个土层土壤真菌群落在白环蘑属和角孢革菌属的相对丰度间均存在显著差异(P<0.05,下同) ,其他类群菌属相对丰度间差异不显著。
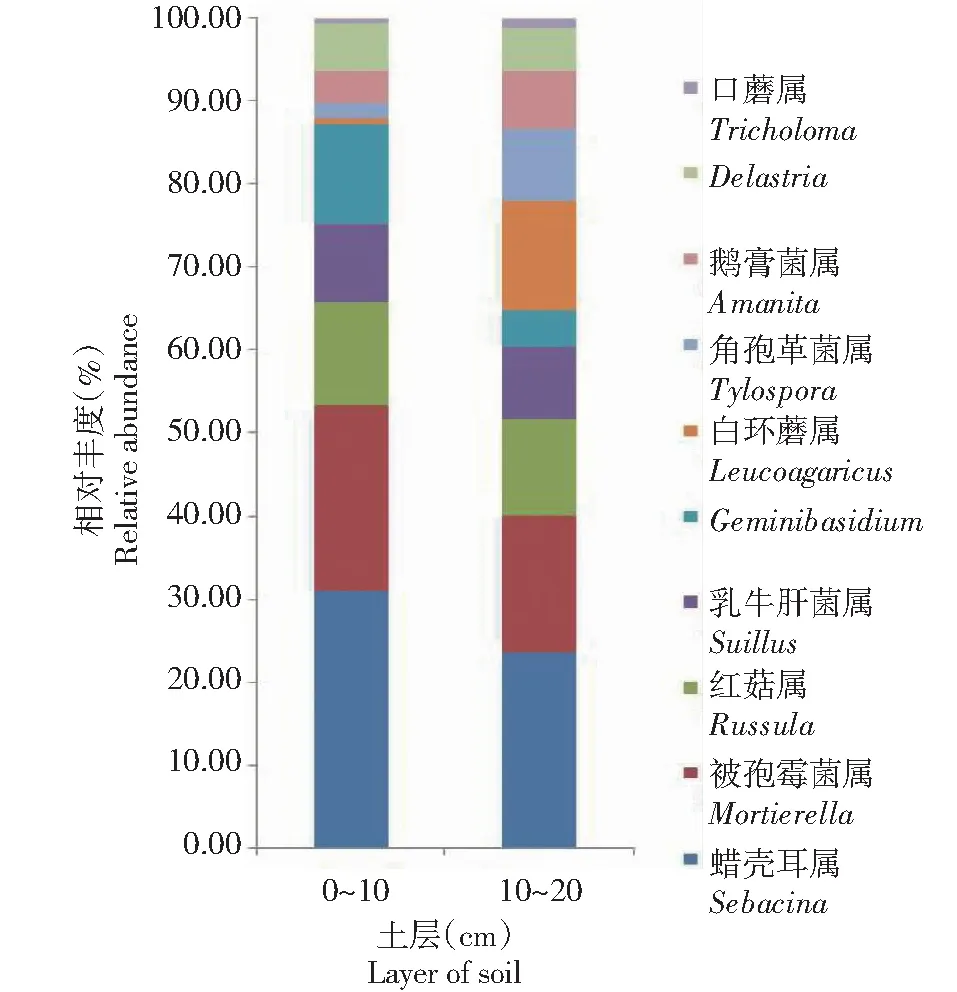
图3 不同土层土壤真菌群落属水平相对丰度Fig.3 Relative abundance of fungi community in different soil layers at genus level
2.4 不同间伐强度土壤真菌群落结构组成特征
2.4.1 不同间伐强度土壤优势真菌群落在门水平上的丰富度分析 从图4可知,在5个间伐强度土壤中优势真菌群落在门水平上包括:担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、罗茨菌门(Rozellomycota)、毛霉门(Mucoromycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)和分类不明确门,0组中占比分别为56.82%、29.63%、6.08%、0.88%、1.26%、0.20%、0.20%和4.55%,1组中占比分别为47.06%、31.14%、9.58%、0.52%、0.81%、0.32%、0.63%和9.65%,2组中占比分别为52.57%、21.20%、16.33%、1.33%、0.52%、0.68%、0.23%和6.83%,3组中占比分别为62.64%、20.56%、4.71%、1.28%、0.56%、0.52%、0.22%和8.96%,4组中占比分别为44.51%、25.94%、13.20%、0.86%、0.92%、1.17%、0.67%和12.40%。方差分析显示,不同间伐强度土壤真菌群落在门水平上的相对丰度均无显著差异,说明间伐强度未改变土壤真菌群落在门水平上的相对丰度。
2.4.2 不同间伐强度土壤优势真菌群落在属水平上的丰富度分析 从图5可知,在5个间伐强度土壤中的属水平上排名前10的优势真菌群落包括:蜡壳耳属(Sebacina)、被孢霉菌属(Mortierella)、红菇属(Russula)、乳牛肝菌属(Suillus)、Geminibasidium、白环蘑属(Leucoagaricus)、角孢革菌属(Tylospora)、鹅膏菌属(Amanita)、Delastria和口蘑属(Tricholoma),0组中占比分别为2.67%、6.07%、14.68%、9.15%、7.39%、0%、12.07%、0%、0%和0%,1组中占比分别为4.28%、9.58%、4.30%、0.82%、1.67%、18.28%、0.21%、0%、12.50%和0%,2组中占比分别为22.24%、16.24%、2.22%、5.79%、5.88%、0.05%、0.78%、0.01%、0.06%和0.24%,3组中占比分别为32.33%、4.70%、4.41%、6.70%、3.81%、0.48%、0.72%、0.45%、0.02%和0%,4组中占比分别为8.32%、13.19%、5.64%、0.94%、2.07%、0%、0.68%、13.98%、1.40%和2.06%。方差分析结果显示,不同间伐强度土壤真菌群落在白环蘑属、鹅膏菌属和口蘑属的相对丰度间均存在显著差异。
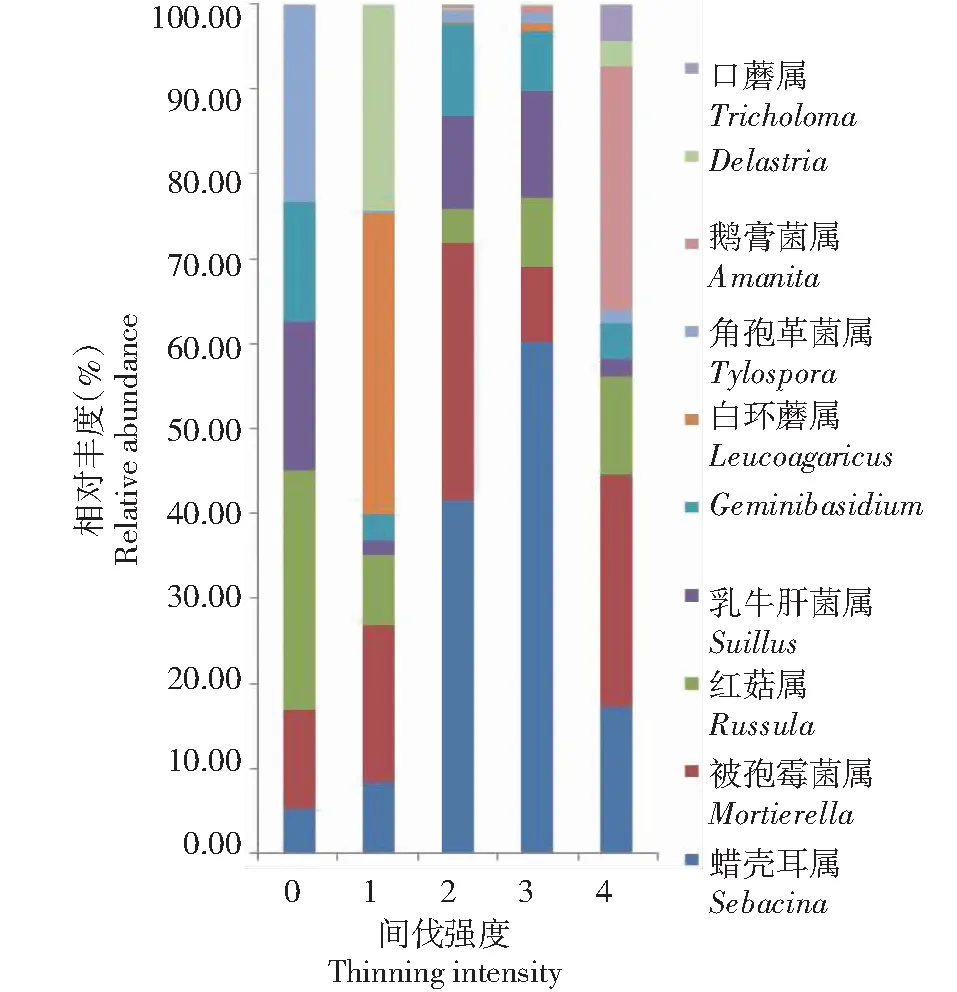
图5 不同间伐强度土壤真菌群落属水平相对丰度Fig.5 Relative abundance of fungi community in different thinning intensities at genus level
2.5 土壤微生物主成分分析
对不同样本群落组成进行主成分分析(PCA),可表征不同处理间土壤真菌群落存在的差异[27]。坐标轴选择能最大反映样品间差异的2个特征值,样本物种组成越相似表现为在图中距离越相近。由图6可知,土壤真菌群落中主成分1(PC1)和主成分2(PC2)差异解释度分别为23.29%和19.51%。同一间伐强度下土壤表层和亚表层距离相近,说明相同间伐强度下两层土壤间物种组成较相似。1组与4组距离相近,说明极强与弱度区物种组成相近;1组和4组与0组距离较2组和3组近,说明极强区和弱度区与对照组物种组成较中强度区更相似。

图6 土壤真菌PCA分析Fig.6 PCA of soil fungi
3 讨 论
通过对不同间伐强度辽东山区红松人工林表层和亚表层土壤进行高通量测序结果进行分析,发现土壤真菌生物量和Ace指数等4个多样性指数总体上表现为表层大于亚表层土壤。说明土壤真菌多样性在表层更高,这与韩世忠[28]的研究结果一致,同时微生物和酶活之间关系密切,在同等条件下,该土层试验结果与酶活土层试验[1]结果一致。
在不同间伐强度土壤中,真菌多样性表现为极强度区>弱度区,均大于对照组,中度区<强度区,均小于对照组。不同间伐强度间土壤真菌多样性差异不显著,也有研究显示,在油松林土壤微生物群落中,土壤真菌群落多样性在不同间伐处理间差异不显著[29]。目前关于间伐对土壤微生物的影响并无一致性结论[30]。本研究中,红松人工林中表现为极强度区真菌种群更丰富,这可能是由于极强度区林分郁闭度低、阳光充足,且随着间伐强度增加,林下草本植被生物量有明显增加的趋势[31],进而导致真菌多样性高。中度区土壤真菌丰富度最低,但中度区对红松大径材培育效益较好,这可能是由于中度区存在对红松生长有积极影响的真菌和外生菌根真菌,在竞争者中占据主导地位,进而导致其他菌群丰富度较低。
本研究中,不同土层和间伐强度中土壤真菌在门分类水平上有担子菌门、子囊菌纲、被孢霉门、罗茨菌门等8个门占优势地位,这与邓娇娇等[32]研究辽东山区2种针叶人工林土壤真菌生物群组成相似。各个处理间在门水平上均无显著差异,说明红松人工林不同处理间在门水平丰富度上相似度较大。不同土层土壤真菌在属分类水平上,只有白环蘑属和角孢革菌属相对丰度间均存在显著差异。其中白环蘑属可与林木形成外生菌根,冯欢[33]的接种试验表明其可影响青杨雌、雄的铅耐受性。高婷婷[34]在红松外生菌根真菌群落随时间尺度的动态变化及影响因素试验中发现红松土壤中的EcMF优势属主要有角孢革菌属。不同间伐土壤真菌在属分类水平上,白环蘑属、鹅膏菌属和口蘑属的相对丰度间均存在显著差异。鹅膏菌属是常见的外生菌根,物种多样性非常丰富的同时还是一类有毒的大型真菌,且毒性价值被广泛深入研究[35]。口蘑属作为美食被大家熟知,徐洋[36]在中国东北地区松茸栖息地土壤微生物多样性研究中发现,样地B在松茸子实体发育期(HTB,8—9月)的优势属—口蘑属占比42.16%,张元霞等[37]在辽宁东部山区珍贵野生食用菌中介绍口蘑属中的棕灰口蘑(Tricholomaterreum)产地为辽东山区落叶松林内或针阔混交林中。
4 结 论
在不同间伐强度辽东山区红松人工林土壤真菌物种的组成中发现,极强与弱度区物种组成相近,极强和弱度区与对照组相近程度高于中度和强度区。间伐处理可使红松人工林林下土壤真菌物种组成产生差异,间伐在一定程度上影响了真菌物种组成。间伐处理及不同土层可使红松人工林林下土壤真菌在丰富度、多样性和物种组成产生差异,在一定程度上影响红松人工林下土壤真菌群落的结构。
——以杉木抚育间伐为例

