基于多作物中吡唑醚菌酯的环境行为评估长期膳食风险
张明浩 ,康珊珊 ,王 曦 ,程有普 ,赵莉蔺 ,李 薇 ,陈增龙 ※
(1. 中国科学院动物研究所农业虫害鼠害综合治理研究国家重点实验室,北京 100101;2. 天津农学院园艺园林学院,天津 300384;3. 河北大学生命科学学院,保定 071002)
0 引 言
谷物(小麦)、油料(花生)、蔬菜(黄瓜)和水果(西瓜)为中国典型代表作物。小麦是世界上种植最为广泛的粮食作物,2021 年全球产量高达77 088 万吨,中国约占全球份额20%;花生是世界五大油料作物之一,中国花生的产量约为5 393 万吨,占全球总产量的41%;黄瓜和西瓜是2 种备受欢迎的果蔬作物,中国产量分别占全球的80%和60%[1]。这些作物无论是自产自销,还是出口贸易都为国家带来巨大的经济效益。然而,上述作物在栽培过程中,易感真菌类病害,如小麦的纹枯病、白粉病,花生白绢病、叶斑病,黄瓜霜霉病、白粉病,西瓜炭疽病、白粉病等。这些病害主要通过危害作物的叶、茎、根等组织,导致作物减产。例如,纹枯病可导致小麦减产10%~20%,严重时可达50%[2]。叶斑病导致花生减产10%~20%,不及时控制损失可达80%以上[3]。可见,病虫害防治对于作物的保产增收具有重要意义,目前仍离不开化学农药。
吡唑醚菌酯(Pyraclostrobin)是一种对真菌类病害具有优异防效的甲氧基丙烯酸酯类杀菌剂,通过阻止细胞色素b 和C1 间电子传递,从而抑制线粒体呼吸,使其不能生产和供应细胞正常代谢所需的能量,最终导致细胞死亡[4]。吡唑醚菌酯现已广泛应用于子囊菌、半知菌、担子菌等引起的纹枯病、白粉病、白绢病、霜霉病、炭疽病、褐斑病、枯萎病等的防治,效果显著。吡唑醚菌酯拌种对小麦苗期纹枯病的防效高达86.6%[5]。花生叶斑病在施加吡唑醚菌酯后能够得到有效防治,防效为89.6%[6]。吡唑醚菌酯自2002 年推广上市以来,市场份额迅速上升,2018 年全球吡唑醚菌酯销售额达9.75 亿美元,在全球最重要的15 个杀菌剂品种中位列第3[7]。随着吡唑醚菌酯在农业生产中的普遍应用,其对生态环境以及人类健康的不良影响逐渐显现。吡唑醚菌酯对水生生物包括鱼类和大型蚤(Daphnia magna)均表现为高毒性。吡唑醚菌酯对鱼类的半致死浓度(LC50, 96 h)为0.006 mg/L。对于大型蚤类,其半最大效应浓度(EC50, 48 h)为0.016 mg/L。更为严重的是,吡唑醚菌酯会对人类的生殖和发育能力产生不良影响[4]。吡唑醚菌酯在葡萄、玉米等作物中的半衰期为1.6~25.9 d[8-10],而在土壤中为8.9~34.7 d[10-11]。目前,中国制定了吡唑醚菌酯小麦、花生仁、黄瓜和西瓜中最大残留限量(maximum residue limit, MRL),分别为0.2、0.05、0.5和0.5 mg/kg[12]。但吡唑醚菌酯在小麦秸秆和花生秸秆中的残留研究仍十分欠缺,尚未制定相应的最大残留限量。此外,国内现有的关于吡唑醚菌酯的风险评估的报道以确定性评估即点评估为主[13-15],该模型数据虽然要求简单,但无法避免评估结果的不确定性,较为保守;鉴于概率性模型通过拟合残留数据和消费量数据分布,可以实现对暴露水平的变异性和不确定性的定量分析,已逐步成为近年来食品安全风险评估领域研究的热点[16-17]。因此,本文通过建立吡唑醚菌酯在小麦、花生、黄瓜和西瓜上的痕量分析方法,对其在不同作物上的环境行为进行表征,并系统比较了传统的确定性和新引入的概率性风险评估结果,量化了风险差异。
1 材料与方法
1.1 材料与试剂
吡唑醚菌酯(纯度为99.5%)标准品购自德国Dr.Ehrenstorfer GmbH 公司。20%吡唑醚菌酯悬浮剂由利民化学有限责任公司提供。色谱纯甲酸(CH2O2)、乙腈(MeCN)购自赛默飞世尔科技(中国)有限公司,分析纯氯化钠(NaCl)、乙酸 (CH3COOH)和无水硫酸镁(MgSO4)购自国药集团化学试剂有限公司,分散固相萃取剂C18 和PSA 由天津博纳艾杰尔科技有限公司提供。
1.2 田间试验
1.2.1 试验小区设置与施药
田间试验于2018—2022 年在4 种作物的主产区开展,各试验地作物品种、土壤属性、水文特征见表1。试验小区依照经济合作与发展组织农作物中农药残留试验准则设置[18],除西瓜每小区面积为150 m2外,其余每个小区面积50 m2,小区间设保护带以防止相互干扰,另设空白对照组,喷洒等量的清水。田间试验施药使用20% 吡唑醚菌酯悬浮剂进行茎叶喷雾,并在发病前或发病初期以推荐剂量进行第一次用药。小麦以180 g/hm2施用2 次,施药间隔期为10 d;花生以300 g/hm2施用2 次,施药间隔期为7 d;黄瓜以210 g/hm2施用3 次,施药间隔期为7 d;西瓜以240 g/hm2施用3 次,施药间隔期为7 d。
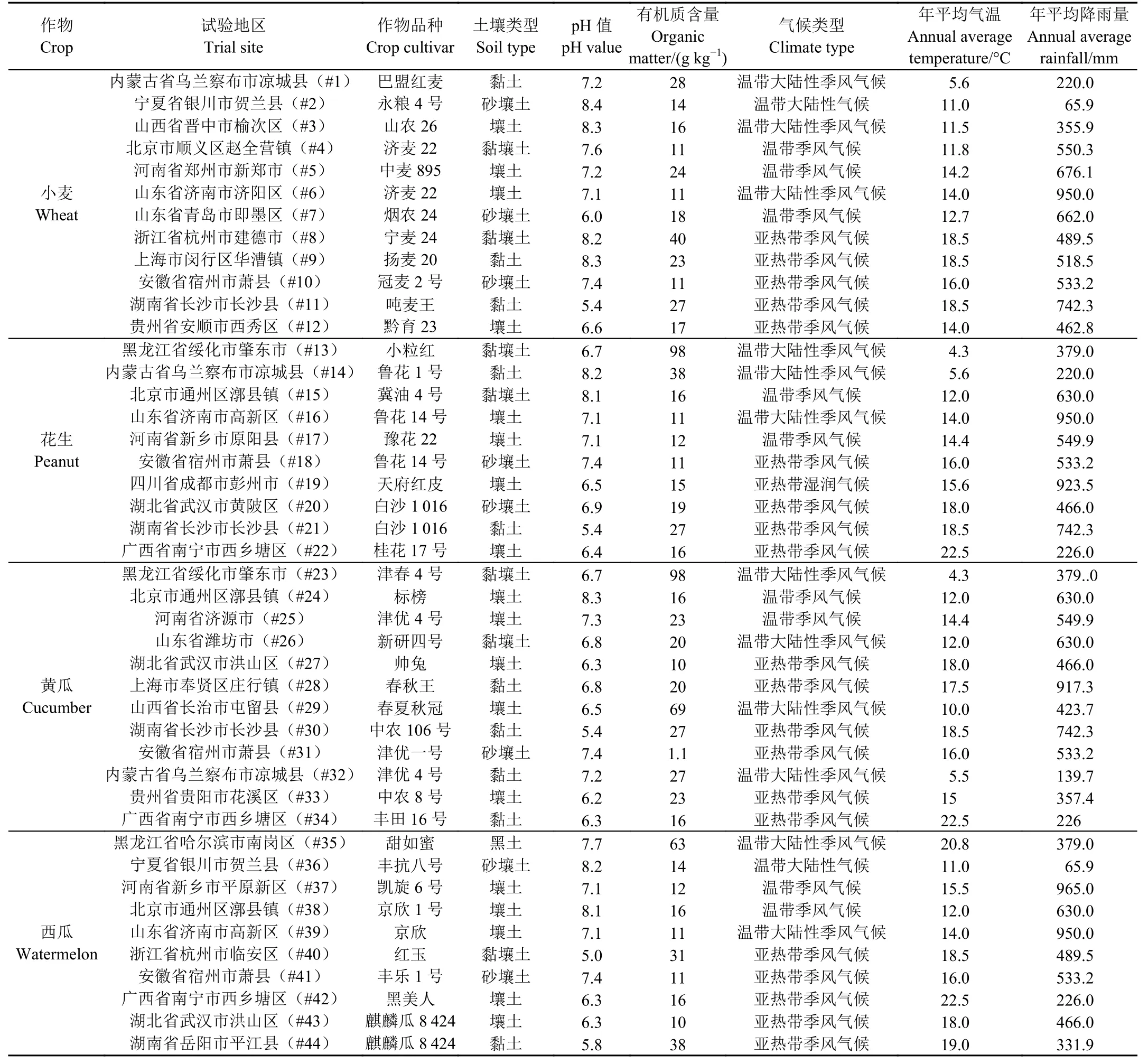
表1 全国田间试验点的土壤属性、水文特征以及作物品种Table 1 Soil properties, hydrological characteristics, and crop cultivars in trial sites across China
1.2.2 试验样品采集与预处理
样品采集通过随机方式多点同步采样,小区边行和每行距离两端0.5 m 内不采样。每个试验小区采集1 kg以上小麦籽粒、花生仁、小麦秸秆及花生秸秆样品及12个以上不少于2 kg 的黄瓜和西瓜样品。按照农作物中农药残留试验准则要求[18],消解试验所需小麦籽粒在最后一次施药后7、14、21、28、35、42 d 采集,花生仁在最后一次施药后0(2 h)、7、14、21、28 和35 d 采集,黄瓜在最后一次施药后0(2 h)、1、2、3、5 和7 d 采集,西瓜在最后一次施药后0(2 h)、3、7、10 和14 d采集;最终残留试验所需小麦籽粒和小麦秸秆在最后一次施药后28 和35 d 采集,花生仁和花生秸秆在最后一次施药后14 和21 d 采集,黄瓜在最后一次施药后2、3和5 d 采集,西瓜在最后一次施药7 和10 d 采集。
采集后的麦粒和花生进行脱壳处理,小麦和花生秸秆被打碎(<1 cm);黄瓜样品切成1 cm 小块,西瓜的瓜瓣切成2 cm 小块,分别放入匀浆机中,搅成浆液。上述处理好的样品混匀后使用四分法缩分,每份样品制备为两份,装入封口样品袋中标记好,并于-20 ℃ 低温避光储藏。鉴于欧洲食品安全局报告已明确指出吡唑醚菌酯在上述作物中的稳定储藏周期达18 个月(-10 ℃)[19],本试验不再进行储藏稳定性验证试验。
1.3 室内试验
1.3.1 样品前处理
分别称取小麦籽粒、小麦秸秆、花生仁和花生秸秆样品5 g(± 0.05 g),黄瓜和西瓜样品10 g(± 0.05 g)置于50 mL 聚四氟乙烯离心管中,小麦籽粒、花生仁样品中加入5 mL 超纯水和5 mL 1.2%乙酸/乙腈 (体积比),小麦和花生秸秆样品中加入10 mL 超纯水和10 mL 1.2%乙酸/乙腈(体积比),黄瓜和西瓜样品中加入10 mL乙腈。混合物分别放入MTV-100 型多管涡旋混合仪(杭州奥盛仪器有限公司)涡旋振荡5 min,随后加入3 g 氯化钠,经CK2000 高通量研磨仪(北京托摩根生物科技有限公司)振荡1 min,最后经FC 5 706 低速离心机(上海奥豪斯国际贸易有限公司)3 500 r/min 离心5 min。取上清液1.5 mL,加入50 mg C18、50 mg PSA、150 mg无水MgSO4净化后,涡旋1 min,最后通过Pico17 型高速离心机(赛默飞世尔科技有限公司)10 000 r/min 离心3 min,取上清液过0.22 μm 有机系滤膜于进样小瓶中进行超高效液相色谱-串联质谱(UPLC-MS/MS)分析。
1.3.2 色谱与质谱参数
色谱参数:Waters ACQUITY HSS T3 色谱柱(100 mm ×2.1 mm,1.8 μm);柱温40 ℃;流速0.45 mL/min;进样量5 μL;以乙腈和含体积分数0.05%甲酸的水溶液为流动相进行梯度洗脱,洗脱条件为:0~0.5 min, 乙腈/甲酸/水(体积比,10/0.05/89.5);0.5~2.5 min, 乙腈/甲酸/水(体积比,90/0.05/9.95); 2.5~2.6 min, 乙腈/甲酸/水(体积比,10/0.05/89.5); 2.6~3.0 min, 乙腈/甲酸/水(体积比,10/0.05/89.5)。
质谱参数:采用电喷雾离子源正模式,离子源温度150 ℃;毛细管电压2.3 kV;脱溶剂气流量650 L/h;脱溶剂温度350 ℃,锥孔气流量50 L/h;多重反应监测模式被采用,定性离子对为 388.1/163.1,碰撞能量为25 V;定量离子对为 388.1/193.9, 碰撞能量12 V;驻留停留时间均为0.034 s;锥孔电压31 V。通过Masslynx NT v.4.1 SCN 940 进行数据采集与分析。
1.4 计算模型
基质效应 (M) 采用基质标准曲线斜率和溶剂标准曲线斜率之比进行评价,见式(1):
式中K1表示基质标准曲线斜率,K2表示溶剂标准曲线斜率。根据文献 [20] 要求,当M≥ 10% 时,表明存在明显的基质增强效应;当M≤ -10% 时,表明存在明显的基质抑制效应;当-10% <M< 10% 时,表明基质效应不明显。
确定性评估也称点评估,其通过将描述统计学参数(例如,规范残留试验中值S1)与毒理学参考值(例如,每日允许摄入量A)进行比较,从而判定农药的膳食暴露风险水平和可接受程度[16]。该方法简单易懂,所需数据相对较少,是中国目前在农药最大残留限量标准制定中所采用的长期膳食摄入评估模型。据此,吡唑醚菌酯的国家估算每日摄入量计算见式(2)。风险商值(R)根据摄入量和毒理学阈值进行计算,见式(3)。
式中N为估计每日摄入的吡啶嘧菌酯量(mg/kg),S1为吡啶嘧菌酯在作物中的规范残留试验中值(mg/kg),S2为经加工因子校正后的规范残留试验中值(mg/kg),F为特定人群对某一食品的消费量(kg/d),A为每日允许摄入量(mg/kg),m为特定人群的平均质量(kg)。当R< 100%,被认为人群通过对某一食品的消费所摄入的吡啶嘧菌酯不会遭受不可接受的膳食风险,反之,则具有风险。
概率性模型在欧盟和美国被广泛用于农药的膳食风险评估。概率模型可以有效地反映不同人群的个体变化,并考虑到试验数据的不确定性,更全面地揭示农药残留暴露于人类的饮食风险,计算模型如式(4)所示:
式中yij是第i组人群在第j天的吡唑醚菌酯摄入量(mg/kg),xijk是第j天第i组人群对作物k的消费量(kg/d),cijk表示第i组第j天所消费的研究作物k中的吡唑醚菌酯浓度(mg/kg)。mi是第i组的体质量(kg),p表示所消费的作物总数。
2 结果与分析
2.1 方法验证
2.1.1 特异性、线性和定量限
通过在小麦籽粒、小麦秸秆、花生仁、花生秸秆、黄瓜、西瓜中添加吡唑醚菌酯并进行UPLC-MS/MS 对比分析,在吡唑醚菌酯保留时间处无干扰(2.13 min),表明该方法特异性良好。如表2 所示,在0.001~0.500 mg/L浓度范围内,小麦籽粒、花生仁、黄瓜和西瓜基质中吡唑醚菌酯的峰面积与质量浓度呈线性关系,决定系数(R2)>0.996 0;小麦秸秆和花生秸秆在0.001~5.000 mg/L和0.001~30.000 mg/L 水平下线性良好,R2> 0.996 7。按照3 倍噪音比计算,仪器检出限(limit of detection,LOD)为0.000 1~0.000 4 mg/kg,而定量限(limit of quantification, LOQ)则通过满足分析要求的最低添加水平确定为0.001 mg/kg。与以前报道的液相方法相比,本研究提出的方法的分析效率提高了1.4~2.0 倍,灵敏度提高了2.0~10.6 倍[21-23]。试验周期内每周评估标准工作液和基质匹配液中吡唑醚菌酯的稳定性,无统计学差异(P>0.05)。
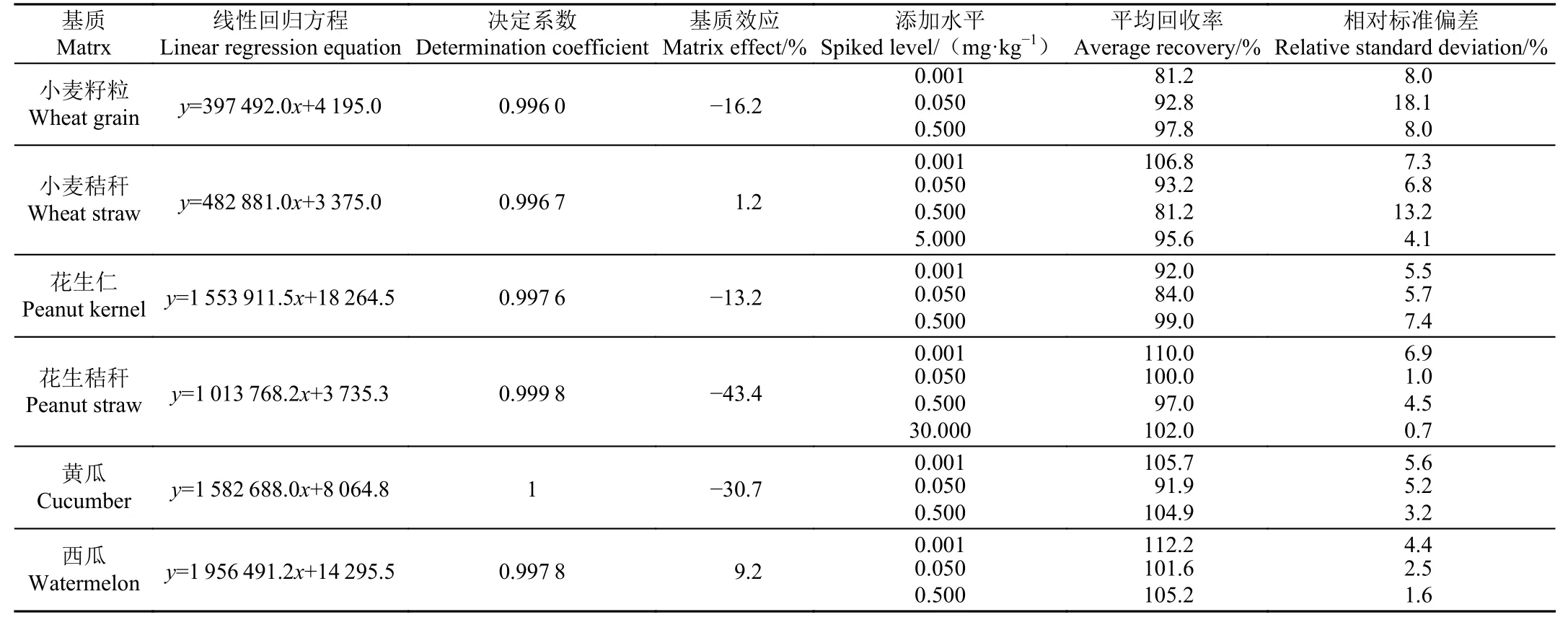
表2 吡唑醚菌酯在小麦籽粒、小麦秸秆、花生仁、花生秸秆、黄瓜和西瓜基质中的方法验证参数Table 2 Method validation parameters of pyraclostrobin in wheat grain, wheat straw, peanut kernel, peanut straw, cucumber and watermelon matrices
2.1.2 准确度和精密度
在小麦、花生、黄瓜和西瓜样本中按照上述前处理方法和仪器条件进行添加回收试验,每个添加水平重复5 次(表2)。在0.001~0.500 mg/kg 添加水平下,吡唑醚菌酯在小麦籽粒、花生仁、黄瓜及西瓜中的平均回收率为81.2%~112.2%,相对标准偏差(relative standard deviation, RSD)为1.6%~18.1%;吡唑醚菌酯在小麦秸秆中添加水平为0.001~5.000 mg/kg,平均回收率为81.2%~106.8%,RSD 为4.1%~13.2%;在花生秸秆中添加水平为0.001~30.000 mg/kg,平均回收率和相应的RSD 分别为97.0%~110.0%和0.7%~6.9%。结果表明建立的方法满足农药残留分析的质量控制和验证标准(回收率在70%~120%之内,RSD≤20%)[20]。
2.1.3 基质效应
吡唑醚菌酯在小麦秸秆和西瓜中基质效应分别为1.2%和9.2%,表明基质效应作用并不明显。然而,靶标分析物在小麦籽粒、花生仁、花生秸秆和黄瓜中的基质效应为-43.4%%~-13.2%,表现出明显的基质抑制效应。这可能与基质本身内源性化合物、分析物的保留时间、前体离子的电离模式以及化合物的化学结构相关[24]。因此, 本研究采取外标法基质配制标准溶液进行定性定量分析, 以消除基质效应对各个样品中吡唑醚菌酯响应的影响, 以获得更加准确的结果。
2.2 吡唑醚菌酯在4 种作物上的沉积与消解
吡唑醚菌酯在花生仁、黄瓜、西瓜上的浓度在施药后2 h 达到最大,分别为<0.001、≤0.209 和≤0.048 mg/kg,而小麦籽粒上吡唑醚菌酯的浓度在7 d 时达到最大值,为0.005~0.043 mg/kg (表3)。不同作物之间原始沉积量的差异与施药方式以及施药剂量相关。花生仁上吡唑醚菌酯的原始沉积水平(<0.001 mg/kg)远小于其他3 种作物(≤0.209 mg/kg)。这主要是因为在茎叶喷雾的施用方式下,生长在土壤中的花生仁能接触到的吡唑醚菌酯的量十分有限。另外,黄瓜和西瓜上靶标分析物的残留浓度(≤0.209 mg/kg)比小麦籽粒和花生仁上(≤0.043 mg/kg)的高,与总施药剂量相关。吡唑醚菌酯在黄瓜和西瓜上的总施用剂量为630~720 g/hm2,远高于小麦和花生作物(360~600 g/hm2)。作物的形态、作物生长地的气候条件以及施药时天气状况也可能是不同作物上吡唑醚菌酯原始沉积量产生差异的原因[25-26]。

表3 吡唑醚菌酯在小麦籽粒、花生仁、黄瓜和西瓜上的消解动力学方程及其相关参数Table 3 Dissipation kinetics equations and correlation parameters of pyraclostrobin in wheat grain, peanut kernel, cucumber and watermelon
吡唑醚菌酯在小麦籽粒、黄瓜和西瓜上的消解动态符合一级动力学方程回归曲线,半衰期分别为5.9~9.9 、2.6~7.5 和1.9~4.7 d(表3)。吡唑醚菌酯在花生仁上未检出,无法拟合动力学方程。因此,靶标分析物在4 种作物上的消解速率从大到小顺序为:花生仁、西瓜、 黄瓜、小麦籽粒。产生上述差异的原因与吡唑醚菌酯在作物上的原始沉积量和作物的含水量相关。吡唑醚菌酯在4 种作物上的原始沉积量越大,降解速率越慢。例如,靶标分析物在小麦籽粒的原始沉积量最大(0.005~0.043 mg/kg),其半衰期最长(5.9~9.9 d),降解速率最慢。其次,吡唑醚菌酯在黄瓜和西瓜上的半衰期明显短于在小麦籽粒上,这与作物的含水量相关。黄瓜和西瓜(90%~97%)的含水量大于小麦籽粒(30%~60%),而较高的含水量会加快吡唑醚菌酯在基质中的水解速率[28]。同时,黄瓜和西瓜的作物形态有利于降雨对其上吡唑醚菌酯的冲刷作用。除此之外,作物生长地的气候条件以及土壤中的微生物分布也可能会影响吡唑醚菌酯的消解动态[26-28]。
同种作物不同地区的半衰期也有所差异。造成这一现象的原因与试验地间的气候特征、土壤类型差异相关。吡唑醚菌酯在试验点#37(未检出)的半衰期明显小于试验点#40(1.9 d)、#35(2.9 d)和 #44(4.7 d),这可能因为试验点# 37(965.0 mm)的降雨量远大于其他试验点(331.9~489.5 mm)。 降雨不仅会加速对西瓜表面吡唑醚菌酯的冲刷,而且有利于吡唑醚菌酯在土壤中的浸出[29]。其次,黄瓜上靶标分析物的消解动态在各个试验地之间的差异较大。究其原因,源于各地土壤有机质含量之间的差异。具有较高有机质含量土壤的试验点(#23)未检出,具有最快的消解速率。土壤有机质越高,具有吡唑醚菌酯的生物降解能力的微生物越多[28]。除此之外,试验地的光照节律、灌溉周期以及所使用的作物品种也可能是产生消解动态差异的原因[25-27]。
2.3 吡唑醚菌酯最终残留水平与MRLs 比对
如表4 所示,吡唑醚菌酯在小麦籽粒、小麦秸秆、花生仁、花生秸秆、黄瓜以及西瓜样品中的最终残留量≤75.291 mg/kg。6 种作物基质中吡唑醚菌酯的残留量基本上随采收时间的延长而减小,但有时也会出现残留量上升的现象。如小麦秸秆在试验地(#1)的28 d 残留量为0.286 mg/kg,低于35 d 的残留量 0.405 mg/kg。相似的现象同样出现在试验地(#5)和(#7)的小麦籽粒、试验地(#14)和(#22)的花生秸秆、试验地(#26)和(#32)的黄瓜、试验地(#44)的西瓜。这主要源于采收间隔期之间吡唑醚菌酯的降解速率缓慢。

表4 吡唑醚菌酯在小麦籽粒、小麦秸秆、花生仁、花生秸秆、黄瓜和西瓜的最终残留差异Table 4 Terminal residual differences of pyraclostrobin among wheat grain, wheat straw, peanut kernel, peanut straw, cucumber and watermelon
同一作物不同部位之间的残留水平存在差异。小麦秸秆中的吡唑醚菌酯残留量(0.187~4.342 mg/kg)明显高于小麦籽粒(≤0.096 mg/kg),相似的情况同样发生在花生秸秆(1.067~75.291 mg/kg)和花生仁中(<0.001 mg/kg)。究其原因,与施药方式以及农药的浓缩效应有关。吡唑醚菌酯的施药方式为茎叶喷雾,秸秆更易接触到农药。同时,能被植株吸收的吡唑醚菌酯约为施加量的9%~31%[30],被壳保护的小麦籽粒和花生仁能接触到的吡唑醚菌酯相当有限。这个发现和吡唑醚菌酯在玉米秸秆和籽粒上的残留结果一致,玉米秸秆上的浓度(0.039~3.2 mg/kg)明显大于玉米籽粒中的浓度 (<0.01 mg/kg)[31]。此外,秸秆中的吡唑醚菌酯会随着脱水过程而发生浓缩效应,进而导致其在秸秆中的高残留检出。小麦和花生秸秆皆为重要的动物饲料资源和可再生能源[32-33],吡唑醚菌酯在这两种秸秆上的高浓度检出应被关注以避免不可接受的农药残留风险。
作物可食部分之间靶标分析物浓度存在差异,原因与采收间隔期以及茎叶喷雾的施药方式相关。具有较短采收间隔期的黄瓜中吡唑醚菌酯的最终水平(≤0.193 mg/kg)明显高于其他3 种作物(≤0.096 mg/kg)。其次,吡唑醚菌酯在花生仁上的残留水平最低。茎叶喷雾的施药方式是造成这一现象的主要原因。生长在土壤中的花生果实接触到的吡唑醚菌酯的浓度有限,并且花生壳能有效保护花生仁受到农药的污染。先前的研究也表明,戊唑醇和嘧菌酯通过茎叶喷雾施加到花生上后,花生壳上的残留量为花生仁上的20.1~367.3 倍[34]。
如表4 所示,吡唑醚菌酯在小麦籽粒、小麦秸秆、花生仁、花生秸秆、黄瓜和西瓜上的规范残留试验中值为0.001~2.870 mg/kg。 最高残留量为 0.001~75.291 mg/kg。小麦、花生仁、黄瓜和西瓜上吡唑醚菌酯的最高残留量均低于中国制定的相关MRL 值[12]。但是截至目前,世界上没有任何国家或组织建立了吡唑醚菌酯在小麦秸秆或花生秸秆上的MRL 值[35]。基于全国范围内的田间试验,吡唑醚菌酯在小麦秸秆和花生秸秆上的MRL 值被推荐为10 和100 mg/kg。鉴于吡唑醚菌酯在小麦和花生秸秆上的高浓度检出,建议中国加快制定吡唑醚菌酯在小麦和花生秸秆上的限量标准以避免不可接受的残留风险和国际上因过量检出而引发的贸易壁垒。
2.4 慢性膳食暴露风险评估
基于全国性的残留试验,吡唑醚菌酯在小麦籽粒、花生仁、黄瓜、西瓜上的规范残留试验中值S1被分别估计为0.004、0.001、0.019、0.003 mg/kg。其他登记作物(棉籽、芒果、荔枝、桃、大白菜、苹果、马铃薯、葡萄、甜瓜、草莓、茶叶、香蕉、大葱、芥蓝、叶用莴苣、西葫芦、丝瓜、芦笋、旱芋、柚子、金橘、枣(鲜)、猕猴桃、柿子、杨梅、火龙果、苦瓜、姜)的S1值,均参考农业农村部农药检定所的数据,对于没有S1值参考的登记作物(包括哈密瓜、大豆、山药、李子、柑橘、梨、水稻、糙米、玉米、番茄)基于风险最大化原则考虑,取相应的MRL 值。吡唑醚菌酯的每日允许摄入量(A)被欧洲食品安全局推荐为0.03 mg/kg[19]。消费者的每日平均摄入量(F)和体质量(m)数据源自中国居民营养与健康状况调查报告[36]。基于以上参数,不同年龄组人群吡唑醚菌酯的长期膳食风险被系统评估,具体风险商值见表5。

表5 吡唑醚菌酯基于确定性和概率性模型的风险商值Table 5 Risk quotient assessment of pyraclostrobin by deterministic and probabilistic models%
吡唑醚菌酯的风险商值为123.959%~406.415%,表明通过膳食途径摄入的吡唑醚菌酯会对消费者造成不可接受的长期风险。乡村人群的暴露风险商值(146.799%~406.415%)显著大于城市人群(123.959%~374.217%)。对比分析作物的城乡膳食消费参数,城镇人群相比乡村人群具有较高的膳食消费量,且体质量较轻[36]。同时,2~10 岁的儿童的风险商值(246.701%~406.415%)显著大于其他人群(123.959%~240.791%),这可能是因为儿童的单位摄入量较高[36]。性别之间并没有发现显著的差异(P<0.05)。
为了减少评估过程中的不确定性,吡唑醚菌酯的概率性风险被进一步评估。基于吡唑醚菌酯在花生仁和黄瓜样品中未被全部检出,其概率浓度分布没有成功拟合。研究结果表明,从P50 到P99.9,通过摄入小麦籽粒和西瓜对消费者造成的慢性风险商值之和为0.025%~11.309% ,远小于100%,并不会对消费者造成潜在风险。研究发现,乡村人群通过长期膳食小麦和西瓜而产生的吡唑醚菌酯的暴露风险商值(0.025%~11.309%)显著高于城镇人群(0.030%~9.330%)(P<0.05)。同时,中国男性和女性膳食暴露风险商值之间也存在显著差异(P<0.05)。男性的膳食风险随着年龄的增大而降低,而4~6 岁的女性面临着最大的潜在暴露。究其原因,是因为4~6 岁的女性的小麦的单位体质量摄入量较大[36]。
通过确定性和概率性评估的比较,发现基于确定性模型计算的风险商值与基于概率性模型计算的在50 百分位时的风险商值相似,主要是因为前者所使用的S1值与后者50 百分位的浓度水平很接近。值得注意的是,无论基于确定性模型还是概率性模型,儿童群体都面临着最大的潜在吡唑醚菌酯暴露。另外,人群在膳食过程中,吡唑醚菌酯暴露风险评估仍存在一定局限性。因此,后续可深入研究加工因子、平均残留量、代谢物、摄入途径等不确定性因素对于中国居民的膳食风险的影响,以制定更为精准的安全使用准则。2020, 742: 140611.
[8] CHEN X X, HE S, GAO Y M, et al. Dissipation behavior,residue distribution and dietary risk assessment of fieldincurred boscalid and pyraclostrobin in grape and grape field soil via MWCNTs-based QuEChERS using an RRLC-QqQMS/MS technique[J] . Food Chemistry, 2019, 274: 291-297.
[9] YOU X W, LIU C Y, LIU F M, et al. Dissipation of pyraclostrobin and its metabolite BF-500-3 in maize under field conditions[J] . Ecotoxicology and Environmental Safety,2012, 80: 252-257.
[10] ZHANG F Z, WANG L, ZHOU L, et al. Residue dynamics of pyraclostrobin in peanut and field soil by QuEChERS and LCMS/MS[J] . Ecotoxicology and Environmental Safety, 2012, 78:116-122.
[11] GUO X Y, WU W Z, SONG N H, et al. Residue dynamics and risk assessment of pyraclostrobin in rice, plants, hulls, field soil,and paddy water[J] . Human and Ecological Risk Assessment,2017, 23(1): 67-81.
[12] 国家卫生健康委员会,农业农村部,国家市场监管总局.食品安全国家标准-食品中农药最大残留限量:GB2763—2021[S] . 北京:中国农业出版社,2021:43-45 .
[13] 蔡光辉,李萌,吴绪金,等. 吡唑醚菌酯在杨桃中残留检测及膳食风险评估[J] . 食品安全质量检测学报,2021,12(14):5531-5539.CAI Guanghui, LI Meng, WU Xujin, et al. Residual determination of pyraclostrobin in carambola and its dietary risk assessment[J] . Journal of Food Safety & Quality, 2021,12(14): 5531-5539. (in Chinese with English abstract)
[14] 林永熙,程海燕,李栋,等. 吡唑醚菌酯和戊唑醇在桃中的残留与膳食风险评估[J] . 农药学学报,2023,25(1):184-192.LIN Yongxi, CHENG Haiyan, LI Dong, et al. Residue and dietary exposure risk assessment of pyraclostrobin and tebuconazole in peach[J] . Chinese Journal of Pesticide Science,2023, 25(1): 184-192. (in Chinese with English abstract)
[15] 倪春霄,吴燕君,赵月钧,等. 杀菌剂吡唑醚菌酯和氟唑菌酰胺在桑椹中的残留检测及膳食风险评估[J] . 蚕业科学,2022,48(1):34-39.NI Chunxiao, WU Yanjun, ZHAO Yuejun, et al. Residues and dietary intake risk assessment of Pyraclostrobin and Fluxapyroxad in mulberry fruit[J] . Acta Sericologica Sinica,2022, 48(1): 34-39. (in Chinese with English abstract)
[16] World Health Organization. Principles and methods for the risk assessment of chemicals in food: ISSN 0250-863X: 2009[S/OL] . [2023-03-01] . https://www.who.int/publications/i/item/9789241572408.
[17] 叶孟亮,聂继云,徐国锋,等. 苹果中乙撑硫脲膳食摄入风险的非参数概率评估[J] . 农业工程学报,2016,32(1):
3 结 论
1)本研究通过超高效液相色谱-串联质谱结合分散固相萃取技术建立了吡唑醚菌酯在小麦、花生、西瓜和黄瓜中的快速、高灵敏的分析方法。方法检出限和定量限分别为0.000 1~0.000 4 和0.001 mg/kg 。
2)通过全国范围内的田间试验对多作物中吡唑醚菌酯的环境行为进行表征,其原始沉积量、半衰期、终残水平分别为≤0.209 mg/kg、1.9~9.9 d 和≤75.291 mg/kg。
3)通过确定性评估模型量化了吡唑醚菌酯对膳食人群的慢性摄入风险,风险商值为123.959%~406.415%,存在不可接受的暴露风险。

