小檗碱桥酶高效原核表达及生物合成l-SLR的研究
梅欢 李玥 刘可蒙 刘吉华
(中国药科大学江苏省中药评价与转化重点实验室 中国药科大学中药学院,南京 211100)
左旋金黄紫堇碱(l-Scoulerine,l-SLR)具有镇静作用,是一种新型抗精神病药,对精神分裂症的阳性症状、阴性症状以及认知障碍均有效且锥体外系不良反应小,具有良好的临床应用前景[1]。据报道,l-SLR是苄基异喹啉类生物碱(benzylisoquinoline alkaloids, BIAs)生物合成途径中的关键中间体,痕量存在于植物中,化学合成困难,从药材中提取分离需消耗大量的药材,给药用植物资源带来严重的破坏。BIAs类生物碱中含量较高的生物碱如左旋四氢原小檗碱,其原料药材如金线吊乌龟、黄叶地不容等由于过度采挖,部分植物资源已严重缺乏[2-3]。小檗碱桥酶(berberine bridge enzyme, BBE)催化左旋网状番荔枝碱(l-reticuline,l-RL)N甲基环化生成l-SLR,是BIAs类生物碱生物合成途径中的关键酶。Dittrich等[4-5]从加州罂粟(Eschscholzia californcia)中分离并鉴定出EcBBE基因在酵母中表达,建立了通过大肠杆菌和酵母共培养的方式实现l-SLR的生物合成途径。大肠杆菌和酵母共培养存在中间体进出两种不同的细胞而转运不便等问题,进而影响其合成效率。此外有报道利用大肠杆菌生产BIAs中间体l-RL的产量高于酵母系统[6],且大肠杆菌具有操作简单、生长速度快、培养成本低等优势,因此采用大肠杆菌作为底盘生物较酵母体系更有优势。课题组前期对EcBBE进行密码子优化后构建的BL21(DE3)-SMR-MEcBO菌株成功实现EcBO在原核宿主中表达[7],但EcBO表达活性较低。因此,需要进一步提高EcBO的原核表达活性。
大肠杆菌表达载体的主要元件包括启动子、复制子和终止子。启动子启动外源基因的转录,是外源基因高效表达的重要调控元件。启动子优化策略一般为使用强启动子、筛选新启动子、使用串联启动子和对启动子核心区进行突变等[8]。启动子在强度过强时转录效率高,蛋白表达速率过快而折叠速度慢,易形成无活性的包涵体;启动子较弱时,蛋白表达速率低。更换不同的表达载体可以在一定程度上增加异源蛋白可溶性表达,需要筛选合适的载体以提高外源蛋白可溶性表达。例如,抗菌肽Scygonadin在 Trc启动子下的产量为10.6 mg/L,而T7启动子下的产量为65.9 mg/L[9]。黄津伟等[10]通过筛选优化启动子提高了重组大肠杆菌生产PHA的产量,重组大肠杆菌的细胞干重由22 g/L提高至29 g/L,PHA的产量由49.1%提高至81.3%。
蛋白表达量增加会使无活性的包涵体的量增加,过量表达分子伴侣和折叠酶或共表达相关转录因子可以促进蛋白质折叠,有效增加重组蛋白的分泌表达量[11]。Laskey等[12]在非洲爪蟾卵的浸出液中发现了分子伴侣蛋白可以通过协助和参与生物大分子的折叠、组装、转运及降解等过程,极大程度提高目的蛋白的可溶性表达,分子伴侣聚集到目的蛋白的附近帮助其正确折叠。方红辉等[13]利用分子伴侣与UGT73C5共表达,UGT73C5与pG-KJE8、pGro7和pG-TF2共表达后均可提高UGT73C5酶活,分别为原始酶活(18.56 U/g细胞)的1.27、1.18及1.37倍。李琦等[14]对6种商业化的分子伴侣蛋白进行筛选以提高β-木糖苷酶(Xln-DT)的可溶性表达量,pG-KJE8与xln-DT基因共表达后,xln-DT的可溶性表达量为原来的1.31倍。邓通等[15]利用分子伴侣蛋白质粒pGro7和醇脱氢酶CbADH 共表达,使 CbADH 的可溶性表达量提高了8.07倍。
本研究通过EcBO与分子伴侣共表达的方式提高其在大肠杆菌中的催化活性,为高效生物转化合成制备l-SLR等BIAs类生物碱提供了新的策略,为利用基因工程菌株生物合成制备中药痕量活性成分提供了研究范例。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒与载体 本实验所用重组菌株、伴侣蛋白共表达菌株列于表1;质粒、引物分别列于表1和表2;伴侣蛋白质粒信息列于表3。pCold II、pET-28a-sumo、pTrc99a、pBad24、pMal-c4x,美国 Novagen 公司;引物合成、E.coliDH5α、E.coliBL21(DE3),安徽通用生物有限公司;分子伴侣蛋白质粒pKJE6、pKJE7、pG-KJE8、pGro7、pG-Tf2和 pTf16,日本TaKaRa公司。

表1 菌株及质粒信息Table 1 Strain and plasmid information

表2 引物列表Table 2 List of primers
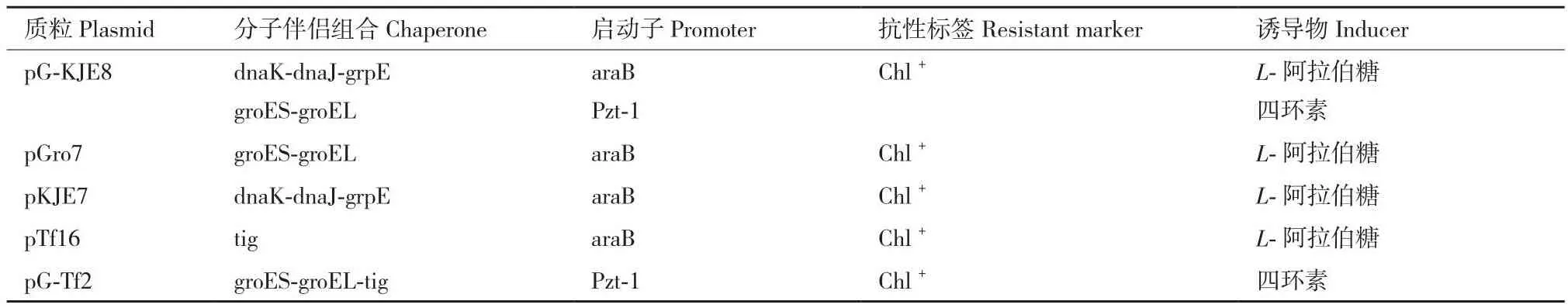
表3 伴侣蛋白质粒信息Table 3 Chaperone protein information
1.1.2 试剂 PageRuler Prestained Protein Ladder,美国Thermo Fisher Scientific;Trimza、Glycine、十二烷基苯磺酸钠(SDS)、四甲基乙二胺(TEMED)、β-巯基乙醇、丙烯酰胺(acrylamide)、N,N'-亚甲基双丙烯酰胺,美国Sigma-Aldrich;溴酚蓝,安徽BIO SHARP;考马斯亮蓝,上海碧云天生物技术有限公司;氯霉素、琼脂粉、异丙基-β-D-硫代半乳糖苷(IPTG),翌圣生物;链霉素,大连美仑生物;L-阿拉伯糖,上海麦克林生化科技有限公司;左旋网状番荔枝碱、左旋金黄紫堇碱,上海源叶生物科技有限公司;色谱甲酸、甲酸铵,上海阿拉丁生化试剂有限公司;色谱甲醇,上海星可高纯试剂有限公司;色谱乙腈,美国天地试剂有限公司;丙三醇(甘油),国药集团化学试剂有限公司。
1.1.3 培养基 LB液体培养基:蛋白胨10 g、酵母提取物5 g、NaCl 10 g,溶解于1 L蒸馏水中,121℃灭菌20 min。LB培养基用于大肠杆菌菌株的活化。
LB固体培养基:在LB液体培养基的基础上添加2%的琼脂粉,121℃灭菌20 min,待温度降至50℃左右加入千分之一的相应抗生素混匀倒入平板中(每个平板约20 mL)待其凝固存放于4℃。TB 培养基:蛋白胨12 g、酵母提取物24 g、磷酸二氢钾2.2 g、磷酸氢二钾7.2 g,溶解于1 L蒸馏水中,121℃灭菌20 min,TB培养基主要用于重组基因工程菌株的诱导表达。
1.1.4 仪器 1260高效液相色谱仪,美国Agilent科技有限公司;恒温混匀仪,杭州奥盛仪器有限公司;纯水仪,美国Millipore公司;微波炉,格兰仕微波生活电器有限公司;Electrophoresis、水平电泳槽,化学发光成像系统,BIO-RAD;SW-CJ-IF单人单面净化工作台,苏州净化设备有限公司;涡旋混合仪,上海精科实业有限公司;智能生化培养箱,宁波江南仪器厂;电热恒温鼓风干燥箱,上海新苗医疗器械制造有限公司;组合式摇床,太仓市强乐实验设备厂;恒温金属浴,杭州奥盛生物仪器有限公司;立式压力蒸汽灭菌器,上海申安医疗器械厂;制冰机,南京华璧科学仪器有限公司。
1.2 方法
1.2.1 菌株复壮 -80℃保存的菌液平板划线于含抗生素的平板上,37℃过夜培养,挑取单菌落培养12-14 h后再次平板划线,挑取单菌落转接2-3代用于后续实验。
1.2.2 重组菌株的构建及SDS-PAGE分析 以质粒SMR-MEcBO为模板,设计带有酶切位点的特异性引物分别对EcBO进行PCR扩增,扩增产物用1.0%琼脂糖凝胶电泳进行分离与验证,条带大小在1 500 bp左右,与实际的分子量一致,表明条带扩增成功,分别胶回收产物。双酶切4种载体pET28a-sumo(BamH I/SacI)、pTrc99a(EcoR I/HindIII)、pBad24(EcoR I/Hind III)、pCold II(NdeI/XhoI)。目的基因片段与相应的酶切载体同源重组转化至E.coliDH5α中,过夜培养,挑选阳性克隆子用表达载体通用引物对克隆子进行菌落PCR验证,条带大小为1 500 bp左右的单一条带为阳性克隆子,阳性克隆子委托通用生物(安徽)测序。测序结果与NCBI中核苷酸序列比对,无移码与突变,重组质粒构建成功。
取测序成功的4种重组质粒分别转化至E.coliBL21(DE3)中,得到工程菌株BL21(DE3)-pCold II-EcBO、BL21(DE3)-pET-28a-sumo-EcBO、BL21(DE3)-pTrc99a-EcBO、BL21(DE3)-pBad24-EcBO。分别挑取单菌落接种于5 mL LB中,37℃,220 r/min摇床培养12 h,活化2-3代后作为种子液。按1%的接种量转接至TB液体培养基中,加入相应抗生素,37℃,200 r/min摇床培养,检测OD600在0.6-0.8之间,加入0.50 mmol/L 的诱导剂IPTG,16℃培养18 h。培养结束后,取发酵菌液至50 mL离心管中,4℃,7 000 ×g离心3min,弃上清,收集菌体,用0.10 mol/L Tris-HCl缓冲液(pH 8.8)溶解混匀,然后用超声波细胞粉碎机破碎菌体。细胞破碎结束取100 μL破碎液于灭菌的离心管中,12 000 r/min离心10 min,吸取80 μL上清至新的1.5 mL EP管中,沉淀加入1 mL双蒸水重悬,离心弃上清,以80 μL 双蒸水重悬沉淀。上清和沉淀分别加入20 μL 5×SDS loading buffer,100℃煮沸5 min。最后SDS-PAGE检测蛋白表达情况。考马斯亮蓝染色液对凝胶染色,脱色处理后用凝胶电泳成像仪观察目的蛋白条带。采用ImageJ对SDS-PAGE图进行灰度扫描分析,以峰面积大小计算几种菌株EcBO蛋白可溶性表达量。
1.2.3 分子伴侣质粒筛选及诱导表达 分别将5种分子伴侣蛋白质粒和重组质粒 SMR-MEcBO混合后转化至E.coliBL21(DE3)感受态细胞中,利用含链霉素和氯霉素 LB 抗性平板进行筛选。分别挑取5种共表达阳性转化子(pKJE7-SMR-MEcBO、pGKJE8-SMR-MEcBO、pGro7-SMR-MEcBO、pG-Tf2-SMR-MEcBO 和 pTf16-SMR-MEcBO)于LB液体培养基中,37℃振荡培养至 OD600为0.60-0.80,添加终浓度0.10 mmol/L的IPTG(分子伴侣需加入1 mg/mLL-阿拉伯糖和(或)5 ng/mL 四环素)进行诱导表达。蛋白制备及SDS-PAGE分析方法同1.2.2节,筛选出能提高目的蛋白表达的分子伴侣蛋白质粒。
1.2.4 共表达菌株的原核表达 分别取99 μL“1.2.2”的细胞破碎液,加入终浓度0.2 mg/mL的l-RL,37℃,200 r/min,18 h(为了获得更高的l-SLR产量,将催化反应时间延长到18 h)。加入1倍体积的甲醇,终止反应,超声30 min,12 000 r/min离心10 min,取上清过滤膜,HPLC计算产物生成的量。
1.2.5 产物检测及计算 精密称定l-SLR标准品,用甲醇配制标准品溶液储备液备用。配置浓度为190 μg/mL 的l-SLR溶液,稀释为95、47.5、23.75、11.875、5.9375 μg/mL。精密称定l-RL标准品,用甲醇配制标准品溶液储备液备用。配置浓度为300 μg/mLl-RL溶液,稀释为150、75、37.5、18.75、9.375 μg/mL,按以下方法进样。色谱条件:Agilent Extend-C18column(4.6 mm × 250 mm, 5 μm)色谱柱,流动相A:水(含有0.1%甲酸和1 mmol/L甲酸铵),流动相B:乙腈;洗脱梯度:5% B,0-3 min;5%-15%B,3-6 min;15% B,6-15 min;15%-95% B,15-17.5 min;95%-5% B,17.5-18 min;5% B,18-23 min。流速:1 mL/min;柱温28℃;进样体积5 μL,检测波长为280 nm。以标准品质量浓度(X)为横坐标,峰面积(Y)纵坐标,进行线性回归,得回归方程。
1.2.6 酶活性测定 EcBO酶活力测定:在一定条件下,1 L 发酵液每分钟产生1 μgl-SLR的量定义为一个酶活力单位,用U表示,单位U/L。
计算公式:U=(C×V×1 000×n)/(t×m )
U:酶活力(U/L);C:产物浓度(1 mg/L); V:反应总体积(L);n:稀释倍数;t:反应时间(min);m:样品的量(L)。
将BL21(DE3)-SMR-MEcBO、菌株A的细胞破碎液于4℃,10 000×g,离心10 min,分别取99 μL上清液与不同浓度l-RL(0.0625、0.125、0.25 mg/mL)、37℃,200 r/min反应90 min后,加入1倍体积的甲醇,终止反应,超声30 min,12 000 r/min离心10 min,取上清过滤膜,HPLC计算产物生成的量。HPLC检测l-SLR产量进行酶活力测定。
1.2.7 共表达条件优化 底物浓度(0.0625、0.125、0.2、0.25、0.5、1)进行优化,诱导剂及浓度为0.10 mmol/L的IPTG,1 mg/mLL-阿拉伯糖,诱导温度为16℃,诱导时间18 h,l-RL终浓度如上,37℃反应18 h,其余同“1.2.3、1.2.4”。对 IPTG 浓度(0.02、0.04、0.05、0.10、0.20 mmol/L)、L-阿拉伯糖质量浓度(0.5、1、2、3、4、5 g/L)和诱导温度(16、20、25、37℃)进行优化,诱导剂浓度优化时,诱导剂浓度如上所述,诱导温度为16℃,诱导时间18 h,l-RL终浓度0.20 mg/mL的,37℃,200 r/min反应18 h,其余同“1.2.3、1.2.4”;诱导温度优化时,除诱导温度外,其余同“1.2.3、1.2.4”。
2 结果
2.1 原核表达载体的构建及重组蛋白的表达
分别用4对引物从质粒SMR-MEcBO扩增长1 500 bp左右基因后与4种双酶切后载体进行同源重组,得到的4种重组质粒转化E.coliDH5α进行菌落PCR验证。重组菌株基因结构及菌落PCR验证如图1。挑选阳性克隆测序成功后,将构建正确的质粒转化E.coliBL21(DE3)得到重组菌株BL21(DE3)-pCold II-MBP-EcBO、BL21(DE3)-pET-28a-sumo-EcBO、BL21(DE3)-pTrc99a-EcBO、BL21(DE3)-pBad24-EcBO。重组菌株分别诱导表达,SDS-PAGE分析如图2,EcBO蛋白大小(57.4 kD),MBP-EcBO蛋白大小(101.4 kD),SUMO-EcBO蛋白大小(69.0 kD),只有BL21(DE3)-SMR-MEcBO、BL21(DE3)-pCold II-MBP-EcBO、BL21(DE3)-pET-28a-sumo-EcBO有蛋白表达,蛋白可溶性表达率较原菌株BL21(DE3)-SMR-MEcBO低,BL2(1DE3)-pCold II-EcBO(52.78%)、BL21(DE3)-pET-28a-sumo-EcBO(47.24%),BL21(DE3)-SMR-MEcBO(67.95%);菌株BL21(DE3)-pTrc99a-EcBO和BL21(DE3)-pBad24-EcBO均无蛋白表达。菌株BL21(DE3)-SMR-MEcBO 生物合成l-SLR产量20.89 mg/L(表4)。因此后续进一步构建分子伴侣与SMR-MEcBO共表达菌株以期提高生物合成l-SLR产量。

图1 重组菌株基因结构图及菌落PCR验证Fig.1 Gene structure mapping of recombinant strains and colony PCR validation
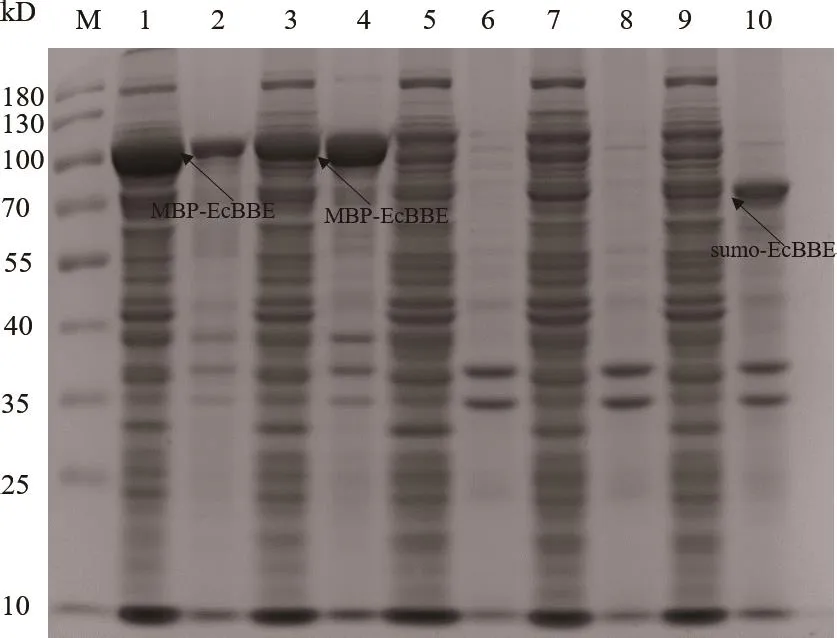
图2 重组菌株诱导表达的SDS-PAGE分析Fig.2 SDS-PAGE analysis of induced expressions of recombinant strains

表4 涉及启动子及对应的重组菌株蛋白表达情况Table 4 Protein expressions of promoters and corresponding recombinant strains
2.2 不同分子伴侣对EcBO可溶性表达及催化活性的影响
将重组质粒SMR-MEcBO分别与5种商业化分子伴侣共表达,转化E.coliBL21得到5种共表达菌株pGro7-SMR-MEcBO(菌株A)、PTf16-SMRMEcBO(菌株B)、PKJE7-SMR-MEcBO(菌株C)、PG-KJE8-SMR-MEcBO(菌株D)、Tf2-SMR-MEcBO(菌株E)。5种菌株分别进行诱导表达,SDS-PAGE结果如图3-A,5种伴侣蛋白共表达菌株可溶性蛋白比例均高于BL21(DE3)-SMR-MEcBO(68.10%),菌株A(78.10%)、菌株B(88.04%)、菌株D(87.69%)、菌株E(82.75%)、菌株C(89.84%),但后3种蛋白表达量明显减少(如图3-B)。5种菌株诱导表达的破碎液加0.2 mg/mL底物,37℃反应18 h后生物合成l-SLR产量:菌株A(71.83 mg/L)>菌株D(32.31 mg/L)>SMR-MEcBO(30.55 mg/L)>菌株B(25.11 mg/L)>菌株E(21.56 mg/L)>菌株C(9.67 mg/L)(图3-C)。综合考虑蛋白表达量及生物合成l-SLR产量筛选出最优伴侣蛋白共表达菌株为菌株A。
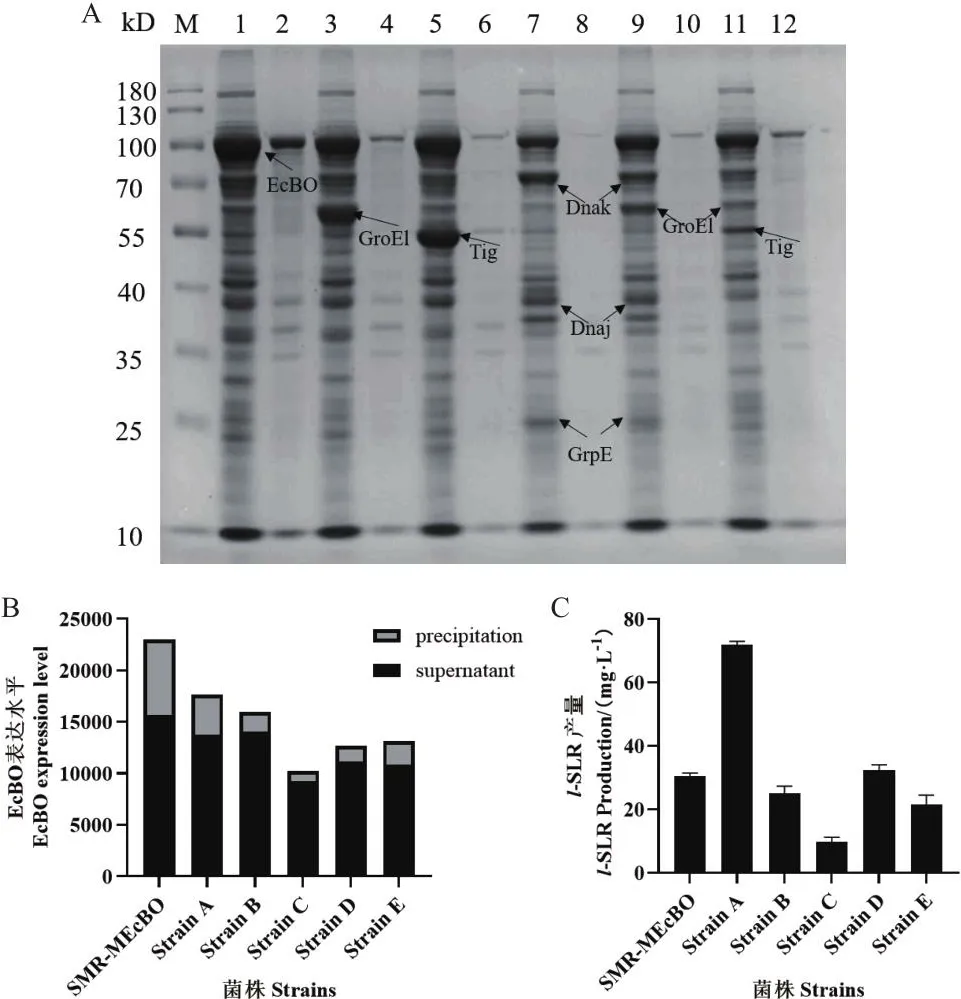
图3 分子伴侣蛋白筛选的SDS-PAGE分析及催化活性影响Fig.3 SDS-PAGE analysis of molecular chaperone protein screening and catalytic activity of EcBO
2.3 BBE酶活性测定
考察菌株A及原始菌株BL21(DE3)-SMRMEcBO的酶活力及不同浓度底物反应90 min时l-SLR产量,结果如图4。相同反应条件下菌株A催化活性及l-SLR产量均高于原始菌株BL21(DE3)-SMRMEcBO。菌株A在底物浓度0.25 mg/mL、反应90 min时EcBO酶活力194.14 U/L,原始菌株BL21(DE3)-SMR-MEcBO在相同条件下EcBO酶活力21.05 U/L,菌株A酶活力较原始菌株BL21(DE3)-SMR-MEcBO提高了9.22倍。在3种底物浓度下菌株A生物合成l-SLR产量随底物浓度增加而增加,0.25 mg/mL时l-SLR产量58.24 mg/L;原始菌株BL21(DE3)-SMRMEcBO生物合成l-SLR产量先增加后降低,0.125 mg/mL 时l-SLR产量最高11.98 mg/L。表明菌株A具有更好的转化l-RL生物合成l-SLR的能力。

图4 不同底物浓度l-SLR产量Fig.4 l-SLR productions at different substrate concentrations
2.4 菌株A培养条件优化
以l-SLR产量(mg/L)为考察指标,对共表达菌株A的表达条件进行优化。l-RL浓度优化时,随l-RL浓度增加,转化率降低,产物量增加。在l-RL浓度为0.062 5 mg/mL时转化率最高70.46%,l-SLR产量44.04 mg/L;在底物浓度为1 mg/mL时转化率已经降到12.42%,产量124.25 mg/L;0.20 mg/mL时,转化率35.92%,l-SLR产量71.83 mg/L。分子伴侣以L-阿拉伯糖为诱导剂,pMal-c4x载体以IPTG为诱导剂,本实验分别优化了诱导剂L-阿拉伯糖浓度、IPTG浓度和诱导温度、底物浓度等条件,结果如图5。L-阿拉伯糖在0.5-5 mg/mL浓度范围内l-SLR产量先升高后降低,在4 mg/mL最高95.72 mg/L。IPTG浓度在0.02-0.20 mmol/L范围内,随浓度增加酶催化活性先升高后降低,0.04 mmol/L时活性最高,l-SLR产量139.64 mg/L。l-SLR产量随诱导温度升高产量降低,16℃时最高71.83 mg/L,37℃时已经没有产物生成。在优化后的表达条件下,菌株A催化生成l-SLR产量达到144.19 mg/L,较未优化前提高了4.01倍。
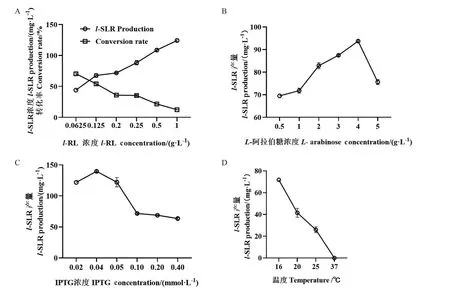
图5 共表达菌株A的培养条件优化Fig.5 Optimization of cultivating conditions for co-expressed strain A
3 讨论
在大肠杆菌中表达外源蛋白简单、快速、廉价且稳定,但外源蛋白快速表达通常会导致蛋白质未折叠或错误折叠。通常采用的措施包括选择适合的表达宿主[21];分子伴侣、融合蛋白、折叠酶的共表达[22];优化表达条件,如改变诱导剂浓度、降低培养温度等。课题组前期成功将EcBO构建在pMalc4x载体上,实现了EcBO的原核活性表达,重组工程菌株SMR-MEcBO可溶性蛋白比例68.10%,生物转化合成l-SLR产量30.55 mg/L。本研究拟通过构建更换表达载体及构建与分子伴侣共表达的菌株提高EcBO的可溶性表达,进而提高转化l-RL的效率。将EcBO构建在pCold II、pET-28a-sumo、pTrc99a、pBad24四种含不同强度启动子的载体上后,结果显示,BL21(DE3)-pCold II-MBP-EcBO、BL21(DE3)-pET-28a-sumo-EcBO有蛋白表达,但可溶性表达比例及活性均低于原菌株BL21(DE3)-SMR-MEcBO;BL21(DE3)-pTrc99a-EcBO、BL21(DE3)-pBad24-EcBO无蛋白表达。携带融合标签的重组菌株EcBO均有可溶性表达,未带融合标签的EcBO不能表达,推测EcBO的表达需要融合标签的辅助。pMal-c4x载体携带由大肠杆菌K12的malE基因编码的,蛋白大小为40 kD的麦芽糖结合蛋白(maltose binding protein,MBP)标签。MBP标签主要用于提高细菌中过量表达的融合蛋白的溶解性,具有范围广、效率高、且易于纯化等优点,且可增加目的蛋白的稳定性[23]。MBP标签增加了EcBO的可溶性表达及稳定性,进而提高了l-SLR产量。pET28a-sumo载体携带的小泛素相关修饰物(sumo)是一类大小约15 kD的高度保守小蛋白,可作为融合标签及分子伴侣。sumo化修饰可以保持融合蛋白基因的稳定性,使多肽正常折叠,提高融合蛋白的可溶性[24]。EcBO的表达需要融合标签的辅助,但EcBO的表达量与载体上启动子有关,合适的启动子有利于EcBO的表达。T7启动子属于强启动子,被T7 RNA聚合酶识别后起始的转录活性非常强,但是T7启动子表达的蛋白往往因缺乏某些蛋白折叠的辅助因子或者表达量过高等原因而不能正确折叠,形成不易溶解的包涵体[25]。Tac启动子为lac和 trp的杂交启动子,强度弱于T7启动子有利于EcBO正确折叠,发挥催化活性。
重组质粒SMR-MEcBO与分子伴侣共表达可进一步提高l-SLR产量。可溶性蛋白比例最高,蛋白正确折叠率不一定最高,以生物合成l-SLR产量为指标,筛选活性最高的分子伴侣共表达菌株。菌株A可溶性蛋白比例78.10%,生物合成l-SLR产量71.83 mg/L;菌株D可溶性蛋白比例87.69%,生物合成l-SLR产量32.31 mg/L;菌株B可溶性蛋白比例88.04%,生物合成l-SLR产量25.11 mg/L;菌株E可溶性蛋白比例82.75%,生物合成l-SLR产量21.56 mg/L;菌株C可溶性蛋白比例89.84%,生物合成l-SLR产量9.67 mg/L;未与伴侣蛋白共表达菌株SMR-MEcBO可溶性蛋白比例68.10%,生物合成l-SLR产量30.55 mg/L。其中,生物合成l-SLR产量最高的分子伴侣组合为GroEL-GroES,GroEL-GroES主要协助部分折叠态的蛋白克服动力学障碍、正确折叠为天然状态[26-27]。DnaK-DnaJ-GrpE、GroESGroEL-Tig分子伴侣组合虽然提高了可溶性表达比例,但可溶性表达量明显降低,l-SLR产量亦降低。Tig(Trigger Factor)标签增加蛋白可溶性比例,有助于新合成多肽链的早期折叠,可以保护新生肽链免受蛋白酶的降解或通过降低折叠速度来提高折叠效率;DnaK-DnaJ-GrpE主要参与蛋白质折叠和蛋白质解聚,在促进蛋白质共翻译折叠方面与 Tig 表现出一定的功能相似性[28]。综合考虑可溶性表达量及l-SLR产量,分子伴侣组合GroEL-GroES有利于EcBO形成正确的折叠,提高EcBO的可溶性表达,进而提高了催化l-RL生成l-SLR的转化效率。
本研究对菌株A及原始菌株SMR-MEcBO进行酶活力测定,在3种底物浓度下反应90 min检测l-SLR产量。菌株A在底物浓度0.25 mg/mL、反应90 min时EcBO酶活力194.14 U/L,原始菌株BL21(DE3)-SMR-MEcBO在相同条件下EcBO酶活力21.05 U/L,菌株A酶活力较原始菌株BL21(DE3)-SMR-MEcBO提高了9.23倍。表明菌株A具有更好的转化l-RL生物合成l-SLR的能力。为进一步提高EcBO的生物合成l-SLR的产量,本研究对菌株A的摇瓶发酵条件进行优化,利用菌株A进行不同l-RL浓度转化过程中,随l-RL浓度增加转化率降低,底物浓度为0.20 mg/mL时,转化率35.92%,l-SLR产量71.83 mg/L,可通过后续研究进一步探究底物浓度对l-SLR产量的影响原因以提高l-SLR产量。诱导剂浓度及诱导温度均对生物合成l-SLR的产量有较高的影响。L-阿拉伯糖价格低廉且对细胞无毒害作用,是分子伴侣蛋白系统必须的诱导剂,在浓度0.5-4 mg/mL范围内可调控蛋白表达量,4 mg/mL时l-SLR产量可到95.72 mg/L。IPTG是一种高效乳糖启动子诱导剂,可作为pMal-c4x表达系统的诱导剂,由于不会被宿主所利用,少量IPTG就能产生持久的诱导作用,IPTG浓度应控制在亚适量水平,浓度过高导致细胞中毒,浓度过低引起启动子启动程度减弱,从而影响外源蛋白高效表达[29]。0.04 mmol/L IPTG生物合成l-SLR产量139.64 mg/L。随诱导温度升高l-SLR产量减少。较低的生长温度降低了无活性聚集体形成的速率和疏水相互作用,从而减少了包涵体的形成,且较低的培养温度有助于增加分子伴侣的表达和活力,从而提高表达蛋白的稳定性和准确折叠率[30]。最终优选条件为,在TB培养基中,当IPTG浓度为0.04 mmol/L,L-阿拉伯糖含量为4 mg/mL,诱导温度为16℃,诱导表达18 h,制备破碎液后加入0.20 mg/mLl-RL,37℃,200 r/min反应18 h,生物合成l-SLR转化率达到72.09%,产量为144.19 mg/L,较初始菌株提高了4.72倍。
4 结论
本文通过更换表达载体及与分子伴侣共表达,构建并筛选了一株由EcBO与GroEL-GroES共表达,能高效转化l-RL为l-SLR的大肠杆菌工程菌株A。菌株A酶活可达194.14 U/L,为原菌株BL21(DE3)-SMR-MEcBO酶活的9.23倍。最终优选条件下,菌株A 摇瓶发酵生物合成l-SLR的转化率达到72.09%,产量为144.19 mg/L。该研究为高效生物合成l-SLR及其他BIAs类生物碱提供了新的策略。