一株多功能菌株的发掘、鉴定及解磷条件优化
谢东 汪流伟 李宁健 李泽霖 徐子航 张庆华
(江西农业大学生物科学与工程学院,南昌 330045)
磷是植物体生长所必需的元素,植物细胞中遗传物质的复制、生物酶的合成和能量的转换都需要磷元素的参与,磷的缺失会限制植物的发育[1]。我国缺磷耕地土壤面积占总耕地面积的74%[2],土壤是植物吸收磷的主要库源。土壤中的磷易与Ca2+、Al3+等金属离子结合,以Ca3(PO4)2、CaHPO4和AlPO4等难溶性磷酸盐的形式存在,难以被植物吸收[3-4],当前环境中可以被直接利用的磷仅占总磷量的0.1%[5]。近年来,随着我国畜牧业、种植业的高速发展,每年产生的农业废弃物总量高达40亿t,是世界上农业废弃物产量最大的国家之一[6]。多数农业废弃物在自然环境中不容易被分解利用,导致农业废弃物的大量堆积,不仅会造成水体的污染,还会伴随恶臭性气体的产生。动物粪便中含有丰富的有机磷和无机磷[7],可以与菌糠[8]和秸秆[9]一起通过堆肥的方式,进而将农业废弃物中的磷转化为植物可以利用的磷,变废为宝。然而,在堆肥环境中,高温持续时间较长,诸多学者筛选的解磷菌只适用于常温环境下解无机磷,关于解有机磷菌株的研究相对较少[10],且先前报道的绝大多数解磷菌株在高温状态容易失活,并不适用高温堆肥这一场景[11]。目前为了解决土壤中有效磷含量不足、植物生长状态不佳的问题,大多采用施加磷肥的方法解决,但所带来的土壤板结、水体污染、施肥效果不佳和微生物区系改变等问题依然突出;由此可见,简单地追加化肥并不利于农业生产的可持续发展[12]。因此,研究细菌解磷的机理和扩大应用范围具有重要意义[13]。筛选出耐高温高效解磷的菌株,应用在堆肥中,将农业废弃物利用生物发酵技术生产成农业肥料,不仅可以二次利用农业废弃物,而且有利于环境的保护,同时达到节约农业生产成本的目的[14]。
农业废弃物中富含多种营养物质,若要得到充分利用,目前的应对办法是添加多种功能性菌株,然而,大多数学者所研究的菌株功能单一,复合菌群的功能性较强,可以达到充分利用废弃物中营养物质的目的[15-16]。然而,复合菌群的构建工作量巨大,复合菌群构建前期需要对菌株间进行拮抗性试验,确保菌株之间无抑制作用后,方能投入使用[16]。因此,多功能菌株的筛选就显得至关重要。
本研究从菌糠鸡粪堆肥中筛选解磷菌株,对所筛选菌株进行物种鉴定;通过响应面优化试验,探究菌株的最强解磷能力及相应的解磷条件;研究该菌株具有的功能,以满足农业废弃物资源的高效利用。
1 材料与方法
1.1 材料
1.1.1 实验样品 取自江西省赣州市信丰县谢建华赣南早脐橙基地,以菌糠和鸡粪为主要原料的高温堆肥。
1.1.2 培养基 LB培养基:胰蛋白胨10.0 g/L、酵母提取物5.0 g/L、氯化钠10.0 g/L、pH 7.0。
无机磷发酵培养基[10]:葡萄糖10.0 g/L、磷酸三钙5.0 g/L、硫酸铵1.0 g/L、氯化钠0.3 g/L、氯化钾0.3 g/L、硫酸镁0.3 g/L、硫酸亚铁0.03 g/L、硫酸锰0.03 g/L、超纯水、pH 7.0、琼脂20 g/L(固体)。有机磷为底物时[11],将植酸钙代替磷酸三钙,浓度为2.0 g/L。
解钾培养基[17]:蔗糖10.0 g/L、硫酸镁0.5 g/L、碳酸钙1.0 g/L、硫酸铵1.0 g/L、氯化钠0.1 g/L、酵母膏0.5 g/L、磷酸氢二钠2.0 g/L、钾长石粉10.0 g/L、pH 7.0。
吲哚乙酸(indole-3-acetic acid, IAA)培养基[18]:蛋白胨10.0 g/L、酵母膏5.0 g/L、氯化钠10.0 g/L、L-色氨酸0.2 g/L、pH 7.0。以上培养基均需在121℃,灭菌20 min。
1.2 方法
1.2.1 解磷菌株的初筛 称取10 g高温堆肥样品,稀释在装有90 mL/250 mL无菌水的三角瓶中,充分振荡,吸取1 mL上清液于装有9 mL无菌水的试管中,依次稀释至10-2、10-3、10-4、10-5、10-6、10-7。取10-5、10-6、10-7三个梯度的稀释液,均匀涂布至无机磷选择培养基中,且每个梯度设置3个重复。将涂布好的平板置于50.0℃的恒温培养箱内,培养5 d,挑取生长旺盛的单菌落,进行多次划线分离纯化至长出单一菌落,4℃保存。
1.2.2 解磷菌株的复筛 将初筛得到的耐高温解磷菌株接种至装有80 mL/250 mL LB液体培养基的三角瓶内,置于50℃、200 r/min条件下的恒温振荡器中培养1 d。将种子液以2.0%(V/V)的接种量接入无机磷液体培养基中,并以2.0%(V/V)的无菌水代替种子液作空白对照,重复3次,置于50.0℃、200 r/min条件下的恒温振荡器中培养,每48 h,测量发酵上清液中的磷含量,并绘制不同菌株的解磷曲线。挑选解磷效果最好的菌株,每24 h测量上清液中的磷含量并绘制相应的解磷曲线。
1.2.3 菌株鉴定
1.2.3.1 菌株Pb1的形态学观察 将菌株Pb1在LB固体培养基上进行划线培养,观察菌落的隆起程度、颜色、透明度、质地、边缘等;挑取少许单菌落,经过革兰氏染色后进行观察。
1.2.3.2 菌株Pb1的生理生化分析 生理生化鉴定:参考《伯杰氏细菌鉴定手册》,通过接触酶反应、甲基红试验、尿素酶等特征性试验考察菌株的生理生化特性[19-20]。
1.2.3.3 菌株Pb1的分子生物学鉴定 采用细菌基因组DNA提取试剂盒提取供试菌株DNA,利用细菌通用引物27 F和1492 R进行PCR扩增。PCR反应体系:菌株基因组DNA 0.5 μL,携有Mg2+的10×Buffer 2.5 μL,dNTP 1 μL, DNA聚合酶0.2 μL,10 μmol/L的上下游引物各0.5 μL,然后加双蒸水至25 μL,PCR条件:94℃预变性45 s;55℃复性45 s,72℃延伸1 min,总共30个循环;72℃修复延伸10 min,4℃下终止反应。将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI上进行比对,使用软件MEGA 6中的Neighbor-joining法构建系统发育树[21]。
1.2.4 单因素实验 以无机磷发酵液体培养基为初始培养基,通过对培养基成分和培养条件的改变,探究菌株B.smithiiPb1的最适培养基成分及最佳培养条件。实验过程中,为了排除高温导致水分蒸发对实验结果造成影响,以相同接种量的无菌水代替菌液设置对照试验。
1.2.4.1 培养基成分对菌株Pb1解磷效果的影响 探究最适碳源(乳糖、果糖、麦芽糖、淀粉、蔗糖、葡萄糖)及最适碳源浓度(5.0、10.0、15.0、20.0、25.0、30.0 g/L)、磷酸三钙浓度(1.0、3.0、5.0、7.0、9.0、11.0 g/L)、最适氮源(草酸铵、硫酸铵、氯化铵、碳酸铵、乙酸铵、硝酸铵)及最适氮源浓度(1.0、2.0、3.0、4.0、5.0、6.0 g/L)、无机盐[22]浓度(0.48、0.96、1.44、1.92、2.40、2.88 g/L)对菌株B.smithiiPb1解磷能力的影响。保持单一变量,其他培养条件与初始培养条件一致,每组实验重复3次。
1.2.4.2 培养条件对菌株Pb1解磷效果的影响 探究培养基初始 pH(4.0、5.0、6.0、7.0、8.0、9.0)、温度(35.0、40.0、45.0、50.0、55.0、60.0℃)、接种量(1.0%、2.0%、3.0%、4.0%、5.0%、6.0%)(V/V)、装液量(40.0、60.0、80.0、100.0、120.0、140.0 mL/250 mL)及摇床转速(175、200、225、250、275、300 r/min)对菌株B.smithiiPb1解磷能力的影响。保持单一变量,其他培养条件与初始培养条件一致,每组实验重复3次。
1.2.5 响应面优化试验
1.2.5.1 PB(Plackett-Burman)试验设计 依据单因素试验结果,利用Design expert 8.0.6软件设计9因素2水平的PB试验,PB试验设计因素及水平见表1。
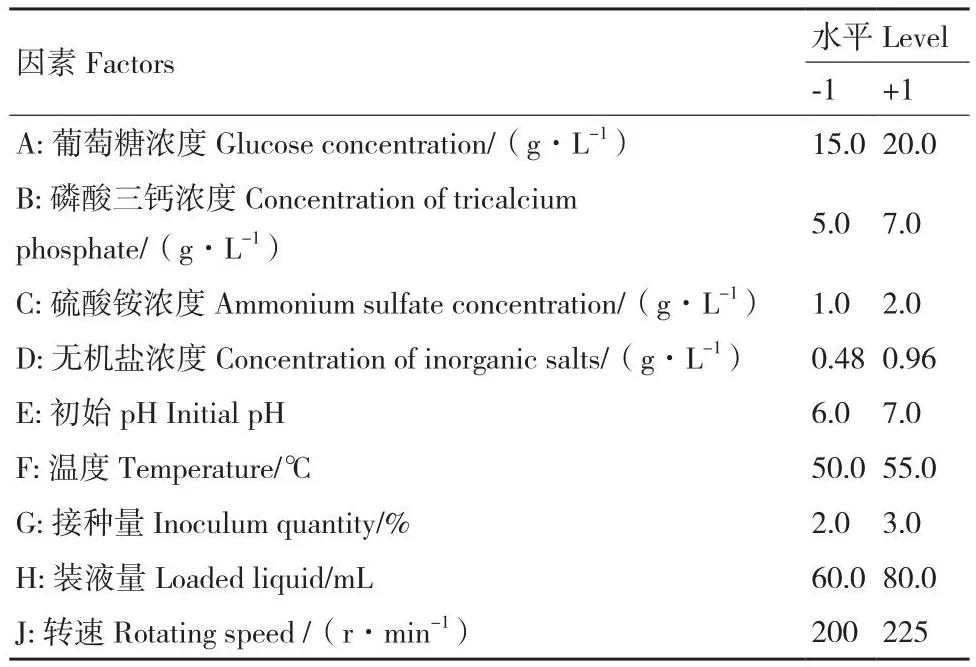
表1 Plackett-Burman试验设计因素及水平Table 1 Factors and levels of Plackett-Burman experiment design
1.2.5.2 最陡爬坡试验设计 根据PB试验结果,选取对菌株Pb1解磷能力影响较大的因素,并确定各因素爬坡方向和步长,设计最陡爬坡试验[23]。
1.2.5.3 Box-Behnken响应面试验 联合PB试验和爬坡试验结果,以溶磷量为响应值,磷酸三钙浓度(B)、装液量(H)、转速(J)为考察因素,根据Box-Behnken试验设计原理,利用Design expert 8.0.6设计试验,试验设计因素与水平如表2。

表2 Box-Behnken试验设计因素与水平Table 2 Factors and levels of Box-Behnken experiment design
1.2.6 菌株B.smithiiPb1解有机磷、产IAA和解钾能力测定 将菌株B.smithiiPb1按2.0%(V/V)的接种量,分别添加至有机磷发酵培养基、IAA培养基和解钾培养基中,以相同接种量的无菌水代替菌液做空白对照,每组实验重复3次。置于培养条件为55.0℃、200 r/min的恒温振荡器中培养,每24 h测量发酵液上清中的速效磷浓度、IAA含量和速效钾浓度并绘制曲线。
速效钾浓度的测定采用原子吸收火焰分光光度计法[17]、IAA浓度的测定用Salkowski比色法[18]、速效磷浓度测定采用钼锑抗比色法[24]。
1.2.7 数据分析 每组实验数据由3次重复实验得到,实验获得的数据用平均数±标准差(SD)表示,用Origin 2021、Design expert 8.0.6和SPSS 2022等统计学软件进行数据分析。
2 结果
2.1 初筛与复筛
由图1-A可知,在耐高温解磷菌株的初筛中,得到7株解磷菌。在50.0℃的恒温振荡器中,培养8 d,发现各菌株解磷能力有所差异,发酵上清液中速效磷浓度范围为16.08-331.25 mg/L。其中,菌株Pb1的解磷能力最强,达331.25 mg/L,因此选择菌株Pb1进行后续试验探究。由图1-B可知,菌株Pb1在培养的前3 d溶磷量上升较快,之后培养基中的可溶性磷含量稍有降低。可能是由于菌株Pb1的生长量达到一定程度后,其自身生长发育需要消耗部分磷。因此,选取发酵时间为3 d时的溶磷量作为菌株解磷能力测定的响应值。

图1 耐高温解磷菌株的初筛和复筛Fig.1 Primary screening and secondary screening of high temperature resistant phosphorus-solubilizing strain
2.2 菌株鉴定
2.2.1 菌株Pb1形态学观察 菌株Pb1在LB培养基上的菌落呈乳白色、不透明、边缘规则、表面湿润;革兰氏染色结果为阳性(G+),菌体呈杆状(图2)。
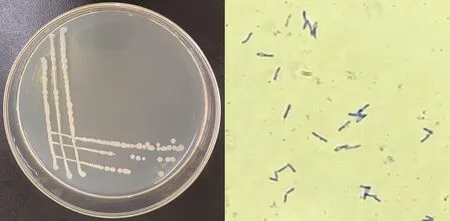
图2 菌株Pb1及革兰氏染色Fig.2 Strain Pb1 and Gram staining(10×100)
2.2.2 菌株Pb1生理生化分析 对菌株Pb1进行生理生化分析,结果如表3所示,参考《伯杰氏细菌鉴定手册》并结合形态学观察,初步认定菌株Pb1为Bacillus smithii。

表3 菌株Pb1生理生化特征Table 3 Physiological and biochemical characteristics of strain Pb1
2.2.3 菌株Pb1的分子生物学鉴定 16S rRNA基因测序结果表明,该菌株的16S rRNA全长1 458 bp,上传至NCBI,登录号为OP09025。在NCBI上进行同源性比对构建系统进化树(图3),发现该菌株Pb1与Bacillus smithii在进化关系上具有最近的亲缘关系,序列同源性为99.80%。综合该菌株的菌落形态观察、生理生化分析和分子生物学鉴定结果,菌株Pb1被鉴定为Bacillus smithiistrain。

图3 基于菌株Pb1 16S rRNA构建的系统发育树Fig.3 Constructed phylogenetic tree based on 16S rRNA of strain Pb1
2.3 单因素影响分析
2.3.1 培养基成分对B.smithiiPb1解磷能力的影响 由图4-A, B可知,B.smithiiPb1的最适碳源为葡萄糖;且随着葡萄糖浓度的不断升高,B.smithiiPb1的解磷能力呈先上升后下降的趋势,在葡萄糖浓度为15.0 g/L时,B.smithiiPb1有最强的解磷能力,溶磷量达367.66 mg/L。试验结果(图4-C, D)所示,最适氮源为硫酸铵,当硫酸铵浓度为2.0 g/L时,溶磷量达369.18 mg/L。由图4-E可知,当培养基中磷酸三钙的浓度为7.0 g/L时,B.smithiiPb1解磷能力最强,达359.41 mg/L;而当发酵液中磷酸三钙的浓度为3.0 g/L和5.0 g/L时,菌株B.smithiiPb1解磷能力的差异不显著(P>0.05)。由图4-F可知,随着无机盐浓度的升高,B.smithiiPb1的解磷能力不断下降,当无机盐浓度为0.48 g/L时,B.smithiiPb1的解磷能力最强,达355.37 mg/L。

图4 不同培养基成分对B.smithii Pb1解磷能力的影响Fig.4 Effects of different medium components on the phosphorus-solubilizaing ability of B.smithii Pb1
2.3.2 培养条件对B.smithiiPb1解磷能力的影响 由图5-A, B可知,当装液量为60.0 mL/250 mL时,B.smithiiPb1的解磷能力最强,达355.37 mg/L。在摇床转速为225 r/min时,B.smithiiPb1的解磷能力最强,达369.08 mg/L。由图5-C可知,B.smithiiPb1的解磷能力随着摇床温度的升高呈现出先上升后下降的趋势,当摇床温度为55.0℃时,B.smithiiPb1的解磷能力最强,达360.97 mg/L,温度为35.0℃时解磷能力最低,为195.36 mg/L,说明该菌株嗜热。由图5-D可得,当接种量为3.0%(V/V)时,B.smithiiPb1解磷能力最强,为363.37 mg/L,超过或低于3.0%(V/V)的接种量时,均会导致菌株解磷能力的下降。由图5-E可知,当培养基初始pH为7.0时,B.smithiiPb1解磷能力最强,达353.42mg/L,稍高于培养基初始pH为6.0时的解磷能力,B.smithiiPb1更适应于中性的环境。
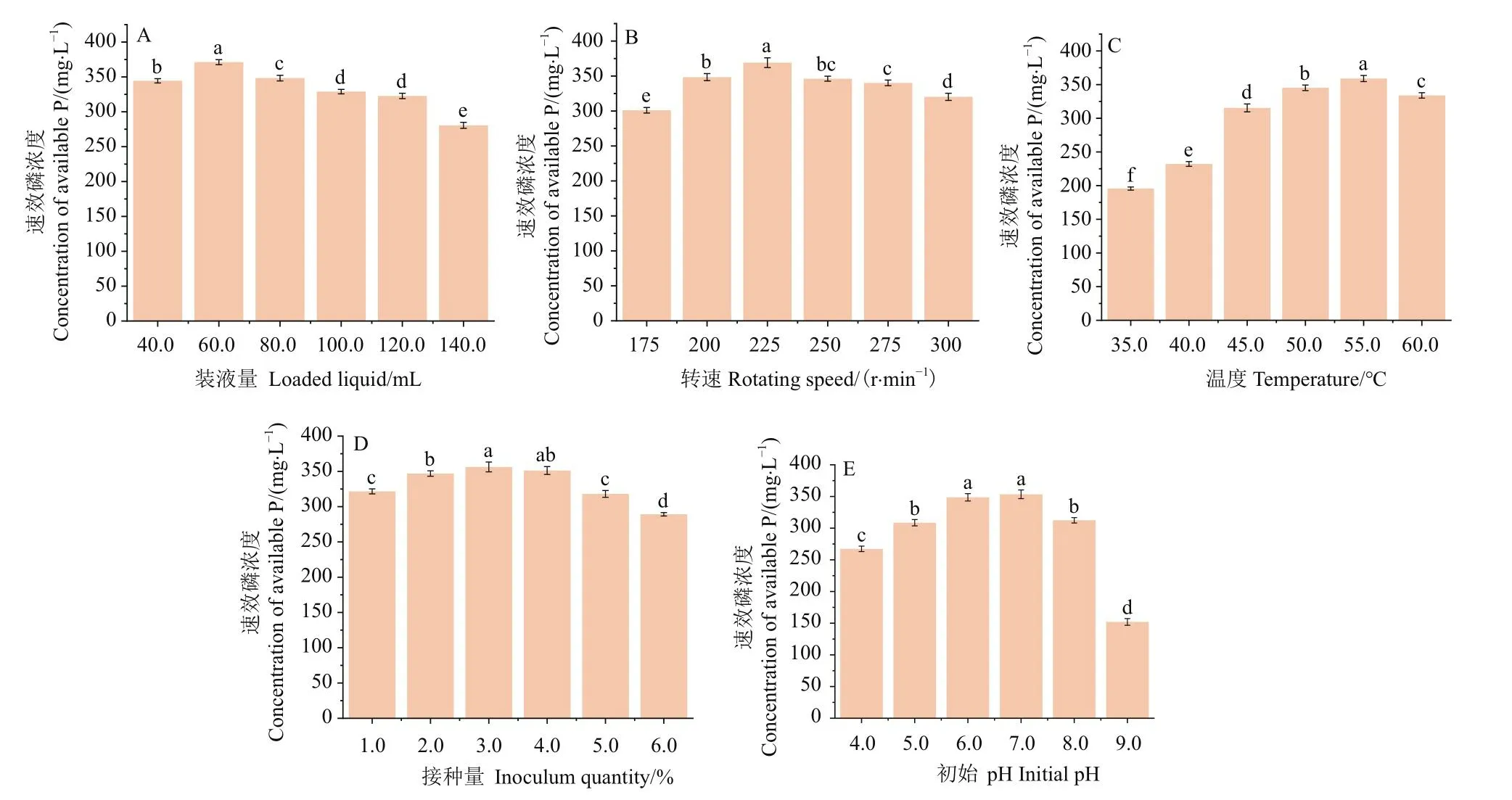
图5 不同培养条件对B.smithii Pb1解磷能力的影响Fig.5 Effects of different culture conditions on phosphorus-solubilizaing ability of B.smithii Pb1
2.4 响应面试验结果
2.4.1 PB试验 PB试验设计及结果如表4、表5所示。由表5的方差分析可知,该模型显著(P<0.05)。试验因素中装液量、转速、磷酸三钙浓度、无机盐浓度和葡萄糖浓度,这5个因素对菌株Pb1溶磷能力的影响是显著的(P<0.05),影响等级分别为1-5,选取对溶磷能力影响较大的H(装液量)、J(转速)、B(磷酸三钙浓度)3个因素进行最陡爬坡试验设计,其余因素按照单因素实验中最优条件进行后续试验。
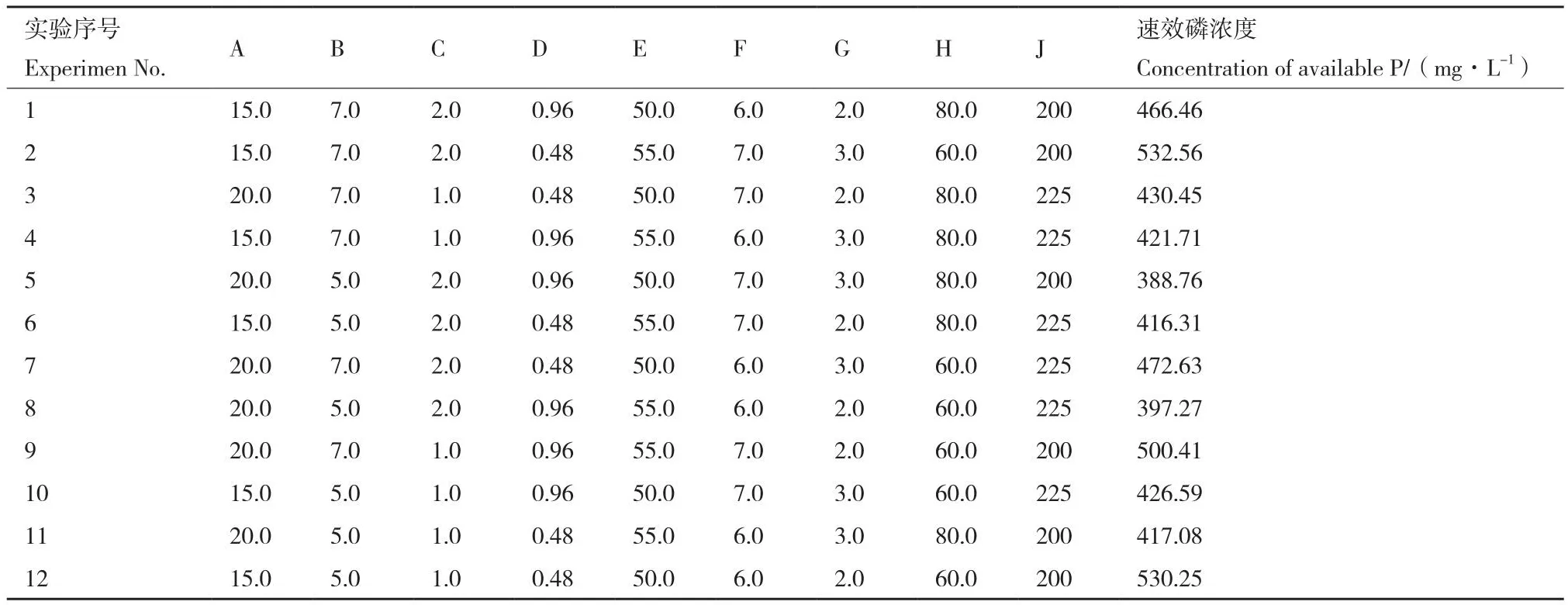
表4 Plackett-Burman试验设计与结果Table 4 Design and results of Plackett-Burman experiments
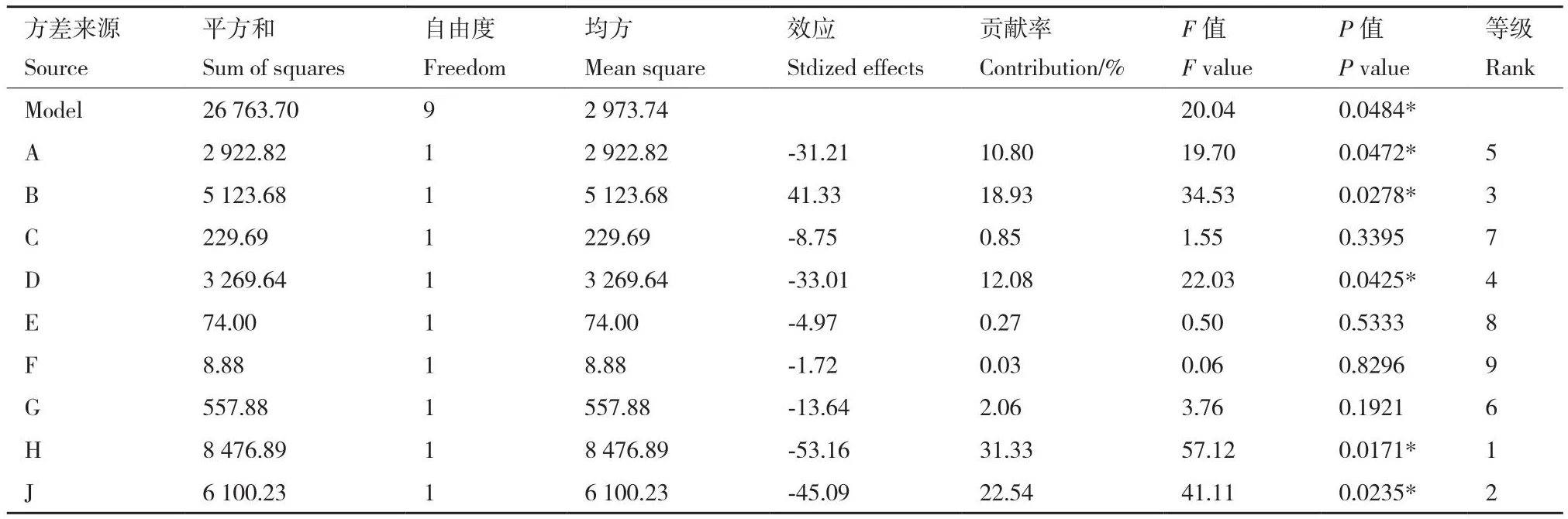
表5 Plackett-Burman试验结果方差分析Table 5 Variance analysis of Plackett-Burman experiments results
2.4.2 最陡爬坡试验 最陡爬坡试验设计及结果如表6所示,试验序号为4所对应磷酸三钙浓度6.5 g/L、装液量65.0 mL/250 mL、摇床转速207 r/min时,B.smithiiPb1的溶磷量最大,为533.28 mg/L。
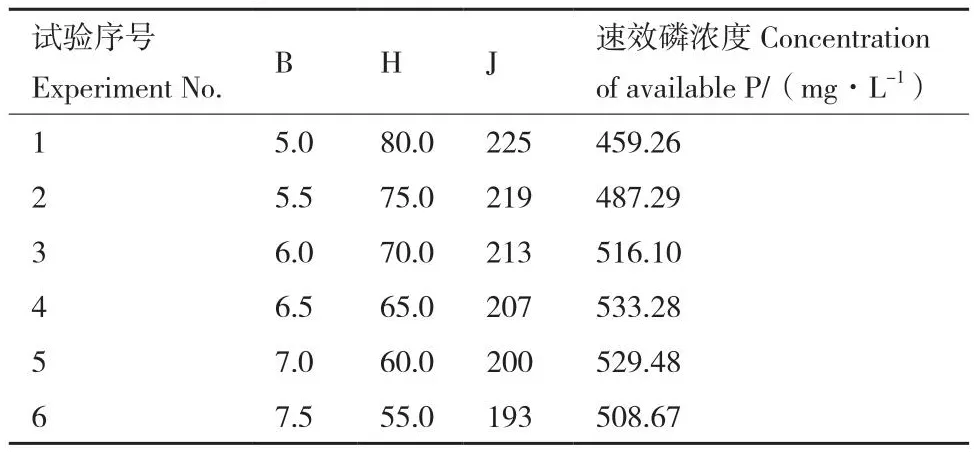
表6 最陡爬坡试验设计及结果Table 6 Design and results of the steepest ascent test
2.4.3 Box-Behnken试验 Box-Behnken试验结果如表7所示,对B.smithiiPb1解磷能力进行多元回归拟合,以Y为溶磷量,B、H和J分别代表磷酸三钙浓度、装液量和转速的编码,得到:
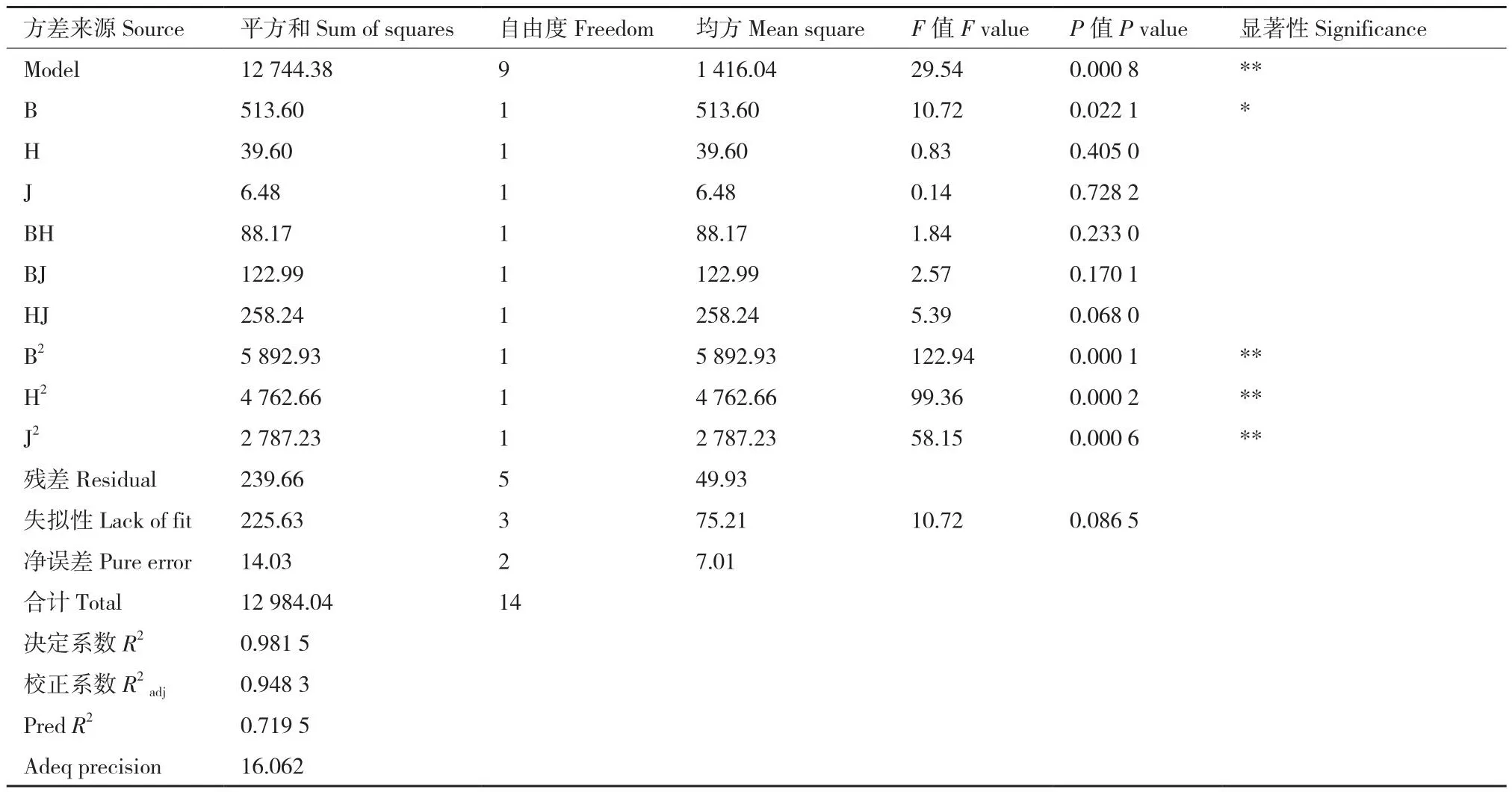
表7 回归模型方差分析Table 7 Variance analysis of regression model
Y=535.83-8.01B-2.23H-0.90J-4.69BH-5.55BJ+8.03HJ-39.95B2-35.91H2-27.48J2
由表7可知,模型F值为29.54,该拟合的模型达到显著水平(P<0.05)。决定系数R2=0.981 5,校正系数R2adj=0.948 3,说明实际B.smithiiPb1的溶磷量与模型的回归值具有良好的一致性,同时该模型能解释71.59%的响应值的变化。失拟项的F值为10.72,P=0.086 5>0.05,失拟项不显著,说明该方程能很好地反映实际情况。
从图6可得,磷酸三钙浓度、转速和装液量均会对B.smithiiPb1的解磷能力产生交互作用。经Design expert 8.0.6软件分析,当磷酸三钙6.40 g/L、装液量64.74 mL/250 mL、转速206.88 r/min时,理论上能达到最大溶磷量536.26 mg/L。由于实际操作的限制,因此选取磷酸三钙6.40 g/L、装液量65.00 mL/250 mL、转速207 r/min进行验证性试验,最终发酵液中溶磷量为534.68 mg/L,与模型预测的最大值相差小于2%,表明此模型可以对B.smithiiPb1的解磷条件进行优化。
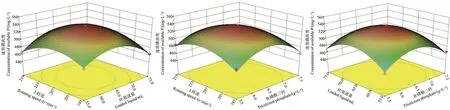
图6 各因素间对菌株B.smithii Pb1溶磷能力影响的响应曲面Fig.6 Response surface of the effects of various factors on the phosphorus solubility of strain B.smithii Pb1
2.5 菌株B.smithii Pb1解有机磷、产IAA和解钾曲线
如图7所示,B.smithiiPb1兼有解有机磷、产IAA和解钾的能力。图7中的相应的速效磷浓度、IAA浓度和速效钾浓度均扣除空白对照之后的浓度。B.smithiiPb1在解有机磷时,在第3天就达到了速效磷浓度的最大值,为238.99 mg/L,之后速效磷浓度略有下降,出现与B.smithiiPb1解无机磷时相同的变化趋势;B.smithiiPb1在第7天达到IAA浓度的最大值,为23.26 mg/L;B.smithiiPb1在解钾培养基中,在第10天为速效磷浓度最大值,达173.37 mg/L。
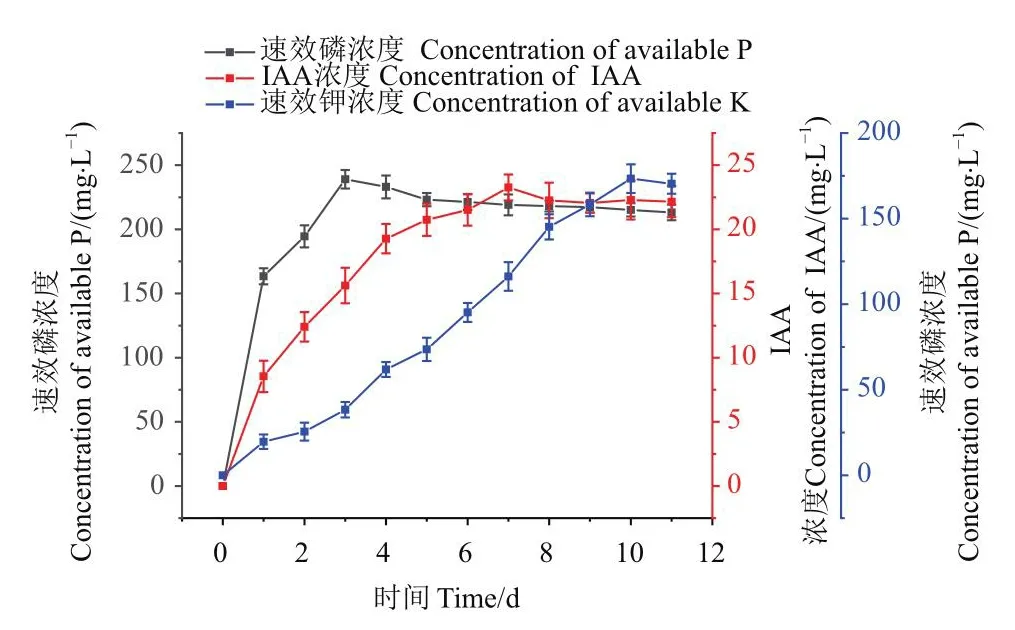
图7 菌株B.smithii Pb1解有机磷、产IAA和解钾曲线Fig.7 Curves of solubilizing organophosphates, IAA production and potassium by strain B.smithii Pb1
3 讨论
本研究从菌糠和鸡粪为原料的高温堆肥中,筛选得到一株嗜热高效解磷菌株Pb1,培养3 d,发酵液中溶性磷含量可达331.25 mg/L。赵越等[25]从高温堆肥中筛选的耐热解磷菌P3,培养8 d,发酵液中可溶性磷含量为47.88 mg/L。杨天学等[26]筛选的两株耐热解磷菌(No.C、No.D),分别培养14 d和16 d,发酵液中的可溶性磷含量最大,为263.8 mg/L和242.0 mg/L。相较之下,本研究所筛选的菌株Pb1在解磷能力上更具优势。菌株Pb1从形态学、生理生化和分子生物学鉴定,表明菌株Pb1属B.smithii细菌。目前,关于B.smithii细菌解磷方面的研究较少,可进一步探究B.smithiiPb1的解磷机制、解磷的关键基因、蛋白和代谢机制。
众所周知,微生物的解磷过程十分复杂,由多种因素共同作用[27]。当前大多数学者对菌株解磷能力进行优化时,考虑因素较为单一[28-29],菌株的差异会导致最终菌株的解磷能力优化结果有所不同,所以应根据所筛选菌株的特性及实际工业化生产菌剂过程中的工艺要求,合理设计因素进行优化。本试验从培养基成分和培养条件共同出发,依次经过单因素实验、PB试验、最陡爬坡试验和响应面优化试验,系统地优化菌株B.smithiiPb1的解磷条件。
在单因素实验中发现,不同的碳源对B.smithiiPb1解磷能力的影响显著,可能是菌株B.smithiiPb1的葡萄糖转运机制较为丰富,生成较多利用葡萄糖的相关性酶,产生足够的生物质能源以供给菌株的生长和增殖,进而促进更多的磷酸三钙溶解。随着葡萄糖浓度的升高,B.smithiiPb1解磷能力呈现出先增加后减小的趋势,与前人研究结果相似[22,27]。当接种量超过或低于3.0%(V/V)时,菌株解磷能力变弱,原因可能是过大的接种量加快了发酵液中营养物质的消耗,也可能是产生过多对菌株有抑制性的代谢产物,而不利于菌株后续的解磷;接种量过低则可能导致解磷菌株生长周期过长,菌株的数量不足,同样会导致菌株解磷能力的下降[12]。当磷酸三钙浓度为7.0 g/L时,B.smithiiPb1的解磷能力最强,可能是磷酸三钙浓度过低导致B.smithiiPb1转化磷源的底物不足,磷酸三钙浓度过高则可能抑制B.smithiiPb1的生长[22];微生物以氧作为呼吸作用的电子受体,氧浓度的高低会影响微生物体的呼吸作用和能量的产生[30]。不同的装液量会改变摇瓶内的溶氧量[31],所以当装液量为60.0 mL/250 mL时,B.smithiiPb1的解磷能力最强,装液量少可能会导致菌株培养空间的较小,不利于B.smithiiPb1的解磷;摇床转速也同样会影响培养基的溶氧量[31],然而当摇床转速超过225 r/min时,B.smithiiPb1的解磷能力变弱,原因可能是摇床转速过高产生的剪切力对菌体造成机械损伤,降低了菌株的活性[31]。由此可见,任何因素的改变都会影响菌株的解磷能力,利用相关软件进行差异显著性分析,探究B.smithiiPb1的最适解磷条件。
通过单因素实验、PB试验、最陡爬坡试验和响应面优化后,最终确定,当葡萄糖、硫酸铵、磷酸三钙、无机盐、温度、转速、初始pH、装液量、接种量分别为15.0 g/L、3.0 g/L、6.4 g/L、0.48 g/L、55.0℃、207 r/min、7.0、65.0 mL、3.0%(V/V)时,B.smithiiPb1的解磷能力最强,培养3 d,无机磷发酵液中的速效磷含量为534.68 mg/L,强于当前大多数学者所筛选的耐热解磷菌。张芮瑞等[22]从白酒丢糟堆肥中筛选了一株耐热(50℃)解磷真菌GDF1,经优化,培养5 d,可溶性磷含量达292.59 mg/L;赵霞[28]从高温堆肥中筛选了9株耐热(50℃)解磷菌,其中3株菌按照一定比例进行复配,经优化,培养7 d,可溶性磷含量达到241.70 mg/L,复配菌株的效果一般都会比单一菌株强,然而,赵霞[28]配制的复合菌并没有高于本研究中B.smithiiPb1单一菌株的解磷效率。胡春明等[29]从磷矿粉高温堆肥中筛选出了1株耐高温(45℃)无机磷降解菌,经优化,培养22 d,培养液中可溶性磷含量达327.60 mg/L。Chang等[32]筛选得到了一株解磷菌B.smithiiF18,在50℃下,培养10 d,可溶性磷含量达544.20 mg/L,虽然与本试验所筛选的解磷菌为同一属,但是本试验中的B.smithiiPb1,在55℃下,仅需培养3 d,溶磷量就能达到534.68 mg/L,对比之下,解磷时间缩短了7 d,解磷效率更高,且有更强的耐热性,即使是在60℃的高温下,仍能保持较高的解磷能力,更适用于高温堆肥环境。
本研究首次发现了B.smithiiPb1兼有解有机磷、解钾和产IAA的能力。B.smithiiPb1的解有机磷能力较强,达238.99 mg/L,强于沈佳佳等[11]所筛选得到FD1-15常温解有机磷菌株,菌株FD1-15的培养液中速效磷含量为2.88-5.30 mg/L。我国每年产生大量的动物粪便,动物粪便中的磷素资源不容小觑。动物粪便并不适宜直接施入土壤中,否则会造成作物的烧苗,必须经过腐熟的过程[33]。我国土壤中所含有的磷浓度并不高[2],而B.smithiiPb1耐热性较好,能在堆肥过程中释放动物粪便中的磷,肥沃土壤;添加外源磷素比释放土壤中固有的有机磷的磷素更具时效性[10]。二次利用动物粪便中的磷源,对于缓解我国磷矿资源的消耗、生态环境的保护以及粮食的增产有重大意义[11]。钾、磷和氮作为作物生长所必需的3种元素,钾是多种酶的激活剂,参与调控植物体内多种营养物质的合成以及植物的光合作用及呼吸作用[34]。目前多数学者筛选的解钾菌只适用于常温下释放土壤中的钾,在生物质堆肥中,钾是肥效的重要组成部分。在接种嗜热菌株B.smithiiPb1后,培养10 d,发酵液中的可溶性钾含量达173.37 mg/L,高于吴红艳等[17]筛选得到常温解钾菌K02的解钾能力,菌株K02使得发酵液中可溶性钾浓度提升至41.84 mg/L,若将菌株B.smithiiPb1接入堆肥中,将提高堆肥中速效钾含量,成品堆肥的质量会进一步提高。IAA是一种植物激素,参与植物体内多种生理生化的调节和控制,提高植株对外界环境的抗逆性,促进植物细胞的分裂及分化、加快植物种子的萌发等作用[35]。强震宇等[35]筛选到常温菌株MC9,IAA分泌量达8.63 mg/L。相较之下,B.smithiiPb1产IAA的能力更有优势。目前,关于成品堆肥营养成分的分析中,尚未将IAA含量纳入参考范围内,而IAA对于植物生长发育的重要性显而易见,若成品堆肥中富含IAA,对于提高堆肥成品的质量同样有积极作用,使得堆肥产物更具独特的竞争力和价值。
当前,对于菌株的筛选研究中,多数学者集中在单一功能上的选育[30-32],关于多功能菌株的研究相对较少。本试验筛选出的菌株B.smithiiPb1有较强的解无机磷、解有机磷、解钾和产IAA的能力。后续研究工作将继续探索B.smithiiPb1所具有的功效,并将B.smithiiPb1参与实际的农业废弃物的堆肥中,分析菌株在堆肥各阶段发挥的作用及探究B.smithiiPb1在堆肥中的解磷、解钾和产IAA的作用机制,为高效堆肥菌株的规模化生产提供优良菌株资源,B.smithiiPb1的工业化应用提供理论依据。
4 结论
本研究从菌糠和鸡粪为原料的高温堆肥中,筛选得到了嗜热(55℃)多功能菌株B.smithiiPb1,该菌株兼有解有机磷、无机磷、解钾和产IAA的能力。B.smithiiPb1在解无机磷时,培养3 d,溶磷量可达534.68 mg/L。培养条件为55.0℃、200 r/min的条件下,B.smithiiPb1在解有机磷时,3 d使得溶液中速效磷含量提升至238.99 mg/L;B.smithiiPb1在解钾时,10 d将发酵液中速效钾浓度提升至81.06 mg/L;B.smithiiPb1在第7天就能产生浓度为23.26 mg/L的IAA。B.smithiiPb1展露出丰富的功能性,为我国农业废弃物的开发利用提供优良菌种资源。