蔬菜软腐病菌广谱拮抗细菌菌株筛选鉴定及防效研究
马俊秀 吴皓琼 姜威 闫更轩 胡基华 张淑梅
(黑龙江省科学院微生物研究所,哈尔滨 150010)
蔬菜营养成分丰富,除日常饮食必须外,其活性成分在保健、农业、医药以及日化品等领域中被广泛应用[1-3]。蔬菜在生产以及贮藏运输中病害频发,其中最常见、危害最重的是软腐病,严重制约蔬菜产业发展。引起蔬菜软腐病的病原菌种类丰富,来源和致病机制具有多样性,主要包括果胶杆菌属(Pectobacterium)、芽孢杆菌属(Bacillus)、黄杆菌属(Flavobacterium)、假单胞菌属(Pseudomonas)和沙雷氏菌属(Serratia),其中国内外研究报道最多为果胶杆菌属,其他几种软腐菌报道较少[4-6]。该病主要通过胞壁降解酶使植株软腐病变[7],感染迅速,在全球范围内普遍流行。除了危害白菜(Brassica rapavar.glabra)、马铃薯(Solanum tuberosumL.)、圆葱(Allium cepa)、芹菜(Apium graveolensL.)、娃娃菜(Brassica pekinensis)等重要蔬菜外,还会对一些观赏性花卉植物、树木、农作物等造成伤害,给农户带来巨大经济损失,严重制约蔬菜产业的可持续发展[8-9]。
生物防治因其对环境友好、人畜安全等优点,成为近年来研究植物病害防治的主要对象[10-11]。目前利用拮抗微生物(细菌、放线菌、真菌)、群体感应淬灭、微生物蛋白农药、小RNA基因沉默等手段防治蔬菜软腐病报道越来越多[12-16]。芽孢杆菌菌株作为拮抗细菌是防治蔬菜软腐病主要资源,可通过产生抑制病原菌的抗菌蛋白、聚酮化合物、脂肽类等抗菌物质发挥抗菌作用[17-18]。研究表明,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和枯草芽孢杆菌(B.subtilis)对白菜软腐病菌Pectobacterium carotovorumsubsp.carotovorum(Pcc)和辣椒软腐病菌Pectobacterium carotovorumsubsp.brasiliense(Pcb)具有良好的抑制效果[19-20]。Tsuda等[21]和冯迪南等[22]发现乳酸菌(Lactobacillus plantarum)和黏质沙雷氏菌(Serratia marcescens)对白菜软腐病菌Pcc和马铃薯软腐病菌Pcb引起的水浸状软腐病具有较好的抑制作用。最近研究发现,贝莱斯芽孢杆菌对娃娃菜软腐病菌Pectobacterium carotovorum(Pc)具有较好防治作用[23]。目前大多研究集中于对单一蔬菜软腐病菌拮抗菌株的筛选,软腐病菌种类多样,具有广宿主性,因此筛选防治多种蔬菜软腐病菌的广谱拮抗菌株极其重要。近年来,利用群体感应淬灭防治植物病害成为研究热点,大量报道证明群体感应系统(quorum sensing, QS)可以调控致病因子的表达,阻断QS可以减轻病害的严重程度。早在2000年就有报道芽孢杆菌可以利用群体感应淬灭技术防治作物软腐病[24]。目前关于软腐菌果胶杆菌的QS系统与其致病基因表达调控关系研究已经很深入,群体感应是一种通过特殊信号因子调控细胞间的交流机制,果胶杆菌致病基因表达受到群体感应信号分子N-酰基高丝氨酸内酯类化合物(AHLs)的调控,从而发挥致病作用使植株腐烂[25]。目前大量报道集中在AHL信号分子淬灭,如See-Too等[26]发现利用AHL信号分子降解酶AHL内酯酶AidP可以有效防治白菜软腐病。最近Zhang等[27]和Fan等[28]分别发现1株新型不动杆菌菌株XN-10(Acinetobactersp.XN-10)和1株中间苍白杆菌D-2(Ochrobactrum intermediumD-2),通过降解AHL信号分子,从而显著降低软腐菌在白菜等蔬菜上的浸渍症状。另外也可通过找寻信号分子抑制剂等手段,有效控制蔬菜软腐害的发生[29]。
黑龙江省白菜、圆葱、娃娃菜软腐病频发,本省主要致病菌BC2、YC1、WWC2具有交叉侵染能力,可感染多种蔬菜。本研究针对3株病原菌,多地点采样进行调查,从蔬菜根际土样中筛选到一株具有良好拮抗作用菌株DJ1,通过菌落形态、生理生化、16S rDNA序列分析对其进行初步鉴定,明确其种属地位,并对其抑菌效果进行初探,为菌株开发应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试病原细菌 白菜软腐病菌(Pectobacterium carotovorum)YC1、圆葱软腐病菌(Burkholderia gladioli)BC2、娃娃菜软腐病菌(Pseudomonassp.)WWC2、大肠杆菌(Escherichia coli)ATCC25922、金黄色葡萄球菌(Staphylococcus aureus)ATCC25923、铜绿假单胞菌杆菌(Pseuduinonas aeniginasa)ATCC27853均为本研究室保存。
1.1.2 供试病原真菌 刺五加立枯病菌(Rhizoctonia solani)、水稻绵腐病菌(Achlya oryzae)、黄瓜枯萎病菌(Fusarium oxysporum)、水稻稻瘟病菌(Pyricularia oryzae)、番茄灰霉病菌(Botrytis cinerea)、豆角炭疽病菌(Colletotrichum gloeosporioides)、玉米茎基腐病菌(Fusarium graminearum)、水稻恶苗病菌(Fusarium moniliforme)均为本研究室保存。根癌农杆菌(Agrobacterium tumefaciens)NT1由华南农业大学赠送。
1.1.3 供试蔬菜与试剂 白菜、圆葱、娃娃菜购自哈尔滨农贸市场。群体感应信号因子(N-己酰基-L-高丝氨酸内酯、N-3-氧-己酰高丝氨酸内酯)购自阿拉丁试剂(上海)有限公司。
1.1.4 培养基 LB培养基:胰蛋白胨10 g、酵母浸粉5 g、氯化钠10 g、琼脂15-20 g(液体培养基不加琼脂)、蒸馏水1 000 mL,pH 7.2左右。PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂15 g、蒸馏水1 000 mL,pH自然。MSM培养基:硫酸铵 2.0 g、磷酸氢二钠 1.5 g、磷酸二氢钾 1.5 g、硫酸镁 0.2 g、结晶氯化钙0.01 g、七水合硫酸亚铁 0.001 g、蒸馏水1 000 mL,pH 6.5。MM培养基:硫酸铵 2.0 g,硫酸镁 0.2 g,无水氯化钙 0.01 g,硫酸亚铁 0.005 g,氯化锰 0.002 g,硫酸氢二钾 10.5 g,磷酸二氢钾4.5 g,pH 6.5。
1.2 方法
1.2.1 软腐病菌的培养 用LB平板划线活化-80℃保存的3种软腐病菌YC1、BC2、WWC2,挑单菌落于LB液体培养基30℃,160 r/min培养24 h,测定菌数,用无菌水稀释至菌液浓度为1×108CFU/mL备用。
1.2.2 拮抗细菌的筛选 采集白菜(Brassica rapavar.glabra)、黄瓜(Cucumis sativusL.)、番茄(Solanum lycopersicumL.)、辣椒(Capsicum annuumL.)、芹菜(Apium graveolensL.)、茄子(Solanum melongenaL.)等蔬菜根际土。称取土样2 g,放入盛有20 mL无菌水的锥形瓶中,30℃,160 r/min振荡培养1 h,取1 mL悬浮液进行倍比稀释,取10-2、10-3、10-4、10-5、10-6五个稀释梯度液体各100 μL涂布LB固体平板[30],每个稀释度3次重复,30℃恒温培养24 h,挑取不同形态单菌落进行划线纯化,用LB培养液30℃培养24 h,以白菜软腐病菌YC1、圆葱软腐病菌BC2和娃娃菜软腐病菌WWC2为靶标,采用抑菌圈方法[31-32]筛选拮抗菌株。取100 μL病原菌液均匀涂布在LB固体平板上,在平板中间放置无菌钢圈,在钢圈中加入50 μL纯化的细菌菌液,30℃培养48 h,每个菌株重复3次,观察有无抑菌圈,采用十字交叉法测量抑菌圈大小。
1.2.3 拮抗细菌的鉴定
1.2.3.1 形态和生理生化特征鉴定 将筛选到的拮抗菌株用LB平板30℃培养24-48 h,从颜色、形状、有无光泽、边缘是否整齐、有无凸起等方面观察菌落形态。依据《伯杰细菌鉴定手册》第八版[33]和《常见细菌鉴定手册》[34]以及相关文献从耐盐性、生长温度、pH、柠檬酸盐利用、碳氮源利用、接触酶、甲基红、V-P、淀粉水解、吲哚、明胶液化等方面进行生理生化特性鉴定,并与已报道贝莱斯芽孢杆菌进行比较[35-37]。
1.2.3.2 分子生物学鉴定 以细菌基因组DNA为模板,利用细菌16S rDNA通用引物27F/1492R[38]进行PCR扩增,PCR产物纯化后测序,所得序列在NCBI数据库中进行BLAST比对,用MEGA5.1软件进行系统发育分析。
1.2.4 拮抗细菌抑菌作用
1.2.4.1 对离体蔬菜软腐病菌的抑制作用 选取健康、外观完好无机械损伤的白菜、圆葱、娃娃菜,首先用75%酒精消毒,再用无菌水冲洗干净。参考Cui等[39]方法并稍作修改,将叶片切成1.5 cm×1.5 cm左右小块,在无菌平皿内铺上两层滤纸,加入3 mL无菌水,用灭菌枪头在切块的中部制造伤口,在伤口处先接种拮抗菌液5 μL(约1×108CFU/mL),置于恒温培养箱中保湿培养4 h,再接种5 μL的软腐菌菌悬液(约1×108CFU/mL),密闭保湿,28℃培养48 h后观察有无病斑,采用十字交叉法测量腐烂病斑大小。只接种病原菌为阳性对照,只接种无菌水为阴性对照,每个处理3次重复。防治效果(%)=(对照病斑直径-处理病斑直径)/对照病斑直径×100%。
1.2.4.2 对白菜软腐病菌群体感应信号因子的降解活性 首先将菌株DJ1接种在含有5 μmol/L信号因子(N-己酰基-L-高丝氨酸内酯、N-3-氧-己酰高丝氨酸内酯)的MSM培养基中,30℃,160 r/min培养48 h,取48 h后菌液10 μL接种在含有X-gal(40 μg/mL)的MM琼脂条上的一端(1 cm宽),然后将根癌农杆菌Agrobacterium tumefaciensNT1连续接种在距其越来越远的地方,30℃,培养48 h后观察现象[27]。
1.2.4.3 对白菜软腐病的田间小区防效 选取长势基本一致白菜植株,4个处理,每个处理50叶片。处理1:只接种病原菌,取1 mL病原菌液用注射器点接在白菜叶靠近根部。处理2:先接种生防菌后接种病原菌,每个叶片先接种生防菌液3 mL,再按处理1方法接种病原菌。处理3:只接种生防菌,每个叶片接种生防菌液3 mL。处理4:无菌水对照,每个叶片接种无菌水3 mL。处理3 d后调查病情,并计算防效。参考孙旺旺等[40]的分级标准,并稍作修改。0级:无病;1级:开始形成;3级:0.5 cm<病斑直径≤1.0 cm;5级:1 cm<病斑直径≦2 cm;7级:病斑直径>2 cm。
病情指数=∑(病害级数×病害叶片数)/(最高病害级数×总叶片数)×100
防病效果(%)=(对照病情指数-处理病情指数)/对照病情指数×100%
1.2.4.4 对病原真菌和人源性病原细菌的抑菌活性 采用对峙培养法[41]测定拮抗细菌对8种病原真菌的抑菌性。采用抑菌圈法测定拮抗细菌对3种人源性病原细菌的抑菌活性,方法同1.2.2。
1.2.5 数据统计与分析 采用MEGA 7.0、Excel 2021、Origin 2022和SPSS 27统计软件构建系统发育树和进行分析处理试验数据。
2 结果
2.1 拮抗细菌的筛选
采用稀释涂布法从蔬菜根际的20个土样中共分离到1 012个细菌,以3种病原菌为靶标筛选到18株对病原菌YC1、BC2有抑菌活性的菌株,其中菌株DJ1、MC1、SD2、TD1、XHS1、SD1抑菌活性较强;筛选出1株对3种病原菌均有抑菌活性的生防菌株DJ1,对YC1、BC2、WWC2三株病原菌的抑菌圈直径分别为10.60、6.92和3.92 mm(表1、图1)。
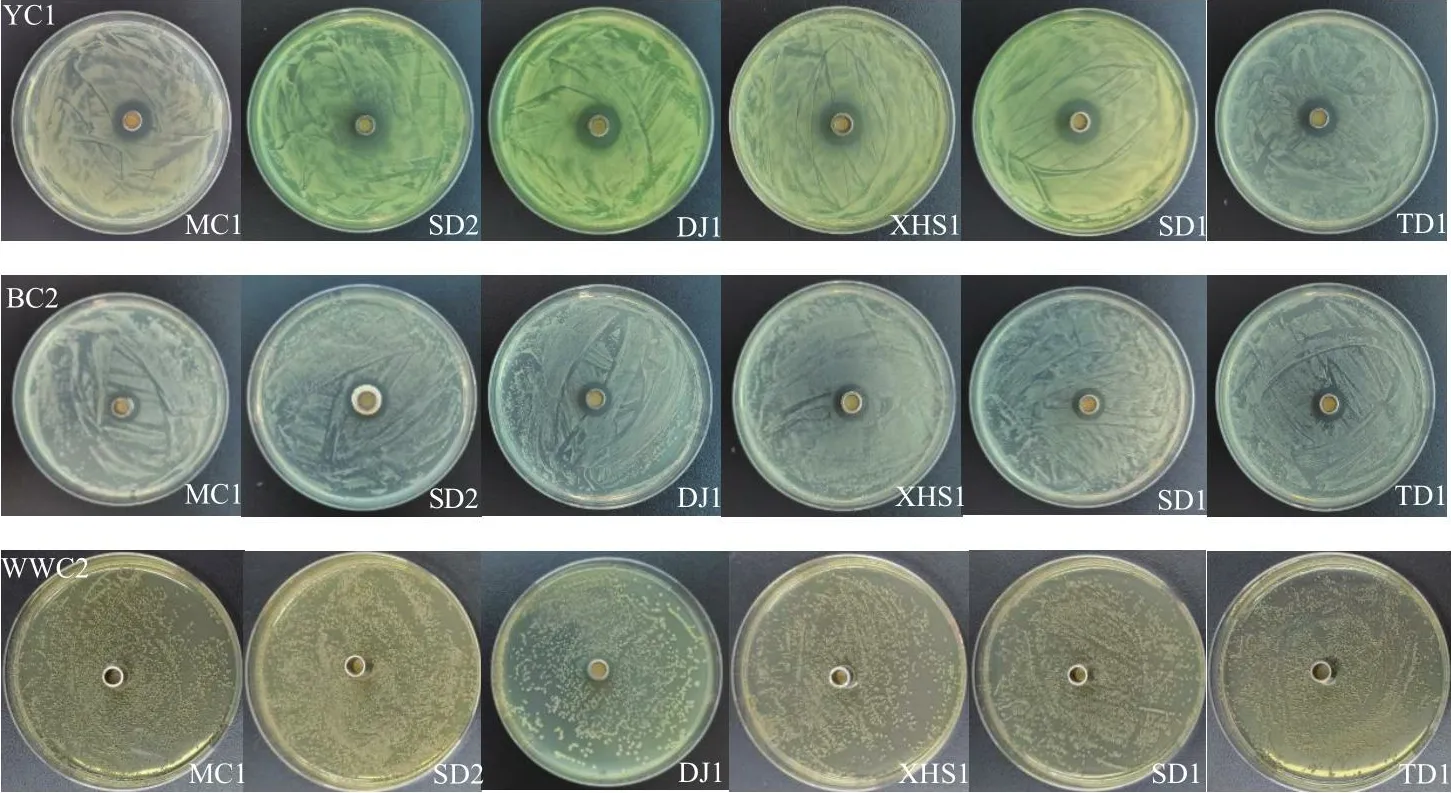
图1 拮抗菌株对软腐病菌YC1、BC2、WWC2的抑菌圈效果Fig.1 Inhibitory zone effect of the antagonistic strains against soft rot pathogens YC1, BC2, and WWC2
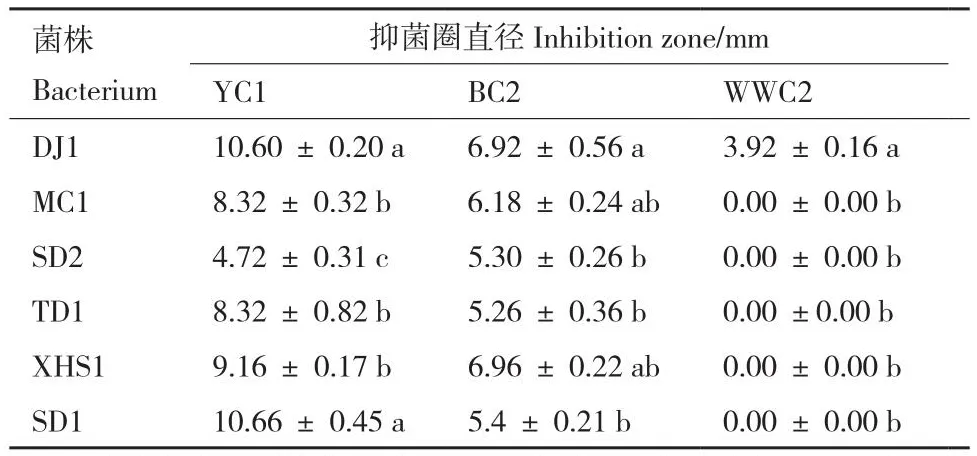
表1 拮抗菌株对软腐病菌YC1、BC2、WWC2的抑制作用Table 1 Inhibitions of the antagonistic strains against soft rot pathogens YC1, BC2, and WWC2
2.2 拮抗细菌鉴定
菌株DJ1革兰氏阳性、杆状、有芽孢(图2-A)。在LB培养基上培养48 h后,菌落呈乳白色,圆形或椭圆形,不透明,表面光滑、有褶皱,边缘不整齐(图2-B)。可在22-42℃、pH 5-9、1%-5% NaCl条件下正常生长。此外,菌株DJ1与文献报道贝莱斯芽孢杆菌的生理生化指标基本一致,如能够利用山梨醇、甘露醇、果糖、蔗糖和丙二酸盐,不能利用柠檬酸盐。接触酶、葡萄糖氧化发酵、明胶液化、V-P、淀粉水解、石蕊牛奶阳性,H2S产生、吲哚反应、甲基红反应阴性。菌株DJ1不能利用海藻糖,不能分解纤维素,硝酸盐还原呈阳性反应,这与文献报道生理生化特性不一致(表2)。应用细菌16S rDNA通用引物PCR扩增获得长度为1 436 bp基因片段,测序后在NCBI上在线Blast比对,与贝莱斯芽孢杆菌同源性较高为99%(图3)。依据《伯杰细菌鉴定手册》和《常见细菌鉴定手册》,综合菌株形态、生理生化特性和16S rDNA 序列分析,将菌株DJ1鉴定为贝莱斯芽孢杆菌。
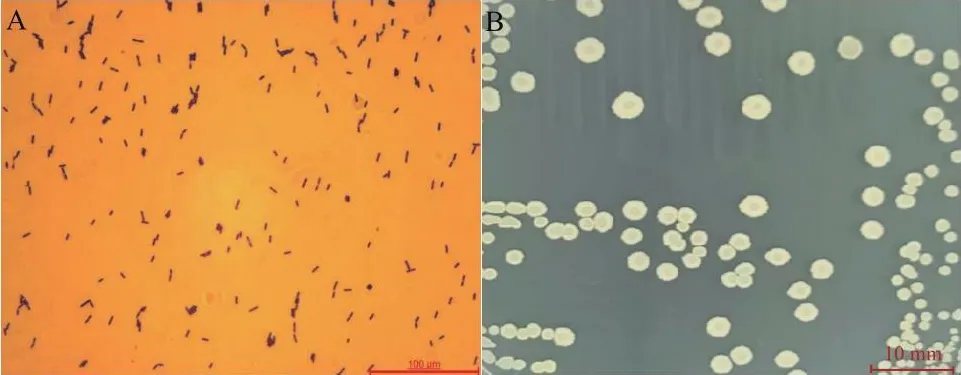
图2 菌株DJ1的形态特征(LB培养基)Fig.2 Morphology of strain DJ1(LB medium)
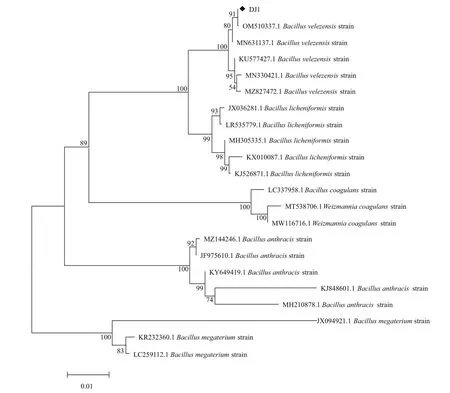
图3 菌株DJ1的系统发育进化树Fig.3 Phylogenetic tree of strain DJ1

表2 菌株DJ1的生理生化特性Table 2 Physiological and biochemical characteristics of strain DJ1
2.3 拮抗细菌对离体蔬菜软腐病菌抑制作用
菌株DJ1对离体白菜、圆葱与娃娃菜菜软腐病菌具有较好的抑制活性,病原菌接种组48 h后出现较大病斑,拮抗菌处理组仅在接种处出现较小病斑(图4),对离体白菜、圆葱与娃娃菜软腐病菌的抑菌率分别为84.30%、60.21%和69.96%(图5)。

图4 拮抗菌DJ1对离体白菜、圆葱和娃娃菜软腐病菌的抑菌活性Fig.4 Antibacterial activities of strain DJ1 against soft rot pathogen of Chinese cabbage(Brassica rapa var.glabra), onion(Allium cepa), and baby cabbage(Brassica pekinensis)in vitro
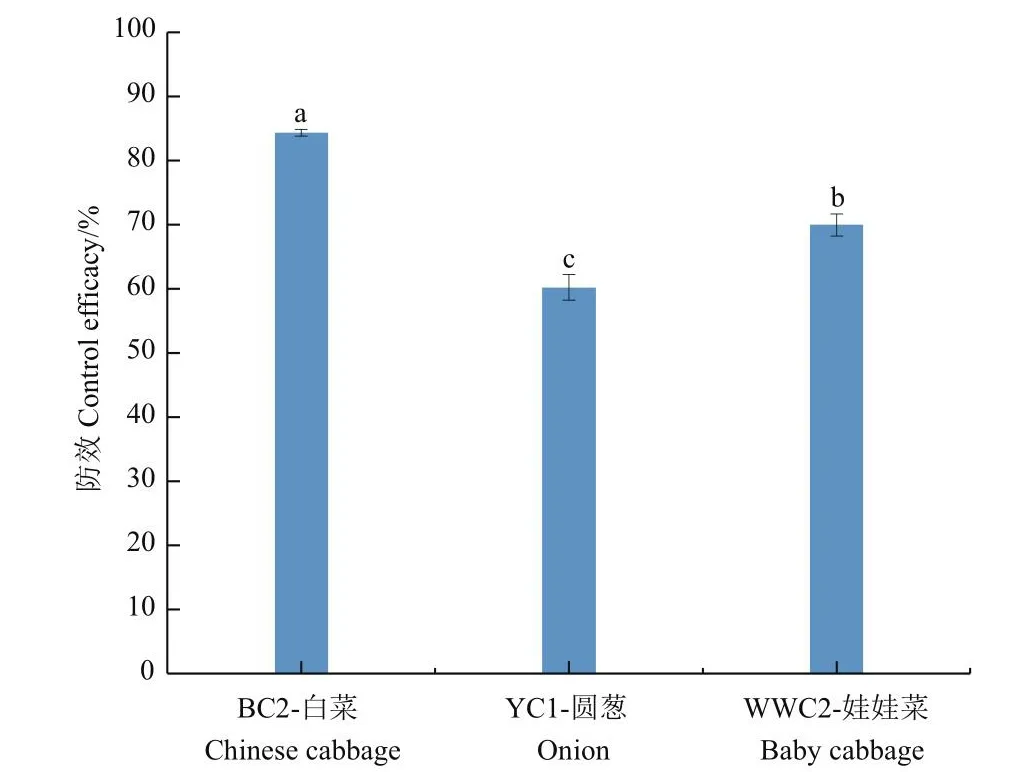
图5 菌株DJ1对离体白菜、圆葱和娃娃菜软腐病菌的防效Fig.5 Control efficacy of strain DJ1 against soft rot pathogen of Chinese cabbage, onion, and baby cabbage in vitro
2.4 拮抗细菌对白菜软腐病菌群体感应信号因子的降解活性
菌株DJ1对白菜软腐病菌群体感应信号因子的降解活性以N-己酰基-L-高丝氨酸内酯和N-3-氧-己酰高丝氨酸内酯(5 μmol/L)两种信号因子作为对照检测菌株DJ1对信号因子的降解活性。根据根癌农杆菌Agrobacterium tumefaciensNT1在琼脂条带上从顶部到蓝色的距离以及颜色的深浅来确定样品中信号因子的残留含量。菌株能在以信号因子为唯一碳源的培养基生长,与只含有5 μmol/L信号因子的对照组相比,加入菌株DJ1的处理组颜色较浅,表明菌株DJ1具有一定的降解白菜软腐病菌群体感应信号因子的能力(图6)。
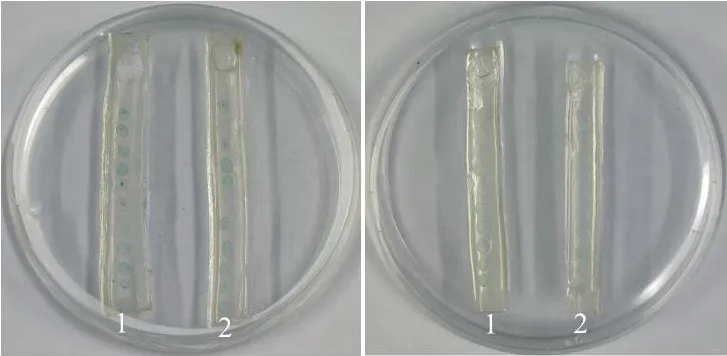
图6 拮抗细菌对白菜软腐病菌群体感应信号因子的降解活性Fig.6 Degradation activity of antagonistic bacteria on the quorum sensing signal factors of soft rot pathogen of Chinese cabbage
2.5 拮抗细菌对其他病原细菌与真菌的抑制作用
菌株DJ1对其他病原真菌的抑菌效果见图7。菌株DJ1除了对3种蔬菜软腐病菌具有较好的抑制效果外,对大肠杆菌和金黄色葡萄球菌(表3)和水稻绵霉菌、黄瓜枯萎病菌、水稻稻瘟病菌、豆角炭疽病菌、玉米茎基腐病菌、水稻恶苗病菌、番茄灰霉病菌8种植物病原真菌也具有抑制作用,对绿脓杆菌无抑制作用。对黄瓜枯萎病菌抑制效果最好,抑制率为71.38%,对刺五加立枯病菌抑制效果较低,抑制率为37.84%。
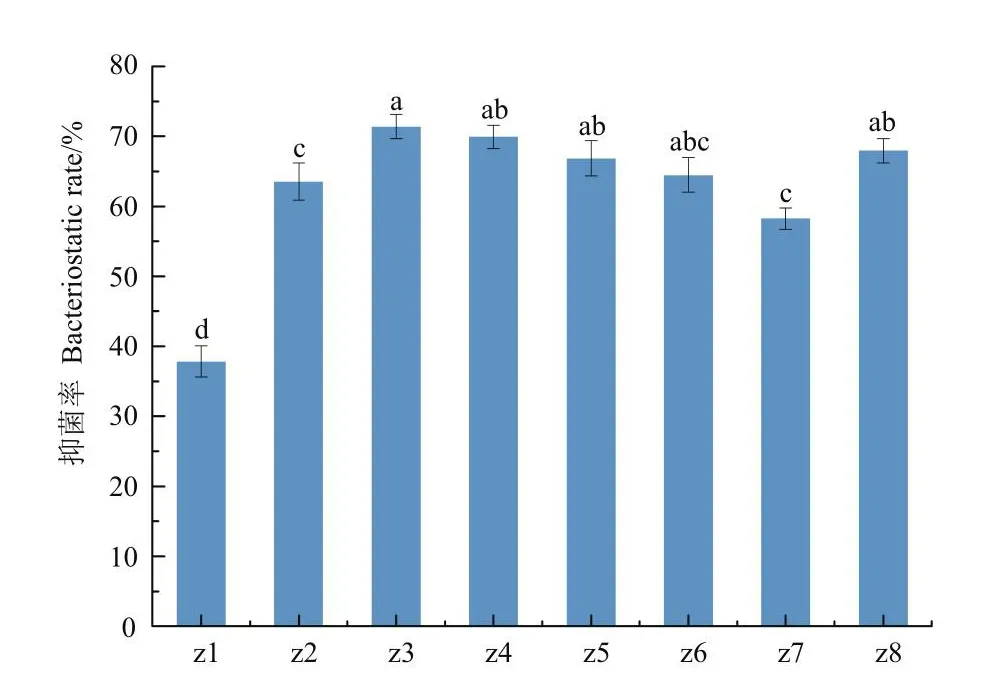
图7 菌株DJ1对不同病原真菌的抑制作用Fig.7 Inhibitory effects of strain DJ1 against different pathogenic fungi
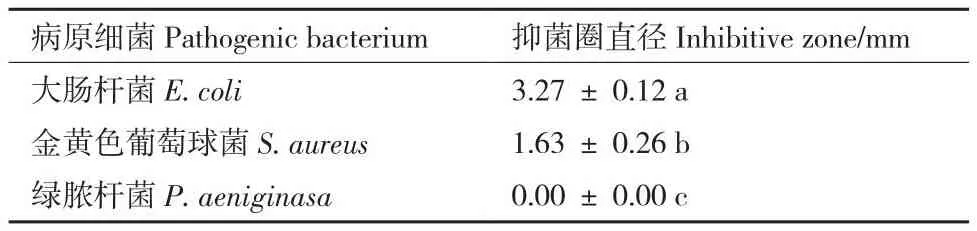
表3 菌株DJ1对不同病原细菌的抑制作用Table 3 Inhibitory effects of strain DJ1 against different pathogenic bacteria
2.6 拮抗细菌对白菜软腐病菌的田间小区防效
生防菌和无菌水对照组不发病,只接病菌组接种1 d发病,3 d病斑扩大(图8),发病较重,病情指数为66.89,生防菌处理组部分叶片发病,发病较轻,病情指数为13.48,对软腐病的防效为79.91%(表4)。

图8 菌株DJ1对白菜软腐病菌BC2的田间小区防效Fig.8 Control effects of strain DJ1 against the soft rot pathogen BC2 of Chinese cabbage in field plots

表4 菌株DJ1对白菜软腐病菌BC2的田间小区防效Table 4 Control effects of strain DJ1 against the soft rot pathogen BC2 of Chinese cabbage in field plots
3 讨论
3.1 贝莱斯芽孢杆菌的生防潜力
贝莱斯芽孢杆菌是近年来新发现的优势生防菌株,广泛存在于土壤、植物根际、植物体与水体等环境中,具有促进植物生长、抑菌谱广、抗逆性强等优势,在植物病害生物防治方面具有重要作用[42-43]。目前,国内外关于贝莱斯芽孢杆菌的研究主要侧重于菌株筛选、生防机制解析、抗菌促生物质挖掘与防效等方面,已经从植物根际土壤、植物体与水体等不同生境中分离获得许多具有防病促生功能的菌株,这些菌株对蔬菜、作物、果树等病原真菌和细菌具有一定的抑制作用,多数处于研究阶段,尚未商品化[44-46]。2021年贝莱斯芽孢杆菌CGMCC NO.14384在国内首次获得微生物农药登记,用来防治烟草和黄瓜白粉病。因此,在植物病害防治方面具有一定优势。如该菌对菜豆枯萎病菌Fusarium solani[47]、马铃薯疮痂病菌Streptomyces galilaeus[48]、柑橘煤污病菌Pseudomonas chlororaphis[49]等均有一定防治作用。本实验以3株致病性较强软腐病菌为靶标,筛选出1株拮抗作用较强贝莱斯芽孢杆菌DJ1,田间小区防效达79.91%,对白菜软腐病离体叶片防效最佳达84.30%,说明贝莱斯芽孢杆菌在植物病害防治方面具有广泛的应用前景,是一种重要的生防资源。
3.2 菌株DJ1群体感应信号分子与抗病之间的关系
除了利用拮抗微生物防治植物病害,近年来又开展了基于群体感应淬灭技术防治软腐病新策略的研究。群体感应系统可以调控抗生素产生、生物膜形成、致病基因表达等群体行为。细菌的群体感应信号分子主要包括N-酰基高丝氨酸内酯类化合物(AHLs)、烯酸类(DSF)、自诱导肽(AIPs)和呋喃硼酸二酯(AI-2)类。大量研究表明[26-28]植物病原细菌的致病性受群体感应系统调控。Rodríguez等[29]从盐角草根际分离到可以降解AHL的菌株P6(Pseudomonas segetisstrain P6),在马铃薯和胡萝卜上接种P6菌株后,显著降低了P.atrosepticum、D.solani和P.carotovorum引起的软腐症状,并且对番茄还具有一定的促生作用。Zhou等[50]研究分离出1株食吡啶红球菌XN-36(Rhodococcus pyridinivoransXN-36),可以快速使AHL信号分子的酰胺键断裂,降解多种AHL信号分子,菌株XN-36作为生物防治剂可以显著降低由P.carotovorum引起的白菜、马铃薯和胡萝卜的软腐病症。Kachhadia等[51]研究发现蜡状芽孢杆菌RC1提取物可以通过群体感应淬灭减少由河生肠杆菌Lelliottia amnigena引起的胡萝卜、马铃薯和黄瓜的软腐状浸渍面积。本研究中分离的贝莱斯芽孢杆菌DJ1具有一定的降解N-酰基高丝氨酸内酯类群体感应信号分子的能力,实验中发现与接种N-己酰基-L-高丝氨酸内酯、N-3-氧-己酰高丝氨酸内酯的对照组比较,加入菌株DJ1的实验组颜色更浅,说明菌株DJ1可以通过降解AHL信号分子从而减轻蔬菜的软腐病害。大量研究表明AHLs信号在防控蔬菜软腐病菌毒性方面具有良好应用前景,将是今后蔬菜软腐病生物防治研究重点,同时也应积极探索其他群体淬灭方式,以挖掘效果更佳的淬灭途径。
3.3 菌株DJ1拮抗细菌的可能机理
作为芽孢杆菌属的一员,贝莱斯芽孢杆菌在生物防治方面研究报道逐年增多。贝莱斯芽孢杆菌抑菌作用机制主要包括竞争、抗生、产生抗菌物质、诱导植物抗性等,其中以产生抗菌活性物质抑制病原菌为主。B.velezensis可产生抗菌蛋白、聚酮化合物、脂肽类等抗菌活性物质抑制病原菌生长。其中,欧婷等[52]研究发现B.velezensisSWUJ1中含有的脂肽类化合物对植物炭疽病菌具有较好拮抗活性,其基因组中存在13个脂肽类抗生素相关基因簇,LC-MS结果显示其含有抗菌物质包括表面活性素(surfactin)、伊枯草菌素(iturin)及丰原素(fengycin)。滕毅[53]研究发现,埃吉类芽孢杆菌B69可产生羊毛硫抗生素,并从中分离到elgicin A I、elgicin A II、elgicin B 及 elgicin C四种新型肽类抗生素。目前羊毛硫抗生素在食品防腐和抗感染治疗领域扮演重要角色,其对革兰氏阳性细菌和部分阴性细菌具有一定抑制效果。聚酮类物质[54]是另一类在防治植物病害中起重要作用的抗菌活性物质,通过在聚酮合酶组织下合成的聚酮类化合物主要包括 macrolactin、bacillaene 和 difficidin 等,研究发现聚酮化合物也是抗植物细菌性软腐病的潜在抗菌物质[37]。而本研究中贝莱斯芽孢杆菌DJ1发酵液对蔬菜软腐病菌有明显抑制作用,说明该菌株中可能含有某些抗菌物质抑制病原菌生长,其具体的抗菌物质种类、抑菌机理研究有待进一步分析确定。由于贝莱斯芽孢杆菌的分类地位是近些年才确定的,对该菌株研究主要集中在分离筛选和病害防控方面,而对其代谢产物的分离纯化和作用机制研究方面欠缺,目前主要是基于基因组数据对现有的抗菌物质基因簇进行分析。因此,未来应深入挖掘贝莱斯芽孢杆菌DJ1的抗菌物质以及它的作用机制,为该菌株今后的应用提供理论依据。
3.4 菌株DJ1对多种植物病害的广谱抗病应用潜力
蔬菜软腐病是一种常见的细菌性病害,在田间和储运期均可发病,引起蔬菜腐烂变质,造成巨大经济损失。目前蔬菜生长阶段的软腐病主要依靠化学药剂防治,农药残留和环境污染等副作用无法消除,储运期因缺乏有效的绿色安全防控手段,一般不用药防治,增加蔬菜腐烂风险。胡萝卜软腐果胶杆菌P.carotovorum是蔬菜软腐病最主要的病原菌,寄主广泛。针对该病菌国内外开展了生防菌株筛选与防效研究,获得了一些能够有效抑制该病菌的解淀粉芽孢杆菌和贝莱斯芽孢杆菌。除了胡萝卜软腐果胶杆菌,近年发现P.atroseptica、P.wasabiae、Pseudomonasspp.和B.gladioli也能引起蔬菜软腐病,目前针对这些病菌的生防菌株筛选研究有限,2021年崔双[30]获得一株贝莱斯芽孢杆菌,能够拮抗魔芋软腐病菌P.atroseptica,温室防效为43%,但鲜见贝莱斯芽孢杆菌抑制Pseudomonasspp.和B.gladioli的报道。本团队前期从黑龙江省多个种植地腐烂的白菜、圆葱、娃娃菜上获得3株病原菌(P.atroseptica、B.gladioli、Pseudomonassp.),本研究以 3 种病原菌为靶标,首次从蔬菜根际土壤中分离获得一株对3种病原菌均具有抑制作用的生防菌株,经过形态、生理生化和分子鉴定为贝莱斯芽孢杆菌。该菌株生长温度和pH宽泛,耐盐抗逆性较强,预示该菌株具有良好的环境适应性。抑菌谱较广,不仅对3种软腐病菌具有抑制作用,对大肠杆菌和金黄色葡萄球菌等人类致病菌以及8种植物病原真菌也具有较好的抑制作用,其中对水稻绵腐病菌(A.oryzae)、黄瓜枯萎病菌(F.oxysporum)、水稻稻瘟病菌(P.oryzae)、番茄灰霉病菌(Botrytis.inerea)、豆角炭疽病菌(C.gloeosporioides)、玉米茎基腐病菌(F.graminearum)防效均在60%以上,具有广谱抑菌活性。说明该菌株具有较好的实用性,因为蔬菜细菌和真菌病害常常混发,广谱性拮抗菌株具有更大的应用潜力,而且该菌株对白菜软腐病的田间防效高于已有报道,是一株具有应用前景的优良生防菌株。今后将对其他蔬菜软腐病田间防效、制剂研制等开展系列深入研究,为该菌株的开发应用奠定基础。
4 结论
从蔬菜根际土中筛选到 18 株具有拮抗效果的菌株,其中 1 株菌DJ1对3种软腐病菌抑制效果较好,并具有一定降解白菜软腐病菌群体感应信号因子能力,经鉴定为贝莱斯芽孢杆菌,其对2种人源性病原细菌以及8种植物病原真菌也具有明显抑制作用,具有广谱抑菌活性。对白菜、圆葱、娃娃菜软腐病离体防效分别为84.30%、60.21%和69.96%,且对白菜田间防效达79.91%,因而表明菌株DJ1在蔬菜软腐病生物防治方面具有一定的开发和应用价值。