TRV病毒诱导大豆基因沉默体系优化及应用
李文辰 刘鑫 康越 李伟 齐泽铮 于璐 王芳
(1.齐齐哈尔大学生命科学与农林学院 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,齐齐哈尔 161006;2.黑龙江省农业科学院畜牧兽医分院,齐齐哈尔 161005)
基因沉默是植物界普遍存在的一种防御反应,其本质是降低或停止植物基因的表达,根据基因转录前后可分为两种,一是转录前由于启动子失活或基因片段特异性甲基化产生的基因沉默(transcriptional gene silence,TGS),二是转录后mRNA被降解导致的基因沉默(post-transcriptional gene silence,PTGS)[1]。病毒诱导的基因沉默(virus-induced gene silencing,VIGS)是一种准确高效的RNA沉默方法,属于PTGS类型的RNAi技术,可以在多种植物中精准沉默植物内源基因且在数周内完成对基因的沉默,不需要转基因植株[2],广泛应用在植物基因功能研究。该技术利用病毒载体将待沉默的RNA转移至寄主植物中,病毒双链RNA(double-stranded RNA,dsRNA)被植物的防御机制所识别,并被植物体内特异性核酸内切酶切割成21-23 nt小干扰RNA(small interfering RNA,siRNA),触发PTGS反应,siRNA与Agronaute(AGO)效应复合物形成RNA诱导复合物(RNA-inducing silencing complex,RISC),RISC与植物中mRNA和病毒中的mRNA结合产生沉默,其特点在于依靠植物防御机制,抵御病毒侵染的同时完成基因沉默[3]。
目前,已开发出超过30个病毒载体被用于VIGS体系构建,如烟草花叶病毒(tobacco mosaic virus, TMV)、大麦条纹花叶病毒(barley stripe mosaic virus, BSMV)、大豆花叶病毒(soybean mosaic virus, SMV)等[4],广泛应用在茄科、十字花科、禾本科等植物的基因功能研究[5]。
利用VIGS技术探索大豆基因功能已成为克服大豆基因转化困难的一种有效研究手段。以豌豆早期褐变病毒(pea early-browning virus, PEBV)、普通花叶病毒(soybean yellow common mosaic virus,SYCMV)、菜豆斑驳病毒(bean pod mottle virus,BPMV)、苹果潜伏球形病毒(apple latent spherical virus, ALSV)、黄瓜花叶病毒(cucumber mosaic virus, CMV)为基础构建的沉默载体已被报道用于沉默大豆基因[6-10]。
烟草脆裂病毒(tobacco rattle virus, TRV)是目前在VIGS系统中应用最广泛的病毒载体,该病毒对植物的毒害作用较轻,避免了对基因沉默表型影响[11]。TRV由2条单链RNA组成,RNA1编码RNA聚合酶及运动蛋白,RNA2编码病毒外壳蛋白和介导线虫传播蛋白,并接受外源基因插入[12-13]。TRV寄主范围广泛,除侵染烟草外,还可以侵染大部分双子叶植物如番茄、拟南芥、核桃、棉花、穿心莲、紫罗兰[14-18]等,以及部分单子叶植物如小麦、玉米[19]。TRV介导的VIGS体系在大豆中报道较少。刘晓彬等[20]研究了TRV-VISG技术与大豆花叶病毒(soybean mosaic virus, SMV)的关系,证明大豆早期接种TRV不影响大豆对SMV的抗性。诸多研究结果表明,TRV能够在不同组织如叶、花、果实、种子[21-24]使靶基因沉默,但关于介导植物根部靶基因沉默的报道较少。病毒存在宿主范围,大多数VIGS病毒载体不能侵染植物的生长点与分生组织。环境温度,载体接种部位、方法对靶基因的沉默效率均有较大影响。有的病毒载体会对宿主植物产生严重的病毒症状,导致叶片萎黄、变形、坏死等现象,从而掩盖了基因沉默的表型。因此针对不同的植物,选择合适的病毒载体与接种方法极为重要[2]。
本研究以八氢番茄红素去饱和酶基因(GmPDS)及前期cDNA文库中筛选到的差异表达E3泛素连接酶基因(GmATL)为对象[25],采用叶片注射、浇灌根部、叶片注射与浇灌相结合3种接种方法,建立TRV诱导基因沉默体系,评估不同接种方法、接种部位、靶基因沉默区域对植物不同组织之间的沉默效率,为今后大豆基因功能研究提供依据。
1 材料与方法
1.1 材料
大豆品种选用中黄13(Glycine max_ZH13),由沈阳农业大学北方线虫研究所赠送。
根癌农杆菌GV3101(pSoup-p19)感受态细胞(Cat No.ZC1407)、大肠杆菌Stbl3感受态细胞(Cat No.ZC108)、沉默表达载体pTRV1(Code No.ZK912)、pTRV2(Code No.ZK914)载体购自北京庄盟国际生物基因科技有限公司。
1.2 方法
1.2.1 植物种植及培养 选取饱满中黄13大豆种子,先后使用70%酒精、0.5% NaClO溶液分别消毒3 min,无菌水冲洗10 min,直至种子表面无NaClO残留。将蛭石与营养土按照1∶1混匀并灭菌,种子置于塑料盆(直径9.5 cm,高12 cm)培养,光周期16 h L/8 h D,25℃恒温育苗,每盆播种3粒种子,出苗后每一盆保留幼苗一株。
1.2.2 引物设计 根据NCBI数据库大豆GmPDS(Gene ID:18G003900)、GmATL3(Gene ID:10079 7420)、内参基因EF4(Elongation Factor 1-alpha,Gene ID:110008577)序列,使用SnapGene软件设计试验引物(表1)。GmATL3的沉默区域设计2组引物,GmATL3-1沉默区域含有ATL基因家族RING-H2保守结构域,GmATL3-2沉默区域不包含该结构域(图1)。

图1 GmATL3与GmPDS序列及沉默片段区域Fig.1 GmATL3 and GmPDS gene sequences and silent fragment regions

表1 引物序列Table 1 Primer sequence
1.2.3 TRV沉默表达载体的构建 提取中黄13新鲜根部组织RNA,并反转录合成cDNA,以cDNA为模板进行PCR扩增,反应体系为cDNA 2 μL、上游引物2 μL、下游引物2 μL、高保真酶25 μL和ddH2O 19 μL;反应条件为94℃ 3 min;94℃ 30 s,68℃ 30 s,72℃ 50 s,34个循环;72℃ 10 min。PCR产物经1.2%琼脂糖凝胶电泳验证后回收并纯化,测定浓度后,与pTRV2载体连接,并转入Stbl3大肠杆菌中,涂布于含50 μg/mL卡那霉素的LB固体培养基上,筛选阳性克隆进行菌落PCR鉴定,提取质粒并送至生工生物工程(上海)股份有限公司进行测序,测序结果均为100%。将重组质粒pTRV2-GmATL3-1、pTRV2-GmATL3-2和pTRV2-GmPDS转入农杆菌GV3101中,涂布于含50 μg/mL卡那霉素、50 μg/mL利福平LB固体培养基上,挑取单克隆菌落,菌液PCR验证,-80℃保存菌种。
1.2.4 农杆菌侵染液制备及接种 配置1% Silwet-77母液以及MES侵染缓冲液(10 mmol/L MES、10 mmol/L MgCl2·6H2O),4℃冷藏。待大豆出苗后3 d,将保存的pTRV1、pTRV2、pTRV2-GmPDS、pTRV2-GmATL3-1和pTRV2-GmATL3-2农杆菌菌液划线于含50 μg/mL卡那霉素与50 μg/mL利福平LB固体培养基,28℃倒置培养48 h,挑取单克隆菌于液体LB培养基,过夜培养,将菌液转入50 mL离心管中,培养至OD=0.5-0.6,4 000 r/min离心10 min,使用MES缓冲液悬浮菌体,再次离心,去除上清液,加
2 结果
2.1 中黄13 GmATL3与GmPDS的克隆
以中黄13 cDNA为模板,使用GmATL3-1/GmATL3-1-R、GmATL3-2-F/GmATL3-2-R、GmPDSF/GmPDS-R引物进行扩增,分别获得374、296和218 bp靶基因片段(图2)。
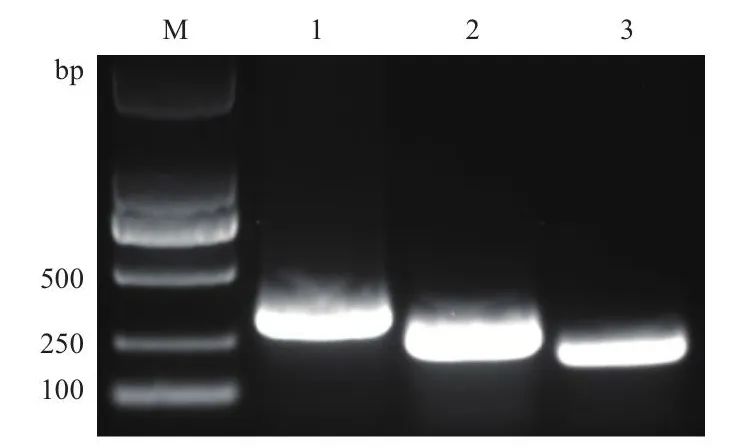
图2 GmATL3-1、GmATL3-2、GmPDS PCR凝胶电泳检测Fig.2 GmATL3-1, GmATL3-2 and GmPDS PCR electrophoresis detection
入MES缓冲液测定OD=0.5-0.6,将pTRV1与重组质粒的MES侵染液等比混合,每毫升侵染液加入1 μL AS母液与0.1 μL Silwet-77母液,室温暗处静置3 h,该过程需要4 d。此时大豆的真叶完全展开,按照3种方法进行接种,第一种方法叶部注射,使用灭菌针头吸取侵染液于大豆真叶背部叶脉处注射侵染;第二种为灌根法,使用灭菌枪头吸取5 mL侵染液插入土壤中,贴近根部浇灌侵染[26];第三种为注射加灌根同时侵染接种。每隔7 d接种一次,每种方法共接种3次。
1.2.5 大豆全植株基因沉默效果检测 侵染后28 d,提取3种处理大豆的第四轮复叶以及根部RNA,反转录cDNA,将第四轮复叶及根部cDNA作为模板,荧光定量PCR检测GmATL3与GmPDS表达量,反应体系为上下游引物各0.8 μL、cDNA 1 μL、2×TB Green Premix Ex Taq II(TaKaRa)10 μL、ROX Reference Dye(50x)0.4 μL、ddH2O 7 μL。RT-qPCR程序为95℃ 30 s;95℃ 5 s,60℃ 30 s,40个循环,根据Ct值,采用2-ΔΔCt法计算实时荧光定量RT-qPCR基因相对表达量[27],以EF-4为内参基因,3次生物学重复和3技术性重复。
2.2 GmPDS基因沉默表型观察
接种28 d后,分别取TRV-GmPDS基因沉默体系的第二、三、四轮复叶观察沉默植株叶片表现症状(图3)。与对照CK(pTRV1-pTRV2空载农杆菌混合液的植株)相比,注射接种叶片出现了由叶边缘到叶内的黄化褪绿现象,灌根接种与注射加灌根接种的叶片表现褪绿黄化以及褶皱褪绿现象。灌根与注射加灌根接种方法的沉默表型更明显。

图3 不同接种方法GmPDS沉默叶部表型观察Fig.3 Phenotypic observations of the leaves after GmPDS silenced via different inoculation methods
分别提取注射接种、灌根接种、注射加灌根接种方法中沉默GmATL3-1、GmATL3-2、GmPDS植株的第四轮叶片与根部RNA,反转录为cDNA,使用qATL3-F/qATL3-R、qPDS-F/qPDS-R引物以及内参基因EF-4引物进行RT-qPCR,根据2-ΔΔCt计算出基因相对表达量。
注射接种,根部GmATL3-1、GmATL3-2相对表达量为35.5%和57.9%,叶部GmATL3-1、GmATL3-2相对表达量为4.1%和19.8%,表明注射接种方法在叶部沉默效率较根部高出25%-30%(图4-A)。

图4 3种接种方法GmATL3-1、GmATL3-2、GmPDS在根与叶中的相对表达量Fig.4 Relative expressions of GmATL3-1, GmATL3-2 and GmPDS in the roots and leaves by three inoculation methods
灌根接种,根部GmATL3-1、GmATL3-2相对表达量为35.6%和66.7%,在叶部测定GmATL3-1、GmATL3-2基因相对表达量为50.8%和81.1%,表明灌根接种方法在根部基因沉默的效率较叶部高出15%-20%(图4-B)。
注射加灌根接种,根部GmATL3-1、GmATL3-2相对表达量为10.8%和29.2%,叶部GmATL3-1、GmATL3-2相对表达量为70.9%和85.7%,表明注射加灌根接种方法在根部基因沉默的效率较叶部高出50%-60%(图4-C)。
在RT-qPCR结果中,3种接种方法GmPDS的CT值均为0,表明基因在叶片与根部沉默效果均接近100%,使用半定量RT-PCR检测GmPDS沉默情况(图4-D)。对照组均有条带,而处理组(3种接种方法)均无条带,进一步表明3种接种方法中GmPDS被完全沉默。
综上所述,在注射接种、灌根接种、注射加灌根接种中,无论在叶部还是在根部,沉默包含保守结构域GmATL3-1的沉默效果均比沉默不包含保守结构域的GmATL3-2效果好。
3 讨论
3.1 TRV介导的大豆PDS沉默表型分析
八氢番茄红素去饱和基因(PDS)作为VIGS沉默的指示基因在植物中被广泛使用,将携带PDS的病毒载体转入农杆菌后侵染植物组织,病毒会在侵染部位积累,并逐步向整个植株扩散侵染,沉默PDS植物产生叶片白化褪绿的可视表型。本研究不同接种方法产生的植物沉默表型存在差异,灌根接种与双重接种叶片出现了褪绿斑点以及褶皱褪绿现象,注射接种出现叶片边缘黄化现象,并且与叶片注射法相比,灌根方法引起更为严重的表型,这与Ryu等[28]的结论相似。所以根据不同的试验要求需要选择合适的接种方法,避免出现因为VIGS病毒掩盖沉默表型的现象。在烟草中,使用TRV-VIGS技术沉默NbPDS,其沉默效果达到100%,沉默植株的叶片出现了白化褪绿的现象[29]。而在本研究沉默GmPDS,发现3种处理下根部与第四轮复叶GmPDS被完全沉默,叶片产生严重褪绿黄化的现象,但叶片并未出现白化现象。刘晓彬等[20]使用TRV载体通过叶片注射的方法沉默GmPDS发现,在第二轮、第三轮复叶产生明显褪绿现象,也未出现白化现象。Constantin等[6]使用PEBV沉默PsPDS,豌豆叶片出现褪绿白化现象。Schachtsiek等[30]使用CLCrVVIGS技术沉默大麻PDS,观察到叶子出现白化斑点。以上研究结果表明,不同病毒载体介导不同植物PDS沉默产生表型存在差异。
3.2 不同接种方法对大豆不同组织的沉默效果
常用的植物病毒接种方法包括摩擦接种(friction inoculation)、喷雾接种(spray inoculation)、叶片注射接种、真空注射接种、灌根接种等[5]。VIGS技术通常利用根癌农杆菌Ti质粒将病毒载体中靶基因T-DNA整合到宿主植物基因组中,产生内源性基因沉默,常采取注射以及灌根接种方法侵染植物。注射方法是接种在植物的茎部与叶部,但是此方法较难浸润玉米等植物叶片,且操作步骤繁琐,耗费大量的人力物力,因此,该方法无法应用田间试验。灌根接种是利用含有二元载体T-DNA病毒载体的根瘤菌侵染植物根际来完成接种,方法相对方便快捷。
孙天杰等[26]使用TRV-VIGS技术沉默大豆内源基因发现,XTH平均沉默效率为93%,TLP平均沉默效率为44%,确定不同基因的沉默效率存在差异。本研究发现TRV介导的PDS在根部与叶部沉默效率均接近100%,GmATL3最高沉默效率为96%。接种方法影响不同组织的基因沉默效率。注射接种在根部及叶部的平均沉默效率分别为53%和88%;灌根接种方法对根部及叶部的平均沉默效率分别为50%和35%;注射加灌根接种方法对根部及叶部的平均沉默效率为80%和22%。结果表明,注射方法对叶片沉默效率最高,注射加灌根结合方法对根部沉默效率最高。接种位置影响病毒扩散的速率,因此,应根据实验的目的选择适宜的接种方法。
3.3 基因沉默片段的选择
基因沉默效率受到沉默片段的长度及位置影响,因此选择合适的沉默片段极为重要。VIGS技术通常选用200-400 bp的基因序列作为沉默片段。本研究的3个沉默片段长度为186、264和342 bp,均具有较好的沉默效果。如果选择的沉默片段与其他基因同源性较高,会导致沉默脱靶现象[31]。为了避免沉默的脱靶效应,本研究将GmATL3分为2条沉默片段,结果表明,二者均能够沉默靶基因,且发现沉默片段包含保守结构域的基因相对表达量在根部及叶部均低于不包含结构域的相对表达量,沉默效果无论在根部还是叶部比均不包含结构域高出20%左右,含有结构域的基因沉默片段具有较高的沉默效率。Chen等[32]发现沉默牵牛花高度保守基因序列可以沉默该基因家族的多个成员。Zhou等[33]沉默本氏烟E2基因高度同源序列,最终沉默E2基因家族大部分基因,且3 nt错配的基因片段会提高沉默的效果。选择基因家族的保守区可能会沉默一个基因家族中的多个基因;如果目标基因是某一基因家族中的单个基因,插入片段应是该基因的特异序列,避免有超过23个核苷酸序列与其他家族成员相同[34]。大豆RING-H2 ATL家族是多基因家族,结构域序列是否会对该家族其他基因产生沉默效果还有待于进一步验证。
4 结论
建立了大豆TRV-VIGS体系,可实现TRV介导的大豆基因沉默,并产生叶片基因沉默表型。不同接种方法均可产生叶片沉默表型,主要表现褪绿黄化及褶皱。接种方法影响植株不同组织的基因沉默效率,注射方法对叶片沉默效率最高,注射加灌根结合方法对根部沉默效率最高。相同接种方法对根及叶部的基因沉默效率也存在差异。