大豆GmHMGR基因响应外源激素及非生物胁迫功能研究
王帅 冯宇梅 白苗 杜维俊 岳爱琴
(1.山西农业大学农学院,太谷 030801;2.山西农业大学林学院,太谷 030801)
萜类化合物是植物中一类重要的次生代谢产物,不仅影响植物的生长发育,而且在响应逆境胁迫等过程中发挥积极作用[1]。在高等植物中,萜类化合物主要通过2条途径合成,即甲羟戊酸(mevalonate,MVA)途径和磷酸甲基赤藓糖(2-C-methyl-D-erythritol-4-phophate,MEP)途径[2-3]。由3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutary-CoA reductase,HMGR)催化的反应是MVA途径的主要限速步骤,负责催化3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl-CoA,HMG-CoA)生成MVA,该反应不可逆,是萜类合成的一个重要调控位点[4-5],影响众多萜类化合物(包括甾醇、植物激素、三萜皂苷等)的生物合成,进而影响植物与环境间的相互作用[6-7]。
HMGR基因作为MVA途径的关键酶基因,已在多种植物中被克隆和表征,如拟南芥(Arabidopsis thaliana)[8]、银杏(Ginkgo biloba)[9]、甜瓜(Cucum ismelo)[10]、棉花(Gossypium)[11]、人参(Panax ginseng)[12]等。与动物单个HMGR基因相比,植物HMGR基因一般以基因家族的形式存在,其不同的成员在空间和时间上表现出不同的表达模式,并且在响应外源激素诱导以及应对胁迫中发挥不同功能[12-14]。如拟南芥含有2个HMGR基因,但其表达模式不同,AtHMGR1的表达受光照调控,并且AtHMGR1缺失突变体表现出矮化、早衰等表型,而AtHMGR2缺失突变体在正常生长条件下无异常表型[8,15]。银杏GbHMGR2与GbHMGR3对冷、暗、茉莉酸甲酯(MeJA)、脱落酸(ABA)、水杨酸(SA)和乙烯利(Eth)处理均有响应[9]。苹果(Malus domestica)MdHMGR2对果实发育和Eth敏感,而MdHMGR5的异源表达激活了拟南芥抗氧化系统,增强了植物对氧化应激的耐受能力[13,16]。此外,外源MeJA诱导青蒿(Artemisia annua)AaHMGR1的表达,而对AaHMGR2和AaHMGR3影响较小[17]。
课题组前期从大豆(Glycine max)中成功克隆了8个HMGR基因,命名为GmHMGR1-GmHMGR8,它们在大豆各个组织表达不同,并且GmHMGR基因的启动子中具有多种胁迫及激素响应元件[18]。但是关于大豆GmHMGR基因家族成员是否响应外源激素及非生物胁迫还不清楚。
本研究分析GmHMGR1-GmHMGR8在大豆不同逆境胁迫及外源激素诱导下的表达模式;在酿酒酵母中异源表达分析该基因家族的不同成员,在盐胁迫与氧化胁迫下的抗逆能力;并研究拟南芥过量表达GmHMGR4与GmHMGR6株系在氧化胁迫与盐胁迫下的抗逆表型,为大豆抗氧化、抗盐机制解析和分子育种提供依据。
1 材料与方法
1.1 材料
以山西农业大学大豆遗传与种质创新课题组提供的武乡小黑豆为供试材料。pYES2载体购自北京华越洋生物科技有限公司;pC3300s载体购自武汉天问生物科技有限公司。INVScI酵母菌株购于上海柯雷生物科技有限公司;拟南芥哥伦比亚生态型(Col-0)购自武汉天问生物科技有限公司;限制性内切酶购于NEB有限公司;甲基紫精(MV)购于西格玛奥德里奇(上海)贸易有限公司。
1.2 方法
1.2.1GmHMGR基因对非生物胁迫和外源激素处理的表达分析 大豆材料种植于Hoagland & Arnon营养液中,置于光照培养箱中(光照16 h,黑暗8 h,25℃)培养15 d,至三叶完全展开后,选取生长状态一致的大豆幼苗进行非生物胁迫及外源激素处理。将幼苗分别置于含100 mmol/L PEG6000、150 mmol/L NaCl、330 mmol/L H2O2的营养液中模拟干旱、盐及氧化胁迫;将450 μmol/L MeJA、200 μmol/L ABA溶液喷施在幼苗叶片至充分湿润进行外源激素诱导。以上各组处理均在处理后0、3、6、12、24和48 h取大豆幼苗根、叶,液氮速冻,-80℃保存备用。
提取大豆幼苗总RNA,并反转录获得cDNA。根据前期获得的GmHMGR1-GmHMGR8序列设计特异性引物(表1),以GmActin作为内参基因。引物均由生工生物工程(上海)股份有限公司合成。使用全式金公司TransStart®Tip Green qPCR SuperMix试剂盒进行荧光定量PCR。采用2-ΔΔCT法计算基因的相对表达量,数据为3个生物学重复平均值±标准误差。
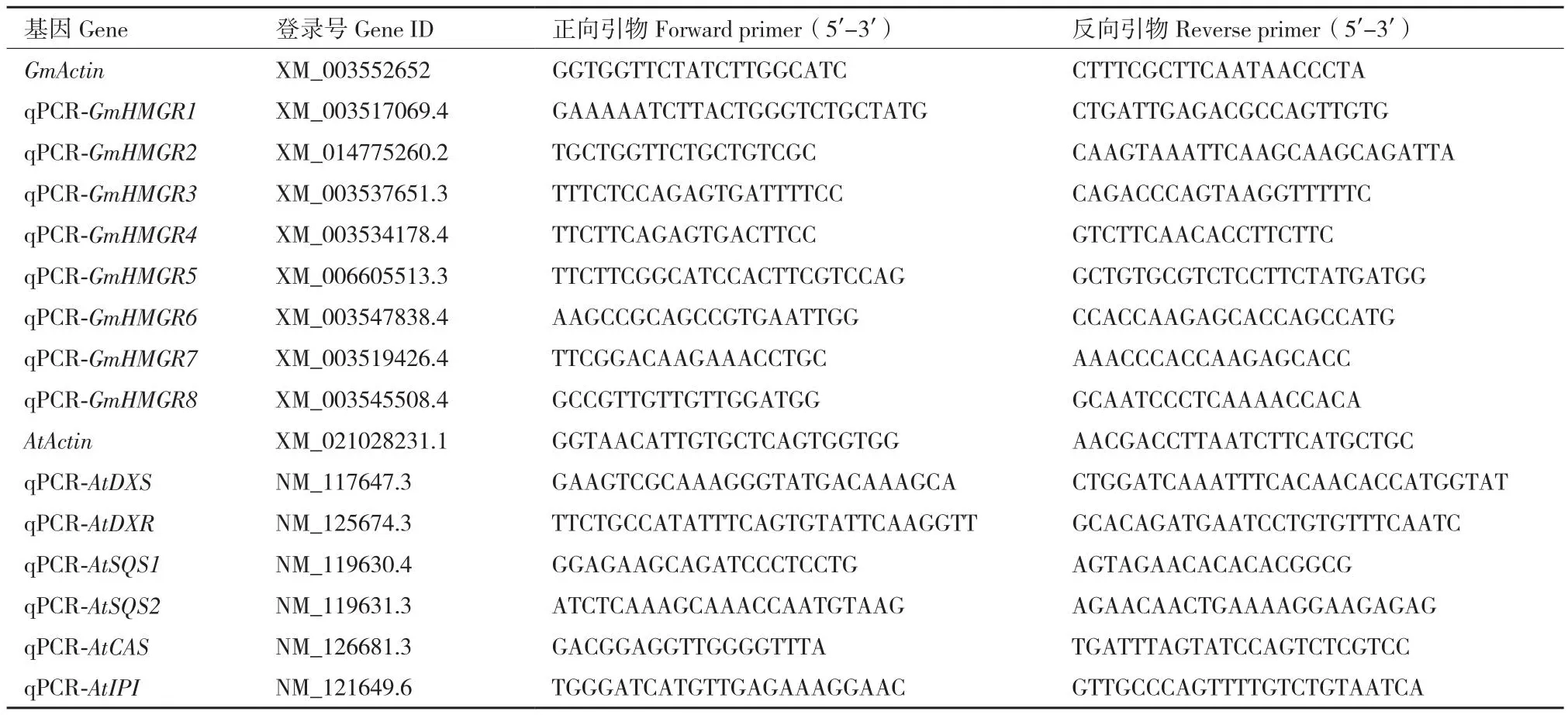
表1 实时荧光定量引物序列Table 1 Primers sequences by real-time quantitative PCR
1.2.2 pYES2重组表达酵母的构建与抗逆分析 根据GmHMGR1-GmHMGR8序列,分别设计带有酶切位点的引物进行扩增,产物经酶切后分别与pYES2表达载体连接,经过测序验证后,转化至野生型INVScI酵母菌株。将转化成功的酵母菌株培养至OD600=1时,稀释10、100、1 000和10 000倍,分别吸取5 μL菌液点样至YPDA培养基(分别含H2O2浓度为7.0和8.0 mmol/L,NaCl浓度为0.9和1.0mol/L),30℃倒置培养3-5 d,观察酵母生长状况。
1.2.3 拟南芥的遗传转化与抗逆分析
1.2.3.1 拟南芥遗传转化 构建重组质粒pC3300s:GmHMGR4与pC3300s:GmHMGR6,随后转化农杆菌菌株GV3101,通过浸花法侵染拟南芥Col-0,单株收取T0种子,利用含有草铵膦的培养基进行筛选培养获得T3。提取幼苗叶片基因组DNA为模板,利用引物Bar F(5'-GAAGGCACGCAACGCCTACGA-3')与Bar R(5'-CCAGAAACCCACGTCATGCCA-3')进行PCR检测;同时提取幼苗叶片RNA,利用引物qPCR-GmHMGR4与qPCR-GmHMGR6进行qPCR检测。
1.2.3.2 转基因拟南芥中萜类合成相关基因的表达分析 根据NCBI(https://www.ncbi.nlm.nih.gov/)查询拟南芥萜类合成相关基因1-脱氧-D-木糖醇-5-磷酸合成酶(1-deoxy-D-xylulose 5-phosphate synthase,DXS)基因AtDXS、1-脱氧-D-木酮糖-5-磷酸还原异构酶(1-Deoxy-D-xylulose 5-phosphate reductoisomerase,DXR)基因AtDXR、角鲨烯合酶(Squalene synthase,SQS)基因AtSQS1和AtSQS2、环阿屯醇合成酶(cycloartenol synthase,CAS)基因AtCAS、异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerases,IPI)基因AtIPI的序列设计特异性引物(表1),以AtActin为内参基因,以T3转基因拟南芥株系cDNA为qPCR模板进行实时荧光扩增,数据为3个生物学重复平均值±标准误差。
1.2.3.3 转基因拟南芥的抗逆分析 在MS培养基上培养7 d后,将拟南芥幼苗移栽至土壤基质中。生长发育4周后,选取生长状态一致的幼苗分组进行氧化及盐胁迫处理。氧化胁迫处理组每隔24 h喷施5 μmol/L甲基紫精(MV)至叶片充分湿润,24 h后取叶片进行NBT染色,72 h后拍照观察表型。盐胁迫处理组浇灌300 mmol/L NaCl进行一周胁迫处理,拍照观察表型,并对叶片进行NBT染色。使用Image J 1.53软件测量每株拟南芥莲座叶直径,并统计NBT染色面积百分比[19]。根据Zhang等[13]方法,取拟南芥叶片测定相对电导率,计算叶片损伤度,叶片损伤度计算方法为:(Lt-Lck)/(1-Lck)×100%,其中,Lt和Lck分别为处理(t)和对照(ck)叶片的相对电导率。使用丙二醛(malondialdehyde,MDA)含量检测试剂盒(北京索莱宝科技有限公司)、过氧化氢酶(catalase,CAT)测定试剂盒、过氧化物酶(peroxidase,POD)测定试剂盒(南京建成有限公司)测定叶片的MDA含量以及CAT、POD的活性。各组设3次生物学重复。
2 结果
2.1 大豆GmHMGR基因的表达分析
2.1.1 大豆GmHMGR基因对非生物胁迫的响应 将大豆叶和根进行PEG6000、NaCl和H2O2非生物胁迫处理,运用RT-qPCR分析GmHMGR1-GmHMGR8的表达情况。结果显示,在PEG6000胁迫处理下,GmHMGR1-GmHMGR8在叶中的相对表达量均呈先上升后下降的趋势,而在根中,PEG6000胁迫6和12 h后,GmHMGR2和GmHMGR6的表达量显著上调并达到峰值(图1-A)。在NaCl胁迫处理下,GmHMGR1和GmHMGR4的相对表达量在叶与根均受到显著上调,NaCl胁迫24 h后,GmHMGR4的相对表达量达到峰值(图1-B)。在H2O2胁迫处理下,叶与根中GmHMGR基因表达量变化趋势不同,在叶中,GmHMGR1-GmHMGR8在H2O2处理后3 h均显著上调,H2O2胁迫48 h后,GmHMGR8的相对表达量达到最高;在根中,GmHMGR基因整体呈现先上升后下降的趋势,其中,GmHMGR4的相对表达量达在H2O2处理后24 h达到峰值(图1-C)。结果表明,GmHMGR基因对PEG6000、NaCl和H2O2胁迫处理均有响应。
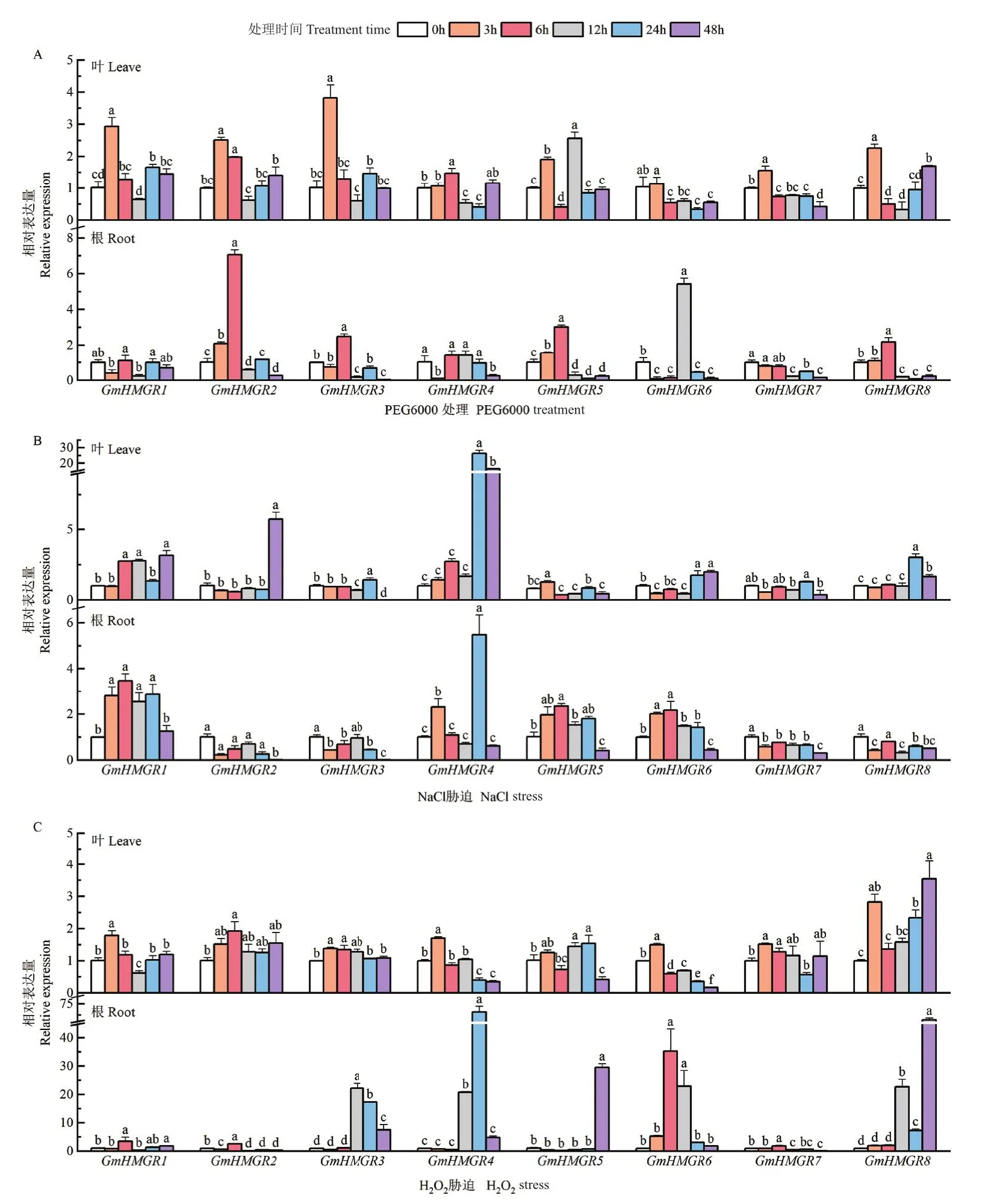
图1 非生物胁迫下大豆GmHMGR基因的表达模式分析Fig.1 Expression patterns of GmHMGR gene in response to abiotic stress in soybean
2.1.2 大豆GmHMGR基因对外源激素的响应 将大豆叶进行喷施外源植物激素MeJA和ABA处理,运用RT-qPCR分析GmHMGR1-GmHMGR8的表达情况。在喷施外源植物激素MeJA后,GmHMGR1-GmHMGR6在叶中的表达量显著上调,在3 h表达水平达到最高值,而GmHMGR7和GmHMGR8的表达量在6 h后显著降低。而在根中,除GmHMGR1和GmHMGR5外,其余GmHMGR基因的表达出现先升高后降低趋势(图2-A)。在ABA处理下,除GmHMGR8外,其余GmHMGR基因在叶中的表达量均显著上调,其中GmHMGR4的表达量在6 h时达到最高水平,约为对照的8.1倍,差异显著;在根中GmHMGR基因的表达均受到一定程度抑制,其中GmHMGR8在ABA处理3 h后显著上调,随后又显著下调并低于对照(图2-B)。结果表明,GmHMGR基因对MeJA和ABA激素处理有响应。
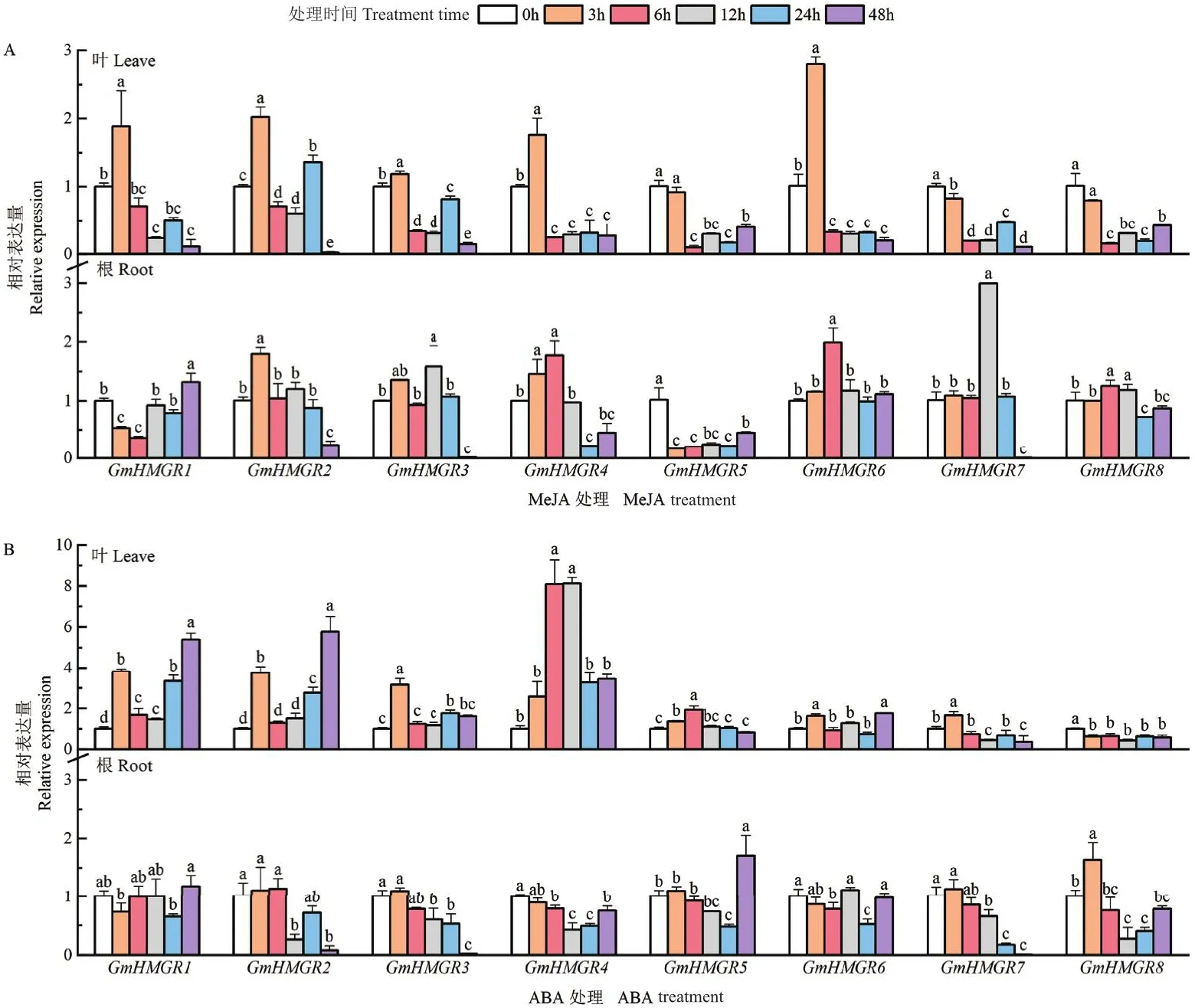
图2 激素处理后大豆GmHMGR基因的表达模式分析Fig.2 Expression patterns of GmHMGR gene in response to hormone treatment in soybean
2.2 GmHMGR基因在转基因酵母中的抗逆性分析
为了检测转GmHMGR基因酵母的抗氧化能力,将转基因酵母点样至YPDA培养基(7.0和8.0 mmol/L H2O2),观察酵母生长状况。在7.0 mmol/L H2O2浓度下,与对照相比,过量表达GmHMGR1、GmHMGR3、GmHMGR5、GmHMGR6和GmHMGR7的酵母长势好;在8.0 mmol/L H2O2浓度下,对照酵母已经不再生长,而过量表达GmHMGR1、GmHMGR3、GmHMGR5、GmHMGR6和GmHMGR7的酵母还可以继续生长(图3-A)。将转基因酵母点样至YPDA培养基(0.9和1.0 mol/L NaCl),观察酵母生长状况。在0.9 mol/L NaCl胁迫下,除过量表达GmHMGR8的酵母外,其余转基因酵母均比对照长势好,当NaCl浓度增至1.0 mol/L时,对照酵母已不能生长,而过量表达GmHMGR1、GmHMGR3、GmHMGR4、GmHMGR5、GmHMGR6和GmHMGR7酵母则仍能生长(图3-B)。结果表明,过量表达GmHMGR1、GmHMGR3、GmHMGR5、GmHMGR6和GmHMGR7可以增加酵母的抗氧化和抗盐能力,并且不同的GmHMGR基因,其抗氧化与抗盐能力也有差异。
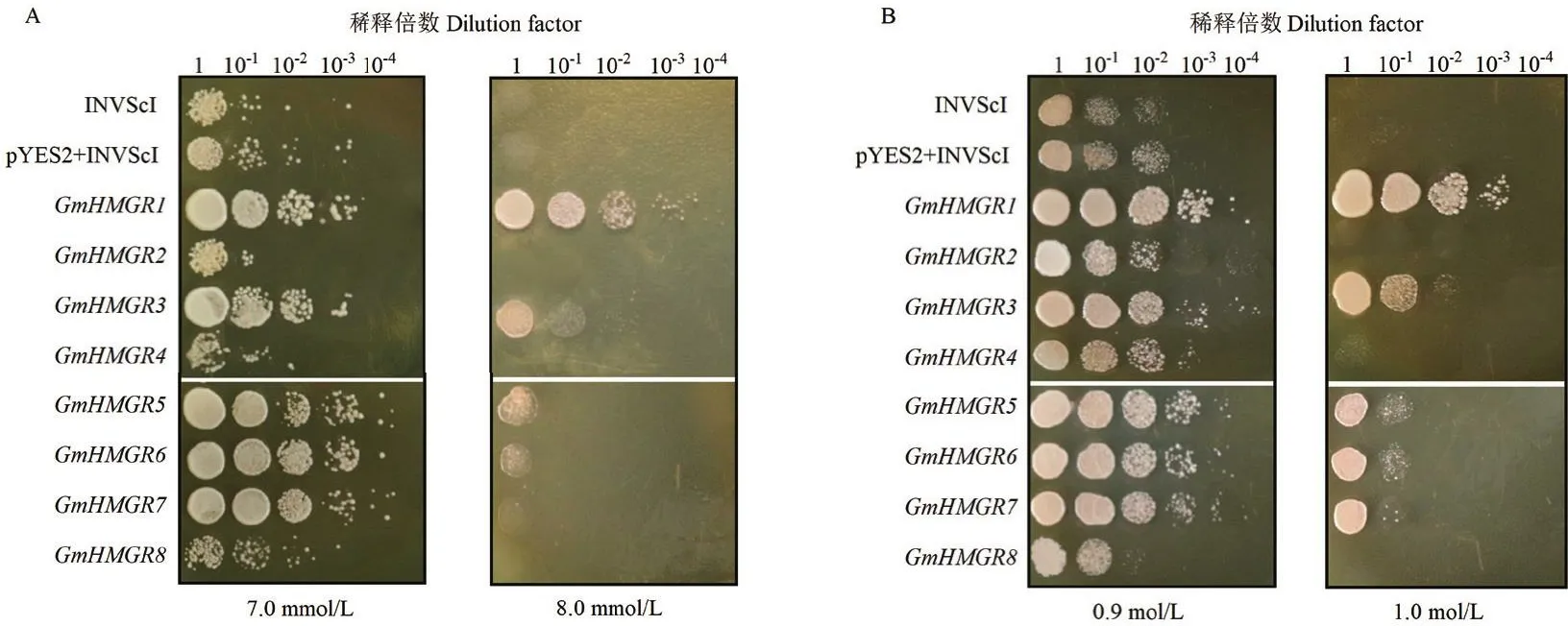
图3 不同胁迫下过量表达酵母的生长情况Fig.3 Growth of overexpressed yeast under different stress
2.3 转GmHMGR4与GmHMGR6拟南芥的抗逆性分析
2.3.1 转GmHMGR4与GmHMGR6植株的获得 在非生物胁迫处理后,GmHMGR4和GmHMGR6的表达水平均有不同程度的升高,并且GmHMGR4和GmHMGR6编码的蛋白具有HMGR的典型结构,通过对转GmHMGR4和GmHMGR6拟南芥纯合株系进行抗逆性鉴定。结果表明,转基因株系中均扩增出约270 bp的Bar条带,而野生型(WT)和阴性对照均无相应的扩增产物(图4-A)。RT-qPCR检测发现,GmHMGR4和GmHMGR6在5个转基因株系中均有不同程度的表达,且表达水平显著高于野生型对照植株(图4-B-C)。因此,分别选取OE4-1、OE4-2、OE4-3以及OE6-1、OE6-2、OE6-3株系进行后续表型观察与分析。

图4 T3代转基因拟南芥的鉴定Fig.4 Identification of T3 transgenic A.thaliana
2.3.2 转GmHMGR4和GmHMGR6拟南芥中萜类代谢途径关键酶基因的表达分析 为了研究过量表达GmHMGR4和GmHMGR6对拟南芥植物萜类代谢途径中相关基因表达水平的影响,测定转基因拟南芥株系中MEP途径基因关键酶基因AtDXS和AtDXR,MVA途径关键酶基因AtSQS1、AtSQS2、AtCAS,以及AtIPI的表达水平。结果表明,除OE6-3株系外,所有转基因植株中AtDXS、AtDXR、AtCAS、AtSQS1、AtSQS2表达量均显著高于野生型植株。而在OE4-1、OE4-2株系中,AtIPI的表达量显著高于野生型,其余株系无显著变化(图5)。结果表明,GmHMGR4与GmHMGR6的过表达增加了拟南芥中萜类代谢途径相关基因的表达水平。
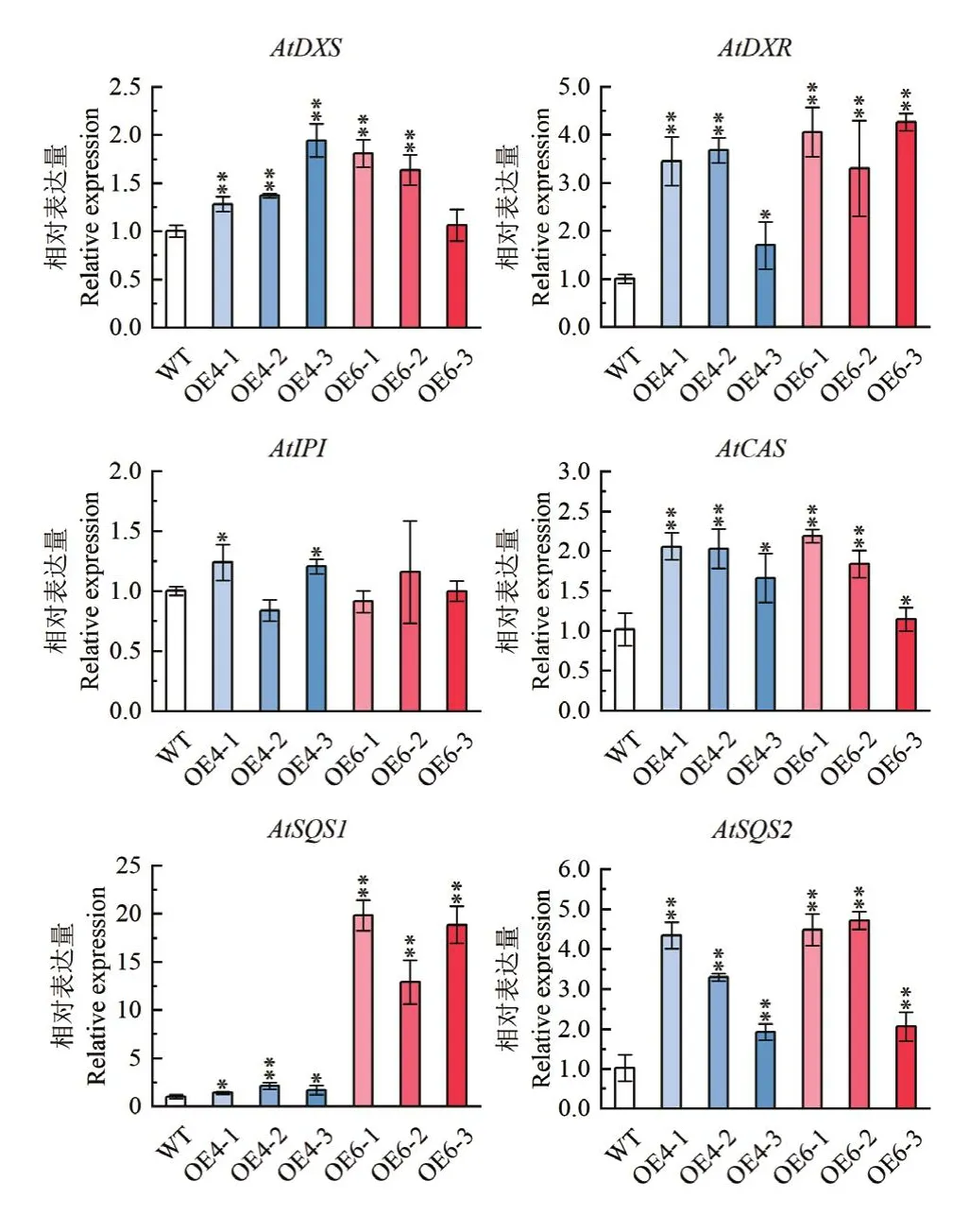
图5 萜类化合物合成相关基因在转基因拟南芥中的表达分析Fig.5 Expression analysis of terpenoid synthesis-related genes in transgenic A.thaliana
2.3.3 不同胁迫下转GmHMGR4和GmHMGR6拟南芥的表型分析 在正常培养条件下,野生型与转GmHMGR4和GmHMGR6拟南芥生长状况一致,莲座直径大小无显著差异(图6-A-B)。在氧化胁迫(5 μmol/L MV)处理后发现,野生型植株叶片发生萎蔫失绿,而转基因植株叶片发生轻微卷曲,生长状态良好(图6-A)。在盐胁迫(300 mmol/L NaCl)处理后,野生型与转基因拟南芥叶片的发育均受到一定程度抑制,但野生型植株的叶片较转基因株系发育缓慢(图6-A),转基因拟南芥株系的莲座直径大小均显著高于野生型(图6-B)。此外,与对照组相比,在胁迫处理后野生型与转基因拟南芥相对电导率与MDA含量均发生上调。在氧化胁迫处理后,过量表达GmHMGR4和GmHMGR6拟南芥株系的相对电导率和叶片损伤度均显著低于野生型(图6-C-D),且转基因拟南芥株系的MDA含量也显著低于野生型(图6-E)。在盐胁迫处理后,与野生型拟南芥相比转基因株系的相对电导率与叶片损伤度差异不显著(图6-C-D),而转基因拟南芥中,除OE4-1外,其余株系的MDA含量均显著低于野生型(图6-E)。结果表明,过量表达GmHMGR4与GmHMGR6增强了拟南芥抗氧化与抗盐能力。2.3.4 不同胁迫下转基因拟南芥ROS的积累与抗逆性分析 对氧化胁迫24 h与盐胁迫一周后的拟南芥叶片进行NBT染色,结果显示,与氧化胁迫下的野生型植株相比,转基因植株的叶片颜色较浅,染色面积百分比均低于野生型,而在盐胁迫处理后,过量表达GmHMGR4拟南芥株系的染色面积百分比低于野生型(图7-A-B)。进一步对转基因拟南芥CAT与POD的活性进行分析,在正常条件下转基因植株和野生型植株的CAT与POD活性无显著差异;在氧化胁迫下,转基因拟南芥株系的CAT的活性均上升并显著高于野生型,而POD活性没有差异(图7-CD)。在盐胁迫处理后,只有过量表达GmHMGR6株系的CAT活性显著高于野生型(图7-C),而OE4-1、OE6-1与OE6-3的POD活性显著低于野生型,其余过表达株系无显著变化(图7-D)。说明过量表达GmHMGR4与GmHMGR6提高了拟南芥ROS的清除能力。
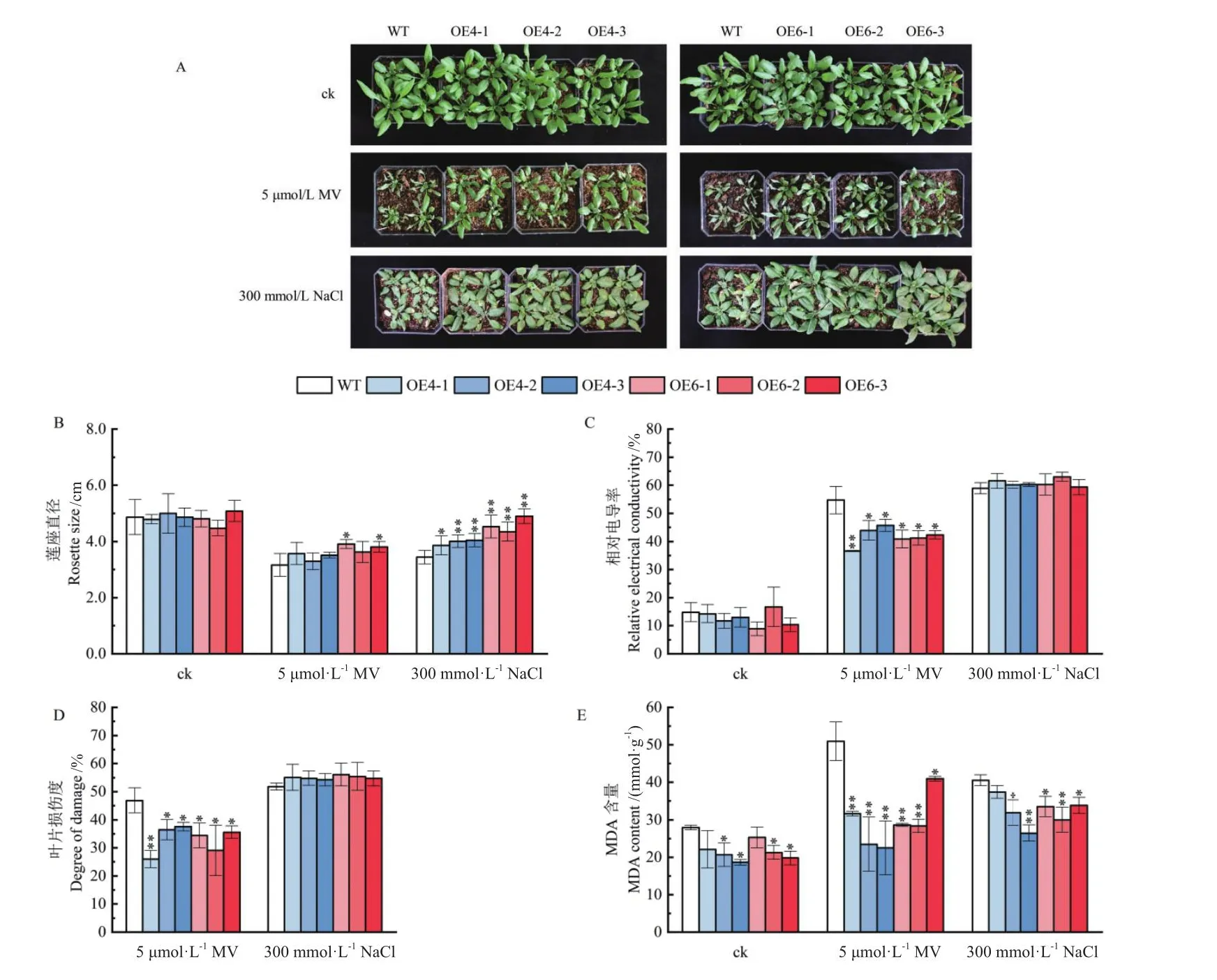
图6 氧化和盐胁迫后转基因拟南芥的表型分析Fig.6 Phenotypic analysis of transgenic A.thaliana after oxidative treatment and salt stress
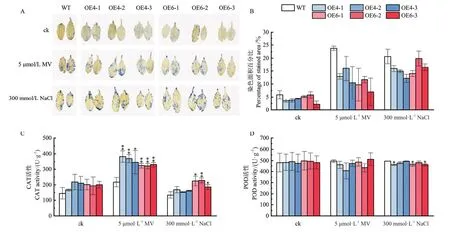
图7 氧化和盐胁迫处理后拟南芥的抗逆能力分析Fig.7 Stress-resistant ability analysis of transgenic A.thaliana after oxidative treatment and salt stress
3 讨论
萜类化合物,也称为类异戊二烯,是存在于植物中的一类天然产物,在大多数植物中可以调节植物与环境相互作用[20]。大豆中倍半萜、三萜皂苷、甾醇等的异戊二烯单元通常由MVA途径产生。HMGR作为MVA途径中的主要限速酶,在植物的发育及响应逆境胁迫中发挥积极作用。根据相关报道,HMGR基因的转录水平影响植物的株高、根长、雄配子体发育、种子的萌发、豆荚大小及根瘤的形成等[8,21-25],此外,烟草过量表达杜梨PbHMGR提高了转基因烟草种子的耐盐性[26],苹果MdHMGR5在拟南芥中的过表达增强了拟南芥的抗氧化能力[13]。许多HMGR基因的启动子区域包含多个顺式作用元件,在应对生物和非生物胁迫的调控中发挥重要功能。如在苹果HMGR基因家族各成员的启动子中存在各种顺式作用元件,Eth、MeJA和SA显著诱导MdHMGR2和MdHMGR4的表达[27-28],而AtHMGR受蛋白磷酸酶2A(PP2A)的调控从而在拟南芥植物应对胁迫中发挥重要作用[29]。以上结果表明,不同物种中HMGR基因在逆境响应过程中存在差异。山西农业大学大豆遗传与种质创新课题组前期研究发现,大豆中具有8个HMGR基因,分别命名为GmHMGR1-GmHMGR8。本研究表明GmHMGR基因家族的各成员在PEG6000、NaCl和H2O2胁迫处理后的叶与根中表达量发生了不同程度的上调,其中,GmHMGR4在NaCl胁迫处理后的叶与根中相对表达量的均显著上调,并且在H2O2处理后根中其相对表达量是对照的65倍。此外,GmHMGR2、GmHMGR4、GmHMGR6受到MeJA的诱导,而ABA处理后的叶中GmHMGR1-GmHMGR7的表达显著上调。以上结果表明,GmHMGR基因在响应非生物胁迫及外源激素诱导中发挥重要功能。另外,过量表达GmHMGR1、GmHMGR3、GmHMGR5、GmHMGR6、GmHMGR7酵母在胁迫条件下生长情况良好。表明GmHMGR基因家族不同成员在大豆抵抗逆境胁迫中发挥的功能不同。
前人研究表明HMGR表达水平的改变通常会导致类异戊二烯的含量变化,进而影响植物的发育及其对逆境的耐受能力[30-31]。如在丹参(Salvia miltiorrhiza)毛状根中过量表达SmHMGR2增加了毛状根中丹参酮和角鲨烯的含量[32],烟草中过量表达HbHMGR导致烟草种子中总甾醇的积累增加了2.5倍[33]。根据前期试验结果,进一步在拟南芥中过量表达GmHMGR4与GmHMGR6,研究其在植物抗逆过程中的作用机制。RT-qPCR结果表明,过量表达GmHMGR4与GmHMGR6不仅提高了拟南芥AtSQS1和AtSQS2的表达水平,而且也显著提高了甾醇代谢的关键酶基因AtCAS的表达量,表明GmHMGR基因的过量表达激活了类异戊二烯途径中的下游基因转录,继而共同调节拟南芥萜类的代谢通量。此外,MEP途径AtDXR基因的表达也显著提高,表明拟南芥MVA途径与MEP途径间可能存在串扰,与之前的研究结果相同[34]。相对电导率、叶片损伤度与MDA含量是植物反应细胞膜损伤程度的重要指标[35],转GmHMGR4与GmHMGR6拟南芥植株在氧化胁迫下的相对电导率、叶片损伤度与MDA含量均显著低于野生型,表明GmHMGR4与GmHMGR6在拟南芥中过量表达可以缓解氧化胁迫过程中细胞膜的损伤,增强植株的抗氧化能力。而在NaCl处理后,转基因拟南芥的相对电导率、叶片损伤度与野生型无显著差异,但MDA含量低于野生型拟南芥,差异显著。说明GmHMGR4与GmHMGR6参与转基因拟南芥盐胁迫响应过程。植物在胁迫条件下会产生ROS,而ROS过量积累会破坏细胞膜,导致细胞发生损伤,进而影响植物生长发育[35]。毛果杨(Populus trichocarpa)中PtHMGR的过表达上调了ROS清除相关基因的表达,并且提高了ABA合成相关基因的转录水平和ABA的含量,进而影响了毛果杨的抗逆能力[36]。芥菜MVA途径相关基因BjHMGS的过表达增加了转基因拟南芥甾醇的含量并提高了其胁迫耐受性[37]。并且一些研究表明挥发性类异戊二烯可以通过调节植物的氧化状态来减轻氧化应激的影响[38-40]。在本研究中,过量表达GmHMGR4和GmHMGR6拟南芥类异戊二烯途径重要酶基因的表达水平高于野生型,差异显著。在氧化胁迫后转基因拟南芥的ROS积累量低于野生型,并且其CAT活性显著高于野生型植株。推测转基因拟南芥中GmHMGR4和GmHMGR6的过表达通过影响激素代谢水平以及抗逆相关异戊二烯产物的代谢通量,进而激活拟南芥抗氧化系统,避免了ROS过量产生引起的严重氧化损伤,具体机制还有待于进一步研究。而在NaCl胁迫下,仅转GmHMGR6株系的CAT活性显著高于野生型,这可能是不同GmHMGR基因在不同胁迫下发挥的功能上的差异,说明GmHMGR6在拟南芥抵抗盐胁迫中发挥更重要的功能。
4 结论
大豆GmHMGR基因对不同非生物胁迫以及激素处理均有响应;不同的GmHMGR基因在酵母中的抗氧化与抗盐能力有差异;过量表达GmHMGR4与GmHMGR6增强拟南芥的抗氧化与抗盐能力;表明GmHMGR基因家族可能在大豆响应氧化和盐胁迫中发挥重要作用。