基于三角梅的病毒诱导基因沉默体系的建立与优化
刘珍银 段郅臻 彭婷 王童欣 王健
(1.海南大学林学院 热带特色林木花卉遗传与种质创新教育部重点实验室 海南省热带特色花木资源生物学重点实验室,海口 570228;2.贵州大学农学院,贵阳 550025)
三角梅(Bougainvilleaspp.)具有花色丰富、花期长、抗逆性强等优点,是南方地区城市园林绿化和家庭观赏中不可缺少的植物之一[1]。近年来有关三角梅的研究主要集中在栽培繁殖、种质资源、园林应用等方面,基因功能相关研究较少。随着测序技术的发展,三角梅生长发育、叶色调控、花色调控等方面的相关基因功能开发将成为研究趋势,简单快速的功能验证方法的建立变得尤为重要。
病毒诱导的基因沉默(virus-induced gene silencing, VIGS)是通过构建携带目的基因的重组病毒载体侵染植株,使目标基因表达被抑制,从而以表型变化分析基因功能的技术[2-3]。与其他基因功能研究方法相比,该方法不需要完整的基因序列,不需要遗传转化,周期短,操作简单,在非模式植物研究中具有明显优势[2]。烟草脆裂病毒(tobacco rattle virus, TRV),作为常用的VIGS病毒载体,具有适应宿主范围广、沉默持续时间长、病毒症状不明显、沉默效率高等优点[4]。基于TRV的VIGS系统已被应用于多种观赏植物的基因功能验证[5-11]。八氢番茄红素脱氢酶(phytoene desaturase,PDS)是类胡萝卜素合成途径的关键酶。PDS基因沉默会直接影响类胡萝卜素的积累,植株会出现光漂白现象,以表型变化评价沉默效果[12-14]。由于表型明显,易于观察,且适用于植株不同部位,PDS基因成为VIGS技术最常用的指示基因之一[15]。
本研究以三角梅‘金心双色’(Bougainvillea peruviana‘Thimma’)品种为试验材料,以PDS基因为标记基因,TRV为病毒载体,构建不同长度沉默基因片段的病毒重组载体,采用摩擦注射农杆菌侵染法,探索三角梅VIGS沉默体系,旨在为后续基因功能研究提供参考。
1 材料与方法
1.1 材料
本试验使用材料‘金心双色’三角梅种植于海南大学儋州校区农科基地。烟草脆裂病毒载体pTRV1、pTRV2保存于本实验室,大肠杆菌DH5α感受态细胞和农杆菌GV3101感受态细胞采购于上海唯地生物技术有限公司。
1.2 方法
1.2.1 目的基因克隆 根据NCBI数据库中的拟南芥PDS基因序列(GenBank登录号:NM_117498.4)和烟草PDS基因序列(GenBank登录号:DQ469932.1),与课题组现有三角梅转录组数据(NCBI,PRJNA812995)进行Blast比对,获取PDS基因片段,命名为BpPDS。在ORF框内选取336 bp和457 bp长度的片段,参考In-fusion引物设计原则设计特异性引物,在引物上设计EcoRI酶切位点,引物由上海生工生物工程公司合成,序列见表1。
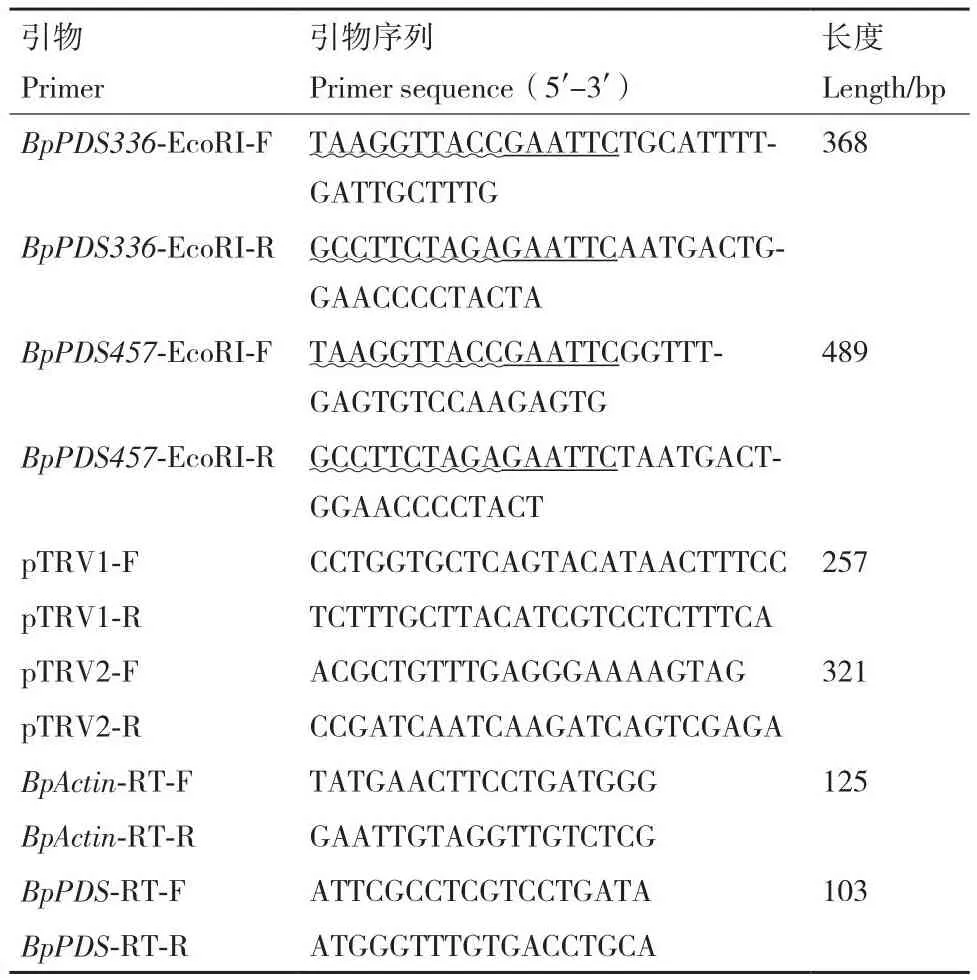
表1 本文中使用的引物序列Table 1 Primers used in this study
采用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司,北京)提取嫩叶总RNA。利用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(宝日医生物技术有限公司,大连)反转录合成cDNA。PCR反应体系为:2 × Phanta Max Master Mix(诺唯赞生物技术股份有限公司,南京)12.5 μL、正向引物(10 μmol/L)和反向引物(10 μmol/L)各1 μL、cDNA 1 μL,补充ddH2O至25 μL。采用Touch down PCR反应程序,94℃ 6 min;94℃30 s,67-64℃ 30 s,72℃ 1 min,-0.5℃/循环,8个循环;94℃ 30 s,64℃ 30 s,72℃ 1 min,30个循环;72℃ 7 min。PCR产物使用1%琼脂糖凝胶电泳检测。利用Universal DNA纯化回收试剂盒(天根生化科技有限公司,北京)回收目的基因片段。
1.2.2 沉默载体构建 利用限制性内切酶EcoRI(赛默飞世尔科技有限公司,上海)对pTRV2载体进行单酶切,获得pTRV2线性片段并分别纯化酶切产物。利用In-Fusion® HD Cloning Kit试剂盒(宝日医生物技术有限公司,大连)连接目的基因片段及pTRV2线性片段,构建pTRV2-BpPDS336和pTRV2-BpPDS457重组载体。将重组载体转化大肠杆菌DH5α(上海唯地生物技术有限公司),在卡那霉素(100 μmol/L)抗性筛选和菌液PCR检测后,进行测序验证。
1.2.3 农杆菌转化与侵染 利用冻融法,将阳性重组质粒pTRV2-BpPDS336和pTRV2-BpPDS457转入农杆菌GV3101感受态(上海唯地生物技术有限公司),在卡那霉素(100 mg/L)和利福平霉素(20 mg/L)抗性条件和菌液PCR检测下筛选阳性转化子。
分别培养含有pTRV1、pTRV2、pTRV2-BpPDS336及pTRV2-BpPDS457质粒的农杆菌GV3101于YEP液体培养基(含100 mg/L卡那霉素和20 mg/L利福平霉素)中,28℃振荡培养至OD600约为0.8-1.1。取菌液离心弃上清,加入现配侵染液(10 mmol/L MES,10 mmol/L MgCl2,148 μmol/L乙酰丁香酮)重悬菌体,OD600调至约1.0。将含pTRV1的农杆菌重悬液分别与含pTRV2(阴性对照)、重组质粒pTRV2-BpPDS336及pTRV2-BpPDS457农杆菌重悬液以1∶1的比例充分混匀,在室温黑暗条件下静置处理2-3 h后用于注射侵染。
注射侵染前在植株顶芽茎秆和嫩叶上制造轻微创伤面,将混合菌液注射进嫩叶(顶端3-4片叶)及顶芽茎秆,并在接种部位覆盖无菌纱布,保鲜膜包裹以保持湿润。侵染后的植株用黑色塑料袋包裹黑暗处理24 h,随后置于25℃、湿度60%、光周期16 h(光)/8 h(暗)条件下培养。在初次侵染处理一周后,对相同侵染部位进行二次处理以保证侵染效果。观察记录各处理植株表型变化。
1.2.4 三角梅叶片光合色素含量测定 参考李瑞雪等[13]的方法测定对照组(pTRV2)和两种沉默组(pTRV2-BpPDS336及pTRV2-BpPDS457)的叶片叶绿素及类胡萝卜素含量,各处理设置3次生物学重复。
1.2.5 荧光定量PCR检测 利用快速DNA提取检测试剂盒和RNAprep Pure多糖多酚植物总RNA 提取试剂盒(天根生化科技有限公司,北京)提取阴性对照组和沉默组的DNA 和RNA,分别用于载体检测和基因表达量检测。利用HiScript II 1st Strand cDNA Synthesis Kit(+gDNA wiper)试剂盒(诺唯赞生物科技有限公司,南京)反转录合成cDNA。BpActin作为内参基因,RT-qPCR引物序列见表1。参照ChamQ Universal SYBR qPCR Master Mix试剂盒(诺唯赞生物科技有限公司,南京),在荧光定量PCR检测仪(LineGene 9600,杭州博日科技股份有限公司)完成检测,每个处理设置3个平行试验。反应体系(10 μL):cDNA 1 μL,正向引物(10 μmol/L)和反向引物(10 μmol/L)各0.5 μL,2 ×ChamQ Universal SYBR qPCR Master Mix 5 μL,ddH2O 3 μL。反应程序为:95℃ 1 min;95℃ 15 s,60℃ 30 s,40个循环。溶解程序:95℃ 30 s,60℃ 30 s,95℃30 s。
1.2.6 数据处理 运用2-ΔΔCT方法计算目的基因相对表达量。试验数据用Excel 2010进行统计,利用SPSS 25.0对所有数据在P<0.05水平上进行差异分析,使用GraphPad Prism 8.0软件作图。
2 结果
2.1 目的基因克隆
由图1可知,三角梅叶片RNA电泳结果可观察到清晰完整的2条带,且OD260/OD280值在1.8-2.0之间,说明RNA质量良好,可用于后续试验。

图1 三角梅叶片总RNAFig.1 Total RNA of B.peruviana ‘Thimma’
考虑到引物5'端10 bp TRV2同源序列和6 bpEcoRI酶切位点,与336 bp的BpPDS片段相连后,片段长度为368 bp;与457 bp的BpPDS片段连接后,片段长度为489 bp。如图2电泳图所示,BpPDS336基因条带位于300 bp左右,BpPDS457基因条带接近500 bp,条带单一清晰,且片段大小与预期结果一致。
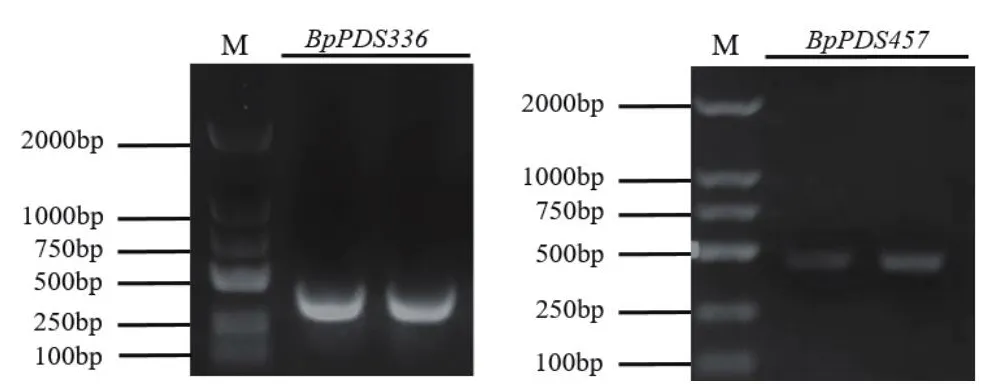
图2 目的基因片段扩增Fig.2 Amplification of target genes
2.2 沉默载体构建
pTRV2载体检测引物可扩增321 bp的条带,重组沉默载体pTRV2-BpPDS336和pTRV2-BpPDS457扩增片段分别为657 bp和778 bp。由图3可知,电泳条带分别在650 bp和780 bp左右,条带单一清晰,且片段大小与预期结果一致,经测序与转录组数据一致,说明载体构建成功。

图3 目的基因TRV2载体扩增检测Fig.3 Detection of target genes on constructed TRV2 vector
2.3 农杆菌侵染
在初次侵染2-3周后,顶端嫩茎侵染处理,两种沉默组均未发现叶片有明显黄化或白化现象。相反,在叶片侵染部位周围颜色变浅,形成浅黄色斑块(图4)。阴性对照(图4-B)同空白对照(图4-A)无明显颜色差异,两个沉默处理组的叶片表型存在一定差别,pTRV2-BpPDS457(图4-C, D)相比pTRV2-BpPDS336(图4-E, F)侵染处理的叶片黄化效果更加明显。

图4 沉默三角梅BpPDS叶片表型Fig.4 Phenotype of BpPDS silenced B.peruviana ‘Thimma’
由图5所示,利用PCR检测pTRV1和pTRV2载体发现空白对照中无pTRV1和pTRV2载体;阴性对照3个样品均在257 bp和321 bp处有清晰单一条带,说明叶片中存在pTRV1和pTRV2载体;在pTRV2-BpPDS336和pTRV2-BpPDS457沉默处理组中扩增条带单一且与重组载体长度相符,表明pTRV2-BpPDS336和pTRV2-BpPDS457重组载体均成功转入三角梅植株。

图5 pTRV1和pTRV2病毒载体PCR检测Fig.5 PCR amplification of virus veetor pTRV1 and pTRV2
2.4 光合色素含量检测
由表2显示,空白对照和阴性对照之间总叶绿素和类胡萝卜素含量没有显著差异,阴性对照与两个沉默处理pTRV2-BpPDS336和pTRV2-BpPDS457之间存在显著差异(P< 0.05)。两个沉默处理之间在总叶绿素和类胡萝卜素含量上没有显著差异,但pTRV2-BpPDS457沉默处理叶片叶绿素a和叶绿素b含量相比pTRV2-BpPDS336显著降低。综上所述,BpPDS沉默处理会降低类胡萝卜素和叶绿素含量的合成,与表型观察相一致。

表2 不同处理三角梅叶片光合色素含量Table 2 Content of photosynthetic pigments in the leaves of B.peruviana ‘Thimma’ under different treatments
2.5 RT-qPCR检测
如图6所示,空白对照与阴性对照中BpPDS表达量之间无显著差异,pTRV2-BpPDS336和pTRV2-BpPDS457沉默处理的叶片BpPDS基因的表达量显著降低,其中pTRV2-BpPDS336处理的叶片中BpPDS表达量显著降低。结果表明,三角梅PDS基因沉默体系可以有效沉默内源BpPDS基因,沉默体系初步建立。

图6 RT-qPCR检测BpPDS基因相对表达量Fig.6 RT-qPCR detection of relative expression of BpPDS
3 讨论
随着三角梅测序技术的开发,更多的研究逐渐倾向于基因功能验证[16]。三角梅作为木本植物,其稳定遗传体系尚不成熟,因此快速、简便的研究方法对基因功能鉴定至关重要。VIGS作为一种快速基因分析技术,已经成功运用在牡丹、玫瑰、观赏海棠等木本花卉植物的基因研究中[9,17-18]。目前,三角梅VIGS体系研究尚未见报道。本研究利用农杆菌介导法,构建三角梅VIGS体系,为三角梅基因功能研究奠定基础。
表型变化是检测基因沉默效果最直观的方法。因此,选择合适的指示基因有助于表型观察,可以快速建立高效的VIGS体系。PDS作为类胡萝卜素合成途径关键基因,主要在植物叶片、花瓣和果实中表达,该基因表达受阻时植株出现光漂白现象,表型直观易观察[13]。其他指示基因也有应用,如镁螯合酶(CHLH)参与叶绿素合成,基因沉默会产生叶片发黄表型[15]。查尔酮合成酶(CHS)参与花青素合成,基因沉默效果可通过花色变化判断[19]。‘金心双色’三角梅因其特有的双色叶片,极具观赏价值,也将是叶色调控研究的最佳材料。在本研究中,克隆了‘金心双色’三角梅叶片转录组中BpPDS基因,构建病毒重组载体,研究基因片段大小、不同接种方法等对基因沉默效果的影响,旨在建立一套稳定快速的三角梅沉默体系。
高效VIGS体系的建立主要包含载体构建、侵染处理、基因沉默评价等[20]。合适的病毒载体是体系构建成功的关键。目前应用于VIGS技术的病毒载体主要有烟草花叶病毒(tomato mosaic virus,TMV)[21]、烟草脆裂病毒(tobacco rattle virus,TRV)[22]、番茄金色花叶病毒(tomato golden mosaic virus, TGMV)[23]等。不同病毒载体接种效果和沉默效果均不同。其中,TRV病毒载体应用较广泛,且TRV感染引起的症状较轻,沉默表型相对集中且均匀[11]。在本研究中,选择TRV病毒载体,构建了pTRV2-BpPDS重组载体,并获得了较均匀清晰的沉默表型的叶片,光合色素也有显著的降低,沉默效果比较理想,说明TRV病毒载体可以应用于三角梅沉默体系构建。载体能否顺利进入植物并实现基因沉默与农杆菌侵染体系密不可分。不同植物对农杆菌侵染的敏感性不同[15]。珊瑚樱VIGS体系构建中对LBA4404和GV3101两种农杆菌侵染效果比较发现,GV3101侵染产生的沉默效率相对高[24]。在水稻中,LBA4404则表现出更强的侵染能力[25]。本试验选用GV3101作为侵染农杆菌,侵染处理的叶片未观察到明显的病菌侵染造成的萎缩或坏死情况,说明该农杆菌适用于三角梅侵染处理。
选择正确的目的基因片段也是确保沉默效果的关键因素。病毒载体中插入片段与靶基因同源性越高,基因沉默效果会越好[26]。当基因片段不合适,会出现沉默基因脱靶现象,继而无法获得预期沉默表型[27]。研究表明大麦条纹花叶病毒(barley stripe mosaic virus, BSMV)诱导小麦VIGS体系插入片段长度在120-500 bp范围内沉默效率高,更短或更长的片段沉默效果低[28]。TRV病毒载体诱导的烟草PDS基因沉默体系插入片段在192-1 304 bp内都会出现叶片光漂白现象,长度达到1 661 bp时沉默效果明显降低[22]。由此可知,最适插入片段要依据不同物种的特性进行试验和选择以获得最佳沉默效果。本试验中,利用本课题组‘金心双色’三角梅转录组数据克隆了两个不同长度的BpPDS插入片段,分别为336 bp和457 bp。两个重组病毒载体均实现了一定的沉默效果。其中pTRV2-BpPDS457侵染处理的叶片黄化表型相对pTRV2-BpPDS336更加明显,色素含量也相对更低,由此可见,457 bp长度的插入片段构建的沉默载体更适用于三角梅,也对后期基因验证中插入片段的选择提供了一定参考。
侵染处理方法和接种部位的选择与目的基因表达部位密切相关。常用的VIGS接种方法主要有真空渗透法[18,29]、摩擦接种法[15,24]、灌根法[30]等。Liu等[31]在枸杞VIGS体系构建时采用的发芽种子真空渗透法相比幼苗真空深空和农杆菌浇灌沉默效率高。Xu等[24]在珊瑚樱VIGS体系构建中采用摩擦加子叶注射法比发芽种子真空渗透沉默效率要高。不同物种选择的接种方法不同,接种部位同样影响VIGS技术的沉默效率。本试验选用PDS基因作为沉默目标,在绿色叶片中正常表达。因此,选择顶端嫩茎和嫩叶作为接种对象,以摩擦注射法接种,对比两者沉默效果发现顶端嫩茎接种的顶端新生嫩叶没有明显的黄化或白化表型,可能同三角梅植株木质化有关。相反,接种的嫩叶表现出黄化,且叶片无明显病态。因此,叶片摩擦接种法可用于三角梅叶色调控、发育代谢等基因验证。
由此可见,建立一个高效的VIGS体系,需要综合考虑各种因素,合适的病毒载体、农杆菌菌系、插入片段大小、接种方法、培养环境等[20]。本研究综合考虑各因素,获得了一定的沉默效果,初步建立了三角梅的VIGS体系,为未来基因功能组学研究奠定了基础。但是,试验中并未获得明显光漂白叶片,体系条件仍需进一步优化,期望建立更高侵染效率的VIGS体系。
4 结论
本研究以三角梅‘金心双色’作为试验材料,TRV病毒为载体,BpPDS为指示基因,采用摩擦接种叶片法,结合表型、光合色素含量测定及基因表达水平,初步构建了三角梅的VIGS基因沉默体系,为后续基因功能研究提供参考。